花生轉錄因子Ahb HLH 18克隆與功能分析
趙小波閆彩霞李春娟黨彥學孫全喜王 奇邱俊蘭單世華*
(1.山東省花生研究所,山東 青島 266100;2.臨沂市農業科學院,山東 臨沂 276003;3.威海市農業農村事務服務中心,山東 威海 264200)
花生(ArachishypogaeaL.)是世界四大油料作物之一,在100多個國家廣泛種植,主要分布在亞洲、非洲和美洲地區。我國是世界花生生產大國,占世界花生總產的40%以上,居世界第一位[1]。2021年中央1號文件明確指出發展花生等油料作物。我國鹽堿土面積占耕地總面積的6.2%,目前利用率僅20%左右[2]。通過培育耐鹽品種,充分利用鹽堿土地種植花生,擴大花生種植面積,是提高花生總產的重要途徑之一。通過對花生種質耐鹽性的評價研究表明,花生對鹽脅迫具有一定的耐受性[3],目前花生耐鹽基因利用方面的研究較少,通過分子生物學方法研究花生耐鹽機制具有重要意義。
bHLH(basic Helix-Loop-Helix)轉錄因子家族廣泛存在于真核生物,是植物最大的轉錄因子家族之一[4]。bHLH 結構域可分為堿性氨基酸區(10~15個氨基酸)和α-螺旋-環-α-螺旋區(HLH 區,40個氨基酸左右)[5]。越來越多的研究表明,該轉錄因子參與植物眾多的生長發育過程。另外,大量的研究表明,bHLH 轉錄因子在植物逆境脅迫響應機制中發揮重要作用。擬南芥轉錄因子ICE1(Inducer of CBF expression1,bHLH 轉錄因子家族成員)通過結合CBF啟動子調節下游相關基因表達,從而響應低溫脅迫[6];AtbHLH92[7]、SlbHLH22[8]、bHLH122[9]等轉錄因子均通過ABA 通路調節以及提高抗氧化防護機制提高植株耐鹽性。此外,bHLH 轉錄因子參與植物鹽脅迫響應還有其他途徑,例如ZmbHLH55通過提高抗壞血酸的生物合成提高植株耐鹽性[10]。前期研究中,我們發現鹽脅迫時,花生轉錄因子AhbHLH18是表達量顯著提高的轉錄因子之一[11]。本研究驗證了花生轉錄因子AhbHLH18的功能,并分析了其作用機制,為深入研究花生耐鹽分子機制提供理論基礎。
1 材料與方法
1.1 轉錄因子克隆
以耐鹽花生品種花育6303為研究對象。加Hoagland氏培養液于28℃,濕度60%,光照強度500μmol/(m2·s)條件下培養。種子培養21 d后,于200 mmol/L NaCl溶液分別處理0、4、8、12、24 h后取根部組織,液氮冷凍后保存于-80℃冰箱以用于RNA 提取[12]。使用MiniBEST Universal RNA Extraction Kit試劑盒(TaKaRa,大連寶生物)提取根部RNA,并利用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa,大連寶生物)進行反轉錄,參考peanutbase(www.peanutbase.org)上的序列設計引物(表1)。反應程序為:94℃,5 min。隨后30個循環設為:94℃,30 s;56℃,50 s;72℃,1 min。最后72℃,8 min。
1.2 目標轉錄因子表達分析
根據擴增得到的序列,用Beacon Designer 7.0設計熒光定量PCR特異引物(表1)。以鹽脅迫處理后0、4、8、12、24 h的根部組織為樣本,以0 h樣本為對照,使用7500 FAST熒光定量PCR儀(ABI公司)分析AhbHLH18的相對表達情況。反應條件:95℃,10 s;95℃,5 s;60℃,30 s;72℃,10 s;40個循環。試驗設置3 次重復。相對表達量的計算采用2-ΔΔCT方法[13],選擇Actin 11作為內參基因[14],試驗數據采用SPSS12.0 分析(SPSS Inc.,Chicago,USA)。
1.3 進化比較與生物信息學分析
AhbHLH18氨基酸序列與擬南芥基因組中已有序列信息[15]進行比對。然后利用Clustal W軟件對測序數據進行人工對齊排序。選擇Kimura2-parameter公式計算遺傳距離。MEGA6.0中采用鄰近法(Neighbor-Joining,NJ)構建系統樹,自舉值Bootstrap為1000次重復。DNAMAN軟件對其氨基酸序列進行理化性質分析。
1.4 擬南芥遺傳轉化
提取耐鹽品種花育6303總RNA,反轉錄成總cDNA。利用表1引物,以cDNA為模板,擴增花生AhbHLH18基因。反應程序為:94℃,5 min;隨后30個循環為:94℃,1 min;57℃,50 s;72℃,50 s;最后72℃,10 min。用SacI和XbaI雙酶切載體pCAMBIA2300,T4連接酶將酶切產物與擴增產物連接至DH5α感受態細胞,篩選陽性克隆,轉化農桿菌GV3101,然后利用花序侵染法轉化擬南芥[16]。
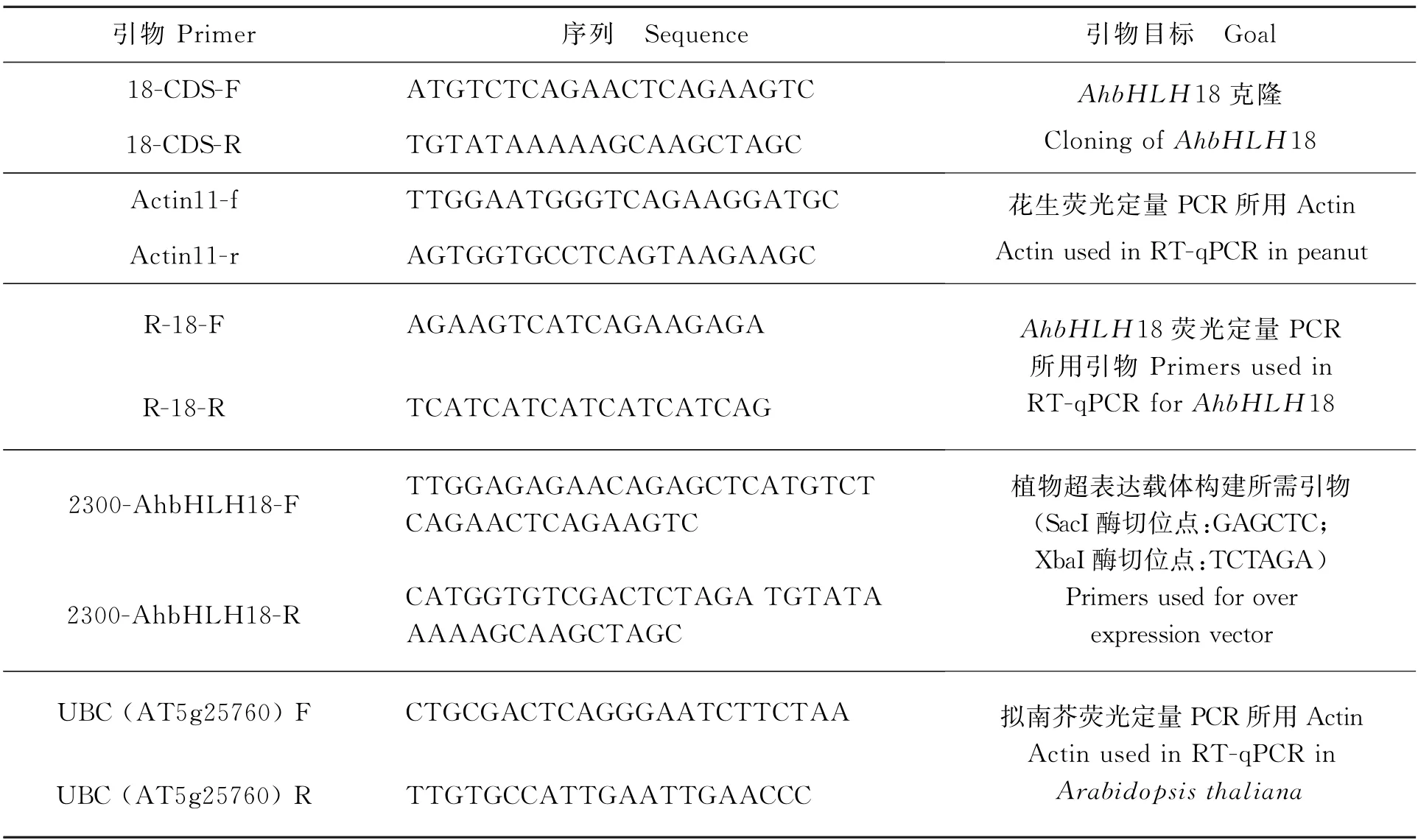
表1 研究所用引物Table 1 Primers used in this research
1.5 轉基因擬南芥的篩選與鑒定
將收獲的轉AhbHLH18轉錄因子的擬南芥T0代種子,播種于含卡那霉素50μg/mL 的MS培養基上,4℃黑暗放置1~2 d后,轉至光周期16 h/8 h(光照/黑暗)條件下培養1個月,提取其基因組DNA 與RNA,利用引物18-CDS-F、18-CDS-R 進行PCR與RT-PCR檢測。對檢測合格的株系保種繁殖,直至獲得T3代植株。
1.6 轉基因擬南芥耐鹽性檢測
野生型與轉基因擬南芥種子放置于4℃黑暗條件下培養3 d,進行春化作用。隨后,種子轉移至光照培養箱中培養,培養條件設置為:晝夜節律16 h/8 h,溫度22℃,光照強度200μmol/(m2·s),相對濕度65%。培養20 d 后,用400 mmol/L NaCl溶液進行鹽脅迫處理10 d,檢測野生型與轉基因擬南芥鹽脅迫下POD(過氧化物酶)、SOD(過氧化物歧化酶)、CAT(過氧化氫酶)活性和MDA(丙二醛)含量[17]。
2 結果與分析
2.1 目標轉錄因子序列與表達分析
測序結果表明,AhbHLH18 轉錄因子的編碼區(coding sequence,CDS)為585 bp,共編碼194個氨基酸,與栽培花生基因組(www.peanutbase.org)中的arahy.5IZP5X 序列一致。該基因位于栽培花生第18號染色體,長度為1 501 bp。編碼氨基酸中絲氨酸、亮氨酸、賴氨酸含量居前三位,分別為26、22和21個,占比分別為11.16%、9.44%和9.01%。AhbHLH18蛋白的分子量為26.147 k D,等電點為10.27,圖1為其二級結構。進化分析顯示AhbHLH18蛋白質與擬南芥同源基因AtbHLH18 蛋白(At2g22750)聚成一支。按照Toledo-Oritiz[15]的分類模式,AtbHLH18蛋白屬于14 亞家族,因此AhbHLH18 也屬于bHLH 家族14亞家族 (圖2)。
圖1 AhbHLH18氨基酸序列二級結構Fig.1 Secondary structure of AhbHLH18 amino acids
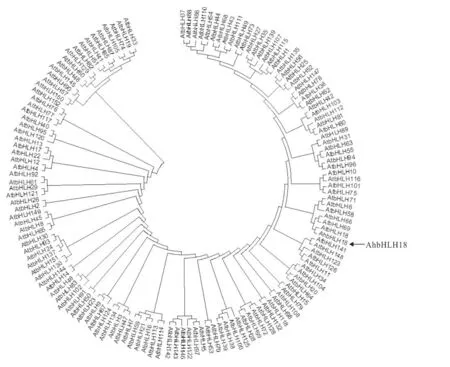
圖2 基于擬南芥基因組的AhbHLH18系統進化樹Fig.2 Phylogenetic analyses of AhbHLH18 protein based on bHLH domains from A rabidopsis thaliana
鹽脅迫處理后,AhbHLH18轉錄因子的表達有明顯變化(圖3)。12 h內,AhbHLH18轉錄因子的相對表達量處于上升階段,12 h后趨于穩定。相比0 h,6 h的相對表達量為顯著差異(P<0.05),12~48 h的表達量為極顯著差異(P<0.01)。
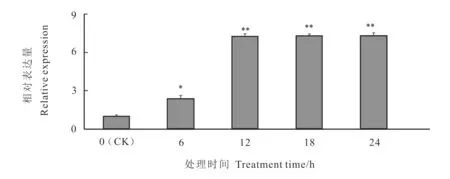
圖3 Ahb HLH 18鹽脅迫處理后表達模式Fig.3 Expression of Ahb HLH 18 under salt stress
2.2 植物表達載體pCAMBIA2300-AhbHLH18的構建與轉基因植株的篩選與鑒定
用SacI和XbaI雙酶切載體pCAMBIA2300和PCR擴增產物,T4 連接酶連接,構建了植物超表達載體。利用基因特異引物進行PCR 檢測,在轉基因擬南芥株系(T3-1與T3-2)中可以擴增到約700 bp的條帶,而在野生型擬南芥株系中未見對應條帶(圖4)。RT-PCR 檢測進一步表明,AhbHLH18 在轉基因擬南芥中已成功表達 (圖5)。
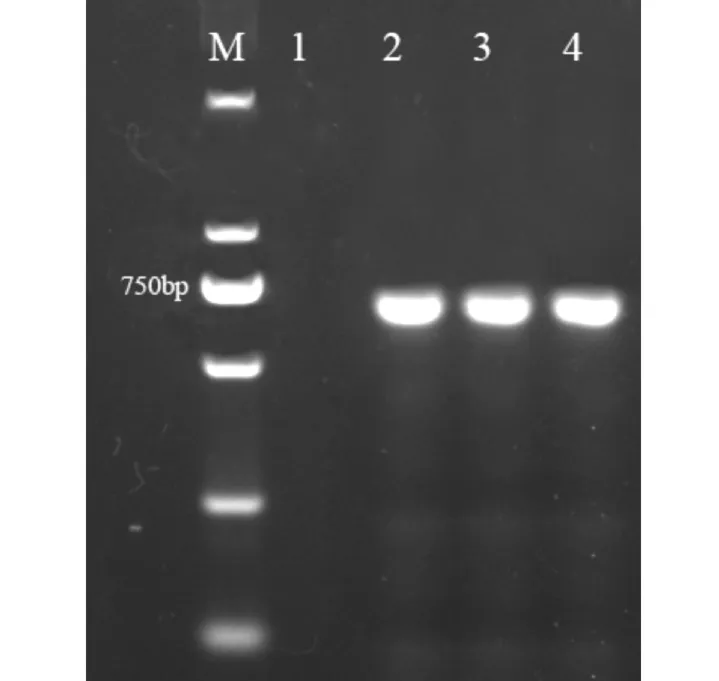
圖4 轉基因擬南芥的PCR 檢測Fig.4 Detection of transgenic lines A rabidopsis thaliana by PCR
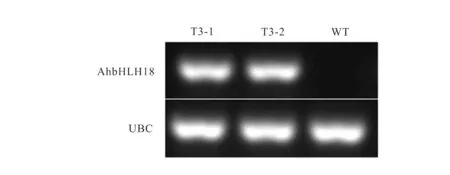
圖5 轉基因與野生型(WT)擬南芥RT-PCR 檢測Fig.5 The transcript level of AhbHLH18 overexpression in transgenic Arabidopsis and wild type(WT)plants assayed by RT-PCR
2.3 轉基因擬南芥耐鹽性檢測
正常條件下,野生型與轉基因擬南芥表型無差異。鹽脅迫處理10 d后野生型擬南芥表現出更加明顯的萎蔫狀態(圖6)。正常條件下,野生型與轉基因擬南芥中的抗氧化酶、MDA 含量無顯著差異。鹽脅迫處理后,轉基因擬南芥各類抗氧化酶如SOD、POD 和CAT 活性顯著高于野生型,野生型擬南芥的MDA 含量則顯著高于轉基因擬南芥(圖7)。試驗數據表明,抗氧化酶活性的增長在AhbHLH18基因應答鹽脅迫時發揮重要作用。花生AhbHLH18基因可調節植物體內抗氧化酶系統以應答鹽脅迫環境。

圖6 鹽處理轉基因與野生型擬南芥Fig.6 Salt-treatment assay of wild type and transgenic Arabidopsis plants
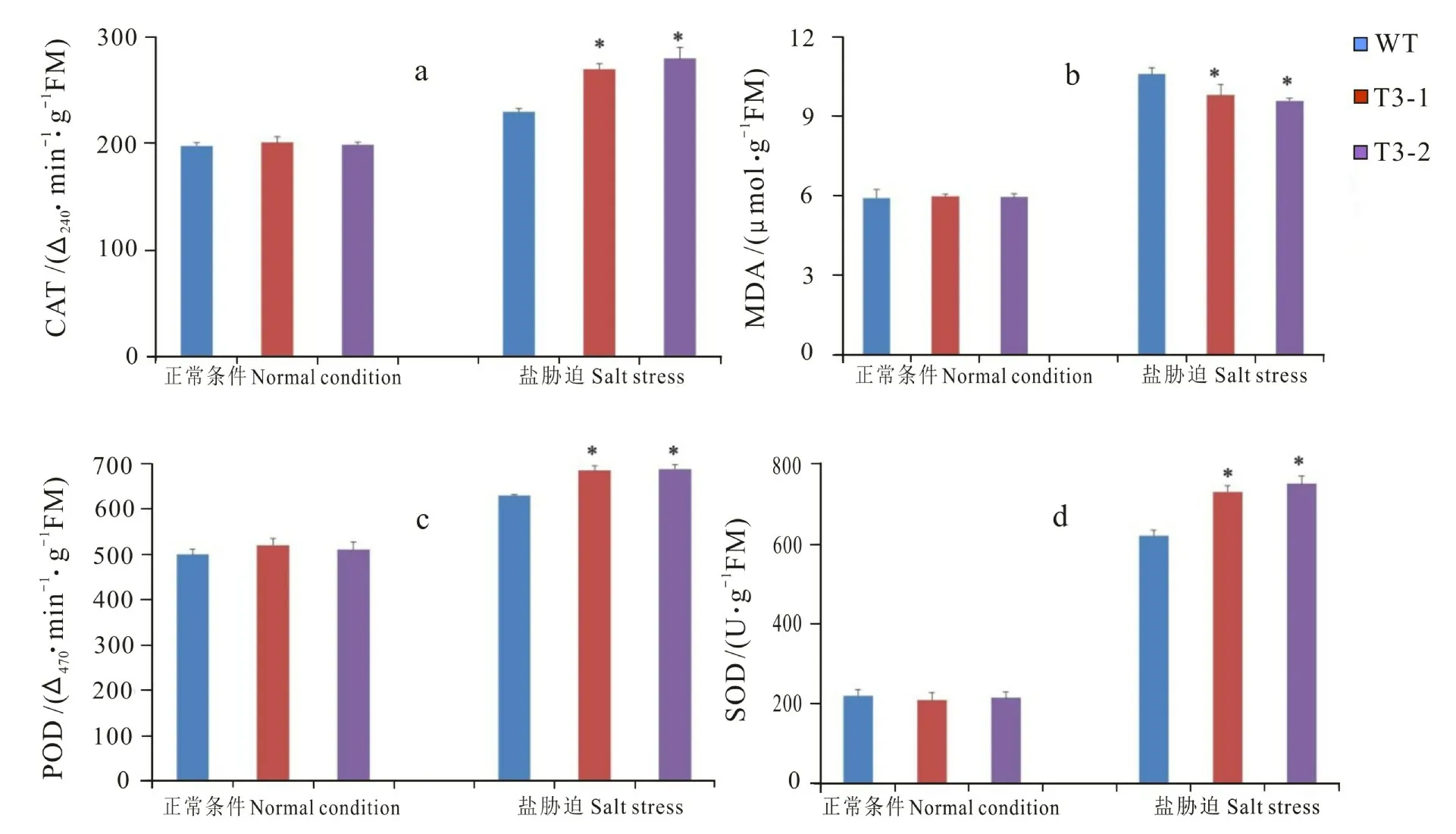
圖7 不同條件野生型擬南芥與轉基因擬南芥的生理指標變化Fig.7 The change of physiological indexes of the wild type and transgenic Arabidopsis plants under normal and salt stress condition
3 討論與結論
bHLH 轉錄因子家族被認為廣泛參與了植物非生物脅迫應答活動,包括干旱脅迫[18-19]、鹽脅迫[22-21]以及低溫脅迫[22-23]。但在花生中,相關研究仍然缺乏。本研究克隆了花生bHLH 轉錄因子AhbHLH18。進化分析顯示,AhbHLH18 蛋白質與擬南芥AtbHLH18(At2g22750)具有較近的親緣關系,屬于bHLH 家族14亞族。柑橘CsbHLH18 被認為由低溫所誘導,過表達CsbHLH18顯著提高了柑橘的耐冷性,沉默CsbHLH18則顯著降低了柑橘的耐冷性[24]。通過植物超表達載體構建,將花生AhbHLH18 基因轉入擬南芥中,鹽脅迫試驗結果顯示,過表達該基因可提高植株耐鹽性。進一步分析,轉基因擬南芥鹽脅迫處理后,一些抗氧化酶,如POD、SOD 和CAT 活性顯著高于野生型擬南芥,同時MDA含量顯著低于野生型擬南芥。結果顯示,AhbHLH18可通過調節過氧化物酶系統以降低植株的活性氧(reactive oxygen species,ROS)活性,從而提高植株的耐鹽性。ROS能夠破壞植物細胞元件,植物的抗逆性很大程度上取決于ROS的產生與消除之間的平衡[25]。研究表明,大量的基因可通過調節抗氧化酶的活性從而提高植株的抗逆性。Magwanga等發現,擬南芥中超表達CYP450基因,可以提高轉基因植株的抗旱性和耐鹽性,轉基因植株抗氧化酶活性顯著高于野生型擬南芥[26];通過提高過氧化酶活性,轉錄因子NtERF172能夠提高煙草抗旱性[27]。除過氧化酶系統外,bHLH 轉錄因子家族成員也可以通過其他方式影響植株的耐鹽性。AtMYC2 可調節Na+/H+轉運蛋白NHX 的表達,提高擬南芥耐鹽性[28];水稻bHLH 轉錄因子OrbHLH001 通過調節OsAKT1基因的表達以保持植株鉀離子平衡,從而提高植株的耐鹽性[29]。
現有研究表明,轉錄因子調控植物分子抗逆機制是一個極其復雜的動態網絡,其中包括整合以及協同競爭作用。下一步的工作應該是在這個動態網絡中,明確不同bHLH 轉錄因子家族成員的精準角色,從而為通過基因工程手段充分利用轉錄因子提高植物的抗逆性發揮更大作用。

