林氏念珠藻對酸化稻田水稻產量和土壤細菌群落結構與功能的影響
邵繼海,陳杰鋒,胡婷
(湖南農業大學 資源環境學院,長沙 410128)
化學氮肥在提高農作物產量方面發揮了極大的作用.然而,長期過量使用化學氮肥已導致一系列的農業和環境問題,如農田土壤酸化、水體富營養化和溫室氣體的釋放等[1-4].自20世紀80年代至今,我國農田土壤酸化形勢依然嚴峻,減少化學氮肥的使用量和提高化學氮肥的利用效率是遏制農田土壤酸化的主要措施.
固氮藍藻是農田生態系統的重要微生物類群.研究表明,固氮藍藻每季向稻田輸入的氮素量可以達到20~60 kg/hm2[5].在水稻生長過程中,接種固氮藍藻可減少近一半的化學氮肥,且使水稻增產10%~30%[6].固氮藍藻在提高水稻產量和減少稻田化學氮肥使用量方面具有很大的應用潛力.盡管目前關于固氮藍藻對農田氮素輸入以及對農作物的生長和增產效應有較多的研究,但向酸化農田接種固氮藍藻后,對水稻產量及農田微生物結構與功能的影響卻鮮有報道.本研究通過稻田小區試驗,探討了在酸化稻田中接種固氮藍藻對水稻產量、土壤酶活性和土壤中細菌多樣性的影響,以期為酸化稻田中固氮藍藻的合理利用以及提高水稻產量與土壤肥力提供科學依據.
1 材料和方法
1.1 小區試驗位點概況及試驗設計
小區試驗于2020年在湖南省瀏陽市蕉溪鎮水稻田(113°32′13.11″E,28°13′40.79″N)進行.該稻田土壤pH為5.2;全氮0.55 g/kg;銨態氮0.05 mg/kg;總磷0.65 g/kg;有效磷11.63 mg/kg.試供藻種為林氏念珠藻(NostoclinckiaFACHB104),由中國科學院水生生物研究所提供.使用BG-11培養基進行藻種擴大培養,培養溫度為28 ℃,光照周期光暗比設置為12L∶12D,光照強度為24 lx.待林氏念珠藻培養至對數末期,將其轉入無氮BG-11培養基中培養15 d,然后接種至稻田.試驗分為對照(CK)和接種林氏念珠藻處理(NL).每個處理設置3個重復,隨機排列,共設計6個試驗小區,每個小區的大小為4 m×5 m.NL處理組接種經過氮饑餓的林氏念珠藻培養液,CK處理組接種等體積的無氮BG-11培養基.每次接種量約為6.6×1010cells/m2.從水稻插秧后第2 d到水稻乳熟期,每15 d接種1次.水稻品種為雜交稻天優華占.水稻插秧前一周施加基肥,施用量為尿素166.67 kg/hm2, 氯化鉀166.67 kg/hm2, 過磷酸鈣291.29 kg/hm2.插秧1月后施加追肥,追肥用量為氯化鉀100 kg/hm2, 過磷酸鈣175.68 kg/hm2.水分管理方式為全生育期淹水.
1.2 樣品采集及測定
土壤樣品于水稻成熟期采集,在各試驗小區采集至少5個點的0~20 cm耕作層土壤,混勻,挑出植物殘體后,采用4分法裝袋.一部分新鮮土樣裝于封口袋放于-80 ℃超低溫冰箱儲存,用于分析土壤微生物分子多樣性;一部分新鮮土壤裝于封口袋放于4 ℃冷藏,用于分析土壤酶活性.另一部分樣品儲存于自封袋內并轉移至實驗室自然風干,碾磨過篩后測定其基本理化性質.
土壤pH采用電位法測定[7];土壤中有機質、銨態氮、硝態氮、總磷、有效磷、陽離子交換量參考文獻[7].土壤中脲酶采用苯酚鈉-次氯酸鈉比色法測定;酸性磷酸酶采用對硝基苯比色法測定;土壤纖維素酶采用蒽酮硫酸比色法測定.上述酶活性具體測定方法參照文獻[8].土壤固氮酶活性采用乙炔還原法測定[9-10].水稻成熟后,采用5點取樣法收割水稻穗.將谷粒樣品置于室外陽光下曬干,稱質量,測定其產量.
1.3 高通量測序
選用土壤DNA提取試劑盒(天根)提取土壤樣品總DNA,使用16S rDNA通用引物515F(5'-GTGCCAGCMGCCGCGG-3')和806R(5'-CCGTCAATTCMTTTRAGTTT-3')擴增細菌16S rRNA基因的V4~V5區[11].PCR熱循環方案設置為:95 ℃預變性5 min,然后進入25個循環擴增階段,每個循環包括變性95 ℃ 30 s,退火54 ℃ 30 s,延伸72 ℃ 30 s,最后于72 ℃保溫5 min.PCR擴增在ABI GeneAmp PCR System 9700(Applied Biosystems,CA,USA)上進行.使用2%(質量分數)的瓊脂糖凝膠對PCR產物進行電泳檢測,并使用AxyPrep DNA凝膠提取試劑盒(Axygen Biosciences,Union City,CA,USA)進一步純化.使用QuantiFluorTM-ST(PromegaUSA)對純化的擴增子進行定量,上海美吉生物醫藥科技有限公司的Illumina MiSeq平臺上進行高通量測序.
1.4 數據統計分析
試驗數據用SPSS 13.1進行統計分析,處理組和對照組的兩兩比較采用t檢驗,p<0.05時表示差異顯著.采用皮爾森(pearson)相關性分析來研究土壤酶活性與土壤理化性質,以及細菌相對豐度與土壤理化性質的相關性.
2 結果與分析
2.1 土壤理化性質與水稻產量
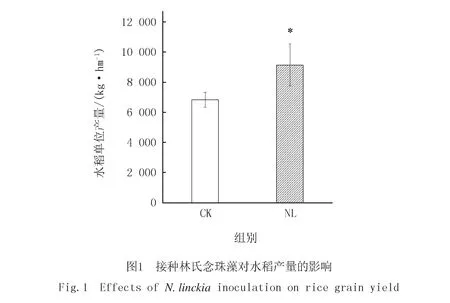
由表1可以看出,接種林氏念珠藻顯著提高了土壤中銨態氮的含量,與對照組相比,其銨態氮含量提高了27.0%.林氏念珠藻對土壤pH,有機質,硝態氮,陽離子交換量影響不顯著.接種林氏念珠藻處理組土壤中速效磷平均值大于對照組,但統計分析結果顯示其差異未達到顯著性水平.由圖1可知,接種林氏念珠藻能顯著增加水稻的產量,增幅為33.7%.

表1 不同處理的土壤理化特征
2.2 土壤酶活性
由圖2可以看出,接種林氏念珠藻處理組的土壤固氮酶、酸性磷酸酶和纖維素酶的活性均顯著增強,與對照相比,分別增加了40.3%,50.8%和90.9%.土壤脲酶活性分析結果顯示,接種林氏念珠藻對該酶的活性沒有顯著影響.
2.3 土壤酶活性與土壤理化性質的相關性分析
由表2可知,土壤中酸性磷酸酶與銨態氮的相關系數為0.82,呈顯著正相關.纖維素酶與pH的相關系數為-0.82,呈顯著負相關.纖維素酶與銨態氮的相關系數為0.96,呈極顯著正相關.固氮酶活性與有機質的相關系數為-0.83,呈顯著負相關.
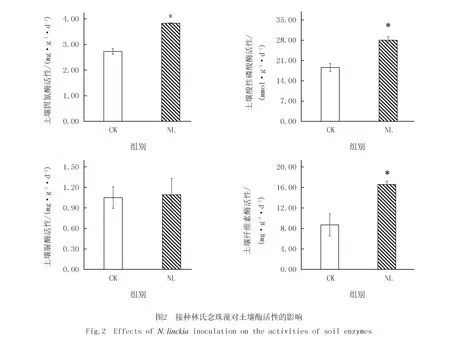
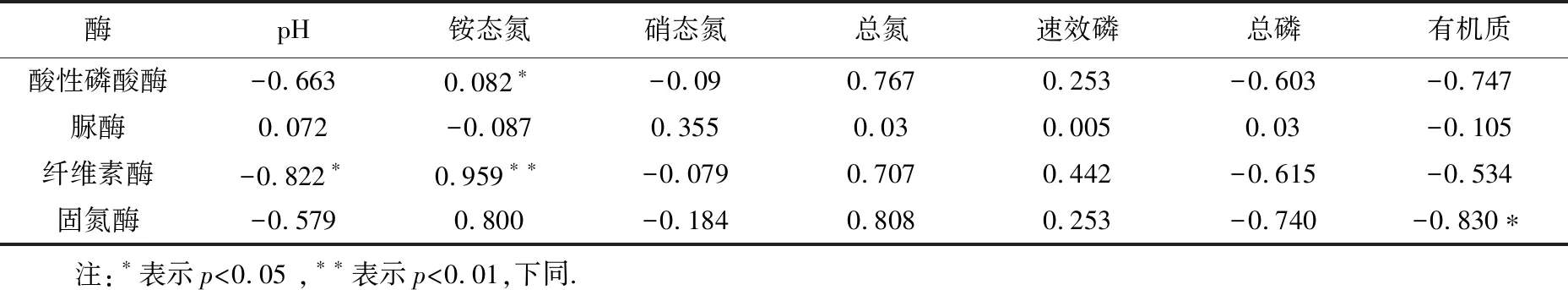
表2 土壤酶活性與土壤理化性質的皮爾森相關性分析
2.4 土壤中細菌群落多樣性分析
高通量測序的結果顯示,該稻田土壤中的優勢細菌主要分布于變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、綠彎菌門(Chloroflexi)、酸桿菌門(Acidobacteria)、浮霉菌門(Planctomycetes),這5個菌門的相對豐度占比之和高達73.19%~74.89%(圖3),其中變形菌門占比最高,為22.89%~23.10%.其次為放線菌門和綠彎菌門,分別占比 13.53%~17.22% 和 12.42%~21.72%.從各類群相對豐度的平均值來看,接種林氏念珠藻后,放線菌門、擬桿菌門(Bacteroidetes)、芽單胞菌門(Gemmatimonadetes)的相對豐度均有所增加,而綠彎菌門和浮霉菌門相對豐度均有所降低.統計分析的結果顯示,在上述主要的微生物類群中,僅放線菌門的相對豐度在接種林氏念珠藻處理和對照之間存在顯著性差異.
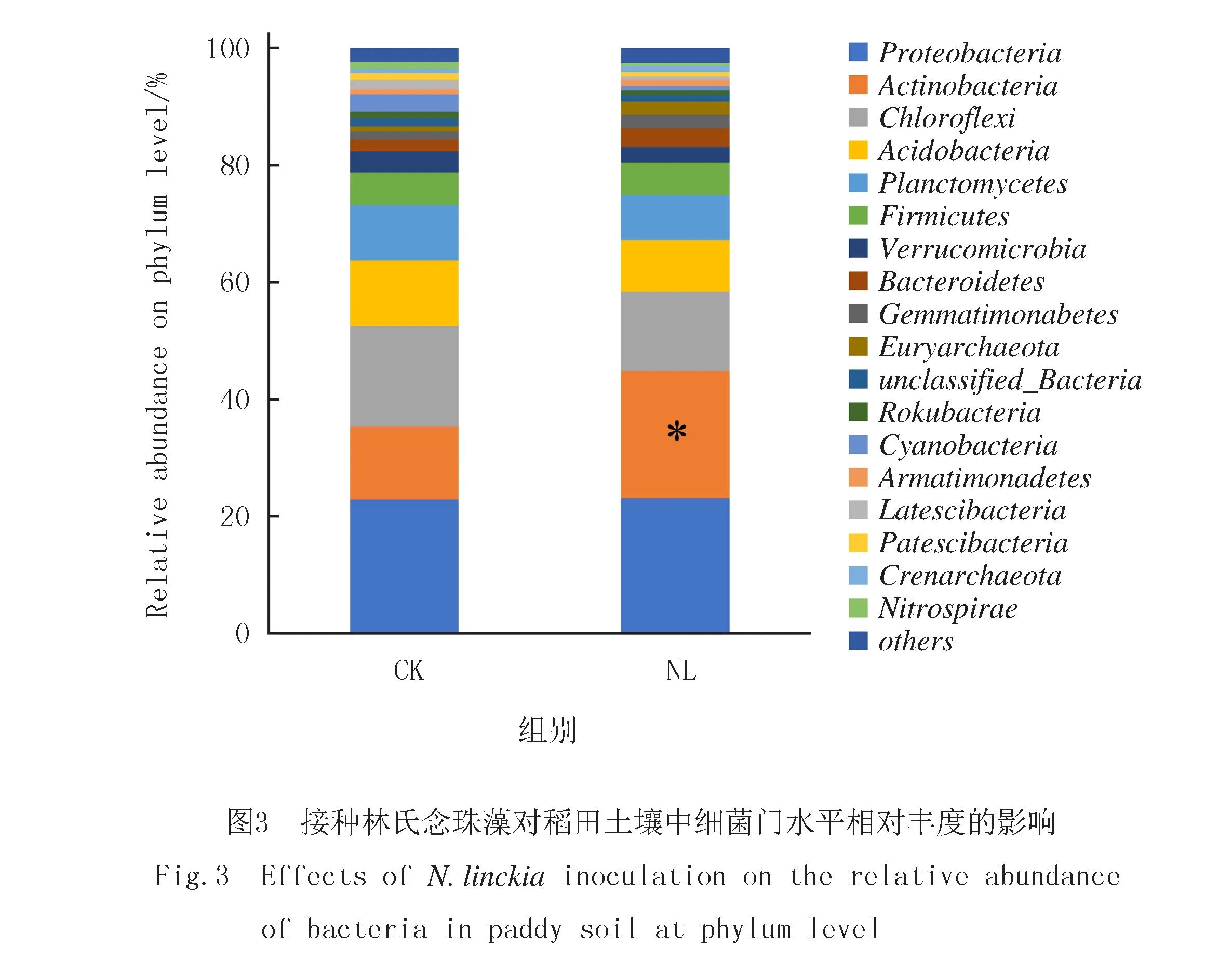
為了揭示土壤中細菌群落結構變化與主要環境因子的關系,將相對豐度前10位的細菌類群(門水平)與土壤中總氮、銨態氮、硝態氮、總磷、效磷、有機質含量和pH等7個環境因子做皮爾森相關性分析(表3).結果顯示,放線菌與浮霉菌的相對豐度分別與土壤中的總磷、速效磷含量呈顯著負相關;疣微菌和藍藻的相對豐度均與土壤中的銨態氮呈顯著負相關;擬桿菌的相對豐度與土壤的氨氮呈顯著正相關,與土壤pH值呈顯著負相關.其余5個主要細菌類群與上述7個環境因子均無顯著相關性.
為了進一步了解細菌群落結構與主要環境因子的關系,在上述相關性分析的基礎上,從目分類水平將放線菌門、疣微菌門、藍藻門、擬桿菌門中的主要類群與土壤的pH、銨態氮、總磷進行了皮爾森相關性分析(附表2),結果顯示疣微菌門中的Chthoniobacterales,藍藻門中的色球藻目(Synechococcales)和細鞘絲藻目(Leptolyngbyales)與pH呈顯著正相關,而擬桿菌門中的擬桿菌目(Bacteroidales)和Kryptoniales與pH呈顯著負相關.色球藻目和細鞘絲藻目與土壤中銨態氮含量呈顯著負相關,而放線菌門中的弗蘭克氏菌目(Frankiales),Solirubrobacterales和擬桿菌門中的擬桿菌目與銨態氮含量呈顯著正相關.疣微菌門中的Pedosphaerales與土壤中總磷含量呈顯著正相關.
表4顯示了不同處理條件下稻田土壤中細菌群落的α多樣性指數的變化情.各處理組高通量測序覆蓋率均大于95%,說明測序結果比較可靠,能夠有效反映樣本中細菌群落的多樣性.除Coverage指標外,接種林氏念珠藻處理的α多樣性指數值均略高于對照組.然而,統計分析的結果顯示,這兩組處理的各多樣性指數均不存在顯著差異.
3 討 論
固氮藍藻可以通過生物固氮和光合作用向農田輸入銨態氮和有機碳,提高土壤肥力,促進農作物生長[10-11].此外,有研究表明,一些固氮藍藻還能合成植物促長激素,促進作物生長和提高作物產量[12].本研究結果顯示,在酸化稻田接種固氮藍藻可以有效地提高水稻產量.研究結果顯示,接種林氏念珠藻可以顯著提高土壤中固氮酶的活性和銨態氮的含量,基于這些結果推測氮素輸入是該固氮藍藻提高水稻產量的作用方式之一.磷酸酶能活化土壤中的非生物有效態磷元素,使其變為作物可以吸收的有效態磷,進而促進作物生長[13].接種林氏念珠藻后,土壤中酸性磷酸酶活性顯著升高,但是土壤中有效磷的含量與對照相比無顯著差異,其原因可能是稻田中的微生物和水稻吸收了更多的有效磷.據此推測,提高磷元素的可獲取性也可能是接種林氏念珠藻提高水稻產量的另一原因.文獻[14]研究了稻田新紀錄固氮藍藻類珠藻對水稻生長、產量及稻田土壤理化特性的影響,在大田試驗條件下,接種類珠藻可以使水稻增產25.1%,但是對土壤理化特性無顯著影響;本研究結果顯示,接種林氏念珠藻使水稻增產33.7%,土壤中的銨態氮含量顯著高于對照處理.本研究所用的土壤為酸性土壤,土壤酸化能抑制作物對氮素養分和無機陽離子的吸收,降低作物產量[15],這些因素導致本田間試驗水稻產量較低.
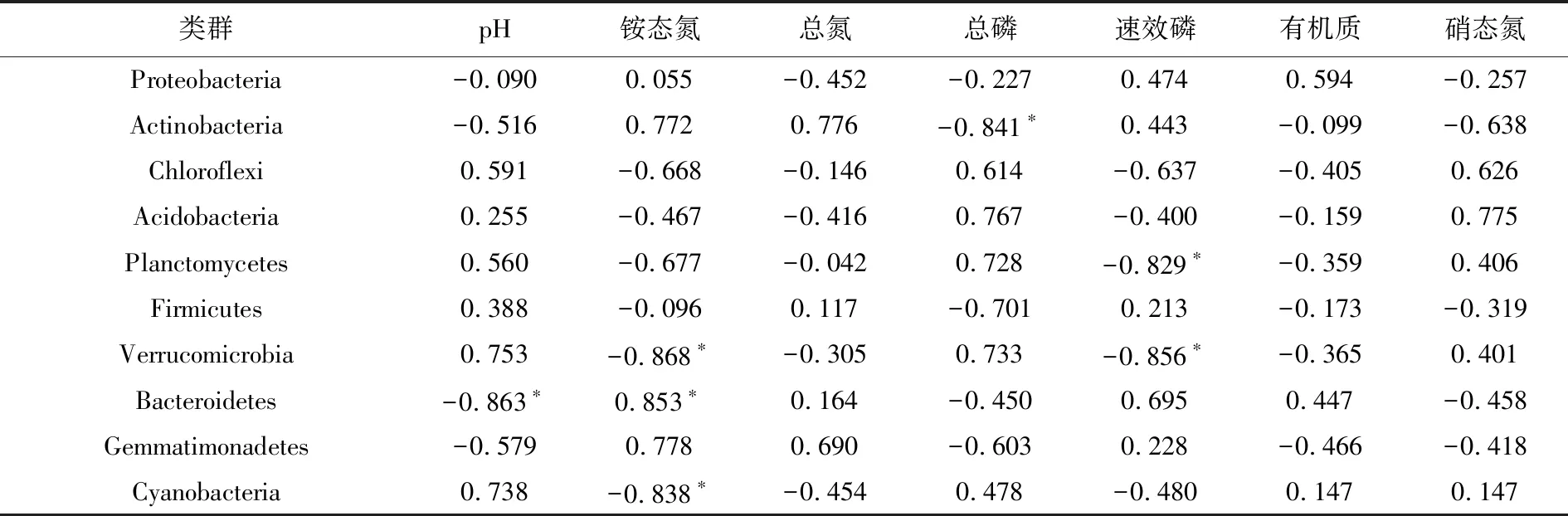
表3 土壤中主要細菌類群相對豐度與土壤理化性質的皮爾森相關性分析

表4 接種林氏念珠藻對土壤中細菌α多樣性指數的影響
土壤酶的活性受土壤理化性質的影響.有研究表明,微生物磷酸酶活性與環境中氮素營養水平直接相關[16].根據本文皮爾森相關性分析結果,土壤中銨態氮含量與酸性磷酸酶呈顯著正相關.接種林氏念珠藻后,土壤固氮酶活性升高,銨態氮含量增加.氮素營養水平的升高刺激土壤微生物磷酸酶的活性.纖維素酶活性是評價土壤肥力的重要指標[17],纖維素分解菌與固氮微生物之間存在較為普遍的碳氮互惠關系[18],接種林氏念珠藻增強了土壤中纖維素酶的活性,再次從酶活性的角度證明固氮藍藻與纖維素分解菌之間存在互惠的關系,該結果也從纖維素酶活性的角度表明接種林氏念珠藻能夠提高土壤肥力.盡管有文獻報道固氮藍藻可以通過光合作用向農田輸入有機碳[11],然而本試驗結束后,接種林氏念珠藻處理組土壤中有機質含量與對照相比無顯著差異.其原因可能是接種固氮藍藻后微生物分解代謝有機質的活性增強,有機物分解速度增加,抵消了固氮藍藻光合作用向土壤輸入的有機質.而土壤有機質與固氮酶活性呈顯著負相關也間接證明了這一點.
土壤中變形菌門、酸桿菌門、浮霉菌門、放線菌門和綠彎菌門的豐度往往較高[19],本研究結果顯示,這5個細菌類群的相對豐度之和超過總細菌類群的70%.這也進一步肯定了這些微生物是稻田土壤的主要細菌類群.如圖3所示,接種林氏念珠藻后,土壤中放線菌門的相對豐度顯著高于對照.放線菌是農田土壤中的重要微生物類群,這類微生物具有強大的有機物分解能力,一些種類還具有生防和固氮的活性[20-21].屬分類水平的分析結果顯示,接種林氏念珠藻處理組土壤中諾卡氏菌屬(Nocardioides)、酸熱菌屬(Acidothermus)及一個未鑒定到屬的蓋勒氏菌目(Gaiellales)放線菌的相對豐度顯著高于對照.諾卡氏菌和酸熱菌對纖維素、木質素及多種有機污染物具有較強的降解能力[22-23].該類微生物豐度的增加可以提高稻田土壤有機碳的周轉,這也可能是接種林氏念珠藻處理組土壤中纖維素分解酶活性高于對照的原因.
土壤中微生物的群落組成與環境因子息息相關.土壤中氮、磷、有機質含量及土壤pH對土壤微生物群落結構有顯著的影響[24].皮爾森相關性分析結果顯示,藍藻門的相對豐度均與土壤中的銨態氮呈顯著負相關,而擬桿菌門和放線菌門中的一些種類的相對豐度與土壤中銨態氮呈顯著正相關.盡管接種的林氏念珠藻在分類系統中屬于念珠藻科(Nostocaceae),本研究在科分類水平的群落組成分析結果顯示,念珠藻科的類群在藍藻門中所占的相對比例比較低,占比均不到10%,其中的優勢類群為色球藻科(Synechococcaceae)、微囊藻科(Microcystaceae)和細鞘絲藻亞科(Leptolyngbyaceae).本研究中生物多樣性樣品的采集時間為水稻成熟期,距離最近的一次林氏念珠藻接種時間已有一個多月,林氏念珠藻種群在稻田中的衰退可能是導致念珠藻科藍藻相對豐度較低的原因.藍藻分布與環境因子的關系復雜,不同生境存在著不同模式.以色球藻科藍藻為例,SILAMBARASAN等[25]研究結果顯示,海洋中色球藻科藍藻的豐度與水體營養鹽,如銨態氮、硝態氮、磷酸鹽等的含量呈負相關,而FRADE等[26]研究結果則顯示大堡礁周圍海水中的色球藻科藍藻的豐度與水體營養鹽呈正相關.本研究結果則顯示稻田色球藻科藍藻與土壤中銨態氮含量呈負相關.也正是因為色球藻目和細鞘絲藻目這些優勢藍藻類群的相對豐度與土壤中銨態氮含量呈負相關,從而出現藍藻門的相對豐度與土壤中銨態氮呈負相關的現象.本研究接種林氏念珠藻后,土壤中綠彎菌門和浮霉菌門相對豐度均有所降低,但相關性分析結果顯示,這兩類微生物的相對豐度變化與本研究測定的7個環境因子均無顯著相關性.土壤中微生物群落結構的演替除了與環境因子相關外,還與微生物之間的相互作用相關[27].對本研究中主要細菌類群相對豐度之間的相關性進行了分析,結果表明綠彎菌與酸桿菌、浮霉菌、疣微菌呈顯著正相關,與擬桿菌呈顯著負相關.浮霉菌與疣微菌呈顯著正相關.目前國內外關于微生物之間的相互作用與群落演替關系的認識還非常有限,關于稻田接種林氏念珠藻引起微生物群落結構改變的驅動因子還有待進一步研究.
4 結 論
向酸化稻田接種林氏念珠藻能顯著增加土壤中銨態氮的含量并提高水稻產量.林氏念珠藻能提高土壤中放線菌的相對豐度,并增強土壤中固氮酶、磷酸酶和纖維素酶的活性.

