基于質量源于設計(QbD)理念的葛根總黃酮-甘草酸納米粉體的制備與質量評價
陳海溶,丁 楊,劉貞貞,劉佳佳,王雨宵,沈愛宗,郭 健, 2, 3, 4,桂雙英, 2, 3, 4
基于質量源于設計(QbD)理念的葛根總黃酮-甘草酸納米粉體的制備與質量評價
陳海溶1,丁 楊1,劉貞貞1,劉佳佳1,王雨宵1,沈愛宗5,郭 健1, 2, 3, 4*,桂雙英1, 2, 3, 4*
1. 安徽中醫藥大學藥學院,安徽 合肥 230012 2. 藥物制劑技術與應用安徽省重點實驗室,安徽 合肥 230012 3. 安徽省中醫藥科學院藥物制劑研究所,安徽 合肥 230012 4. 現代藥物制劑安徽省工程技術研究中心,安徽 合肥 230012 5. 中國科學技術大學附屬第一醫院/安徽省立醫院藥劑科,安徽 合肥 230001
基于質量源于設計(quality by design,QbD)理念優化制備葛根總黃酮-甘草酸納米粉體(total flavonoids-glycyrrhizic acid nanopowder,PG-NP),并對其進行質量評價。采用超聲破碎-高壓均質法制備PG-NP混懸液。以PG-NP混懸液的粒徑、多分散指數(polydispersity index,PDI)和ζ電位作為關鍵質量屬性,應用魚骨圖篩選風險因素。采用Plackett-Burman設計試驗篩選關鍵工藝參數(critical process parameters,CCPs),在此基礎上結合Box-Behnken設計優化PG-NP混懸液的處方配比,應用單因素試驗確定PG-NP中凍干保護劑含量。對優化后的PG-NP進行掃描電子顯微鏡(scanning electron microscope,SEM)、X射線衍射儀(X ray diffraction,XRD)、差示量熱掃描儀(differential scanning calorimetry,DSC)表征,并考察PG-NP中葛根素體外溶出性能。PG-NP的最優制備工藝和處方配比:藥輔比為 17.5∶1、甘草酸用量為0.13%、攪拌轉速為470 r/min、均質壓力為128.3 MPa、甘露醇用量為5%。優化后PG-NP粒徑為(228.00±7.80)nm,PDI為0.29±0.05,ζ電位為(?23.10±0.93)mV。PG-NP為具有針棒狀晶型的淡黃色粉末,且其體外溶出性能較原料藥有明顯提高。采用QbD理念優化的PG-NP制備工藝簡單易行,處方設計合理,質量可控,可有效改善難溶性成分的溶出。
質量源于設計;葛根總黃酮;甘草酸;納米粉體;溶出度;質量評價;超聲破碎-高壓均質法;魚骨圖;Plackett-Burman設計;關鍵工藝參數;Box-Behnken設計
葛根總黃酮(total flavonoids,PF)是來源于葛根中的一類活性成分,具抗血栓[1]、抗動脈硬化[2]、抗氧化應激[3]等多種藥理活性。PF中成分包括葛根素、大豆苷、3′-羥基葛根素、3′-甲氧基葛根素以及葛根素芹菜糖苷等[4],其黃酮成分上的C-4和C-7位羥基常被葡萄糖、磷脂糖或木糖等糖殘基取代,形成7--或4--糖苷化合物。由于以上PF的結構特性,導致PF的水溶性和脂溶性均不佳。此外,PF的主要活性成分葛根素屬于BCS分類系統IV類化合物[5],溶解度僅為0.86%,口服吸收差,生物利用度較低[6]。目前,PF的市售制劑主要為葛酮通絡膠囊[7]和愈風寧心片[8]。然而PF生物利用度低導致患者順應性差,使其臨床應用受到了極大的限制[6]。為了解決難溶性藥物口服吸收生物利用度低的問題,近年來相繼開發了固體分散體[9]、固體脂質納米粒[10]、微乳[11]、生物黏附制劑[12]及藥物納米粉體等新型制劑。
其中納米粉體(nanopowder,NP)具有載藥量大、溶解度高、易于加工成其他劑型、給藥途徑靈活的優點。NP可通過增加介質與藥物晶體接觸的曲率和降低粒徑改善藥物的生物利用度和組織分布[13]。選擇NP作為PF載體,有助于提升PF的溶解度和溶出效率,為更好的發揮PF的藥理作用奠定了制劑學基礎。甘草酸是一種含有2種葡萄糖醛酸的三萜皂苷[14]。甘草酸的疏水性基團三萜部分殘基可吸附于難溶性藥物表面,親水基團葡萄糖醛酸殘基則分散在水中形成球網狀結構[15],通過降低NP的自由流動性提高難溶性藥物的溶解度[16]。甘草酸的表面活性特性表明其可作為NP天然穩定劑[17]。此外,有研究發現甘草酸還可通過影響腸上皮細胞膜內脂質位置和排列順序增加藥物在小腸部位的滲透,促進藥物口服吸收[18]。因此,本實驗選擇甘草酸作為葛根總黃酮-甘草酸納米粉體(PF-glycyrrhizic acid nanopowder,PG-NP)的穩定劑,有望進一步提高PF的溶解度和生物利用度,并為后續口服劑型開發提供依據。
由于采用傳統經驗篩選法對制劑處方工藝進行優化存在耗時,且無法體現各因素結合后集體效應與相互作用的缺點。采用質量源于設計(quality by design,QbD)理念對制劑處方工藝進行優化是通過實驗設計建立起因變量和自變量之間的聯系,管理最終產品質量的風險,具有降低產品變動性、提高生產效率以及節約生產成本的優勢[19-20]。本實驗以PF為原料藥物,應用QbD理念優化PG-NP混懸液的制備工藝與處方。以目標產品質量特性描述(quality target product profile,QTPP)為起點,對藥物質量特性、有效性深入研究分析[13]。采用魚骨圖分析法對影響PG-NP生產工藝的關鍵質量屬性(critical quality attribute,CQA)的各類因素進行分析,運用Plackett-Burman(PB)設計試驗篩選關鍵工藝參數(critical process parameters,CPPs),結合Box-Behnken設計(BBD)建立CPPs與CQA聯系的設計空間,優選出PG-NP混懸液最優處方與制備工藝。選擇單因素試驗優化凍干保護劑甘露醇的含量,并采用掃描電子顯微鏡(scanning electron microscope,SEM)觀察、X射線衍射(X ray diffraction,XRD)分析、差示量熱掃描(differential scanning calorimetry,DSC)分析等方法表征PG-NP的形貌和結構,考察了PG-NP的體外溶出度。本實驗通過借助QbD設計管控PG-NP全部制備過程的質量,以期得到工藝簡單易行,處方設計合理,質量穩定的PG-NP。
1 儀器與材料
1.1 儀器
U3000型高效液相色譜儀,賽默飛世爾科技公司;01B203超聲破碎儀;APV2000型高壓均質機,德國SPX;AE240型十萬分之一電子天平,美國Mettler-Toledo公司;KQ200型數控超聲波清洗器,昆山市超聲儀器有限公司;3000HS型粒徑分析儀,美國Malvern Instrument公司;S-4800型掃描電子顯微鏡,株式會社日立制作所;Dmax2500 X型射線衍射儀,日本理學株式會社;RTC-2型磁力攪拌器,鞏義市予華儀器有限責任公司;ZRS-8L型智能溶出試驗儀,天大天發科技有限公司;Alpha 1-4 LSCplus型冷凍干燥機,德國Christ公司。
1.2 試劑
葛根素對照品,上海源葉科技有限公司,批號B20446,質量分數>98%;PF(葛根素質量分數≥31%),安徽九方制藥有限公司饋贈,批號210916;甘草酸,批號NO9GS166788,質量分數≥95%,上海源葉科技有限公司;甘露醇,批號1906012,質量分數≥95%,西隴科學股份有限公司;超純水,由Millipose公司Milli-Q超純水系統制備;甲醇、乙腈均為色譜純;其他試劑均為分析純。
2 方法與結果
2.1 PG-NP混懸液的制備
精密稱取PF 60.00 mg,加入1 mg/mL甘草酸的水溶液中,加熱攪拌,超聲15 min(20~25 kHz,390 W),得到PG-NP粗混懸液,轉入高壓均質機,在一定壓力下均質循環15次,即得PG-NP混懸液。
2.2 平均粒徑、多分散指數(polydispersity index,PDI)、再分散指數(redispersibility index,RDI)的測定
取“2.1”項中PG-NP混懸液適量,采用馬爾文粒度儀平行測定粒徑及PDI 3次,取均值。以RDI為納米粉體凍干后再分散性的評價指標,計算公式為RDI=凍干再分散后測得的粒徑/初始粒徑。RDI數值越接近1,表明凍干后“固化損傷”越小。
2.3 QTPP分析
以QbD理念中的產品研發思路為指導,根據已經上市的PF制劑要求以及臨床口服制劑要求制定了QTPP,結果見表1。
2.4 CQA分析
通過分析QTPP表格,深入探討評估在后續處方開發、工藝篩選以及藥品安全性的實驗中滿足規定質量屬性,確定一些影響力較大的質量屬性為CQA,結果如表2所示。
2.5 PG-NP混懸液的風險評估(魚骨圖法)
魚骨圖法探究可能影響PG-NP混懸液CQA的風險因素,主要包括設備、環境和人員等不可控風險因素以及物料、處方配比和制備工藝等可控因素,初步對各因素潛在風險因素進行定性評估和標記,結果見圖1。
2.6 實驗設計優化PG-NP混懸液處方及工藝
2.6.1 PB設計試驗篩選關鍵影響因素 通過對PG-NP混懸液處方及制備工藝的分析,以藥輔比(1)、甘草酸用量(2)、攪拌轉速(3)、攪拌溫度(4)、超聲頻率(5),超聲時間(6)、高壓均質循環次數(7)、高壓均質壓力(8)為考察對象,以粒徑(1)、PDI(2)和ζ電位(3)為評價指標,利用PB設計試驗篩選出對PG-NP性質影響較顯著的因素。因素水平、篩選試驗安排及結果見表3。

表1 PG-NP的QTPP

表2 CQA分析

圖1 PG-NP混懸液魚骨圖
通過Mintab軟件分析PB設計試驗,其回歸模型為1=?279.03+18.681+29.682+2.753+9.634+0.485-13.876-7.537-27.688,1=0.961 7,1adj=0.859 5;2=0.37-0.030 581+0.082 72+0.011 433+0.018 484+0.011 425+0.010 776-0.015 487-0.009 18,2=0.952 4,2adj=0.825 5;3=-33.175+3.2871+2.0922-1.5033+0.8804+0.3755-0.4486+0.1087+0.0638,3=0.985 7,3adj=0.947 5。說明以上模型與數據擬合度較高,模型的預測結果符合混懸液制備過程實際操作情況。通過12次運行評估8個因素,以粒徑、PDI以及ζ電位為指標,確定顯著影響因素CPPs。通過ANOVA和多元線性回歸分析評估顯著性水平和因素系數,結果見表4。結果發現主要的顯著因素為處方因素藥輔比和甘草酸用量(<0.05),高壓均質壓力對粒徑的影響有顯著影響(<0.05),且攪拌轉速對電位也有顯著影響(<0.05)。因此在接下來的BBD設計中進一步考察藥輔比、甘草酸用量、攪拌轉速以及高壓均質壓力4個變量。

表3 PG-NP關鍵影響因素的PB設計試驗的因素水平、試驗安排及結果(n = 3)
2.6.2 BBD優化 通過PB設計試驗,篩選出對PG-NP混懸液性質影響較顯著的4個因素:1、2、3、8。因素水平、處方優化試驗結果見表5。將上述4個因素作為考察對象,以1、2和3為評價指標,采用Design Expert 12.0軟件進行數據分析,對綜合評分與各考察因素之間的關系進行2項式方程擬合和方差分析,結果所得方程如下:1=255.47-30.531+5.072+0.210 83-24.668+41.3912+14.2782,12=0.922 5,adj12=0.901 4;2=0.303 0-0.039 11-0.010 12-0.017 63-0.046 08+0.041 312+0.047 112+0.020 832+0.042 782,22=0.892 0,adj22=0.848 8;3=?35.29-8.371-0.014 172-0.445 03-0.504 28+12.2512,32=0.917 0,adj32=0.899 0。由此可證明模型擬合良好。各方差分析顯示藥輔比對粒徑、PDI和ζ電位影響最大,根據擬合方程繪制各因素與粒徑、PDI和ζ電位的3D曲面圖2~4。

表4 Y1、Y2和Y3的統計分析
根據Design Expert 12.0實驗設計軟件綜合評價后給出的最佳制備條件:PF與甘草酸的比例為17.5∶1、甘草酸用量為0.13%、攪拌轉速為470 r/min、高壓均質壓力為128.3 MPa。3批驗證試驗與模型優選的最佳處方條件,測得PG-NP混懸液的粒徑、PDI和ζ電位。

表5 BBD試驗設計及結果(n = 3)
2.6.3 優化處方驗證 根據Design Expert 12.0實驗設計軟件綜合評價后給出的PG-NP混懸液的最佳制備工藝和處方:藥輔比為17.5∶1,甘草酸用量為0.13%,攪拌轉速為470 r/min,高壓均質壓力為128.3 MPa。按照“2.1”項下方法制備最優處方PG-NP 3批,按照“2.2”項方法測定PG-NP平均粒徑、PDI和ζ電位,實測值與模型預測值結果見表6,可知實測值和模型預測值比較接近,說明模型預測性良好。
2.7 固化工藝考察
以PG-NP的外觀和RDI為指標,考察凍干保護劑甘露醇的用量(1%、3%、5%、7%),結果見表7。隨著甘露醇凍干保護劑用量增加,凍干粉表面逐漸平整,RDI呈先降低后增大的趨勢。當甘露醇用量為5%時,PG-NP為色澤均勻的淡黃色粉末,質地疏松均一,無塌陷現象,且復溶后平均粒徑最小,平均粒徑為(228.00±7.80)nm,重分散性最佳,RDI為0.970。因此,選擇5%的甘露醇用量作為PG-NP混懸液的凍干保護劑。

圖2 自變量X1、X2、X3和X4與因變量Y1的3D效應面圖

圖3 自變量X1、X2、X3和X4與因變量Y2的3D效應面圖

圖4 自變量X1、X2、X3和X4與因變量Y3的3D效應面圖

表6 各指標預測值和實測值
偏差=(實測值-預測值)/預測值
deviation = (observed value-predicted value)/predicted value
2.8 PG-NP質量評價
2.8.1 SEM觀察形態 取適量PF原料藥和PG-NP,黏附于樣品池上,表層減壓噴金處理以增加其電導率。在SEM下觀察兩者表面形態和晶體結構。由圖5可見PF原料藥大小不均勻,呈較大的塊狀。而PG-NP在高倍數電鏡鏡下以不規整的細小片狀存在,粒徑大部分分布在200 nm左右,與粒度儀測定結果相吻合。
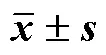
表7 凍干保護劑含量的篩選結果(, n = 3)
2.8.2 XRD分析 采用XRD分析測試樣品(甘草酸、PF原料藥、PG-NP凍干粉)。測試條件為CuKα作為輻射源衍射(=0.154 nm),40 kV,154 mA,連續掃描,掃描速度5°/min,間隔0.1°。通過不同晶面發生的衍射現象的強度來繪制衍射圖,以得到樣品晶體結構和粒度方面的信息。分析結果見圖6,PG-NP相對于甘草酸的衍射峰和峰強度明顯減少,結晶度降低,表明在工藝條件下PF狀態發生明顯改變。
2.8.3 DSC分析 將甘草酸、PF原料藥、PF和甘草酸混合物及PG-NP凍干粉進行DSC分析。以氧化鋁為參比物,在氮氣流中,從30~300 ℃,以10 ℃/min的速率升溫掃描,結果見圖7,結果顯示PG-NP凍干粉在163.09、167.61 ℃出現明顯熔融峰,而PF和甘草酸物理混合物未出現熔融峰。據研究表明161 ℃為甘露醇的熔點峰[21],PG-NP的熔點峰相對發生了偏移,可能是制劑凍干后甘露醇結晶狀態發生改變。表明PG-NP凍干粉中PF可能仍以無定形態存在。

圖5 PF原料藥(50 μm, a)和PG-NP (50 μm, b; 5 μm, c) 的SEM圖
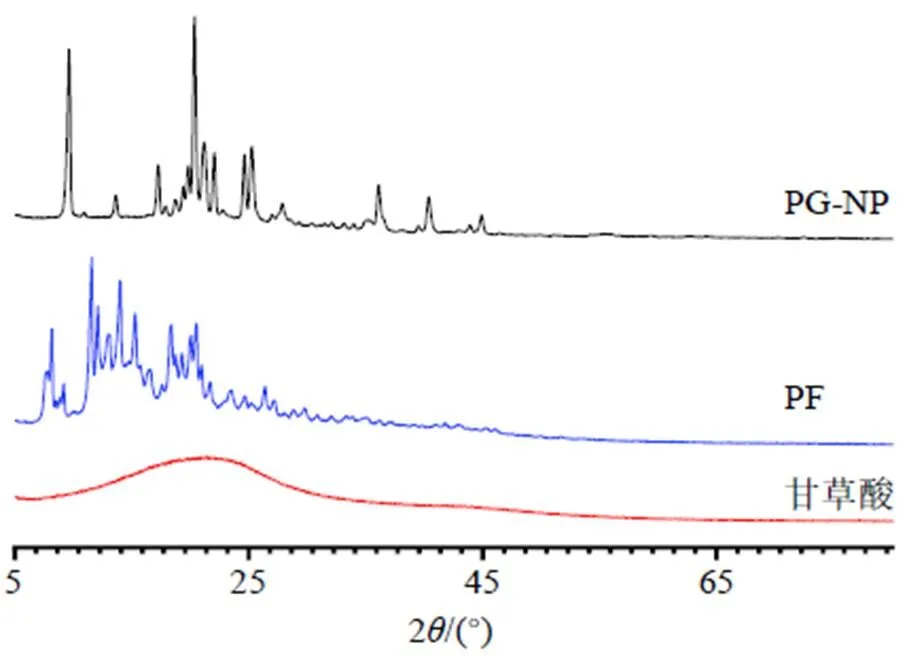
圖6 PG-NP和PF的XRD圖
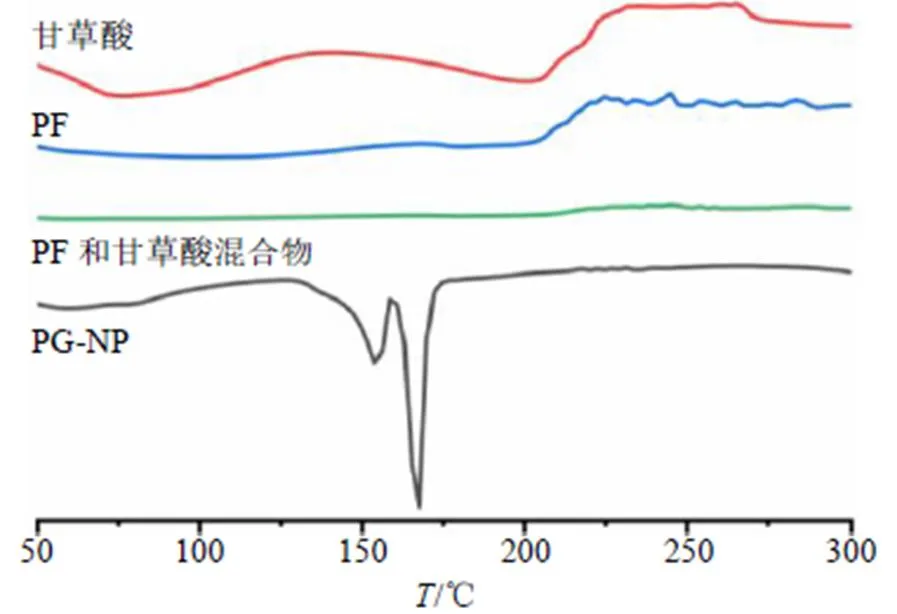
圖7 PG-NP凍干粉DSC分析圖譜
2.9 PG-NP體外溶出度測定
2.9.1 色譜條件 色譜柱為Kromasil柱(250 mm×4.6 mm,5 μm);流動相為乙腈-0.05%醋酸水溶液(10∶90),洗脫程序:0~20 min,10%乙腈;21~30 min,10%~20%乙腈;31~40 min,20%~10%乙腈;檢測波長為254 nm;柱溫40 ℃;體積流量1 mL/min;進樣量10 μL。
2.9.2 對照品溶液的制備 精密稱取葛根素對照品2.02 mg,用30%乙醇超聲溶解置于10 mL量瓶,即得質量濃度為20.2 μg/mL的對照品儲備液。
2.9.3 供試品溶液的制備 精密稱取PG-NP凍干粉3.39 g,置50 mL量瓶中,加入30%乙醇溶液稀釋至刻度,搖勻,即得67.80 μg/mL的對照品溶液
2.9.4 線性關系考察 精密吸取的對照品溶液適量,用30%乙醇稀釋得質量濃度分別為4.04、8.08、12.12、20.20、24.24、28.28 μg/mL的葛根素對照品溶液,在“2.9.1”項色譜條件下進樣分析,以質量濃度為橫坐標(),色譜峰面積為縱坐標(),繪制標準曲線,得到回歸方程=0.083 44+0.208 4,2=0.999 8>0.999,結果表明葛根素在4.04~28.28 μg/mL與峰面積呈良好的線性關系。
2.9.5 精密度試驗 精密吸取葛根素對照品溶液6份,按“2.9.1”項下的色譜條件進樣,計算葛根素峰面積的RSD為1.28%,表明儀器精密度良好。
2.9.6 重復性試驗 精密稱取PG-NP凍干粉0.1 g,6份,按“2.9.3”項下方法制備供試品溶液。在“2.9.1”項下的色譜條件進樣,測得對應峰面積,得到葛根素質量分數的RSD為0.12%,表明本法重復性良好。
2.9.7 穩定性試驗 取適當質量濃度的供試品溶液,于制備后0、1、2、4、8、12 h分別精密吸取供試品溶液,注入液相色譜儀分析,記錄葛根素峰面積,測得其RSD為0.80%,表明供試品溶液在12 h內穩定。
2.9.8 加樣回收率試驗 精密量取已測定葛根素質量分數的PG-NP凍干粉0.05 g,6份,分別精密加入相當量的對照品溶液,揮干溶劑,同“2.9.3”項下方法處理,測定,計算加樣回收率。測得葛根素的平均加樣回收率為100.28%,RSD為0.68%。
2.9.9 溶出度測定 取PG-NP及PF原料藥和甘草酸的物理混合物各500 mg,各12份,采用《中國藥典》2020年版一部附錄XC規定的溶出度測定項下第一法槳法,以300 mL水為溶出介質,溫度為(37.0±0.5)℃,轉速100 r/min。分別于5、10、15、20、30、40、50、60、120 min取樣1 mL,同時補充同溫度超純水1 mL,0.45 μm微孔濾膜濾過,計算葛根素的累積溶出率,以時間對累積溶出率作圖得溶出曲線如圖8所示,PG-NP凍干粉的溶出速率較原料藥得到明顯提高。
PG-NP凍干粉在60 min內藥物溶出度達到90.73%,60 min以后PF完全釋放,達到平衡狀態。圖8中發現PG-NP在前20 min的溶出速率已經達到87.10%,而原料藥的溶出率僅為74.15%,由此可見PG-NP凍干粉的溶出速度和程度優于原料藥和甘草酸的物理混合物(<0.05)。

圖8 PF和PG-NP中葛根素體外溶出度曲線(, n = 3)
3 討論
傳統的納米制備技術如高壓均質法、反溶劑沉淀法可能會造成藥物混懸液不穩定或者有機物污染。本研究采用的超聲破碎法的空化作用使液體產生更多的空化泡[15],降低了粒徑。但是其制備得到的納米粒徑均勻性較低,所以組合高壓均質機,基于其射流均勻原理所得的混懸液通過活塞間隙均質器進行均勻化制備,在剪切力和空化力作用下促進藥物顆粒破碎[22],使PG-NP混懸液中的粒子更加均勻化且粒徑進一步減小。體外溶出試驗結果表明,小粒徑的PG-NP在20 min內的體外溶出率是原料藥的1.16倍。這主要歸功于高壓均質-超聲破碎過程導致的介質與藥物晶體接觸的曲率增加[23]。根據Noyes-Whitney方程,粒徑的減小會增加藥物粉末相互作用的表面積,進一步會增加該部分在生物流體中的溶解速率。
甘草酸為天然皂苷類成分,與傳統表面活性劑結構一樣具有兩親性,可與藥物作用形成網狀結構,阻止粒子的團聚[24],較少量就使PF在水溶液中達到穩定的效果。研究表明靜電斥力和空間穩定作用參與了甘草酸穩定機制[25]。同時有研究表明甘草酸進入小腸上皮細胞膜后,可以通過影響脂質的位置和排列順序,增加細胞膜的通透性,使細胞膜彈性增加和彈性模量分布變窄,促進藥物的細胞內化,提高藥物的口服吸收效率[26-27]。因此,甘草酸在納米粉體中既發揮藥物輔料作用,又具有一定的藥理作用潛力,體現了中藥制劑的“藥輔合一”理念。通過SEM、XRD、DSC的綜合分析,結果表明PG-NP外觀呈現不規則大小的勻稱細小片狀,且PF可能以無定形晶體狀態存在PG-NP中。無定形晶體有利于藥物成分的快速溶出,該結果通過體外溶出實驗也得到了證實。
以QbD理念指導優化PG-NP混懸液的制備模型,有效提高了PG-NP的穩定性及制備工藝工業化生產的可行性,為后續的制劑工業擴大化開發提供了參考依據,也為后續的PG-NP藥物生物利用度與協同增效藥理作用研究奠定了基礎。
利益沖突 所有作者均聲明不存在利益沖突
[1] Zhou Y X, Zhang H, Peng C. Puerarin: A review of pharmacological effects [J]., 2014, 28(7): 961-975.
[2] Zhang Y, Yang X, Ge X H,. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice [J]., 2019, 109: 726-733.
[3] Kulczyński B, Gramza-Micha?owska A, Suliburska J,. Puerarin-an isoflavone with beneficial effects on bone health [J]., 2021, 26(12): 1653-1667.
[4] 李昕, 潘俊嫻, 陳士國, 等. 葛根化學成分及藥理作用研究進展 [J]. 中國食品學報, 2017, 17(9): 189-195.
[5] Li H W, Dong L, Liu Y,. Biopharmaceutics classification of puerarin and comparison of perfusion approaches in rats [J]., 2014, 466(1/2): 133-138.
[6] 黎迎, 宋軼群, 何亞麗, 等. 葛根總黃酮生物黏附漂浮微丸體外Caco-2細胞轉運和體內生物利用度評價 [J]. 藥學學報, 2016, 51(7): 1144-1149.
[7] 李鵬躍. 基于MD-MS技術研究葛根總黃酮及葛根素靜脈和鼻腔給藥的藥動學差異 [D]. 北京: 北京中醫藥大學, 2014.
[8] 張嘉家, 易荊麗, 周毅生,等. 葛根總黃酮分散片的藥動學研究及其與愈風寧心片的比較 [J]. 中國實驗方劑學雜志, 2014, 20(1): 107-110.
[9] 張嘉家. 葛根總黃酮分散片的制備工藝、質量標準及藥動學研究 [D]. 廣州: 廣東藥學院, 2013.
[10] 朱昆. 葛根總黃酮固體脂質納米粒的研制 [D]. 長春: 吉林大學, 2009.
[11] 孫士淋. 葛根總黃酮自微乳制劑吸收機制的研究 [D].長春: 吉林大學, 2017.
[12] 林文慧. 葛根總黃酮胃腸道生物粘附制劑的研究 [D].北京: 中國協和醫科大學, 2008.
[13] Taghipour Y D, Hajialyani M, Naseri R,. Nanoformulations of natural products for management of metabolic syndrome [J]., 2019, 14: 5303-5321.
[14] Coon J T, Ernst E.in the treatment of upper respiratory tract infections: A systematic review of safety and efficacy [J]., 2004, 70(4): 293-298.
[15] He W, Lu Y, Qi J P,. Food proteins as novel nanosuspension stabilizers for poorly water-soluble drugs [J]., 2013, 441(1/2): 269-278.
[16] Kong R P, Zhu X Y, Meteleva E S,. Enhanced solubility and bioavailability of simvastatin by mechanochemically obtained complexes [J]., 2017, 534(1/2): 108-118.
[17] 劉羅娜, 李小芳, 仲粒, 等. 以甘草酸為穩定劑制備黃芩苷固體納米晶體 [J]. 中草藥, 2019, 50(9): 2057-2064.
[18] Selyutina O Y, Polyakov N E, Korneev D V,. Influence of glycyrrhizin on permeability and elasticity of cell membrane: Perspectives for drugs delivery [J]., 2016, 23(3): 858-865.
[19] Cunha S, Costa C P, Moreira J N,. Using the quality by design (QbD) approach to optimize formulations of lipid nanoparticles and nanoemulsions: A review [J]., 2020, 28: 102206.
[20] Peterson J J, Lief K. The ICH Q8 definition of design space: A comparison of the overlapping means and the Bayesian predictive approaches [J]., 2010, 2(2): 249-259.
[21] 王莉芳, 陳孝男, 李軍, 等. 龍血竭酚類提取物納米混懸劑的制備及體外溶出研究 [J]. 中國中藥雜志, 2019, 44(11): 2236-2243.
[22] Guo Z, Zhang M, Li H,. Effect of ultrasound on anti-solvent crystallization process [J]., 2005, 273(3/4): 555-563.
[23] Gujar K, Wairkar S. Nanocrystal technology for improving therapeutic efficacy of flavonoids [J]., 2020, 71: 153240.
[24] Al-Kassas R, Bansal M, Shaw J. Nanosizing techniques for improving bioavailability of drugs [J]., 2017, 260: 202-212.
[25] Chen Y C, Liu Y, Xu J N,. A natural triterpenoid saponin as multifunctional stabilizer for drug nanosuspension powder [J]., 2017, 18(7): 2744-2753.
[26] 楊富恒, 李國鋒, 李振東, 等. 基于甘草酸為載體的紫杉醇-甘草酸納米膠束的構建和口服生物利用度的評價 [J]. 中國醫院藥學雜志, 2018, 38(10): 1040-1044.
[27] Selyutina O Y, Polyakov N E. Glycyrrhizic acid as a multifunctional drug carrier-From physicochemical properties to biomedical applications: A modern insight on the ancient drug [J]., 2019, 559: 271-279.
Preparation and evaluation oftotal flavonoids-glycyrrhizic acid nanopowders based on concept of quality by design (QbD)
CHEN Hai-rong1, DING Yang1, LIU Zhen-zhen1, LIU Jia-jia1, WANG Yu-xiao1, SHEN Ai-zong5, GUO Jian1, 2, 3, 4, GUI Shuang-ying1, 2, 3, 4
1. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China 2. Anhui Province Key Laboratory of Pharmaceutical Preparation Technology and Application, Hefei 230012, China 3. Institute of Pharmaceutics, Anhui Academy of Chinese Medicine, Hefei 230012, China 4. Anhui Province Engineering Technology Research Center of Modernized Pharmaceutics, Hefei 230012, China 5. The First Affiliated Hospital of University of Science and Technology of China/Department of Pharmacy, Anhui Provincial Hospital, Hefei 230001, China
To optimizetotal flavonoids nanopowder-glycyrrhizic acid nanopowder (PG-NP) based on concept of quality by design (QbD) and evaluate their quality.PG-NP suspension was prepared by ultrasonic crushing and high pressure homogenization method. A fishbone diagram was used to evaluate risk factors that could affect the particle size, polydispersity index (PDI) and ζ potential of PG-NP suspensions as critical quality attributes. A Plackett-Burman experimental design was used to screen the key process parameters, based on which the prescription ratio of the PG-NP suspension was optimized in conjunction with the Box-Behnken Design, then a single factor test was used to determine the content of lyoprotectant in PG-NP. The scanning electron microscope (SEM), X ray diffraction (XRD) and differential scanning calorimetry (DSC) were used to characterize the optimized PG-NP, and thedissolution properties of puerarin in PG-NP were investigated.The optimum preparation process and formulation ratio of PG-NP were as follows: the adjuvant ratio was 17.5:1; the content of glycyrrhizin acid was 0.13%; the stirring speed was 470 r/min; the homogenizing pressure was 1 283 MPa, and the content of mannitol was 5 %. The particle size of the optimized PG-NP was (228.00 ± 7.80) nm, the PDI was 0.29 ± 0.05, and the ζ potential was (?23.10 ± 0.93) mV. PG-NP was light yellow powder with needle-rod crystal form, anddissolution performance was significantly improved compared with the PDI.In this study, the preparation process of PG-NP optimized by the QbD concept was simple and feasible, the formula design was reasonable, and the quality was controllable, which can effectively improve the dissolution of poorly soluble components.
quality by design;total flavonoids; glycyrrhizic acid; nanopowder; dissolution; quality evaluation; ultrasonication and high pressure homogenization method; fishbone diagram; Plackett-Burman design; critical process parameters; Box-Behnken design
R283.6
A
0253 - 2670(2022)23 - 7384 - 09
10.7501/j.issn.0253-2670.2022.23.008
2022-06-27
安徽省高校自然科學研究重點項目(KJ2021A0538);安徽省高校自然科學研究重點項目(KJ2021A0541);安徽中醫藥大學藥學院研究生培養基金(21pyjj05);安徽中醫藥大學高層次人才支持計劃基金(2022rczd003)
陳海溶(1997—),女,碩士研究生,研究方向為新劑型與中藥新制劑研究。Tel: 17730019304 E-mail: Chenhairong0122@126.com
通信作者:桂雙英,教 授,研究方向中藥新制劑與新技術研究、藥物新劑型與新制劑研究。Tel: (0551)68129121 E-mail: guishy0520@126.com
郭 健,副教授,研究方向制劑新技術與新輔料研究。Tel: 19810963774 E-mail: guoj0719@126.com
[責任編輯 鄭禮勝]

