中藥多糖防治阿爾茨海默病作用機制的研究進展
張 健,李 全,周妍妍
中藥多糖防治阿爾茨海默病作用機制的研究進展
張 健,李 全*,周妍妍*
黑龍江中醫藥大學,黑龍江 哈爾濱 150040
阿爾茨海默病(Alzheimer’s disease,AD)是一種常見的神經退行性疾病,已成為嚴重威脅老年人身心健康的重要疾病之一,中藥因其多靶點、多途徑以及性質穩定等特點被廣泛應用于治療AD的實驗研究。大量研究表明中藥多糖在防治AD中起著重要作用。主要綜述了防治AD的中藥多糖來源、作用途徑,中藥多糖防治AD的作用機制(抑制β-淀粉樣蛋白生成、降低Tau磷酸化水平、抑制氧化應激、抑制神經炎癥、抑制細胞凋亡、調節自噬、改善能量代謝等),旨在為中藥多糖類成分防治AD的臨床藥物開發提供參考和依據。
中藥多糖;阿爾茨海默病;β-淀粉樣蛋白;Tau磷酸化;氧化應激;神經炎癥;細胞凋亡;自噬;能量代謝
阿爾茨海默病(Alzheimer’s disease,AD)又稱老年性癡呆,是一種常見的神經退行性疾病,其發病假說主要包括β-淀粉樣蛋白(amyloid β-protein,Aβ)級聯假說、Tau蛋白過度磷酸化假說以及膽堿能假說等[1]。然而腦內Aβ沉積作為AD的標志性病理改變和中心環節不僅能介導Tau蛋白過度磷酸化和膽堿能系統失衡,還可引發氧化應激、神經炎癥、細胞凋亡、線粒體及突觸功能障礙等一系列級聯反應[2-8]。但迄今為止,只有膽堿酯酶抑制劑和-甲基-天冬氨酸拮抗劑2類藥物被批準用于治療AD,并且這些藥物的作用是控制癥狀而不是改變疾病的進程[9-11]。
多糖是一種重要的生物大分子,由20余個單糖分子脫水縮合而成,并由糖苷鍵連接而成的高分子碳水化合物。多糖類成分廣泛分布于動物及植物中,在動物體內主要以糖原的形式存在,而在植物細胞中可分為胞內多糖和胞外多糖2類,主要以纖維素、肽聚糖和淀粉的形式存在[12-15]。多糖具有抗病毒、抗炎、抗氧化、抗腫瘤及調節免疫系統等多種生物活性且使用安全、不良反應少,被認為是食品和藥品開發與利用的理想原材料[16-20]。
據2021年《中國阿爾茨海默病報告》表明,截至2019年底我國現存AD患者超過1000萬,并呈現高患病率和高死亡率的“雙高”特點[21]。因此,AD已經成為嚴重威脅老年人身心健康的重要疾病之一,逐漸成為社會無法回避的問題。前期大量學者圍繞AD的各種假說機制進行深入研究,盡管已經研制出幾類靶向治療AD的化學藥物,但其作用效果不甚理想,還常伴有不同程度的不良反應。中藥因其多靶點、多途徑以及性質穩定等特點已被廣泛應用于治療AD的實驗研究,特別是具有多重活性作用的多糖類成分。因此,本文旨在對防治AD的中藥多糖來源、作用途徑,中藥多糖類成分防治AD的作用機制(抑制Aβ生成、降低Tau磷酸化水平、抑制氧化應激、抑制神經炎癥、抑制細胞凋亡、調節自噬、改善能量代謝等)進行綜述,以期為防治AD的中藥多糖類成分開發提供幫助。
1 中藥多糖來源
由于多糖類成分通常與其他成分共存,因此其提取、純化以及分析的方法較為復雜。常見的提取多糖方法主要有熱水提取、酶輔助、微波輔助、超聲輔助和超臨界流體萃取等[22-24];多糖純化的常用方法包括沉淀法、凝膠色譜法、陰離子交換色譜法、大孔樹脂柱色譜法、超濾法等[25-26];多糖分離的技術主要為色譜方法與其他結構分析技術結合使用[27-29]。近10年防治AD的中藥多糖類成分大多來源于藥用植物如黨參(Franch.) Nannf.、黃芪(Fisch.) Bge. var.(Bge.) Hsiao、當歸(Oliv.) Diels、肉蓯蓉Y. C. Ma、山茱萸Sieb. et Zucc.、枸杞L.、五味子(Turcz.) Baill.以及菌類植物如靈芝(Leyss. ex Fr.)、香菇(Berk.) Sing、猴頭菇(Bull.) Pers.、蜜環菌(Vahl) P. Kumm.、阿里紅(Vill. ex Fr.) Ames等,但來源于藥用動物部位卻極少。2013—2017年、2018—2022年防治AD不同來源中藥多糖的使用頻次見圖1、2。此外,提取自海洋產物海藻、螺旋藻的中藥多糖防治AD亦是當下的研究熱點之一。這些中藥多糖主要由葡萄糖、甘露糖、半乳糖、鼠李糖、阿拉伯糖、木糖、巖藻糖、半乳糖醛酸和葡萄糖醛酸等3~10個單糖構成,并且這些中藥多糖的構成既有中性糖又有酸性糖,見表1。
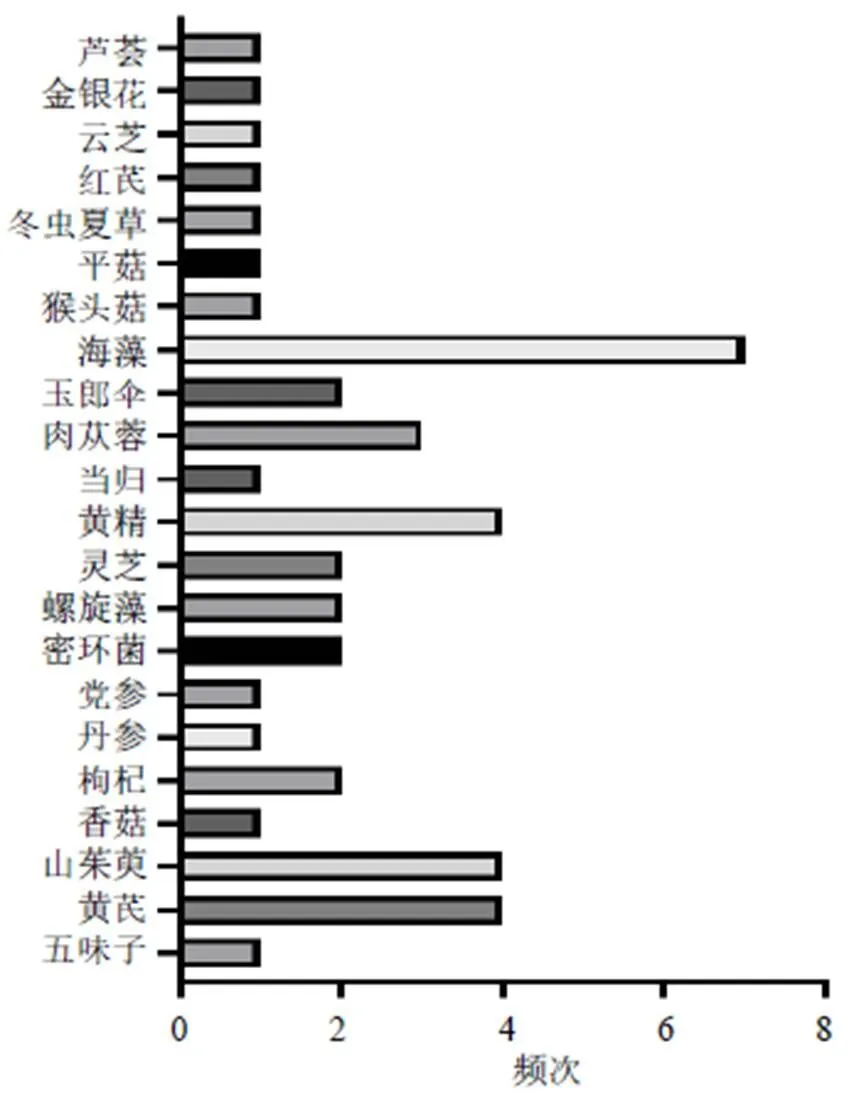
圖1 2013—2017年防治AD不同來源中藥多糖的使用頻次
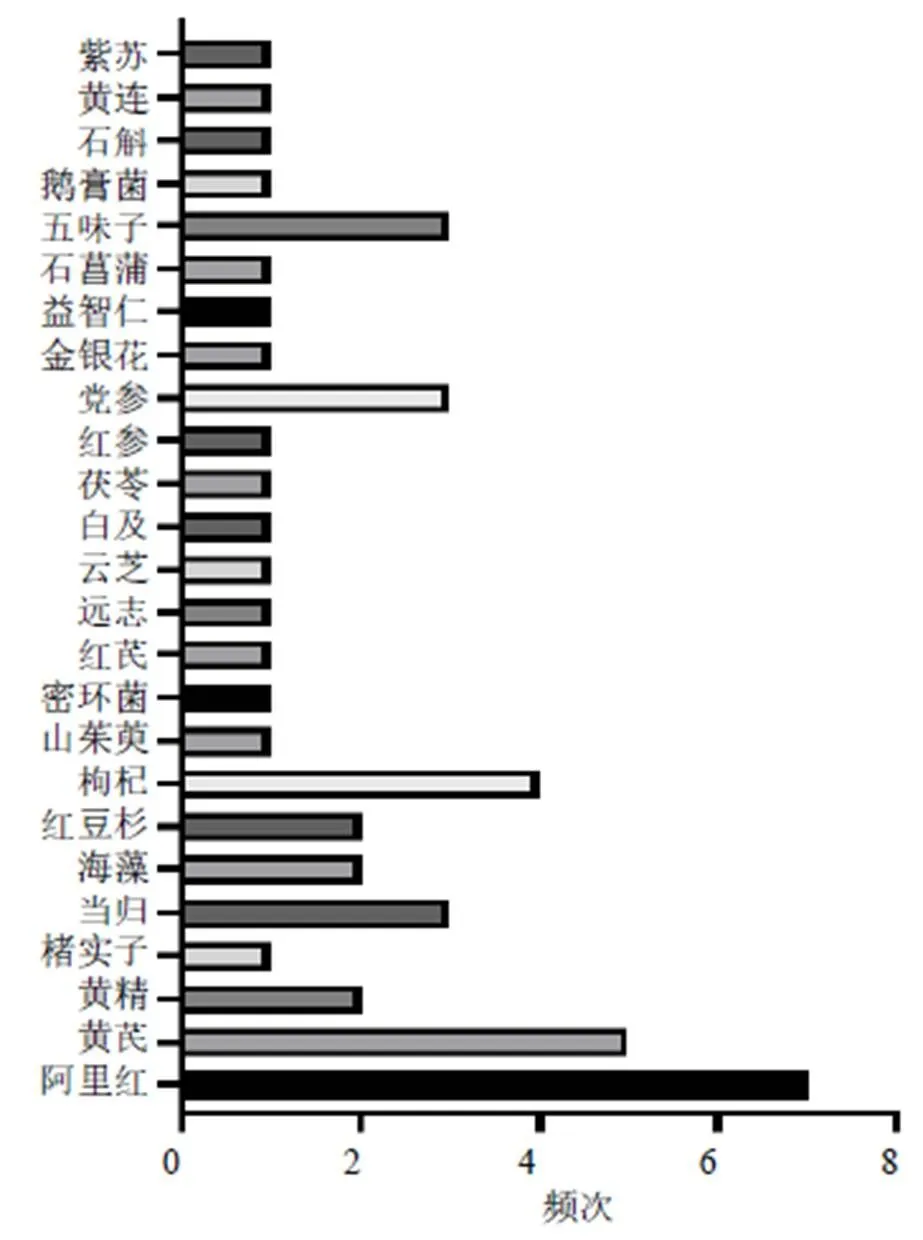
圖2 2018—2022年防治AD不同來源中藥多糖的使用頻次
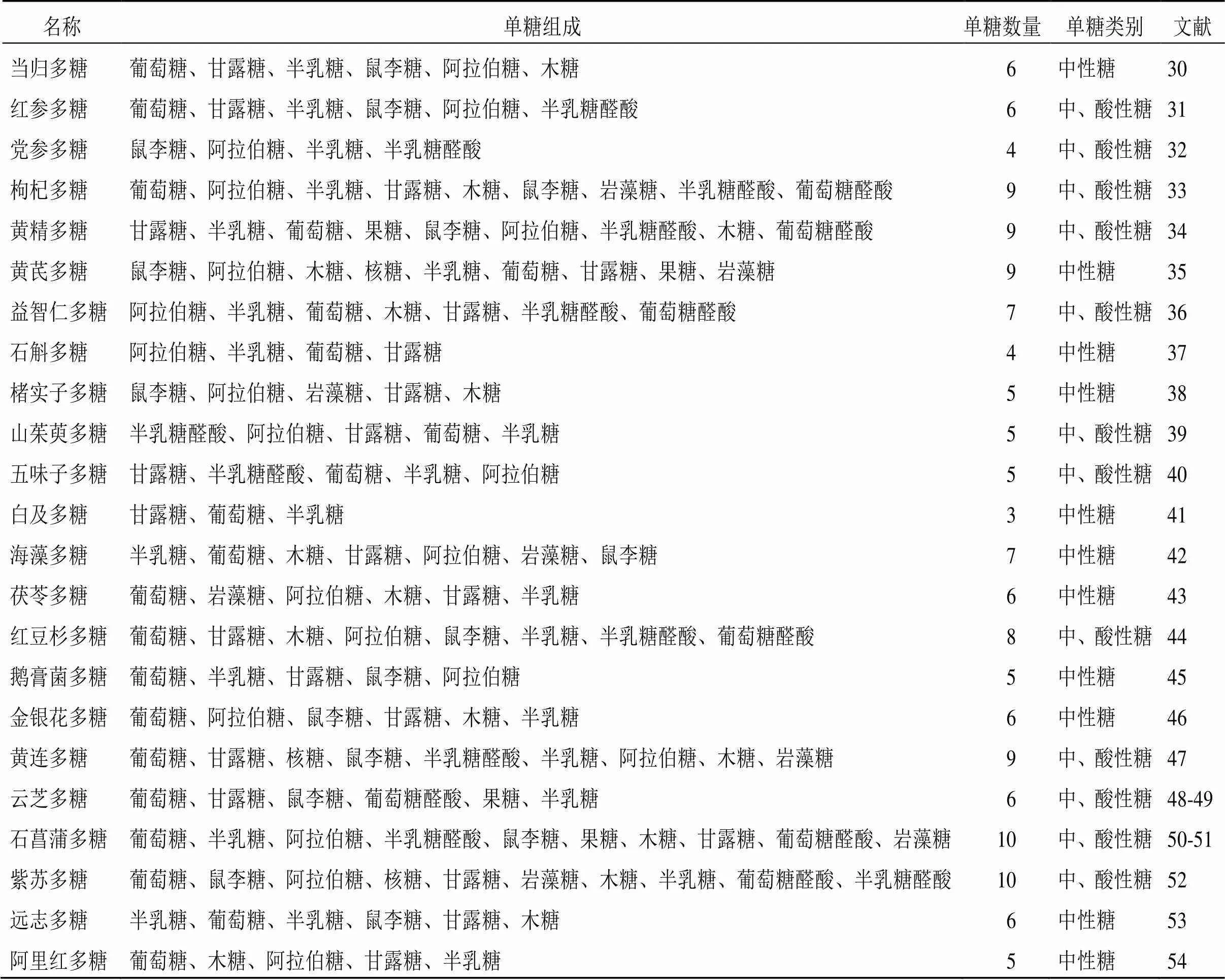
表1 防治AD的中藥多糖的單糖組成
2 防治AD的中藥多糖作用途徑
由于AD病變部位在大腦,使得大多數小分子和大分子藥物進入腦內受到諸多因素的限制,其中藥物跨血腦屏障的無效運輸是最大的障礙。中藥多糖的相對分子質量大多在1000以上,但血腦屏障僅允許相對分子質量小于500的脂溶性物質通過被動擴散進入腦內[55]。目前,使藥物通過血腦屏障進入腦內主要有2種途徑:(1)與血腦屏障上的轉運體特異性結合,中藥多糖等大分子物質通過載體介導的轉運蛋白(如ABC轉運蛋白、葡萄糖轉運蛋白)、受體或吸附介導的胞吞作用(細胞穿透肽、轉鐵蛋白受體、胰島素受體、低密度脂蛋白受體)通過血腦屏障進入大腦;(2)通過改變給藥方式使藥物進入腦內,主要有高滲透壓溶液暫時打開緊密連接、腦內注射或導管引導藥物注射等侵入性方法,然而侵入性方法存在感染風險,因此通常優先選擇通過iv或鼻內給藥、聚焦超聲暫時打開血腦屏障等非侵入性方法進行給藥[56]。此外,在AD中Aβ沉積可破壞血腦屏障的完整性和通透性,使中藥多糖等大分子物質有機會進入腦內完成藥物遞送并達到治療作用。
3 中藥多糖防治AD的作用機制
3.1 抑制Aβ沉積
Aβ沉積形成的斑塊是AD標志性病理改變,抑制Aβ在腦內沉積主要有減少Aβ生成、加快Aβ清除與轉運[57]。Aβ是由α、β、γ 3種分泌酶對淀粉樣前體蛋白(amyloid precursor protein,APP)的切割所形成,其中α-分泌酶剪切APP使C末端片段(-terminal fragment,CTF)83保留在膜中并由γ-分泌酶進一步切割,進而釋放易于水解的Aβ肽段,β-分泌酶剪切APP使CTF 99保留在膜中并由γ-分泌酶進一步切割形成難以水解且具有一定神經毒性作用的Aβ肽段[58]。Aβ的清除主要依靠小膠質細胞的吞噬以及腦啡肽酶、胰島素降解酶的清除作用。β-分泌酶的標志性蛋白為β-位點淀粉樣前體蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme 1,BACE1),γ-分泌酶的標志性蛋白為早老蛋白1(presenilin1,PS1),因此抑制Aβ在腦內沉積可通過降低BACE1、PS1的表達并促進腦啡肽酶和胰島素降解酶的分泌而實現。
黨參多糖能顯著減少APP/PS1小鼠海馬區BACE1的表達和Aβ40、Aβ42的生成,并在轉染APP的小鼠腦神經瘤N2a細胞和人胚腎HEK293細胞實驗中驗證了這一作用[59]。Li等[60]使用纖維素陰離子交換柱純化提取鵝膏菌多糖,發現鵝膏菌多糖可降低-半乳糖和AlCl3誘導的AD大鼠腦內BACE1的表達。此外,采用低溫結合真空系統提取的白芨多糖也可減少AlCl3誘導的AD模型大鼠海馬區BACE1的表達[61]。鐵皮石斛多糖可促進快速老化小鼠海馬組織內腦啡肽酶、胰島素降解酶的分泌進而達到抑制Aβ42的表達[62]。Chen等[63]采用APP/PS1小鼠以及單核細胞為研究對象,探討云芝多糖對Aβ的抑制作用,給藥后APP/PS1小鼠海馬區Aβ斑塊明顯減少,神經細胞數量增多,并增強了單核細胞對Aβ的攝取能力。阿里紅多糖可顯著降低APP/PS1小鼠海馬區糖原合酶激酶-3α(glycogen synthase kinase-3α,GSK-3α)、APP及PS1蛋白水平并改善其空間記憶能力,提示阿里紅多糖可抑制Aβ的生成,減少其在腦內的聚集[64]。海藻多糖雖然可呈劑量相關性抑制APP23轉基因小鼠腦內的APP、CTF蛋白表達并減少Aβ40、Aβ42的表達,但對AD HAW、20E2模型細胞內的BACE1、PS1的表達水平無統計學意義[65]。Luo等[66]以5xFAD小鼠作為AD模型探討黃精多糖抑制Aβ的作用機制。結果顯示黃精多糖能增強5xFAD小鼠海馬組織內小膠質細胞對Aβ斑塊的吞噬作用,顯著降低Aβ40、Aβ42的表達并改善小鼠記憶認知功能。
3.2 抑制Tau蛋白磷酸化
Tau屬于微管相關蛋白家族,Tau的翻譯修飾主要以磷酸化為主,正常磷酸化Tau蛋白具有穩定神經元細胞骨架、促進微管結合與組裝以及軸突運輸的生理功能[67]。但在AD中聚集的Aβ通過GSK-3α、GSK-3β和細胞周期蛋白依賴性激酶5(cyclin dependent kinase 5,CDK5)的活性來誘導Tau過度磷酸化,使其失去支撐細胞骨架作用,形成神經纖維纏結并導致突觸功能障礙[68],因此抑制Tau過磷酸化是實現防治AD的重要途徑之一。
Zhang等[69]采用HEK293/Tau細胞模型,探討黨參多糖對Tau蛋白過度磷酸化的抑制作用,發現黨參多糖能夠提高及HEK293/Tau細胞的存活率,在升高蛋白磷酸酶2A活性的同時降低Tau在Ser199、202和Thr205、Thr231位點的磷酸化水平。李珍等[70]研究發現阿里紅多糖可升高APP/PS1小鼠海馬內蛋白激酶B(protein kinase B,Akt)表達,并抑制GSK-3β、Tau表達,表明阿里紅多糖可能通過抑制GSK-3β介導的Tau過度磷化從而發揮拮抗AD的作用。此外,山茱萸多糖可降低AD模型大鼠及APP/PS1小鼠海馬組織內GSK-3β和磷酸化Tau的表達水平,提高其學習記憶能力[71]。
3.3 抑制氧化應激
氧化應激是指由于氧自由基產生超過抗氧化劑清除能力范圍所形成失衡狀態。而在AD中,沉積于腦內的Aβ可促進丙二醛、過氧化氫等活性氧物質的釋放,導致線粒體膜電位下降、金屬穩態失衡以及突觸功能紊亂,最終導致認知功能障礙的發生,而超氧化物歧化酶(superoxide dismutase,SOD)、醌氧化還原酶1(quinone oxidoreductase 1,NQO1)、以及血紅素加氧酶-1(heme oxygenase-1,HO-1)等抗氧化酶體可清除上述促氧化因子[72]。拮抗氧化應激損傷的另一個重要機制是核因子E2相關因子2(nuclear factor E2 related factor 2,Nrf2)信號通路的激活,Nrf2通過與Kelch樣環氧氯丙烷相關蛋白1(kelch like epichlorohydrin related protein 1,Keap1)結合對其進行負調控,并啟動保守抗氧化反應元件子序列以激活細胞保護基因的轉錄[73]。
Qin等[74]研究發現黃芪多糖可通過激活Keap1/Nrf2通路,下調APP/PS1小鼠海馬區Keap1、丙二醛的含量,顯著上調Nrf2、SOD和谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的表達,而在給予Nrf2抑制劑后,黃芪多糖對上述分子的調節作用被顯著逆轉,表明黃芪多糖可以激活Nrf2通路,改善AD小鼠的生理功能。此外,黃芪多糖還可激活Wnt/β-連環蛋白(β-catenin)信號通路降低促氧化酶體的表達水平,進而抑制氧化應激對神經元的損傷[75]。紫蘇多糖同樣可激活Nrf2信號通路提高小鼠海馬神經元HT22細胞的活力,上調Nrf2、HO-1、SOD蛋白表達水平的同時抑制Keap1的活性[76]。此外,枸杞多糖[77]、阿里紅多糖[78-80]也可活化Nrf2相關信號通路,降低活性氧、丙二醛等促氧化酶的表達水平進而發揮抗氧化作用。當歸多糖可在下調促氧化酶體活性的同時促進抗氧化酶體的分泌,抑制氧化應激反應進而發揮防治AD的作用[81]。
3.4 抑制神經炎癥
在中樞神經系統內膠質細胞的激活是發生免疫反應的核心,當小膠質細胞激活后可分泌各種促炎因子和趨化因子如白細胞介素-1β(interleukin-1β,IL-1β)、IL-6和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α),將更多的膠質細胞募集到炎癥部位促進病原體的清除[82]。在AD中,小膠質細胞可識別并吞噬Aβ,但過多的Aβ生成和過度磷酸化的Tau會使這種免疫清除機制失調,這是由于Aβ本身刺激可觸發小膠質細胞的極化,形成具有促炎作用的M1型小膠質細胞,并喪失清除Aβ的功能。除小膠質細胞外,腦內其他配體如Toll樣受體(toll like receptor,TLR)、NOD樣受體也可識別Aβ并激活先天免疫炎癥小體[83]。值得注意的是,TLR2、4、6、9被認為是識別Aβ和觸發免疫炎癥的主要亞型,這些TLR的激活由白細胞分化抗原14(cluster of differentiation 14,CD14)、CD36受體調節,并激活髓樣分子因子88(myeloid molecular factor 88,MyD88)信號通路的下游靶蛋白如核因子-κB(nuclear factor-κB,NF-κB)和干擾素調節因子的活化[84]。
石菖蒲多糖[85]、遠志多糖[86]可通過降低脂多糖誘導的小膠質細胞中TLR4的活性,抑制MyD88/NF-κB通路的激活,下調其介導的促炎因子的表達水平。此外經遠志多糖和TLR4抑制劑TAK242預處理的小膠質細胞并未受脂多糖的影響而顯示出炎癥因子的過表達,提示遠志多糖抑制神經炎癥的作用與TLR4介導的MyD88/NF-κB信號通路的調節有關。Shi等[87]研究發現益智仁多糖干預AD模型小鼠后,其腦內一氧化氮、前列腺素E2、TNF-α、IL-1β等炎癥因子表達顯著下降,并在脂多糖誘導的小膠質細胞中驗證了這一作用機制。五味子多糖可下調AD模型小鼠海馬區小膠質細胞標志物、TNF-α、IL-1β、IL-6等炎癥因子表達,降低絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信號分子磷酸化水平;為進一步驗證五味子多糖抗神經炎癥作用,以脂多糖誘導的BV2細胞為研究對象發現五味子多糖能夠通過抑制p38 MAPK/NF-κB信號通路,抑制M1型小膠質細胞的極化,提高低密度脂蛋白相關蛋白-1(low density lipoprotein associated protein-1,LRP-1)的表達水平進而發揮保護神經的作用[88-89]。鐵皮石斛多糖同樣可使BV2細胞從促炎表型轉變為抗炎表型,下調AD模型小鼠海馬組織IL-1β、IL-6和TNF-α表達進而抑制炎癥反應[90]。
3.5 抑制細胞凋亡
凋亡作為細胞的一種程序性死亡,具有維持細胞群穩態、免疫防御的作用,通常在組織細胞受損、營養缺乏等條件下發生[91]。但在AD中,由于Aβ級聯反應引起的氧化、炎癥損傷使線粒體功能障礙,導致神經細胞大量凋亡,最終使記憶認知水平的急劇下降。凋亡發生的步驟主要包括線粒體去極化和透化、細胞色素C(cytochrome C,Cyt C)的釋放、半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)的激活、B淋巴細胞瘤-2(B lymphocyte tumor-2,Bcl-2)耗竭、凋亡相關蛋白Bax增多和Akt的失活。另外,抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt信號通路或激活MAPK、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)通路同樣可介導細胞凋亡的發生[92]。
紫蘇多糖可通過激活PI3K/Akt信號通路,并抑制過氧化氫誘導的HT22細胞內MAPK/NF-κB信號通路的傳導,進而下調Bax、Cyt C和Caspase-3、8、9的表達,提高腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)和Bcl-2的表達含量,這提示紫蘇多糖可通過抑制細胞凋亡進而達到保護神經作用[93]。黃精多糖同樣能夠阻斷AlCl3誘導形成的AD斑馬魚模型腦內p38 MAPK的磷酸化,上調-鈣黏蛋白水平,減少凋亡細胞數量,提高其學習記憶能力[94]。Li等[95]以Aβ25-35處理后的腎上腺嗜鉻細胞瘤PC12細胞探討黃連多糖抗細胞凋亡機制,結果顯示黃連多糖能夠通過抑制JNK信號通路,降低Cyt C及Caspase-3的表達,提高Bcl-2/Bax值,減少細胞凋亡數量并改善線粒體功能。當歸多糖可激活腦源性神經營養因子(brain derived neurotrophic factor,BDNF)/酪氨酸蛋白激酶B(tyrosine protein kinase B,TrkB)/環腺苷酸應答元件結合蛋白(cyclic adenylate response element binding protein,CREB)通路,提高Aβ25-35誘導的AD模型大鼠海馬區Bcl-2/Bax的值,降低Caspase-3表達[96]。黃芪多糖可在下調Cyt C及Caspase-3、9表達的同時提高Bcl-2的含量,降低細胞凋亡數量,從而達到保護神經的作用[97-98]。Zhang等[99]采用-半乳糖與小膠質細胞共培養的方式建立AD體外模型,并探討紅豆杉多糖抑制細胞凋亡機制,結果顯示,紅豆杉多糖50 μg/mL能夠顯著提高Aβ誘導的BV2細胞Bcl-2/Bax值,降低Caspase-3的表達水平,這種變化在給予紅豆杉多糖的AD模型小鼠體內得以驗證。
3.6 調節自噬
自噬是清除受損蛋白質和細胞器的主要途徑之一,它通過自噬囊泡將蛋白質聚集體和受損細胞器包裹并攜帶到溶酶體內降解來發揮作用[100]。自噬過程受自噬相關蛋白(autophagy related proteins,Atg)組成的多分子復合物級聯調節,在生理條件下哺乳動物雷帕霉素(mammalian target of rapamycin,mTOR)通過抑制Unc-51樣激酶(Unc-51-like kinase,ULK)復合物來阻礙自噬,但在能量缺乏時,mTOR被抑制而ULK復合物被激活從而觸發自噬啟動[101]。能量消耗會激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK),促進了ULK復合物的組裝進而激活Atg14L復合物,促進自噬體和溶酶體融合。此外,磷酸化的PI3K可激活泛素樣結合復合物(由Atg5、Atg12組成)以釋放微管相關蛋白輕鏈3(microtubule associated protein light chain 3,LC3),介導自噬體的形成并引導它們與溶酶體的融合。而在AD中Aβ沉積和Tau蛋白過度磷酸化可導致溶酶體功能下降,阻礙了受損細胞器的降解而在胞體中積聚[102]。
黃芪多糖可促進APP/PS1小鼠海馬組織自噬調控因子Beclin-1及溶酶體關聯膜蛋白2(lysosome associated membrane protein 2,LAMP2)的表達,降低選擇性自噬接頭蛋白P62表達水平及LC3II/ LC3I值,提高自噬水平進而加快清除腦內錯誤折疊蛋白[64]。Wang等[103]以小鼠腦內注射脂多糖建立AD模型,探討金銀花多糖對細胞自噬的調節作用機制。結果顯示,給藥后AD模型小鼠的空間記憶能力顯著提高,尼氏染色顯示神經細胞丟失數量減少,呈劑量相關性提高Atg5、Beclin-1、脂質激酶Vps-34等蛋白表達的同時下調LC3II表達含量,表明金銀花多糖可以促進自噬體的形成,發揮改善學習記憶功能的作用。紅豆杉多糖可抑制PI3K/Akt/mTOR信號通路的激活,上調Aβ25-35誘導的AD模型大鼠海馬區Beclin-1蛋白表達含量[104],枸杞多糖同樣可抑制該通路并上調Aβ誘導HT22細胞Beclin-1及LC3I蛋白水平,降低p62、Akt及mTOR蛋白表達,逆轉自噬抑制狀態[105]。
3.7 改善能量代謝
線粒體被稱為細胞“發電站”的細胞器,通過氧化磷酸化產生三磷酸腺苷(adenosine triphosphate,ATP)為大腦提供能量,在線粒體基質中發生的三羧酸循環,可還原氧化后的黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)、煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD),為細胞的生物學功能提供能量支持[106]。此外,過氧化物酶體增殖物激活受體γ共激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)是線粒體供能的主要調節因子,被沉默信息調節因子3(silent information regulator 3,SIRT3)激活的PGC-1α可協調線粒體基因編碼和蛋白質的轉錄,從而增加能量供給。但Aβ沉積和Tau蛋白過度磷酸化可破壞線粒體結構導致其合成能量受阻,造成能量代謝障礙,神經元分化受損最終促使AD發生。
Hu等[107]采用Aβ1-40誘導的PC12細胞建立AD模型,研究黨參多糖改善能量代謝障礙的潛在機制。結果表明,黨參多糖能通過調節CD38/NAD+信號通路,提高Aβ1-40誘導PC12細胞活力,顯著上調SIRT1、SIRT3、PGC-1α、ATP、NAD+表達含量并減少活性氧、CD38的生成,這表明黨參多糖可通過提高能量代謝水平進而發揮防治AD的作用。Shin等[108]發現紅參多糖能改善Aβ誘導HT22細胞線粒體形態并提高線粒體呼吸率,促進神經元增殖,這提示紅參多糖能夠通過改善Aβ的沉積介導線粒體功能障礙達到防治AD的作用。此外,當歸多糖還可通過抑制Aβ25-35誘導的AD模型大鼠海馬區葡萄糖調節蛋白78(glucose regulatory protein 78,GRP78)、CCAAT/增強子結合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)的表達,抑制內質網應激進而改善線粒體能量代謝[109]。
3.8 其他
3.8.1 改善神經遞質 乙酰膽堿的合成發生在膽堿能神經元的細胞質中,膽堿乙酰轉移酶(choline acetyltransferase,ChAT)可催化膽堿和乙酰輔酶A合成乙酰膽堿[110]。當膽堿能神經元去極化時,突觸小泡將乙酰膽堿釋放到突觸間隙中,隨后被存在于突觸間隙的乙酰膽堿酯酶(acetylcholinesterase,AChE)迅速滅活,轉化為膽堿和乙酸鹽[111]。在AD中,一方面Aβ的廣泛聚集可導致神經元丟失使乙酰膽堿合成減少,另一方面AChE可與Aβ相互作用造成乙酰膽堿快速降解和膽堿能纖維的扭曲,最終促使認知功能障礙的發生。
姜倩倩等[112]采用DEAE52柱色譜法提取楮實子多糖,以Aβ25-35誘導人神經母細胞瘤SH-SY5Y細胞損傷,觀察楮實子多糖神經保護作用,結果顯示0.1 mol/LNaCl溶液洗脫得到的楮實子多糖能夠顯著抑制AD模型細胞內AChE的表達,提高細胞活力。五味子多糖[113]、茯苓多糖[114]可促進AD模型大鼠海馬區乙酰膽堿、ChAT的分泌,降低AChE的表達,促神經遞質分泌,改善AD的記憶認知功能障礙。
3.8.2 調節突觸可塑性 突觸可塑性是神經元連接強度的活動依賴性變化,反映大腦學習和記憶水平的改變[115]。線粒體對突觸可塑性的調節至關重要,線粒體產生的ATP為突觸前后區室的發育、膜電位的產生、突觸小泡的募集和釋放提供動力。長時程增強(long term enhancement,LTP)和長時程抑制(long term suppression,LTD)是反映突觸可塑性變化的重要指標,同時也依賴于線粒體合成的能量供應以維持生物功能,而Aβ沉積可阻斷線粒體氧化磷酸化即線粒體產生ATP的代謝途徑,導致LTP減弱以及LTD的增強。
枸杞多糖可提高APP/PS1小鼠LTP,促進神經元核細胞增殖,進而改善其空間記憶及新物體識別記憶能力[116]。黨參多糖可提高APP/PS1小鼠海馬組織突觸后致密蛋白95(postsynaptic density 95,PSD95)、突觸相關蛋白Synaptotagmin的表達水平,提示黨參多糖可調節突觸可塑性,提高小鼠學習記憶功能[117]。中藥多糖類成分防治AD的作用機制見表2和圖3。
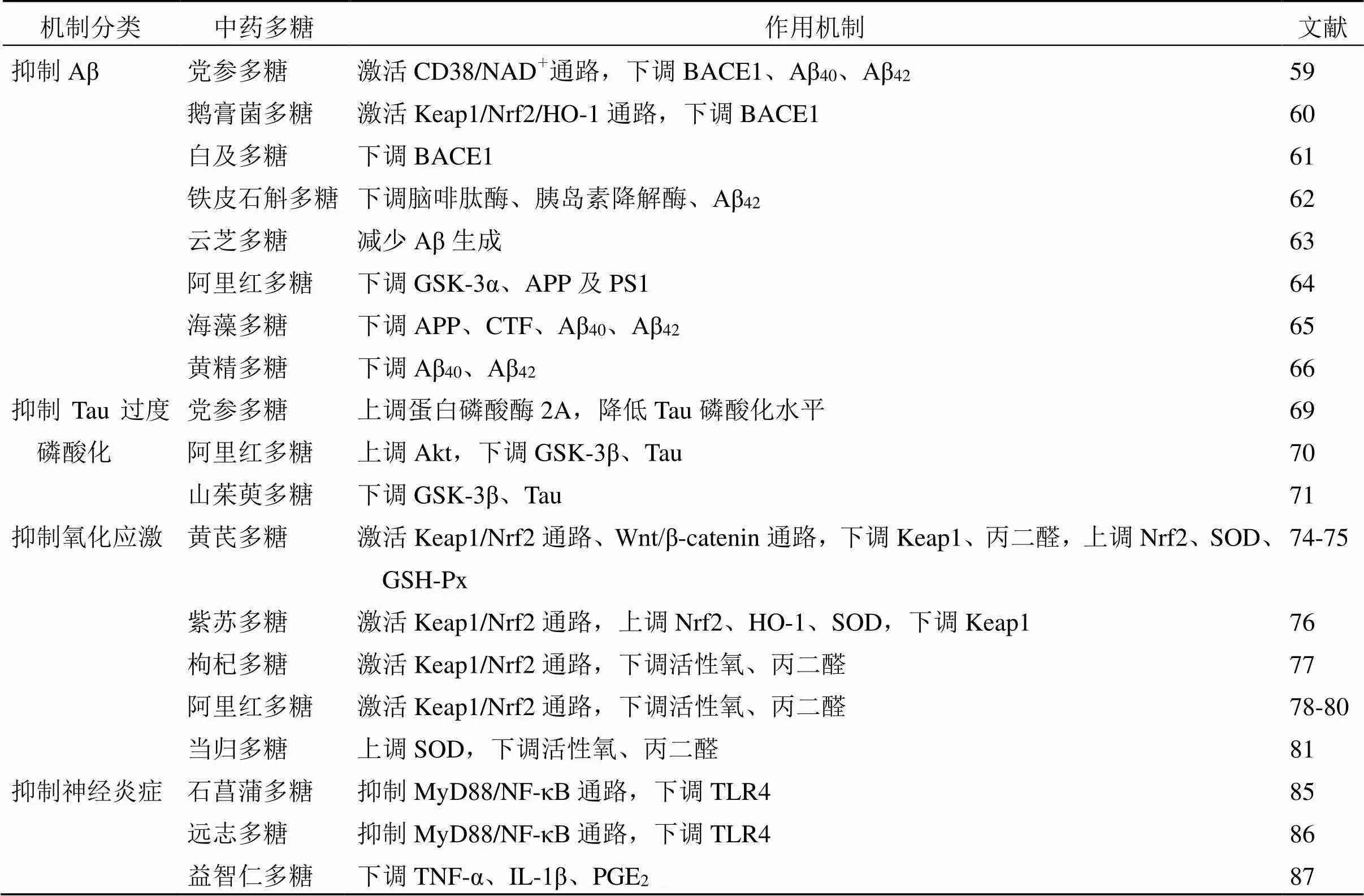
表2 中藥多糖防治AD的作用機制
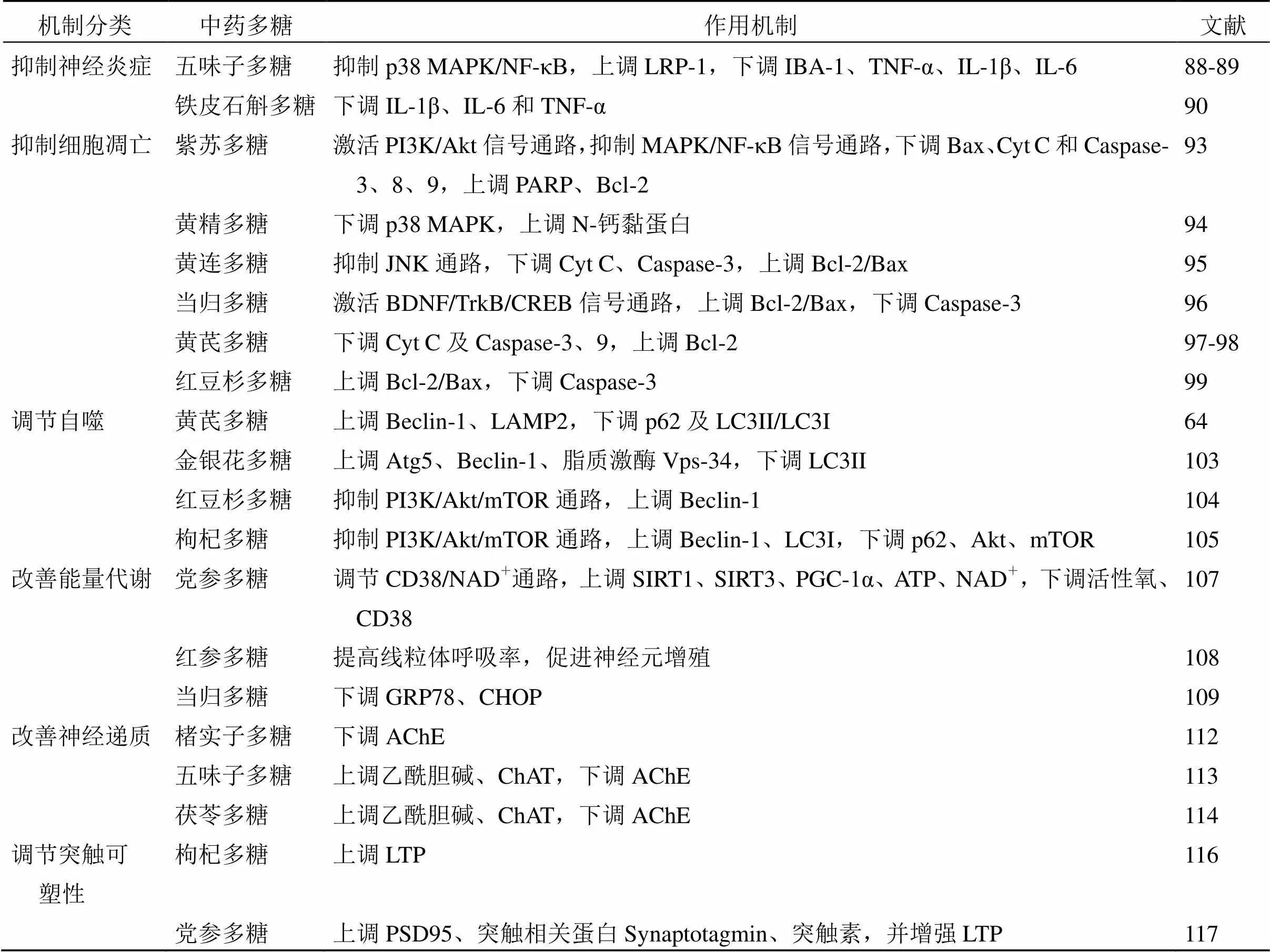
續表2
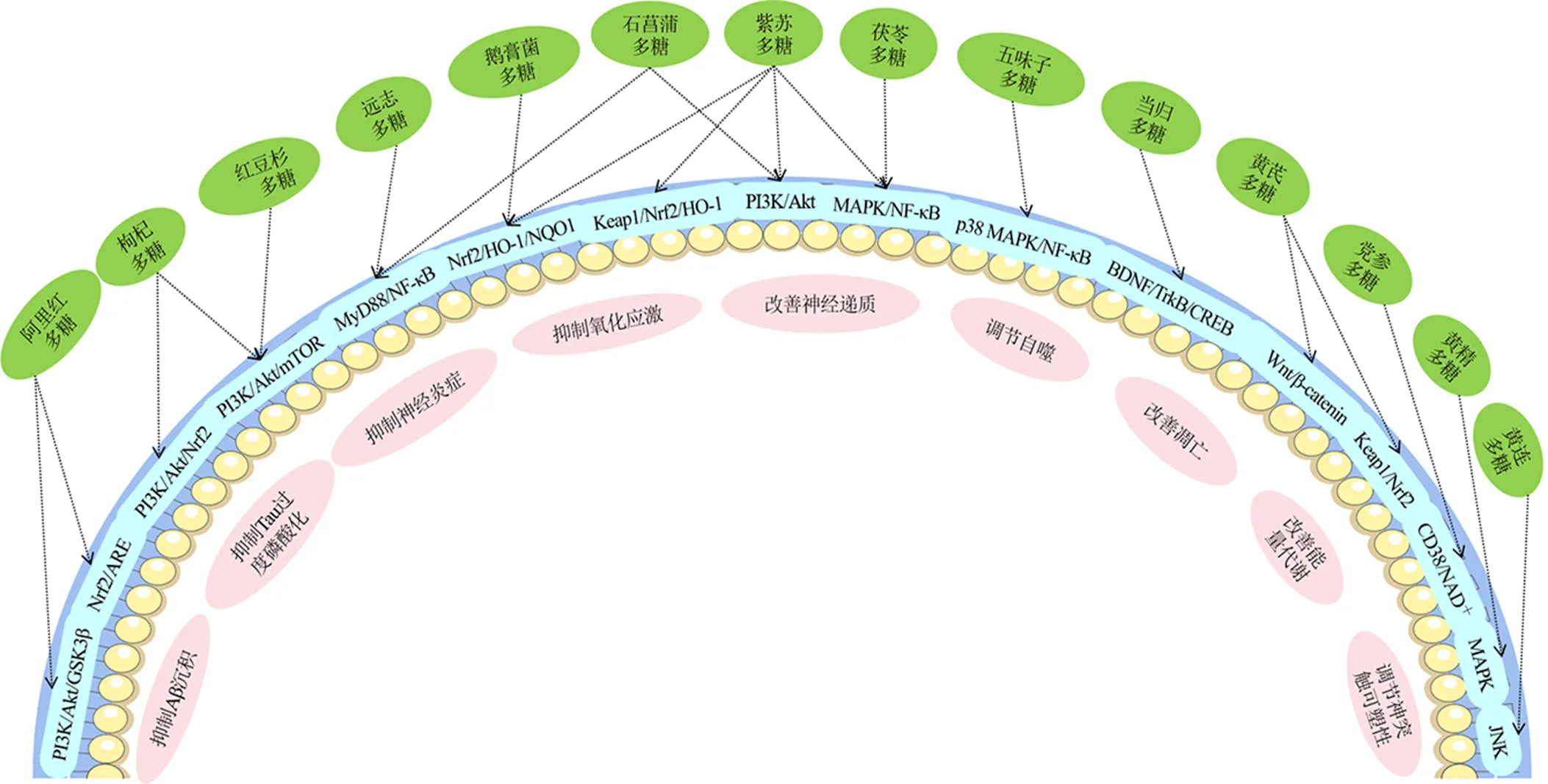
圖3 中藥多糖調節相關信號通路防治AD機制
4 結語
AD作為一種機制復雜的神經退行性疾病,年齡是其最大的誘發因素的之一,特別是我國人口老齡化日益嚴重,如何有效運用中醫藥防治AD,延緩其病理進程,改善患者的生活質量是當前面臨的難題。中藥多糖類成分是一種大分子物質,制備簡便,易于提取,具有多重活性作用,已被廣泛應用于防治AD的實驗研究中,其作用效果獲得了廣泛的認可。
通過查閱、整理并分析近5年國內外中藥多糖類成分防治AD作用機制相關文獻,共涉及25味中藥,其中以阿里紅、黃芪、當歸、枸杞、五味子頻次較多,作用機制主要集中在減少Aβ生成、降低Tau磷酸化水平、抗氧化、抗神經炎癥、抗細胞凋亡、調節自噬、改善能量代謝等方面。此外,近5年英文文獻的相關研究內容以細胞、動物實驗相互驗證偏多,而中文文獻的相關研究更偏向于單一的動物實驗,并且這些中藥多糖類成分能夠呈劑量相關性改善AD,然而中藥多糖并不是通過單一的作用途徑和靶點改善AD,如枸杞多糖、石菖蒲多糖、黃芪多糖、阿里紅多糖等可通過調節多條信號通路下游的靶蛋白,延緩AD的發病進程。
然而目前仍然存在一些問題亟待解決,盡管中藥多糖類成分在基礎實驗中已被證明了能夠改善AD的相關癥狀和病理進程,但為臨床提供的指導作用較小。其次,由于大分子物質很難通過血腦屏障進入腦內,因此這些中藥多糖進入腦內途徑的機制需進一步闡明。此外,這些多糖類成分的提取主要來源于補益類中藥,其他類別的中藥占比較少,研究方法和作用機制也較為常規。一些來自海洋和菌科的中藥具有一定的毒性,如何選擇合適的提取方法,在降低對人體不良反應的同時又不影響生物活性顯得尤為重要。最后,當前中藥多糖防治AD的作用機制尚未完全明確,因此可以結合生物信息學等相關技術,進一步挖掘中藥多糖類成分的潛在作用機制。
利益沖突 所有作者均聲明不存在利益沖突
[1] Soria Lopez J A, González H M, Léger G C. Alzheimer’s disease [J]., 2019, 167: 231-255.
[2] Sery O, Povová J, Mí?ek I,. Molecular mechanisms of neuropathological changes in Alzheimer’s disease: A review [J]., 2013, 51(1): 1-9.
[3] Graff-Radford J, Yong K X X, Apostolova L G,. New insights into atypical Alzheimer’s disease in the era of biomarkers [J]., 2021, 20(3): 222-234.
[4] Khan S, Barve K H, Kumar M S. Recent advancements in pathogenesis, diagnostics and treatment of Alzheimer’s disease [J]., 2020, 18(11): 1106-1125.
[5] Metaxas A, Kempf S J. Neurofibrillary tangles in Alzheimer’s disease: Elucidation of the molecular mechanism by immunohistochemistry and tau protein phospho-proteomics [J]., 2016, 11(10): 1579-1581.
[6] Lleó A, Nú?ez-Llaves R, Alcolea D,. Changes in synaptic proteins precede neurodegeneration markers in preclinical Alzheimer’s disease cerebrospinal fluid [J]., 2019, 18(3): 546-560.
[7] Tarawneh R, D’Angelo G, Crimmins D,. Diagnostic and prognostic utility of the synaptic marker neurogranin in alzheimer disease [J]., 2016, 73(5): 561-571.
[8] Anand P, Singh B. A review on cholinesterase inhibitors for Alzheimer’s disease [J]., 2013, 36(4): 375-399.
[9] Eldufani J, Blaise G. The role of acetylcholinesterase inhibitors such as neostigmine and rivastigmine on chronic pain and cognitive function in aging: A review of recent clinical applications [J]., 2019, 5: 175-183.
[10] Prajapati V D, Maheriya P M, Jani G K,. Carrageenan: A natural seaweed polysaccharide and its applications [J]., 2014, 105: 97-112.
[11] Briggs R, Kennelly S P, O’Neill D. Drug treatments in Alzheimer’s disease [J]., 2016, 16(3): 247-253.
[12] Chen F, Huang G L. Preparation and immunological activity of polysaccharides and their derivatives [J]., 2018, 112: 211-216.
[13] Liu Y, Sun Y Y, Huang G L. Preparation and antioxidant activities of important traditional plant polysaccharides [J]., 2018, 111: 780-786.
[14] Chen L, Huang G L. The antiviral activity of polysaccharides and their derivatives [J]., 2018, 115: 77-82.
[15] Huang H L, Huang G L. Extraction, separation, modification, structural characterization, and antioxidant activity of plant polysaccharides [J]., 2020, 96(5): 1209-1222.
[16] Cui H Y, Wang C L, Wang Y R,.polysaccharide (PN-S) enhances the immunity of immunosuppressed mice [J]., 2015, 13(10): 760-766.
[17] Ceole L F, Companhoni M V P, Sanches Lopes S M,. Anti-activity of polysaccharide fractions fromleaves [J]., 2020, 34(11): 1558-1562.
[18] Jin M L, Zhao K, Huang Q S,. Structural features and biological activities of the polysaccharides from[J]., 2014, 64: 257-266.
[19] Cheng H, Huang G L. Extraction, characterisation and antioxidant activity ofpolysaccharide [J]., 2018, 114: 415-419.
[20] Liu M, Gong Z, Liu H,. Structural characterization and anti-tumor activityof a water-soluble polysaccharide from dark brick tea [J]., 2022, 205: 615-625.
[21] Ren R J, Yin P, Wang Z H,. China Alzheimer’s disease report 2021 [J]., 2021, 20(4):317-337.
[22] Yan J K, Wang W Q, Wu J Y. Recent advances inpolysaccharides: Mycelial fermentation, isolation, structure, and bioactivities: A review [J]., 2014, 6: 33-47.
[23] Yin X L, You Q H, Su X Y. A comparison study on extraction of polysaccharides fromby response surface methodology [J]., 2014, 102: 419-422.
[24] Wang J L, Zhang J, Wang X F,. A comparison study on microwave-assisted extraction ofpolysaccharides with conventional method: Molecule structure and antioxidant activities evaluation [J]., 2009, 45(5): 483-492.
[25] Chen Y, Yao F K, Ming K,. Polysaccharides from traditional Chinese medicines: Extraction, purification, modification, and biological activity [J]., 2016, 21(12): E1705.
[26] Zeng P J, Li J, Chen Y L,. The structures and biological functions of polysaccharides from traditional Chinese herbs [J]., 2019, 163: 423-444.
[27] Sun L, Wu D, Ning X,. Α-amylase-assisted extraction of polysaccharides from[J]., 2015, 75: 152-157.
[28] Wang Q J, Fang Y Z. Analysis of sugars in traditional Chinese drugs [J]., 2004, 812(1/2): 309-324.
[29] Preethi S, Mary S A. Screening of natural polysaccharides extracted from the fruits ofas a pharmaceutical adjuvant [J]., 2016, 92: 347-356.
[30] Zhao L, Wang Y, Shen H L,. Structural characterization and radioprotection of bone marrow hematopoiesis of two novel polysaccharides from the root of(Oliv.) Diels [J]., 2012, 83(8): 1712-1720.
[31] 英欣. 紅參多糖的分離純化及結構分析 [D]. 長春: 東北師范大學, 2018.
[32] He J Y, Ma N, Zhu S,. The genus(Campanulaceae): A review of phytochemistry, bioactivity and quality control [J]., 2015, 69(1): 1-21.
[33] Tian X J, Liang T S, Liu Y L,. Extraction, structural characterization, and biological functions ofpolysaccharides: A review [J]., 2019, 9(9): E389.
[34] Cui X W, Wang S Y, Cao H,. A review: The bioactivities and pharmacological applications ofpolysaccharides [J]., 2018, 23(5): E1170.
[35] Li S S, Qi Y L, Ren D D,. The structure features and improving effects of polysaccharide fromon antibiotic-associated diarrhea [J].(), 2019, 9(1): E8.
[36] 楊鑫. 益智仁多糖的結構特征和免疫調節活性研究 [D]. 海口: 海南大學, 2020.
[37] Guo L H, Qi J X, Du D,. Current advances ofpolysaccharides in dermatology: A literature review [J]., 2020, 58(1): 664-673.
[38] 姜倩倩, 梁少瑜, 李仲秋, 等. 構樹果實: 楮實子的資源分布、古今用藥、化學成分及藥理作用 [J]. 河南科技大學學報: 醫學版, 2018, 36(3): 236-240.
[39] Tan J Q, Cui P S, Ge S Q,. Ultrasound assisted aqueous two-phase extraction of polysaccharides fromfruit: Modeling, optimization, purification, and characterization [J]., 2022, 84: 105966.
[40] 張紅梅, 李方懌, 趙春霞, 等. 五味子多糖的分離、純化及結構表征 [J]. 天津中醫藥, 2022, 39(4): 509-515.
[41] Yang R Y, Wang D Y, Li H L,. Preparation and characterization ofpolysaccharide/ polylactic acid composite [J]., 2019, 24(11): E2104.
[42] Xu S Y, Huang X S, Cheong K L. Recent advances in marine algae polysaccharides: Isolation, structure, and activities [J]., 2017, 15(12): E388.
[43] Li X L, He Y L, Zeng P J,. Molecular basis forpolysaccharide used as an antitumour drug in China [J]., 2019, 23(1): 4-20.
[44] Wu M B, Zhang F F, Yu Z P,. Chemical characterization andantitumor activity of a single-component polysaccharide fromvar.[J]., 2015, 133: 294-301.
[45] Surayot U, Wangtueai S, You S G,. Extraction, structural characterisation, and immunomodulatory properties of ediblesub species(Corner and Bas) mucilage polysaccharide as a potential of functional food [J]., 2021, 7(9): 683.
[46] Zhou X N, Lu Q Q, Kang X Z,. Protective role of a new polysaccharide extracted fromThunb. in mice with ulcerative colitis induced by dextran sulphate sodium [J]., 2021, 2021: 8878633.
[47] 張亞麗, 高簡, 苗祥貞, 等. 黃連多糖中單糖組成的HPLC-MSn法快速識別 [J]. 世界中醫藥, 2017, 12(11): 2775-2778.
[48] 孫小文. 云芝多糖提取、純化、單糖組成分析及體外抗氧化活性的研究 [D]. 哈爾濱: 黑龍江中醫藥大學, 2014.
[49] Jing Y S, Zhang S L, Li M S,. Research progress on the extraction, structure, and bioactivities of polysaccharides from[J]., 2022, 11(14): 2126.
[50] Wang J, Zhang Y X, Xu X H,. ASP2-1, a polysaccharide fromSchott, inhibits osteoclastogenesis via modulation of NFATC1 and attenuates LPS-induced bone loss in mice [J]., 2020, 165(Pt B): 2219-2230.
[51] Zhang W X, Song D, Xu D,. Characterization of polysaccharides with antioxidant and immunological activities from[J]., 2015, 133: 154-162.
[52] 張紅嬌. 紫蘇多糖的分離純化、結構表征及應用研究 [D]. 太原: 中北大學, 2022.
[53] Xin T, Zhang F B, Jiang Q Y,. Extraction, purification and antitumor activity of a water-soluble polysaccharide from the roots of[J]., 2012, 90(2): 1127-1131.
[54] 依力奴爾·艾尼瓦爾. 維藥阿里紅多糖的分離純化其體外抗氧化活性研究 [D]. 烏魯木齊: 新疆醫科大學, 2017.
[55] Xie J B, Shen Z Y, Anraku Y,. Nanomaterial-based blood-brain-barrier (BBB) crossing strategies [J]., 2019, 224: 119491.
[56] Wong K H, Riaz M K, Xie Y N,. Review of current strategies for delivering Alzheimer’s disease drugs across the blood-brain barrier [J]., 2019, 20(2): 381.
[57] Zhang H Q, Wei W, Zhao M,. Interaction between Aβ and tau in the pathogenesis of Alzheimer’s disease [J]., 2021, 17(9): 2181-2192.
[58] Gouras G K, Olsson T T, Hansson O. Β-Amyloid peptides and amyloid plaques in Alzheimer’s disease [J]., 2015, 12(1): 3-11.
[59] Wan L, Zhang Q, Luo H B,.polysaccharide attenuates Aβ toxicity and cognitive defects in APP/PS1 mice [J]., 2020, 12(13): 13422-13436.
[60] Li Z P, Chen X, Zhang Y F,. Protective roles ofpolysaccharides against Alzheimer’s disease via Nrf2 pathway [J]., 2019, 121: 29-37.
[61] Lin Y W, Fang C H, Liang Y J,. Modified low-temperature extraction method for isolation ofpolysaccharide as antioxidant for the prevention of Alzheimer’s disease [J]., 2021, 22(23): 12760.
[62] Feng C Z, Cao L, Luo D,.polysaccharides attenuate cognitive impairment in senescence-accelerated mouse prone 8 mice via modulation of microglial activation [J]., 2019, 1704: 1-10.
[63] Chen S H, He C Y, Shen Y Y,. Polysaccharide krestin prevents Alzheimer’s disease-type pathology and cognitive deficits by enhancing monocyte amyloid-β processing [J]., 2022, 38(3): 290-302.
[64] 李珍, 阿依江·哈拜克, 叢媛媛, 等. 阿里紅多糖對阿爾茨海默癥小鼠認知功能的作用機制研究 [J]. 中國臨床藥理學雜志, 2022, 38(10): 1097-1100.
[65] Liu Y H, Wang J L, Hsiung G Y R,. Trehalose inhibits Aβ generation and plaque formation in Alzheimer’s disease [J]., 2020, 57(7): 3150-3157.
[66] Luo S L, Zhang X, Huang S,. A monomeric polysaccharide fromimproves cognitive functions in a model of Alzheimer’s disease by reshaping the gut microbiota [J]., 2022, 213: 404-415.
[67] Laurent C, Buée L, Blum D. Tau and neuroinflammation: What impact for Alzheimer’s disease and tauopathies? [J]., 2018, 41(1): 21-33.
[68] Leyns C E G, Holtzman D M. Glial contributions to neurodegeneration in tauopathies [J]., 2017, 12(1): 50.
[69] Zhang Q, Xia Y Y, Luo H B,.polysaccharide attenuates tau hyperphosphorylation and cognitive impairments in hTau infected mice [J]., 2018, 11: 437.
[70] 李珍, 叢媛媛, 阿依江·哈拜克, 等. 阿里紅多糖組分對APP/PS1雙轉基因模型小鼠海馬區AKT/GSK3β/Tau/P-tau蛋白表達的影響 [J]. 天然產物研究與開發, 2020, 32(2): 288-295.
[71] 蘇亞楠, 程開, 竇鵬揮, 等. 山茱萸多糖對阿爾茨海默病模型大鼠學習記憶及海馬糖原合成酶激酶-3β表達的影響 [J]. 中國老年學雜志, 2018, 38(11): 2700-2702.
[72] Chen Z C, Zhong C J. Oxidative stress in Alzheimer’s disease [J]., 2014, 30(2): 271-281.
[73] Ma Q. Role of nrf2 in oxidative stress and toxicity [J]., 2013, 53: 401-426.
[74] Qin X D, Hua J, Lin S J,.polysaccharide alleviates cognitive impairment and β-amyloid accumulation in APP/PS1 mice via Nrf2 pathway [J]., 2020, 531(3): 431-437.
[75] 蘇國華, 劉立海, 陳慧麗, 等. 黃芪多糖對AD大鼠模型氧化應激反應與Wnt信號通路的影響 [J]. 中國煤炭工業醫學雜志, 2020, 23(1): 21-26.
[76] Osakabe N, Yasuda A, Natsume M,. Rosmarinic acid, a major polyphenolic component of, reduces lipopolysaccharide (LPS)-induced liver injury in-galactosamine (-GalN)-sensitized mice [J]., 2002, 33(6): 798-806.
[77] 劉瀟然. 枸杞多糖對Aβ42誘導的SH-SY5Y細胞氧化損傷及其干預LPS刺激的BV-2細胞炎癥反應的作用研究 [D]. 銀川: 寧夏大學, 2018.
[78] 楊倩, 鄧明珠. 阿里紅多糖干預對β淀粉樣蛋白1-42誘導的阿爾茨海默病大鼠腦內氧化應激狀態及記憶功能的影響 [J]. 中國醫藥, 2022, 17(1): 107-111.
[79] 蘇麗燕·賽力木江, 依木然·馬瑞士, 叢媛媛, 等. 阿里紅多糖通過激活Nrf2/ARE通路改善阿爾茨海默病大鼠海馬及腦皮層的氧化應激損傷 [J]. 天然產物研究與開發, 2021, 33(1): 89-96.
[80] 阿依江·哈拜克, 木卡德斯·哈力克, 帕麗達·阿不力孜. 阿里紅多糖對APP/PS1雙轉基因小鼠神經損傷的保護作用 [J]. 中藥藥理與臨床, 2019, 35(3): 59-66.
[81] 王虎平, 吳紅彥, 李海龍, 等. 當歸多糖對阿爾茨海默病模型大鼠學習記憶及β-淀粉樣蛋白代謝的影響 [J]. 中國中醫藥信息雜志, 2018, 25(4): 51-55.
[82] Woodburn S C, Bollinger J L, Wohleb E S. The semantics of microglia activation: Neuroinflammation, homeostasis, and stress [J]., 2021, 18(1): 258.
[83] Dhapola R, Hota S S, Sarma P,. Recent advances in molecular pathways and therapeutic implications targeting neuroinflammation for Alzheimer’s disease [J]., 2021, 29(6): 1669-1681.
[84] Anwar S, Rivest S. Alzheimer’s disease: Microglia targets and their modulation to promote amyloid phagocytosis and mitigate neuroinflammation [J]., 2020, 24(4): 331-344.
[85] Zhong J, Qiu X, Yu Q,. A novel polysaccharide fromprotects against LPS-induced neuroinflammation and neurotoxicity by inhibiting TLR4-mediated MyD88/NF-κB and PI3K/Akt signaling pathways [J]., 2020, 163: 464-475.
[86] Chen H Y, Zhong J, Li J X,. PTP70-2, a novel polysaccharide from, prevents neuroinflammation and protects neurons by suppressing the TLR4-mediated MyD88/NF-κB signaling pathway [J]., 2022, 194: 546-555.
[87] Shi W T, Zhong J, Zhang Q,. Structural characterization and antineuroinflammatory activity of a novel heteropolysaccharide obtained from the fruits of[J]., 2020, 229: 115405.
[88] Xu M J, Yan T X, Fan K Y,. Polysaccharide ofameliorates cognitive decline in a mouse model of Alzheimer’s disease [J]., 2019, 237: 354-365.
[89] Xu M J, Wang J Y, Zhang X Y,. Polysaccharide fromacts via LRP-1 to reverse microglia activation through suppression of the NF-κB and MAPK signaling [J]., 2020, 256: 112798.
[90] Wang K P, Yang X W, Wu Z J,.polysaccharide protected CCl4-induced liver fibrosis through intestinal homeostasis and the LPS-TLR4-NF-κB signaling pathway [J]., 2020, 11: 240.
[91] Elmore S. Apoptosis: A review of programmed cell death [J]., 2007, 35(4): 495-516.
[92] He B, Chen W, Zeng J S,. microRNA-326 decreases tau phosphorylation and neuron apoptosis through inhibition of the JNK signaling pathway by targeting VAV1 in Alzheimer’s disease [J]., 2020, 235(1): 480-493.
[93] Byun E B, Cho E J, Kim Y E,. Neuroprotective effect of polysaccharide separated fromBritton var.Kudo against H2O2-induced oxidative stress in HT22 hippocampus cells [J]., 2018, 82(8): 1344-1358.
[94] 陳毅飛, 劉凱菲, 吳世敏, 等. 黃精多糖對阿爾茨海默病模型斑馬魚p38 MAPK/N-cadherin的影響 [J]. 中國藥理學與毒理學雜志, 2021, 35(9): 659-660.
[95] Li Y J, Wang B M, Liu C,. Inhibiting c-Jun-terminal kinase (JNK)-mediated apoptotic signaling pathway in PC12 cells by a polysaccharide (CCP) fromagainst amyloid-β (Aβ)-induced neurotoxicity [J]., 2019, 134: 565-574.
[96] Du Q, Zhu X Y, Si J R.polysaccharide ameliorates memory impairment in Alzheimer’s disease rat through activating BDNF/TrkB/CREB pathway [J]., 2020, 245(1): 1-10.
[97] 屈文英, 解建國, 梁安心, 等. 黃芪多糖對阿爾茨海默病大鼠神經細胞活性、認知功能及Caspase-9表達水平的影響 [J]. 卒中與神經疾病, 2021, 28(5): 543-549.
[98] 賈寧, 張澤, 韓錕. 黃芪多糖對APP/PS1轉基因小鼠認知功能的自噬及凋亡的改善作用機制研究 [J]. 中國臨床藥理學雜志, 2020, 36(20): 3328-3331.
[99] Zhang S W, Li L L, Hu J T,. Polysaccharide ofvar.Cheng et L. K. Fu attenuates neurotoxicity and cognitive dysfunction in mice with Alzheimer’s disease [J]., 2020, 58(1): 959-968.
[100] Levine B, Kroemer G. Autophagy in the pathogenesis of disease [J]., 2008, 132(1): 27-42.
[101] Guo F, Liu X Y, Cai H B,. Autophagy in neurodegenerative diseases: Pathogenesis and therapy [J]., 2018, 28(1): 3-13.
[102] Reddy P H, Oliver D M. Amyloid beta and phosphorylated tau-induced defective autophagy and mitophagy in Alzheimer’s disease [J]., 2019, 8(5): E488.
[103] Wang J D, Liu P, Huang X B,. Validation of the protective effects ofpolysaccharide on lipopolysaccharide-induced learning and memory impairments via regulation of autophagy based on network pharmacology [J]., 2021, 10(2): 1089-1100.
[104] 陳華群, 王靈俊, 王錦燕, 等. 紅豆杉多糖對阿爾茨海默病大鼠的保護作用及其可能機制 [J]. 中國臨床藥學雜志, 2020, 29(4): 261-266.
[105] 李海寧, 馬婷婷, 王妍柏, 等. 枸杞多糖通過PI3K/ Akt/mTOR通路調節自噬減輕β淀粉樣蛋白1-40對HT22細胞的損傷 [J]. 寧夏醫學雜志, 2019, 41(10): 872-875.
[106] Kerr J S, Adriaanse B A, Greig N H,. Mitophagy and Alzheimer’s disease: Cellular and molecular mechanisms [J]., 2017, 40(3): 151-166.
[107] Hu Y R, Xing S L, Chen C,.polysaccharides alleviate Aβ1-40-induced PC12 cells energy dysmetabolism via CD38/NAD+signaling pathway [J]., 2021, 18(3): 208-221.
[108] Shin S J, Nam Y, Park Y H,. Therapeutic effects of non-saponin fraction with rich polysaccharide from Korean red ginseng on aging and Alzheimer’s disease [J]., 2021, 164: 233-248.
[109] 車敏, 安方玉, 王燕, 等. 當歸多糖對阿爾茨海默病模型大鼠海馬神經元內質網應激的影響 [J]. 中醫臨床研究, 2021, 13(2): 7-11.
[110] Hampel H, Mesulam M M, Cuello A C,. The cholinergic system in the pathophysiology and treatment of Alzheimer’s disease [J]., 2018, 141(7): 1917-1933.
[111] Ferreira-Vieira T H, Guimaraes I M, Silva F R,. Alzheimer’s disease: Targeting the cholinergic system [J]., 2016, 14(1): 101-115.
[112] 姜倩倩, 梁少瑜, 李新萍, 等. 楮實子多糖的制備、分離及其對Aβ25-35誘導的SH-SY5Y細胞損傷和AChE的抑制作用 [J]. 深圳中西醫結合雜志, 2021, 31(17): 1-4.
[113] Liu Y Y, Liu Z Y, Wei M Y,. Pharmacodynamic and urinary metabolomics studies on the mechanism ofpolysaccharide in the treatment of Alzheimer’s disease [J]., 2019, 10(1): 432-447.
[114] Zhou X B, Zhang Y X, Jiang Y Q,.polysaccharide attenuates damage of nervus in Alzheimer’s disease rat model induced by-galactose and aluminum trichloride [J]., 2021, 32(8): 727-737.
[115] Cardozo P L, de Lima I B Q, Maciel E M A,. Synaptic elimination in neurological disorders [J]., 2019, 17(11): 1071-1095.
[116] Zhou Y, Duan Y H, Huang S C,. Polysaccharides fromameliorate amyloid pathology and cognitive functions in APP/PS1 transgenic mice [J]., 2020, 144: 1004-1012.
[117] 萬璐. p53蘇木化異常修飾促進衰老與阿爾茨海默癥發病機理研究[D]. 武漢: 華中科技大學, 2021.
ResearchprogressonmechanismoftraditionalChinesemedicinepolysaccharides in preventing and treating Alzheimer’s disease
ZHANG Jian, LIQuan, ZHOU Yan-yan
Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China
Alzheimer’s disease (AD) is a common neurodegenerative disease, which has become one of the important diseases seriously threatening the physical and mental health of the elderly. Traditional Chinese medicine has been widely used in experimental research on the treatment of AD because of its multi-target, multi-channel and stable nature. A large number of studies have shown that traditional Chinese medicine polysaccharides play an important role in the prevention and treatment of AD. This paper mainly reviewed the source and action way of traditional Chinese medicine polysaccharide for prevention and treatment of AD, and the action mechanism of traditional Chinese medicine polysaccharide for prevention and treatment of AD (inhibition of amyloid β-protein production, reduction of Tau phosphorylation level, inhibition of oxidative stress, inhibition of neuroinflammation, inhibition of cell apoptosis, regulation of autophagy, improvement of energy metabolism, etc.), aiming to provide reference and basis for the clinical drug development of traditional Chinese medicine polysaccharides in the prevention and treatment of AD.
traditional Chinese medicine polysaccharide; Alzheimer’s disease; amyloid β-protein; Tau phosphorylation; oxidative stress; neuroinflammation; cell apoptosis; autophagy; energy metabolism
R282.710.5
A
0253 - 2670(2022)23 - 7553 - 13
10.7501/j.issn.0253-2670.2022.23.027
2022-08-02
國家自然科學基金資助項目(81774197);國家自然科學基金資助項目(81803984)
張 健(1996—),男,碩士,研究方向為中醫藥防治老年性疾病。E-mail: 904407928@qq.com
通信作者:周妍妍(1977—),女,教授,博士生導師,主要從事中醫藥防治老年性疾病研究。E-mail: 13339319259@163.com
李 全(1978—),男,副教授,碩士生導師,主要從事中醫藥防治老年性疾病研究。E-mail: liquan_hljucm@163.com
[責任編輯 崔艷麗]

