光呼吸研究進展
鐘孝芬,李波娣,李敏姬,張智勝,彭新湘
(華南農業大學生命科學學院,亞熱帶農業生物資源保護與利用國家重點實驗室,廣州 510642)
1 光呼吸代謝途徑概述
光合作用是綠色植物利用光能,把CO2和H2O轉化為儲存能量的有機物,同時釋放O2的過程。光合作用能為整個生命系統提供物質和能量。光呼吸伴隨著光合作用而進行,綠色植物、藻類和藍細菌利用光能并在O2的參與下將有機物分解為CO2和H2O,該過程即為光呼吸[1–3]。每年大約有29 Gt 的光合產物以CO2形式被重新釋放到大氣中[4–5]。光呼吸的產生是因為1,5-二磷酸核酮糖羧化酶/加氧酶Rubisco 具有雙功能酶活性,1,5-二磷酸核酮糖在Rubisco 的催化下既可進行羧化反應又可進行加氧反應,而加氧或者羧化反應的程度取決于CO2和O2濃度的比值,高比值有利于羧化反應,低比值有利于加氧反應[6]。RuBP 的羧化結果是產生2 分子3-磷酸甘油酸,然后進入卡爾文循環,而RuBP 氧化結果則是產生1 分子3-磷酸甘油酸(3-PGA)和1 分子2-磷酸乙醇酸(2-PG)。2-PG 經過光呼吸代謝途徑再部分生成3-PGA 回流進入卡爾文循環[7],光呼吸代謝途徑能夠回收75%的2-PG 中的碳,其余25%的碳以CO2的形式在線粒體中釋放[8–9]。葉綠體、過氧化物體、線粒體及細胞質中均有光呼吸代謝過程,此過程還涉及多種酶的共同參與[10]。光呼吸的代謝過程見圖1。

圖1 高等植物光呼吸途徑及其與卡爾文循環和氨同化的相互聯系[11]。2-OG: 2-酮戊二酸; 3-PGA: 3-磷酸甘油酸; 2-PG: 2-磷酸乙醇酸; Ala: 丙氨酸;Asn: 天冬酰胺; ASNS: 天冬酰胺合成酶; Asp: 天冬氨酸; CAT: 過氧化氫酶; Gln: 谷氨酰胺; FD-GOGAT: 鐵氧還蛋白依賴性谷氨酸合酶; Glu: 谷氨酸;GDC: 甘氨酸脫羧酶復合物; GLO: 乙醇酸氧化酶; GLYK: 甘油酸3-激酶; GGAT: 谷氨酸:乙醛酸轉氨酶; GS2: 谷氨酰胺合成酶; SGAT: 絲氨酸:乙醛酸轉氨酶; SHMT: 絲氨酸羥甲基轉移酶; Rubisco: 核酮糖1,5-二磷酸羧化/加氧酶; HPR1: 羥基丙酮酸還原酶1。Fig.1 Photorespiration pathway in higher plants and their relationship with Calvin cycle and ammonia assimilation[11].2-OG: 2-Oxoglutaric acid; 3-PGA:3-Phosphoglycerate; 2-PG: Phosphoglycolic acid; Ala: Alanine; Asn: Asparagine; ASNS: Asparagine synthetase; Asp: Aspartic acid; CAT: Catalase; Gln:Glutamine; FD-GOGAT: Ferridoxin-dependent glutamate synthase; Glu: Glutamate; GDC: Glycine decarboxylase complex; GLO: Glycolate oxidase; GLYK:Glycerate 3-kinase; GGAT: Glutamate:glyoxylate aminotransferase; GS2: Plastid glutamine synthetase 2; SGAT: Serine:glyoxylate aminotransferase; SHMT:Serine hydroxymethyltransferase; Rubisco: Ribulose 1,5-bisphosphate carboxylase/oxygenase; HPR1: Hydroxypyruvate reductase 1.
Rubisco 在葉綠體中催化RuBP 產生2-PG,乙醇酸磷酸酶(PGLP)催化2-PG 去磷酸化生成乙醇酸,乙醇酸通過乙醇酸/甘油酸逆向轉運蛋白從葉綠體運輸至細胞質中,然后進入過氧化物酶體中[12]。在乙醇酸氧化酶(GLO)的催化下,乙醇酸氧化生成乙醛酸并產生H2O2,H2O2被過氧化氫酶(CAT)分解。乙醛酸在谷氨酸:乙醛酸轉氨酶(GGAT)和絲氨酸:乙醛酸轉氨酶(SGAT)的作用下轉化為甘氨酸。甘氨酸從過氧化物酶體轉移到線粒體后,由甘氨酸脫羧酶(GDC)和絲氨酸羥甲基轉移酶(SHMT)將2個甘氨酸分子催化為1 個絲氨酸并釋放1 分子CO2和NH3。氧化脫羧步驟GDC 復合體將NAD+還原成NADH。在SGAT 的作用下,絲氨酸從線粒體返回到過氧化物酶體產生羥基丙酮酸(HP)。在羥基丙酮酸還原酶(HPR1)的催化下,HP 還原為甘油酸。最后甘油酸返回葉綠體,在甘油酸激酶(GLYK)的作用下,甘油酸磷酸化生成3-磷酸甘油酸(3-PGA),重新返回到卡爾文循環中[13]。
2 光呼吸的生理功能
光呼吸的主要生理功能是清除Rubisco 加氧反應生成的毒性中間代謝物2-PG 并回收部分碳素,但該過程釋放的CO2降低了植物的凈光合效率[14–16]。然而值得關注的是,在逆境條件下光呼吸對C3植物的光合作用及產量維持可能具有保護作用[17–18]。此外已知光呼吸還與植物其它多種生物學過程密切相關,C3植物光呼吸減弱后會導致氮素吸收與同化受到抑制[19–20]。Gao 等[21]報道擬南芥(Arabidopsis thaliana)cat2突變體中光呼吸生成的H2O2可誘導葉片生長素濃度降低并出現葉片邊緣卷曲表型,而Kerchev 等[22]報道外源施加生長素類似物可消除cat2突變體因光呼吸H2O2積累而誘發的細胞程序性死亡表型。在擬南芥、煙草(Nicotiana tabacum)和水稻(Oryza sativa)等植物中光呼吸還參與了其非寄主抗性防衛信號以及病原菌誘發的水楊酸信號的轉導過程[23–25]。光呼吸不僅在C3植物中具有重要功能,而且在光呼吸速率相對低的C4植物或藍藻中也起著不可或缺的作用,因為發現這些低光呼吸生物的突變體同樣表現出典型的光呼吸表型[26–27]。總之,關于光呼吸的功能至今雖然仍存在頗多爭議,但似乎已一致認可光呼吸與植物碳代謝、氮同化、能量代謝以及H2O2信號發生等多個代謝過程密切相關[28–29],并且還可能在植物抗逆性和抗病性中發揮重要作用[30–32]。
3 優化光呼吸的3 種策略
光呼吸是一個耗能的代謝過程,在正常生長條件下,C3植物中可消耗掉凈光合產物的25%~30%[7,33],當遭遇干旱、高溫、高光等逆境脅迫時,其損耗可高達50%[34]。鑒于光呼吸是制約光合作用效率的一個關鍵因子,為提高作物的生產力,目前主要采取了3 種改造策略以試圖降低光呼吸速率而提高光合效率:第1 種是通過酶工程來提高Rubisco 的羧化效率,即直接提高Rubisco 催化的羧化反應速率或減少其加氧反應速率[35];第2 種是通過基因工程與合成生物學技術將某些植物所具備的CO2濃縮機制(CCM)導入到C3植物中,增加Rubisco 周圍的CO2濃度而抑制光呼吸;第3 種是在C3植物中創建光呼吸代謝支路,以降低光呼吸代謝的能量損耗并限制光呼吸。
3.1 分子改造Rubisco
由于光呼吸發生的根本原因是CO2和O2競爭性地與Rubisco 活性中心結合,同時Rubisco 催化RuBP 發生羧化/加氧反應,影響著植物光合作用和光呼吸速率[36]。因此Rubisco 一直被視為固碳系統改造的首要選擇目標,目的是提高其底物選擇性和動力學性能。
Rubisco 復合體的組裝過程復雜,對其改造極具挑戰性,嘗試用藍藻和紅藻的酶替代植物Rubisco但并沒有成功[37]。將編碼紅藻Rubisco 小亞基的基因通過質體轉化在煙草葉綠體高效表達后,煙草本身的大亞基卻不能與紅藻Rubisco 小亞基組裝成全酶[4]。
最近有報道稱將藍藻的CO2濃縮機制和Rubisco引入高等植物的葉綠體中可以提高植物CO2的固定速率,同時降低光呼吸速率[38]。雖然來源于紅藻的Rubisco基因轉化至煙草葉綠體并進行了轉錄表達,但轉基因植株缺乏功能性的Rubisco,認為共表達相容性分子伴侶對于紅藻Rubisco 在植物中的成功組裝是必要的[39]。在水稻Rubisco 中將RbcS 完全替換為高粱RbcS,獲得的雜交Rubisco 表現出幾乎與C4植物類似的催化特性,但與野生型水稻相比,轉基因株系中積累的Rubisco 水平降低[40]。來自類球紅細菌(Rhodobacter sphaeroides)的red-type Rubisco(RsRubisco)可在煙草葉綠體中完成組裝,但其活性只有野生型煙草Rubisco 活性的40%,并且轉基因煙草生長緩慢。轉入RsRubisco 活化酶RsRca 后,RsRubisco 活性顯著提高,轉基因煙草的光合效率和生長速率明顯高于野生型[41]。因此,通過改善Rubisco 的動力學特性來提高植物的光合效率是一個長期的目標[42–43]。
3.2 提高Rubisco 周圍CO2 濃度
另一種策略旨在優化并利用幾種自然存在的CO2濃縮機制(CCM)。C4植物、藻類和藍細菌依賴于自身的CCM 可以增加Rubisco 附近的CO2濃度,從而增加羧化作用進而抑制加氧作用,該機制可在低CO2條件下提高光合作用的運行效率。藍細菌及藻類中已進化出的CCM 組分包括Rubisco、無機碳轉運蛋白周圍的羧酶體或蛋白核結構和碳酸酐酶[44–46]。在藍細菌和一些變形菌中,Rubisco 聚集在一組稱為羧酶體的微室中[46],這些微室是CCM 的一部分,與CO2和HCO3–轉運蛋白一起參與反應,從而提高細胞質中HCO3–含量。其外層由蛋白質殼包圍,內含碳酸酐酶、Rubisco 蛋白等[46–48]。
目前已經成功將藻類的CCM 部分結構導入植物體,這為在植物體內構建功能性CCM 奠定了基礎[38,49]。將萊茵衣藻CO2濃縮機制(CCM)的成分整合到煙草葉綠體中,轉基因株系表現出光合速率可提高約15%,生物量明顯增加,并積累了更多的碳水化合物[50]。研究還表明,將藍細菌β-羧酶體組分CcmM35 與Rubisco 大、小亞基整合至煙草中,可形成早期羧酶體結構,并在葉綠體基質中形成大分子復合物。當在煙草中瞬時表達多種β-羧酶體蛋白(CcmK2、CcmM、CcmL、CcmO 和CcmN 等),可形成高度有序的空室類似結構[37],其中,CcmM 的SSUL 模塊可參與Rubisco 蛋白聚集過程[51]。在高等植物葉綠體中組裝藍細菌α-羧酶體結構,可提升細胞內碳酸氫鹽含量,從而將CO2大量聚集在Rubisco周圍[52],促進羧化反應的進行。但目前研究工作也僅限于在煙草葉綠體中合成簡化版的羧酶體結構,在植物葉綠體中完全組裝羧酶體和蛋白核結構仍存在一些限制因素。同時只有將Rubisco 正確組裝到CCM 微室,才能確保CCM 結構完整性。只有在進一步了解CCM 結構、組裝機理和功能的基礎上完善所導入CCM 結構的完整性,才可能最終產生改善光合作用的實效[53]。
在C3作物中引入C4植物CCM 系統也可增加Rubisco 附近CO2濃度,將玉米磷酸烯醇/丙酮酸羧化酶(PEPC)和丙酮酸磷酸雙激酶(PPDK)轉入水稻中,雖然這2 種酶能夠高表達,但是轉基因水稻的光合特性沒有改變,在C3植物中引入C4植物光合作用酶還需進一步探索[54]。將C4植物光合系統相關酶引入C3植物時,需要考慮其光合過程中生化反應的變化,由于C4植物Kranz 結構特殊性及其光合作用相關的關鍵酶的分布和作用具有顯著的時空特異性,所以僅將C4植物光合基因引入C3植物形成單一細胞型C4植物無法真正達到C4植物的高光效功能[5,55–56]。C4植物中Rubisco 附近的CO2濃度由葉肉細胞和束鞘細胞之間的代謝活動來提供的,在葉肉細胞中,CO2首先被磷酸烯醇式丙酮酸(PEP)羧化酶轉化為四碳酸,隨后被主動運輸到維管束鞘細胞中[57]進行脫羧,增加Rubisco 附近的CO2濃度。這種C4植物“CO2泵”每固定1 mol CO2需要消耗2個ATP。在水稻中過表達玉米(Zea mays)GOLDEN2-LIKE基因,水稻維管束鞘細胞中光合作用酶得到積累并起作用,表明C4水稻工程的關鍵一步已完成[58]。將玉米C4途徑關鍵酶ZmPEPC、ZmPPDK、ZmNADPMDH和ZmNADP-ME的原始基因分別轉入水稻中,轉基因植株的相應酶活性增強,但光合速率幾乎沒有變化。雖然能完成C4光合途徑的羧化反應,但不能完成后續的PEP 再生構建完整的C4循環[59],水稻等作物的人工C3到C4的轉化將會是一項長期的任務[57]。
3.3 創建光呼吸支路
通過降低光呼吸的能量需求和將光呼吸釋放的CO2重新定位到葉綠體中,可以增強作物光合作用提高產量。構建新型光呼吸支路被認為是提高植物Rubisco 固碳能力的有效途徑之一。由于光呼吸中間代謝產物2-磷酸乙醇酸與乙醇酸等對細胞具有毒性,因此大部分光呼吸支路的構建都以乙醇酸為底物。作為降低Rubisco 氧化作用和自身光呼吸途徑效率的替代方法,在C3植物中創建光合CO2濃縮機制一直是光呼吸研究領域關注的熱點。
根據時間線對已創建的光呼吸支路予以梳理,2007年,Kebeish 等[60]在擬南芥葉綠體中過表達大腸桿菌乙醇酸脫氫酶(GDH)、乙醛酸聚醛酶(GCL)和羥基丙二酸半醛還原酶(TSR),簡稱GGT 支路,此支路在葉綠體中將2 個乙醇酸轉化為甘油酸和CO2,這樣降低了光呼吸代謝ATP 需求量,同時避免了NH3的產生,GGT轉基因植株在特定培養條件下[光照8 h,光強為100μmol/(m2·s)]光合速率提高,同時光呼吸降低,生物量顯著提高。2012年,Maier等[61]在擬南芥的葉綠體中表達乙醇酸氧化酶、蘋果酸合酶和過氧化氫酶(簡稱GMC 支路),此支路能完成乙醇酸代謝循環,不僅在葉綠體中釋放CO2,同時部分避免了NH3的釋放。特定培養條件下,過氧化氫酶活性顯著提高的過表達株系表現出光合速率和生物量的增加。然而,GMC 途徑會比植物自身的光呼吸途徑更加耗能[62]。2014年Nolke 等[63]在馬鈴薯(Solanum tuberosum)葉綠體中僅導入大腸桿菌乙醇酸脫氫酶,轉基因植株的光合效率、生物量和產量也大幅提升。2015年Dalal[64]在亞麻薺(Camelina sativa)中重復了GGT 途徑,將3 個酶基因導入亞麻薺并定位到葉綠體中,與野生型相比,轉基因植株生長更迅速,提前約1 周開花,光合速率和生物量得到提高,油籽產量提高了57%~73%,并降低了光呼吸速率。2016年在馬鈴薯葉綠體中重復了Kebeish 等[60]的GGT 支路,支路1 導入乙醇酸脫氫酶,命名為synGDH;支路2 導入乙醛酸聚醛酶和羥基丙二酸半醛還原酶,命名為synGT。synGDH轉基因植株的生物量比野生型和synGT轉基因植株增加了11%,雖然synGT轉基因植株積累的生物量低于synGDH轉基因植株,但還是明顯高于野生型。同時synGDH轉基因植株的產量分別比野生型和synGT轉基因植株增加38%和16%,這說明在植物葉綠體中表達乙醇酸代謝途徑是有效的[3]。2019年South 等[65]設計了3 條光呼吸支路,支路1是重復Kebeish 等[60]的GGT 支路;支路2 是重復Maier 等[61]的GMC 支路;支路3 是將蘋果酸合酶(MS)和乙醇酸脫氫酶(CrGDH)基因導入葉綠體中,利用RNAi 技術下調光呼吸途徑中乙醇酸轉運蛋白(PLGG1)的表達,進而限制乙醇酸的轉運量。溫室種植條件下,3 條支路的植株生物量與野生型相比,支路1 提高13%,支路2 的無明顯提高,支路3 增加18%,而同時下調PLGG1 的支路3 轉基因植株的生物量顯著增加24%。光合速率與生物量的提高表現一致,田間試驗表明,支路3 轉基因植株的生物量增加25%,同時下調PLGG1 的支路3 轉基因植株生物量增加了40%。
2019年Shen 等[66]將水稻乙醇酸氧化酶(GLO)、草酸氧化酶(OXO)和過氧化氫酶(CAT)基因導入水稻葉綠體中,使乙醇酸在葉綠體中完成代謝并釋放CO2,簡稱GOC 支路(圖2: A),GOC轉基因植株比野生型的凈光合速率與生物量顯著提高。春季大田種植,產量顯著提高,但秋季大田種植產量有所下降。GOC 支路在分流光呼吸同時可減少碳、氮損耗,是第一次在主要糧食作物水稻中成功創建光呼吸代謝支路,具有重要意義。2020年Wang 等[67]將水稻乙醇酸氧化酶(OsGLO1)、大腸桿菌過氧化氫酶(EcCAT)、大腸桿菌乙醛酸聚醛酶(EcGCL)和大腸桿菌羥基丙二酸半醛還原酶(EcTSR)基因(其中EcGCL和EcTSR 以融合蛋白形式EcGCL*EcTSR)引入葉綠體中,簡稱GCGT 支路(圖2: B)。春季大田種植,轉基因植株相比于野生型,凈光合速率、生物量及單株產量顯著提高。2021年Roell 等[68]在擬南芥中導入β-羥基天冬氨酸循環4 個核心酶,即天冬氨酸:乙醛酸轉氨酶、β-羥基天冬氨酸醛縮酶、β-羥基天冬氨酸脫氫酶和亞氨基琥珀酸還原酶,通過融合過氧化物酶體靶信號(PTS)定位到過氧化物酶體(簡稱BHAC 支路)。β-羥基天冬氨酸循環能不依賴于光呼吸中間產物3-磷酸甘油酸再生或光呼吸前體脫羧,而是以高效碳、氮和節約能量的方式將光呼吸的代謝產物乙醛酸轉化為草酰乙酸,這意味著在C3植物中構建C4循環具有可行性。
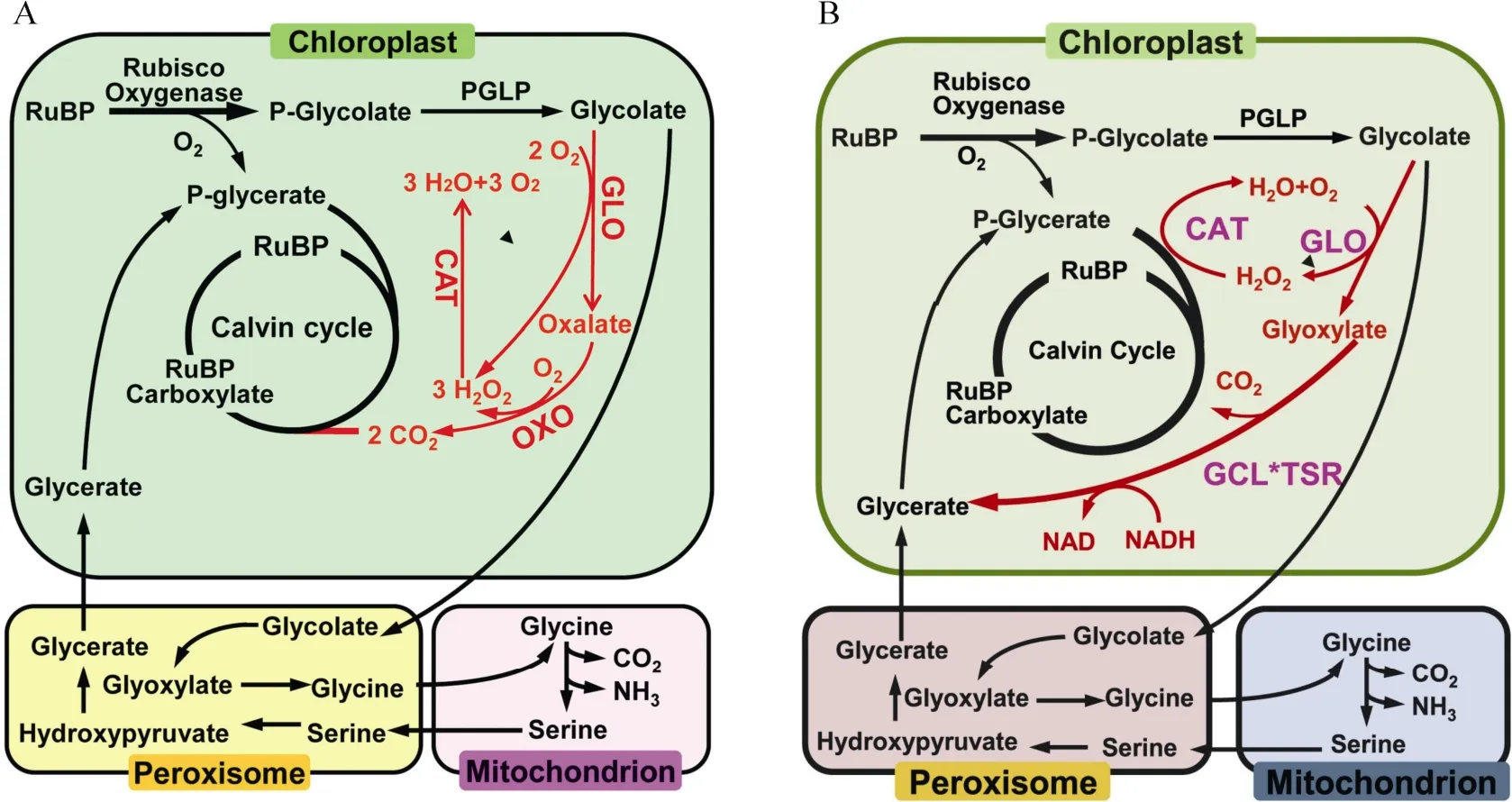
圖2 水稻葉綠體中GOC (A)與GCGT (B)光呼吸支路示意圖[66–67]Fig.2 Schematic diagram of photorespiration bypasss of GOC (A) and GCGT (B) in rice chloroplasts[66–67]
3.4 光呼吸支路改造中的能量平衡
Peterhansel 等[62]對光呼吸改造支路代謝途徑所消耗能量進行計算,自身光呼吸代謝過程需消耗12.25 個ATP,GGT 支路需消耗9.25 個ATP,GMC支路需消耗15 個ATP,GOC 支路中沒有產生額外還原力,整個支路需要消耗20 個ATP,GCGT 支路反應過程中也沒有還原力的產生,整個支路要消耗11.75 個ATP。GGT 途徑與自身光呼吸代謝相比減少了3 個ATP 的消耗,降低了光呼吸過程中的能量消耗。GMC 支路與GOC 支路在能量平衡方面沒有優勢,其能量消耗還高于自身光呼吸代謝,尤其是GOC 高出7.75 個ATP。但為何GMC 支路與GOC支路轉基因植株光合速率與產量仍有明顯提高,可能是提高了葉綠體周圍的CO2濃度,在葉綠體中形成了CO2濃縮機制所致[13]。
4 展望
近年來對于如何進一步降低C3作物光呼吸速率,提高其光合效率以及產量進行了大量研究并取得了一定的進展,隨著基因工程、酶工程及合成生物學的快速發展,降低Rubisco 氧化反應,創建CO2濃縮機制及光呼吸支路的技術水平將會不斷提升。相較于天然固碳途徑,人工生物固碳似乎取得的效果更為明顯,并逐漸成為當前關注的熱點。相比于其它優化光呼吸的策略,未來通過光呼吸支路改造與優化以及Rubisco 固碳效率的提升最具有潛力與前景,這對于解決環境、碳中和、糧食等重大問題,實現生態綠色可持續發展等戰略要求具有重要的理論和實踐意義。

