長鏈醇類和油類物質洗滌液在磁珠法DNA和RNA共提取中的應用
王 鼎, 李福剛, 羅 旺, 陳華劍, 張 珂, 謝國明
(1.重慶醫科大學檢驗醫學院臨床檢驗診斷學教育部重點實驗室,重慶 400042;2.上海奧普生物醫藥股份有限公司,上海 201399)
快速、靈敏的病原體核酸檢測已經成為防控公共衛生事件的重要方法。從生物樣本中提取高純度的核酸在確保核酸檢測準確性中起著極其重要的作用[1]。傳統的核酸提取方法需要復雜的設備,操作繁瑣,耗時長,容易引起交叉污染和核酸樣本損失。微流控技術具有集成化、自動化的特點,其完全密封的流體系統可避免核酸樣本的交叉污染和損失[2]。因此,將微流控技術應用于核酸提取,有助于實現快速、高效、自動化的核酸檢測,對于病原體感染的早期診斷和及時治療具有巨大的臨床應用價值。目前,微流控核酸提取的主要問題在于傳統的70%乙醇洗滌液存在易揮發、易燃的缺點,嚴重制約了其在微流控領域的應用。此外,乙醇殘留對后續的聚合酶鏈反應(polymerase chain reaction,PCR)、逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)、環介導等溫擴增(loopmediated isothermal amplification,LAMP)等檢測步驟,尤其是對低濃度模板的擴增有明顯的抑制作用。有研究結果顯示,一些無揮發性的油性物質,如硅油、FC-40、長鏈醇類均可作為核酸提取的洗滌液候選物,處理后的核酸回收率較高,且對后續的擴增抑制作用很小,甚至無抑制作用[3]。另外,油性物質還具有儲存條件寬松和儲存期較長的優點。為此,本研究擬探討以8種長鏈醇類和油類物質作為洗滌液在磁珠法核酸提取中的應用價值,旨在克服微流控技術在臨床應用中的局限性。
1 材料和方法
1.1 試劑和儀器
硫氰酸胍、Tris-Base、氯化鈉、檸檬酸鈉、乙二胺四乙酸、二甲基硅油、十一醇、正癸醇、正辛醇、1-壬醇購自國藥集團化學試劑有限公司,2-十二烷醇、FC-40購自西寶生物科技(上海)股份有限公司。磁性微球購自蘇州為度生物技術有限公司。北京康為世紀生物科技有限公司MagBead Virus DNA/RNA Kit和北京啟研生物科技有限公司核酸提取/純化試劑盒。PCR master mix、RT-PCR master mix由上海奧普生物醫藥股份有限公司研發。PCR引物序列采用肺炎支原體(Mycoplasma pneumoniae,Mp)基因:上游引物MP-F為5'-CAACATCTGGGACTGGACTGTA-3'、下游引物MP-R為5'-GCCCTATGATTTAGAGATTGCGG-3'、探針引物MP-P-FAM/BHQ為5'-CCTTCAGCCCCAAAACCATCACAGG-3'。RT-PCR所用引物序列采用呼吸道合胞病毒(respiratory syncytial virus,RSV)基因:上游引物RSV-F為5'- AACTCTGGGGCAAATAACAA-3'、下游引物RSV-R為5'-GCRTCTGTWCCATTACACTT-3'、探針引物RSV-P-ROX/BHQ為5'-GCAAAGGCTATCTTAGTGCTCT-3'。引物均由南京金斯瑞生物科技有限公司合成。PCR所用的DNA模板為含引物基因片段的質粒,由生工生物工程(上海)股份有限公司合成。RT-PCR所用的RNA模板為轉錄RNA,先由生工生物工程(上海)股份有限公司合成含引物匹配基因片段的質粒,在基因序列前加入T7序列,再用HiScribe T7 Quick RNA Synthesis Kit(美國NEB公司)轉錄出RNA,并用RNeasy Mini kit(德國Qiagen公司)純化。Mp及培養基均購自美國典型培養物保藏中心(American Type Culture Collection,ATCC),嚴格按菌株說明書進行培養。Q5熒光定量PCR儀購自美國ThermoFisher Scientific公司。
1.2 方法
1.2.1 溶液配制 (1)吸附液:3.6 mol/L硫氰酸胍,10 mmol/L Tris-Base,800 mmol/L氯化鈉,200 mmol/L檸檬酸鈉,pH值5.2。(2)洗脫液:10 mmol/L Tris-Base,1 mmol/L乙二胺四乙酸,pH值8.4。
1.2.2 核酸提取 取200 μL待提取的樣本,加入400 μL核酸提純吸附液,加入1.0 mg磁珠,在旋轉儀上以20 r/min搖勻5 min,用磁力架吸附磁珠,吸棄管中的液體;加入800 μL洗滌液,充分混勻后,用磁力架吸附磁珠,吸棄管中的液體;加入200 μL洗脫液,充分混勻后,在旋轉儀上以20 r/min搖勻解吸附5 min,用磁力架吸附磁珠,待磁珠全部被吸附后,吸出核酸提取物,作為擴增模板。
1.2.3 PCR和RT-PCR (1)反應體系:PCR reaction master mix或RT-PCR reaction master mix 5 μL,10 μmol/L引物各1 μL,10 μmol/L探針各0.5 μL,待測樣本2 μL,用無核酸酶水補至總體積15 μL。(2)PCR擴增條件:95 ℃ 2 min;94 ℃ 10 s,58 ℃ 30 s,50個循環。RT-PCR在PCR擴增條件前增加60 ℃ 5 min進行逆轉錄。
1.2.4 模擬臨床樣本制備 用咽拭子在健康人咽喉部采樣,在保存液中涮洗,取4 mL涮洗液加入100 μL Mp培養物,混勻,制成Mp模擬臨床樣本。95 ℃金屬浴5 min,熱裂解產物等量分裝,測試不同核酸提取方法的性能,并與商品化核酸提取試劑盒進行比較。
1.2.5 不同洗滌液對核酸提取的影響 (1)以102~105拷貝/μL的DNA和RNA混合物為待提取樣本,以5種長鏈醇類物質(十一醇、正癸醇、正辛醇、1-壬醇、2-十二烷醇)和3種油類物質(二甲基硅油、FC-40、石蠟油)為洗滌液,以70%乙醇為陽性對照,采用磁珠法進行核酸提取,比較8種洗滌液的核酸提取性能。(2)在15 μL反應體系中添加3 μL長鏈醇類或油類洗滌液,以3 μL ddH2O為陰性對照,分析8種洗滌液殘留對101~103拷貝/μL DNA和RNA模板擴增的影響。(3)以二甲基硅油、FC-40和70%乙醇作為洗滌液,分別與濕式試劑、干式試劑配合使用,對103拷貝/μL DNA和RNA模板進行提取,比較不同試劑狀態下的核酸提取性能。(4)以二甲基硅油、FC-40和70%乙醇作為洗滌液,分別采用渦旋混勻、移液槍混勻、顛倒混勻3種混勻方式,比較不同混勻方式下103拷貝/μL DNA和RNA模板的核酸提取性能。(5)分析以二甲基硅油、FC-40和70%乙醇為洗滌液的磁珠法對Mp模擬臨床樣本中病原體基因組DNA的提取性能,并與商品化核酸提取試劑盒A和試劑盒B進行比較。所有實驗均重復3次。
1.3 統計學方法
采用SPSS 20.0軟件進行統計分析。呈正態分布的計量資料以±s表示,組間比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 8種洗滌液的核酸提取性能
8種洗滌液中,二甲基硅油和FC-40均能成功提取102~105拷貝/μL的DNA和RNA,提取性能與70%乙醇比較,差異均無統計學意義(P>0.05)。十一醇未能成功提取出102拷貝/μL DNA,其他5種洗滌液在提取102~104拷貝/μL DNA和RNA模板時均有不同程度的提取失敗。見表1。
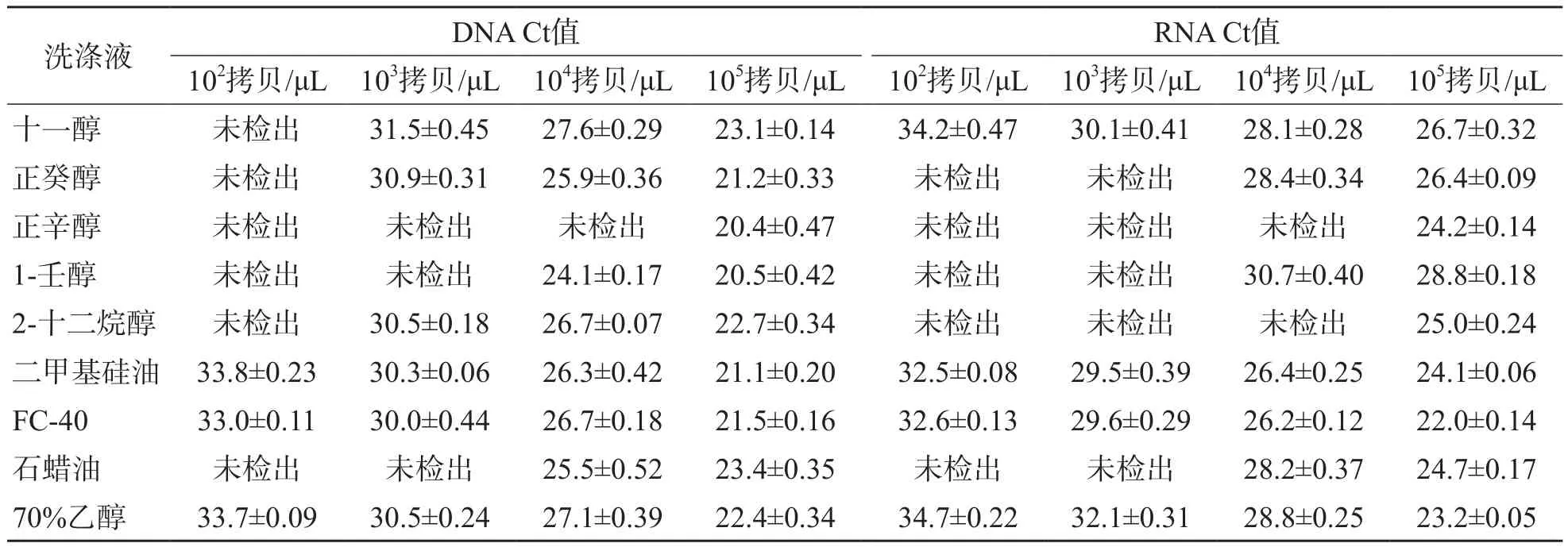
表1 8種洗滌液對102~105拷貝/μL DNA和RNA的提取性能
2.2 8種洗滌液殘留對核酸擴增的影響
8種洗滌液中,二甲基硅油和FC-40殘留均能成功擴增DNA和RNA,與陰性對照ddH2O比較,差異均無統計學意義(P>0.05)。其他6種洗滌液殘留對PCR和RT-PCR均有不同程度的抑制作用,尤其是低拷貝數的DNA和RNA的擴增受到顯著抑制。見表2。
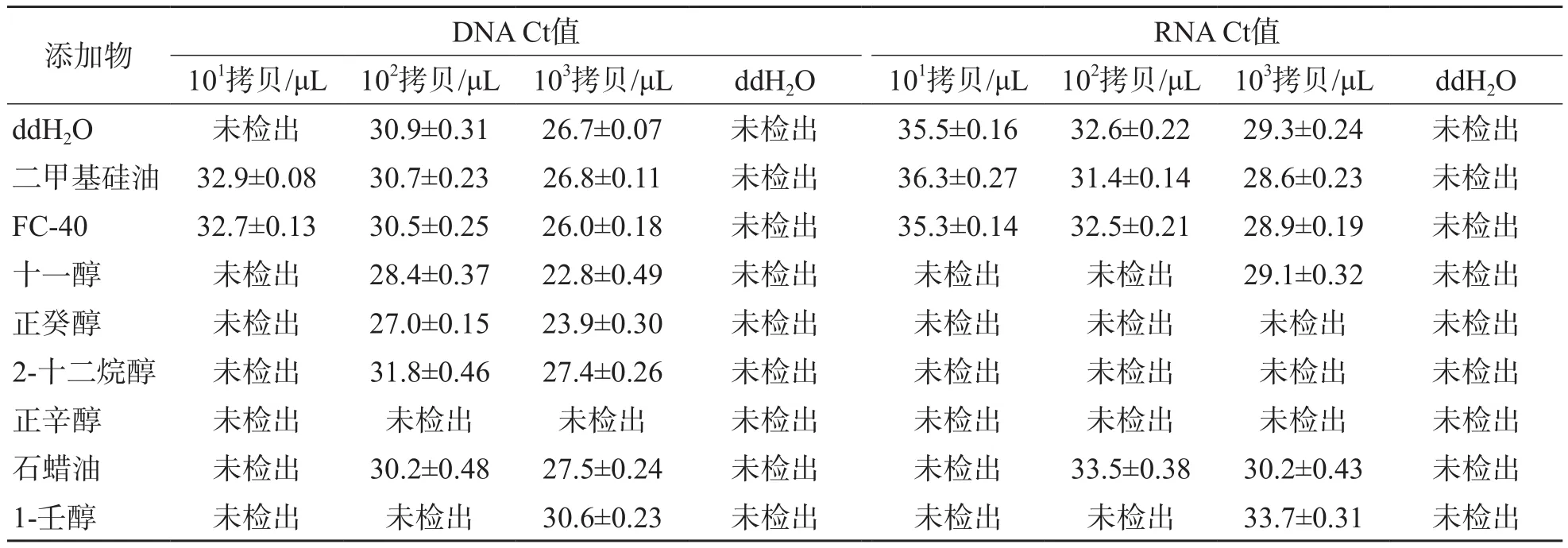
表2 8種洗滌液殘留對核酸擴增檢測的影響
2.3 二甲基硅油和FC-40配合不同狀態試劑使用時對核酸提取性能的影響
以二甲基硅油和FC-40作為洗滌液,無論是配合干式試劑還是濕式試劑,提取103拷貝/μL DNA和RNA模板的Ct值與70%乙醇洗滌液比較,差異均無統計學意義(P>0.05)。見表3。

表3 不同狀態試劑結合油類洗滌液的核酸提取性能
2.4 不同混勻方式對二甲基硅油和FC-40洗滌液的適用性
無論采用哪種混勻方式,以二甲基硅油、FC-40為洗滌液提取103拷貝/μL DNA和RNA模板的Ct值與70%乙醇比較,差異均無統計學意義(P>0.05)。見表4。
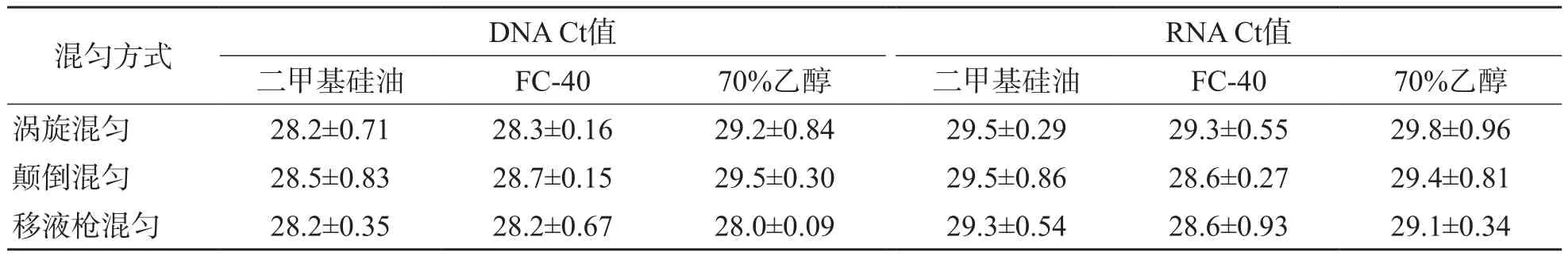
表4 不同混勻方式對二甲基硅油和FC-40洗滌液的適用性
2.5 二甲基硅油和FC-40洗滌液對病原體樣本核酸的提取性能
以二甲基硅油和FC-40為洗滌液,提取Mp模擬臨床樣本DNA的Ct值分別為32.34±0.18和31.87±0.03,與以70%乙醇為洗滌液的Ct值(32.28±0.20)比較,差異無統計學意義(P>0.05)。以二甲基硅油和FC-40為洗滌液的磁珠法提取DNA的Ct值低于商品化核酸提取試劑盒B(Ct值為35.48±0.01)(P<0.05);與商品化核酸提取試劑盒A(Ct值為31.81±0.30)比較,差異無統計學意義(P>0.05)。
3 討論
感染性疾病的病原體種類多種多樣,準確、快速的病原體的精準檢測已成為疾病診療和防控的關鍵。傳統的病原體培養法周期長,抗體法易受既往感染史影響,而核酸法可規避上述弊端,能從復雜的生物樣本中快速、準確地檢測出特定病原體的基因組DNA或RNA,敏感性高,特異性好[4]。傳統的核酸檢測方法是實時熒光PCR,操作繁瑣,極易造成交叉污染,導致假陽性結果。分子微流控以微管道網絡為結構特征,可制備成全封閉的、自動化的設備,整合了核酸提取和擴增檢測的全過程,可避免交叉污染,同時縮短了核酸檢測的時間,擴大了核酸檢測的應用范圍[5]。
核酸檢測的性能很大程度上取決于核酸提取步驟。目前,主流的核酸提取方法——磁珠法具有簡便、快速、高通量、自動化等優勢[6],其使用的洗滌液為70%~80%的乙醇。由于乙醇易揮發、易燃,整合在微流控板卡中運輸和儲存時存在一定的安全隱患;乙醇濃度降低還會導致核酸從磁珠上解吸附,造成核酸量的損失。此外,微流控產品具有體積小、重量輕、可常溫儲存等優點,各反應試劑需盡可能地制備成凍干品,以便常溫運輸和儲存,但具有揮發性質的乙醇既不能做成凍干品,也無法滿足上下游試劑凍干品在微流控組裝過程中的極干燥環境要求[3]。因此,乙醇無法用于微流控產品。近年來,研究者們采用基于水相-氣相-油相結構的表面張力輔助的不混溶相過濾(immisciblefiltration assisted by surface tension,IFAST)體系來構建微流控核酸提取和檢測系統,洗滌液通常選用油類化合物[7]。HU等[8-9]構建了IFAST體系,從全血和血漿樣本中迅速分離游離DNA(cell-free DNA,cfDNA),整個提取過程不超過15 min,后續又構建了基于IFAST和LAMP的一體化核酸芯片,可在60 min內完成cfDNA的提取和檢測,證實了油性洗滌液在微流控平臺上的潛在應用價值。
本研究對5種長鏈醇類和3種油類洗滌液在微流控平臺上的應用進行了分析,并針對病原體的基因組分DNA和RNA兩大類的特點,探討了DNA、RNA共提取的方法,以便在微流控平臺上開展多種病原體的聯合檢測,結果顯示,8種洗滌液中,二甲基硅油和FC-40對DNA和RNA的提取性能與70%乙醇相比差異較小,在DNA和RNA模板量為102~105拷貝/μL時均能檢出,而其他6種洗滌液的提取效率相對較低,尤其是對于低濃度核酸模板而言,效率更低。考慮到微流控技術平臺無法模擬手工移液器的吸棄操作,難以實現洗滌液的完全去除,本研究特別檢測了各種油性洗滌液殘留對后續擴增的影響,其中二甲基硅油和FC-40對PCR和RT-PCR均無抑制作用,而其他6種洗滌液對下游擴增反應均有程度不同的抑制。由此可見,二甲基硅油和FC-40可取代70%乙醇,作為核酸提取的洗滌液。
針對微流控的特點,本研究將吸附液、洗脫液制成干式試劑,復溶后結合二甲基硅油和FC-40洗滌液,其核酸提取性能與濕式試劑無差異,說明油類洗滌液配合干式試劑適用于微流控平臺。另外,油類洗滌液黏度較高,為探索適合微流控平臺的洗滌混勻方式,本研究對渦旋混勻、移液槍混勻、顛倒混勻3種不同的混勻方式進行了探討,結果顯示,無論采用哪種混勻方式,以二甲基硅油、FC-40為洗滌液提取103拷貝/μLDNA和RNA模板的Ct值與70%乙醇比較,差異均無統計學意義(P>0.05)。說明以二甲基硅油、FC-40為洗滌液時,不同的混勻方式對核酸提取無影響。
本研究結果還顯示,以二甲基硅油和FC-40為洗滌液,提取Mp模擬臨床樣本DNA后的Ct值與以70%乙醇為洗滌液時的Ct值比較,差異無統計學意義(P>0.05);且與商品化核酸提取試劑盒A的DNA提取性能基本一致(P>0.05),提示油類洗滌液可用于臨床樣本的核酸提取。
綜上所述,以二甲基硅油和FC-40為洗滌液,采用磁珠法對DNA和RNA進行共提取的效率與傳統70%乙醇洗滌液等效,且具有不易揮發、安全的優點,適用于微流控產品的開發和臨床應用。

