雪腐鐮刀菌和醬油曲霉轉化橙皮苷生成橙皮素單葡萄糖苷效果
張風亭,胡 坦,潘思軼
(華中農業大學食品科學與技術學院,湖北 武漢 430070)
橙皮苷是存在于柑橘類水果中的一種黃烷酮化合物,具有抗炎、抗氧化、促進成骨細胞分化等多種藥理活性[1],除此之外,還可用作食品添加劑、果蔬保鮮劑等[2]。但由于橙皮苷的水溶性較差(2 mg/100 g)[3],生物利用度較低,因此,必須對其進行改性,增加水溶性,從而擴大橙皮苷在醫藥、食品以及化妝品等領域的應用。
目前國內外對橙皮苷改性方法研究較多的是生物轉化法[4]。生物法避免了化學法存在的反應不易控制、反應條件劇烈以及環境污染嚴重等缺陷,憑借其反應效率高、特異性強、反應條件溫和等優勢在一定程度上取代了化學法[5]。生物轉化包括酶法和微生物發酵法。近年來,微生物發酵法因其易于培養、菌種資源豐富、產生的酶系強大等特點,在生物轉化領域備受關注。李小莉[6]在篩選高產且傳代穩定的橙皮苷酶生產菌株時發現,雪腐鐮刀菌(Fusarium nivale)是最佳的發酵菌株。劉曉晶[7]利用雪腐鐮刀菌發酵產橙皮苷酶的特性研究并優化了橙皮苷改性的工藝條件。橙皮苷酶和柚皮苷酶都是含有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的復合酶,均可用于橙皮苷的轉化,一般途徑為橙皮苷在α-L-鼠李糖苷酶的作用下生成橙皮素單葡萄糖苷(hesperitin-7-O-glucoside,HMG),HMG在β-D-葡萄糖苷酶的作用下繼續生成橙皮素[8-9]。鄭美瑜等[10]研究發現,柚皮苷酶可以更快酶解橙皮苷。與此同時,國外研究報道指出[11-12],從韓國傳統大豆發酵產物中分離得到的醬油曲霉(Aspergillus sojae)具有較強的柚皮苷酶活性,該酶作用于橙皮苷得到了溶解度較高的HMG。但迄今為止,鮮有關于該菌株發酵轉化橙皮苷的研究報道。因此,本研究基于雪腐鐮刀菌和醬油曲霉均可轉化橙皮苷這一理論,以雪腐鐮刀菌、醬油曲霉和混合菌(雪腐鐮刀菌-醬油曲霉1∶1)這3種菌株作為出發菌株,比較其發酵轉化橙皮苷的效果,旨在篩選出更為適合橙皮苷轉化的菌株。
1 材料與方法
1.1 材料與試劑
1.1.1 材料與菌種
橙皮苷(純度95%) 上海源葉生物科技有限公司;雪腐鐮刀菌(14 mm試管斜面)、醬油曲霉(凍干粉) 北納生物科技有限公司。
1.1.2 試劑
醋酸-醋酸鈉緩沖液(pH 5.5)、橙皮苷、HMG及橙皮素標準品 上海源葉生物科技有限公司;甲醇(色譜純)、88%甲酸(分析純) 武漢飛揚生物科技有限公司;葡萄糖 國藥集團化學試劑有限公司;酵母膏(微生物級)、三水合磷酸氫二鉀(分子生物級)生工生物工程(上海)股份有限公司。
1.1.3 培養基
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:葡萄糖20 g,馬鈴薯浸出粉5 g,瓊脂14 g,蒸餾水1 000 mL,pH值自然,121 ℃滅菌15 min;液體種子培養基:葡萄糖40 g,酵母膏5 g,K2HPO4·3H2O 2 g,蒸餾水1 000 mL,pH值自然,121 ℃滅菌15 min。
1.2 儀器與設備
PHS-3C pH計 上海儀電科學儀器股份有限公司;LK50T顯微鏡 天津徠科光學儀器有限公司;LX-C35L高壓滅菌鍋 合肥華泰醫療設備有限公司;KQ-300DE超聲波清洗器 昆山市超聲儀器有限公司;AllegraX-30R高速冷凍離心機 貝克曼庫爾特有限公司;THZ-98A恒溫振蕩器 上海一恒科學儀器有限公司;e2695高效液相色譜儀(配有可變波長紫外檢測器及Empower數據處理系統)、MA 01757超高效液相色譜-質譜聯用儀(配有電噴霧離子源及UNIFI科學信息系統)美國Waters公司。
1.3 方法
1.3.1 菌種活化
雪腐鐮刀菌:試管斜面經表面消毒之后,在超凈工作臺中打開,用無菌接種鋤和接種鏟切0.5 cm×0.5 cm的小正方形塊,然后將其平放至平板中心,28 ℃培養4 d,菌種長出即可使用。
醬油曲霉:將0.3~0.5 mL無菌水或液體培養基注入凍干管中,輕輕敲打,充分溶解成菌懸液。吸取菌懸液,均勻打入2個平板瓊脂表面上(每個約200 μL),涂布均勻,然后放入培養箱中,28 ℃培養4 d,活化成功后即可進行下一步實驗。
1.3.2 菌株的形態特征
取活化成功后的雪腐鐮刀菌平板和醬油曲霉平板各一個,觀察菌體在固體平板上的形狀、顏色、黏稠度、透明度等特征,然后用無菌水制備菌懸液,在顯微鏡下觀察菌體的形態[13]。
1.3.3 接種發酵
1.3.3.1 橙皮苷的預處理
將0.2%橙皮苷置于超凈工作臺中,紫外燈持續照射30 min。然后將其倒入滅菌冷卻后的種子培養基中,充分搖勻,制備發酵培養基,用于后續實驗。
1.3.3.2 單菌發酵
雪腐鐮刀菌:選取長勢較好的雪腐鐮刀菌平板,加入無菌水制備菌懸液,然后取6%的菌懸液注入種子培養基中,于30 ℃、160 r/min培養24 h后,再按4%的比例接種于發酵培養基中,相同條件下繼續培養一段時間。此后,每隔12 h取一次發酵液,發酵液經煮沸、離心之后進行檢測。醬油曲霉操作同雪腐鐮刀菌。
1.3.3.3 混菌發酵(雪腐鐮刀菌-醬油曲霉1∶1)
參照單菌發酵方法,首先制備不同菌株的種子培養基,然后均按照4%的比例同時接種于同一發酵培養基中,并于30 ℃、160 r/min培養,每隔12 h取樣一次,煮沸、離心后進行發酵液的檢測。
1.3.4 發酵液pH值的測定
取不同菌株不同時間段的發酵液,采用室溫、10 000 r/min離心5 min后測定其pH值。
1.3.5 酶活力的測定[14-15]
用pH 5.5的醋酸-醋酸鈉緩沖液將橙皮苷配成0.1%的底物溶液,取底物溶液10 mL于30 ℃恒溫水浴鍋預熱5 min,然后加入發酵液10 mL,充分搖勻,30 ℃保溫10 min,立即用沸水滅活5 min,采用高效液相色譜法測得HMG生成量。將在30 ℃、pH 5.5條件下,每分鐘生成1 μg HMG所需的酶量,定義為一個酶活力單位(U)。
1.3.6 發酵產物的鑒定
1.3.6.1 HMG的定性分析
稱取HMG標準樣品2 mg溶于10 mL甲醇中,采用反相高效液相色譜法測定其出峰時間。稱取橙皮苷、HMG及橙皮素標準樣品溶于10 mL甲醇中,測定混合標準品中三者各自的出峰時間。將取出的發酵液置于沸水浴5 min,離心、過濾,同樣采用高效液相法進行檢測。
高效液相色譜法的檢測條件[16]:色譜柱:Amethyst C18-H(4.6 mm×250 mm,5 μm);流動相為甲醇-0.2%甲酸溶液,梯度洗脫;進樣量20 μL;檢測波長283 nm;柱溫控制在30 ℃,一個梯度程序的跑樣時間為30 min,具體的洗脫程序如表1所示。

表1 高效液相色譜法梯度洗脫程序Table 1 Gradient elution program for high performance liquid chromatography
1.3.6.2 發酵液中HMG的結構驗證
稱取HMG標準樣品2 mg溶于10 mL色譜級甲醇中,對其進行質譜檢測。將取出的發酵液置于沸水浴5 min,離心、過濾,采用超高效液相色譜-質譜聯用技術進行測定。
超高效液相色譜-質譜聯用儀的洗脫條件如表2所示。質譜條件:電子電離源;毛細管電壓4 kV;離子源溫度135 ℃;脫溶劑溫度350 ℃;脫溶劑氣體流速600 L/h;掃描范圍m/z50~1 000。
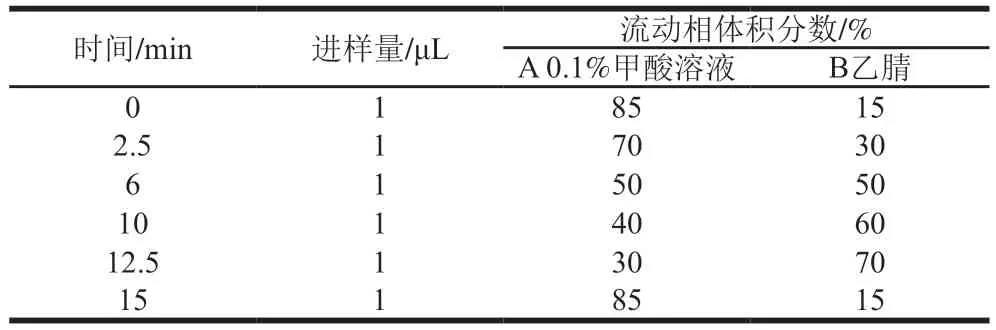
表2 超高效液相色譜-質譜法梯度洗脫程序Table 2 Gradient elution program for ultra-high performance liquid chromatography-mass spectrometry
1.3.6.3 發酵產物HMG的定量檢測
橙皮苷、HMG及橙皮素標準原液的配制:準確稱取橙皮苷2.5 mg、HMG 2 mg及橙皮素2 mg,分別用色譜級甲醇定容至10 mL,超聲輔助溶解,即配成2.5 mg/mL的橙皮苷、2 mg/mL的HMG及2 mg/mL的橙皮素溶液,置于4 ℃的冰箱中貯藏備用。
橙皮苷、HMG及橙皮素標準曲線的制作[17]:用一定量的色譜級甲醇將橙皮苷、HMG及橙皮素標準原液進行稀釋并混勻,分別配制5、10、20、60、80 μg/mL的橙皮苷標準溶液,1、5、10、25、100 μg/mL的HMG標準溶液,1、2、5、30、40 μg/mL的橙皮素標準溶液,將配好的所有樣品溶液過0.22 μm濾膜后進行檢測,且每種標準品的每個質量濃度均做3個平行,進樣量為20 μL,用高效液相色譜法進行測定并記錄峰面積,以各物質質量濃度為橫坐標、峰面積為縱坐標分別繪制橙皮苷、HMG及橙皮素標準曲線,即橙皮苷的標準曲線為y=55 560x-69 549,R2=0.999 6;HMG的標準曲線為y=55 575x-40 577,R2=0.999 8;橙皮素的標準曲線為y=79 183x+248.88,R2=0.999 9。橙皮苷、HMG及橙皮素分別在5~80、1~100 μg/mL及1~40 μg/mL范圍內有良好的線性關系,可以用于這3種物質的定量檢測。
1.4 數據分析
應用Origin和Excel軟件對數據進行分析,實驗結果取3次平行測定的平均值。
2 結果與分析
2.1 菌株的形態特征
雪腐鐮刀菌是一種減毒、弱毒或低致病性的小型絲狀真菌,在綜合PDA培養基上菌落明顯,菌絲白色,密集低平,向平板邊緣蔓延生長,培養基背面淡黃色(圖1a);不產生小分生孢子,大分生孢子小,棒狀,平直或略彎(圖1b)。
醬油曲霉在綜合PDA培養基中培養4 d之后,質地絲絨狀,較薄,中央有氣生菌絲,具輻射狀溝紋,顏色為暗草綠色或黃綠色,培養基背面無色(圖1c);分生孢子頭幼時為球形,后成輻射形,分生孢子梗大多生自基質,壁近于光滑或有時在近頂囊處現粗糙,頂囊近球形(圖1d)。
圖1 菌株的形態特征(×400)Fig. 1 Morphological characteristics of F. nivale and A. sojae (× 400)
2.2 發酵液pH值的變化

圖2 發酵液pH值的變化Fig. 2 Changes in pH of the fermentation broth
由圖2可知,無論是單一菌株還是混合菌株發酵,在整個發酵過程中發酵液均表現出pH值不斷下降的趨勢,而且混合菌株發酵pH值下降程度較單菌株更為明顯。橙皮苷轉化為HMG是通過微生物產生的酶實現,而pH值又對酶解反應過程尤為重要[18-19],只有當發酵液pH值始終處在該酶的最適pH值范圍內,酶分子活性中心必需基團的解離程度才會處于較高水平,從而使得反應速率變快,達到目標產物轉化率較高的最終目的。所以,通過探究發酵過程中發酵液pH值的變化以及各個階段的酶活力變化,對于后期嚴格控制發酵環境、指導HMG的生成具有重要意義[20-21]。
2.3 酶活力測定結果
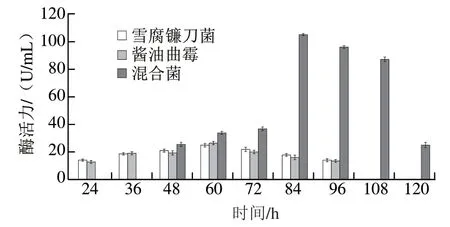
圖3 各菌株產生α-L-鼠李糖苷酶的活力Fig. 3 Change in α-L-rhamnosidase activity during fermentation
由圖3可見,三者的酶活力均呈現先上升后下降的趨勢。通過單因素方差分析可知,雪腐鐮刀菌與醬油曲霉差異并不顯著,而雪腐鐮刀菌與混合菌、醬油曲霉與混合菌分別呈顯著差異(P<0.05)。雪腐鐮刀菌和醬油曲霉發酵12 h無酶活力,隨后酶活力逐步上升;而混合菌持續發酵36 h后仍檢測不出酶活力,可能與菌株自身的適應期、繁殖以及彼此之間的競爭等密切相關[22-23]。雪腐鐮刀菌和醬油曲霉發酵60 h達到了酶活力最高點,但混合菌發酵60 h后,酶活力仍在不斷攀升,84 h獲得最大酶活力(104.81 U/mL)。因此,就酶活力而言,混合菌的產酶能力完全高于雪腐鐮刀菌和醬油曲霉[24-25],前者也極有可能在發酵84 h積累較多的HMG。
2.4 發酵產物的鑒定與分析
2.4.1 HMG出峰時間的確定
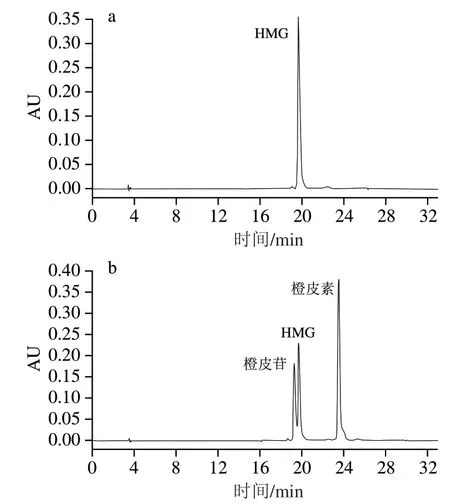
圖4 HMG標準樣品(a)和橙皮苷、HMG及橙皮素的混合標準樣品(b)色譜圖Fig. 4 Chromatograms of HMG standard (a) and mixed standard of hesperidin, HMG and hespcretin (b)
由圖4a可知,HMG標準樣品的出峰時間為19.668 min。橙皮苷經微生物發酵之后可能產生HMG及橙皮素物質,為了便于區分發酵液中可能同時存在的這3種物質,進行了橙皮苷、HMG及橙皮素混合標準品的檢測,得到三者的出峰時間分別為19.229、19.655 min和23.485 min(圖4b)。結合圖4a、b看,HMG的出峰時間可能會發生微小偏移,而它與橙皮苷出峰時間又較為接近,因此,后續實驗要特別注意發酵液中HMG的產生情況,必要時可以對其結構進行鑒定。
2.4.2 發酵液中HMG的生成情況
圖5為雪腐鐮刀菌、醬油曲霉、混合菌在發酵過程中同一時間點(84 h)取樣進行高效液相色譜檢測的結果。結果表明,3種發酵液中均含有HMG,雖然出峰時間略有不同,但始終維持在19.6 min左右,并且通過內標法進一步證實了HMG的存在。從峰高看,混合菌發酵液中HMG含量明顯高于單菌,證實了上述對混合菌在發酵84 h可能積累較多HMG的推論。所以,就雪腐鐮刀菌和醬油曲霉轉化橙皮苷生成HMG效果而言,混合菌發酵84 h較為理想[26]。
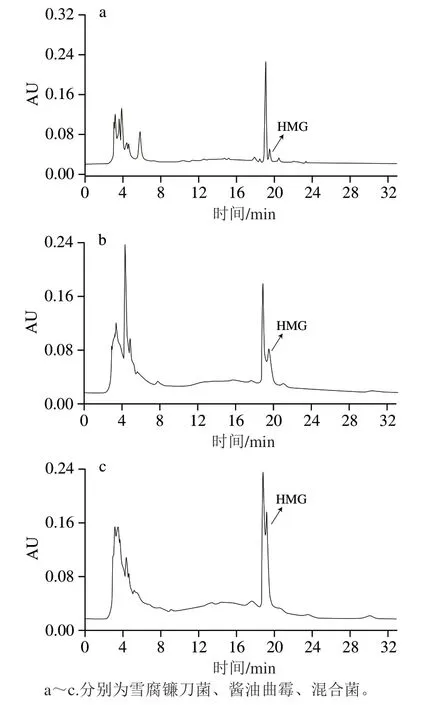
圖5 菌種發酵液的色譜圖Fig. 5 Chromatograms of HMG in fermentation broths
2.4.3 產物HMG的鑒定結果
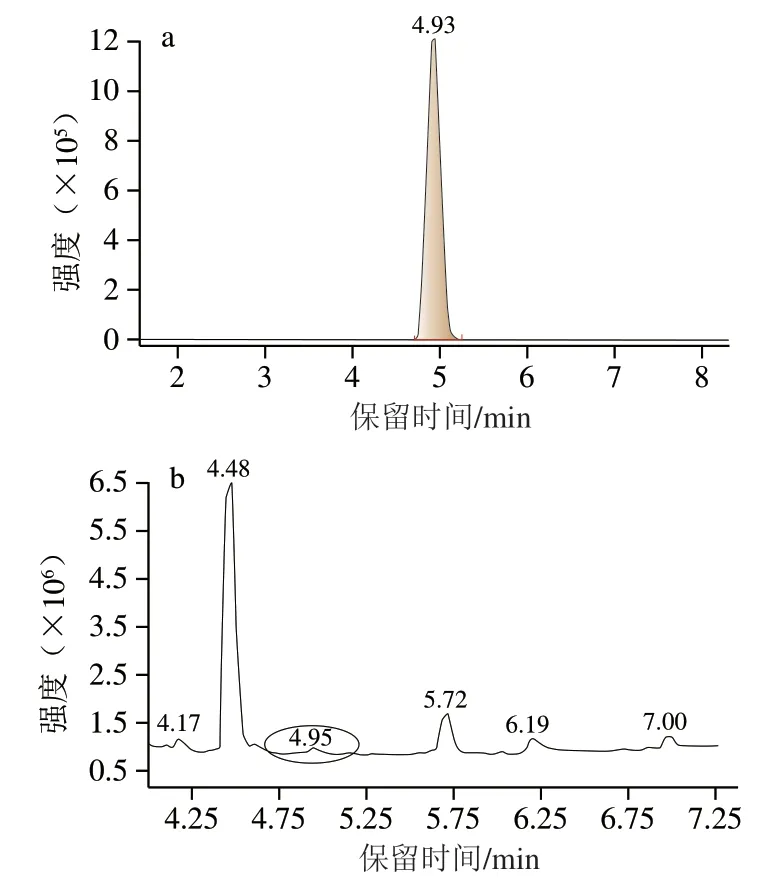
圖6 HMG標準樣品(a)及菌種發酵液(b)的超高效液相色譜-質譜圖Fig. 6 UPLC-MS chromatograms of HMG standard (a) and mixedstrain fermentation broth (b)
已知HMG的相對分子質量為464[27-28],檢測得出其保留時間為4.93 min(圖6a)。在負離子作用下,一級質譜圖中出現m/z463.12的碎片離子峰,說明HMG丟失一個H,形成了[M-H]-的碎片離子峰,而二級質譜圖中孤立且強度較大m/z301.07的碎片離子峰,是HMG被打碎之后形成的新的碎片離子峰。圖6b是混合菌某一時間點發酵液的檢測結果,對比圖6a看,其保留時間發生較小偏移,為4.95 min。根據相對分子質量和保留時間這兩個條件尋找相對應的物質,該物質經分子擬合之后證實確為HMG。雪腐鐮刀菌和醬油曲霉單獨發酵的液相色譜-質譜檢測結果也得到了同樣的結論。總之,通過高效液相色譜的初步檢測和超高效液相色譜-質譜技術的結構驗證,證實了雪腐鐮刀菌、醬油曲霉以及混合菌轉化橙皮苷一定時間之后均可得到HMG[29-32]。
2.4.4 產物HMG質量濃度變化
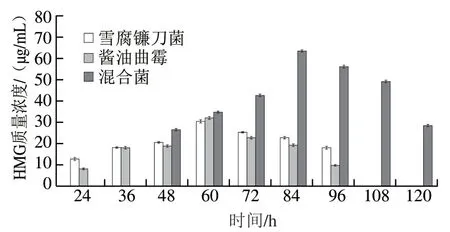
圖7 菌種發酵液中HMG質量濃度的變化Fig. 7 Changes in HMG concentration of fermentation broths at different time points
圖7為雪腐鐮刀菌、醬油曲霉及混合菌某次發酵過程中HMG質量濃度變化情況。通過單因素方差分析可知,雪腐鐮刀菌與醬油曲霉差異并不顯著,而雪腐鐮刀菌與混合菌、醬油曲霉與混合菌分別呈顯著差異(P<0.05),該顯著性分析與酶活力的分析結果保持一致。混合菌發酵84 h獲得最大酶活力(104.81 U/mL)的同時,產生了最大質量濃度(63.52 μg/mL)HMG,若此時對其發酵液進行分離純化,1 L發酵液可得63.52 mg HMG(不考慮損失),其他任一組合均無法達到該效果。HMG質量濃度可直觀地表達發酵效果,是衡量發酵質量的關鍵因素和重要指標。
3 結 論
雪腐鐮刀菌、醬油曲霉及混合菌均在酸性條件(pH 4~6)下完成搖瓶發酵,pH值對微生物的生長及發酵產酶至關重要,適宜pH值可以提高發酵效果。微生物轉化橙皮苷生成HMG是通過其產生的α-L-鼠李糖苷酶水解橙皮苷完成,酶活力越高的時間點,該處積累的發酵產物可能就越多,混合菌發酵84 h達到最大酶活力(104.81 U/mL)的同時,也產生了最大質量濃度(63.52 μg/mL)的HMG,此時它的酶活力明顯優于雪腐鐮刀菌(24.73 U/mL)和醬油曲霉(26.17 U/mL),這表明多種微生物之間存在協同作用,混菌發酵可以彌補菌種之間的代謝差異性,相輔相成能起到單一菌株起不到的作用。發酵產物-HMG經高效液相色譜初步檢測和超高效液相色譜-質譜結構驗證證明確實存在,并成為衡量發酵效果的關鍵因素和重要指標。

