Ca2+對‘伏脆蜜’裂果調控生理的研究
張晶晶,宋璐瑤,王振磊 ,吳翠云 ,林敏娟*
(1塔里木大學園藝與林學學院,新疆 阿拉爾 843300)
(2南疆特色果樹高效優質栽培與深加工技術國家地方聯合工程實驗室,新疆 阿拉爾 843300)
鮮食棗‘伏脆蜜’具有早熟豐產、耐旱、含糖量高且口味酸甜等特點,深受廣大消費者喜愛[1]。但因成熟期‘伏脆蜜’裂果率較高,因而嚴重影響果實品質與產量。
分布在纖維素和半纖維素微絲中的果膠質與木質素、蛋白質及礦物質共同構成植物細胞壁結構,細胞壁結構物質變化與裂果的發生密切相關,有關學者對龍眼[2]、番茄[3]及錦橙[4]研究發現,裂果果皮中纖維素及果膠含量顯著低于正常果果皮。Ca2+在維持細胞壁結構和功能中發揮著重要作用,缺鈣是導致果實裂果的重要原因之一[5]。通過噴施鈣制劑可補充果實的Ca2+含量,高活性鈣與果膠質結合形成果膠酸鈣,果膠酸鈣可以連接相鄰細胞,增加表皮層厚度和細胞間韌性。郭紅彥等[6]研究發現不同時期噴施CaCl2可提高‘壺瓶棗’果皮中原果膠及纖維素含量,降低棗果實裂果率。因此Ca2+可通過影響植物細胞壁中物質的含量影響裂果的發生[7-9]。
有研究發現,細胞壁代謝相關酶對細胞壁網絡結構的形成起主要作用,細胞壁代謝酶可通過降解細胞壁物質含量而降低果皮強度,導致裂果率增加[8]。易裂荔枝品種‘糯米糍’中的果膠酶、纖維素酶和果膠甲酯酶活性顯著高于耐裂荔枝品種‘淮枝’[10]。噴施鈣制劑可明顯降低植物細胞壁降解酶活性,使細胞壁物質不易發生水解,有利于維持細胞壁結構穩定,增加果皮抗裂能力,不易裂果[7,11]。噴施外源鈣素可顯著降低‘寒富’[12]蘋果及臍橙[13]中果膠甲酯酶、多聚半乳糖醛酸酶、纖維素酶的活性,減少細胞壁物質的水解,提高果實硬度從而降低果實裂果率。果皮解剖結構也是引起裂果的重要因素,不同品種果實之間由于果皮組織解剖結構不同會導致果皮延展性及抗張強度不同,致使裂果率不同[14],果實表皮層厚度、表皮細胞大小與形狀、細胞排列疏松程度和果肉空腔大小都與果實抗裂相關[15-16]。
目前關于棗裂果的研究多集中于同一品種不同部位或者不同品種相同部位的激素含量、礦物質元素、果皮解剖結構等方面。關于噴施外源Ca素對棗裂果部位及非裂果部位細胞壁物質含量、細胞壁代謝酶活性、果皮解剖結構等方面的研究報道較少。因此本研究以易裂鮮食棗品種‘伏脆蜜’為試驗材料,測定噴施CaCl2、噴施清水、自然條件處理后的‘伏脆蜜’棗裂果及非裂果部位細胞壁物質含量、細胞壁代謝酶活性,觀察果皮解剖結構,以期通過研究噴施CaCl2對棗裂果及相關生理指標的影響,探討Ca2+對棗裂果的作用機理,為棗裂果防治提供科學理論依據。
1 材料與方法
1.1 試驗材料
試驗材料為易裂鮮食棗品種‘伏脆蜜’,來自于塔里木大學園藝試驗站棗種質資源圃,樹齡10年,常規田間管理,水肥條件一致。
1.2 試驗設計與處理方法
于2021年棗樹盛花期,選擇長勢一致、開花較多的果樹進行掛牌標記。盛花期后30~65 d對棗樹進行噴施清水以及噴施CaCl2(200倍液)處理,以自然條件對照。每個處理選取10棵棗樹,每隔7 d在傍晚黃昏時分從棗樹不同方向分別噴施CaCl2、噴施清水,至葉面、果面自然滴水為止,共噴施5次。在棗裂果中期(盛花期后80 d)采摘100個裂果果實,蒸餾水清洗干凈,取裂果部位和非裂果部位果皮,液氮冷凍后裝入自封袋,做好標記,置于-80℃冰箱保存備用。
1.3 棗裂果方式及裂果率調查
盛花期后80 d(棗裂果中期),分別調查統計噴施CaCl2、噴施清水以及自然條件下100個棗裂果的裂果方式(縱裂、環裂、不規則裂),每個處理重復3次。分別調查統計噴施CaCl2、噴施清水及自然條件下3棵棗樹總果數以及裂果數,并計算裂果率[17]。
1.4 細胞壁代謝酶活性測定
纖維素酶(cellulase,CE)和多聚半乳糖醛酸酶(polygalacturonase,PG)活性采用DNS終止反應法[18],果膠甲酯酶(pectin methylesterase,PME)活性及β-半乳糖苷酶(β-galactosidase,β-Gal)活性測定采用果膠甲酯化程度試劑盒及β-半乳糖苷酶試劑盒(蘇州科銘生物技術有限公司)。
纖維素酶及多聚半乳糖醛酸酶液提取:稱取0.2 g果皮于預冷的研缽中,加入1 mL 0.04 mol/L,pH為6.0的醋酸鈉溶液研磨,將研磨過后的勻漿倒入10 mL離心管,用醋酸鈉緩沖液沖洗研缽3遍,每次加1mL,將樣液置于4℃冰箱中保存1h后,4℃,5000 r/min離心30 min,上清液即為兩種酶的粗提取液,將提取液置于0℃碎冰上待測。
纖維素酶:吸取2 mL 1%甲基纖維素和0.5 mL粗酶液于試管中,40℃水浴保溫1 h后立即加入2.5 mL DNS終止反應,置于沸水中顯色5 min,待冷卻后于540 nm下比色。
多聚半乳糖醛酸酶:吸取0.2 mL 0.04 mol/L,pH為4.6的醋酸鈉緩沖液于玻璃試管中,加入0.3 mL 1%多聚半乳糖醛酸溶液,吸取0.1 mL酶液于試管中,加入0.4 mL蒸餾水于37℃水浴保溫1 h,立即加入1 mL DNS終止反應,置于沸水中顯色5 min,待冷卻后于540 nm下比色。
果膠甲酯酶:取適量棗果皮組織,液氮研磨,取約0.1 g組織,加入1 mL蒸餾水,冰浴震蕩2 min,4℃9 500 r/min高速離心10 min,棄去上清液,留沉淀。沉淀中加入1 mL提取液,混勻后90℃水浴2 h,冷卻后4℃9 500 r/min離心10 min,上清液即為果膠酯酶待測液。
β-半乳糖苷酶:取0.1 g棗果皮組織于研缽中,液氮迅速研磨,加入1 mL提取液,冰浴震蕩2 min,4℃11 500 r/min離心10 min,上清液即為β-Gal提取液,放置0℃冰上待測。
1.5 細胞壁物質含量測定
纖維素和半纖維素的含量測定采用蒽酮比色法,水溶性果膠、離子結合型果膠及共價結合型果膠的含量測定采用咔唑硫酸比色法[18]。
稱取1.0 g果皮,加入2.5 mL 80%的乙醇溶液,將勻漿倒入15 mL離心管中再依次加入2.5 mL 80%的乙醇提取液沖洗3次,于90℃水浴20 min,冷卻后6 000 r/min離心15 min,棄去上清液(重復5~6次),加入10 mL 90%的二甲基亞砜于4℃冰箱靜置15 h,6 000 r/min離心,棄上清液,加入10 mL氯仿∶甲醇為1∶1的混合液沖洗濾渣,離心棄上清液,加10 mL丙酮,洗滌沉淀(重復2遍),棄去上清液,將沉淀置于45℃恒溫箱中烘干至恒重,得到粗細胞壁。
粗細胞壁用50 mmol/L的乙酸鈉溶液(pH為6.5)震蕩3 h提取得到水溶性果膠,5 000 r/min離心后取出水溶性果膠溶液,在沉淀中加入50 mmol/L EDTA溶液(含50 mmol/L的乙酸鈉)震蕩3 h得到離子結合型果膠,5 000 r/min離心后取出離子結合型果膠溶液,在沉淀中加入50 mmol/L碳酸鈉溶液(含2 mmol/L EDTA)得到共價結合型果膠,剩余沉淀用4 mmol/L氫氧化鉀溶液提取12 h,洗滌沉淀1次,合并2次上清液,得到半纖維素提取液,剩余沉淀再用ddH2O洗滌2次,離心棄上清液,沉淀即為纖維素,加入10 mL 60%濃硫酸置于4℃冰箱水解12 h,以測定纖維素含量。
1.6 石蠟切片制作與解剖結構觀察
石蠟切片制作在參考高秋玲等[19]研究方法的基礎上略有改動。用不銹鋼刀片在噴施CaCl2處理、噴施清水處理、自然條件的裂果及非裂果部位分別切取5 mm×5 mm大的棗果皮組織,立即放入由50%乙醇∶醋酸∶38%甲醛配置比例為90∶5∶5的FAA固定液中,抽至真空,常溫保存備用。FAA固定棗果實材料經乙醇梯度脫水-二甲苯透明-浸蠟-包埋、修蠟-切片(5~10 μm)、粘片-二甲苯40 ℃脫蠟-染色(番紅,固綠)-封片。將噴施CaCl2、噴施清水、自然條件下的裂果及非裂果部位分別制作6張石蠟切片,在光學顯微鏡(10×),總放大倍率為6.3倍下觀測并拍照,每個切片觀察5個視野。測量果皮蠟質層厚度、表皮層厚度、內表皮層厚度及果肉空腔大小。
1.7 數據分析
采用DPS 7.55軟件和Microsoft Office Excel 2010軟件對數據進行處理并作圖,采用Duncan新復極差測驗法進行差異顯著性檢驗。
2 結果與分析
2.1 不同處理對‘伏脆蜜’裂果方式及裂果率的影響
由表1分析可知,縱裂是‘伏脆蜜’主要的裂果方式,縱裂率為77.00%~81.00%,環裂率為9.00%~15.33%,不規則裂變化范圍為7.67%~10.00%;噴施CaCl2可顯著降低棗裂果率,噴施CaCl2后棗裂果率分別比自然條件及噴施清水處理低10.61%、24.29%。
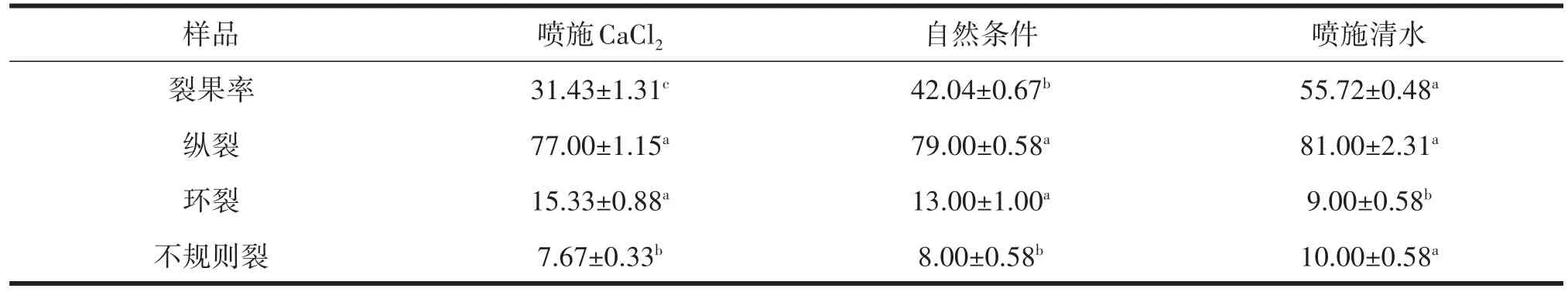
表1 不同處理對‘伏脆蜜’裂果方式及裂果率的影響 %
2.2 不同處理對‘伏脆蜜’果皮細胞壁代謝酶活性的影響
由表2分析可知,噴施CaCl2、噴施清水及自然條件下棗果皮不同部位細胞壁代謝酶活性存在顯著差異,噴施CaCl2后非裂果部位CE及β-Gal活性高達2 678.63 U/g、25.35 U/g,高于自然條件及噴施清水處理裂果及非裂果部位酶活性;噴施CaCl2后的‘伏脆蜜’PG活性顯著降低,非裂果部位PG值最低為2 149.29 U/g,分別比自然條件及噴施清水處理非裂果部位酶活性低74.34 U/g、258.70 U/g;自然條件及噴施清水處理裂果及非裂果部位PME活性顯著高于噴施CaCl2處理,噴施CaCl2后非裂果部位酶活性相比自然條件及噴施清水處理降低12.29%、20.15%。
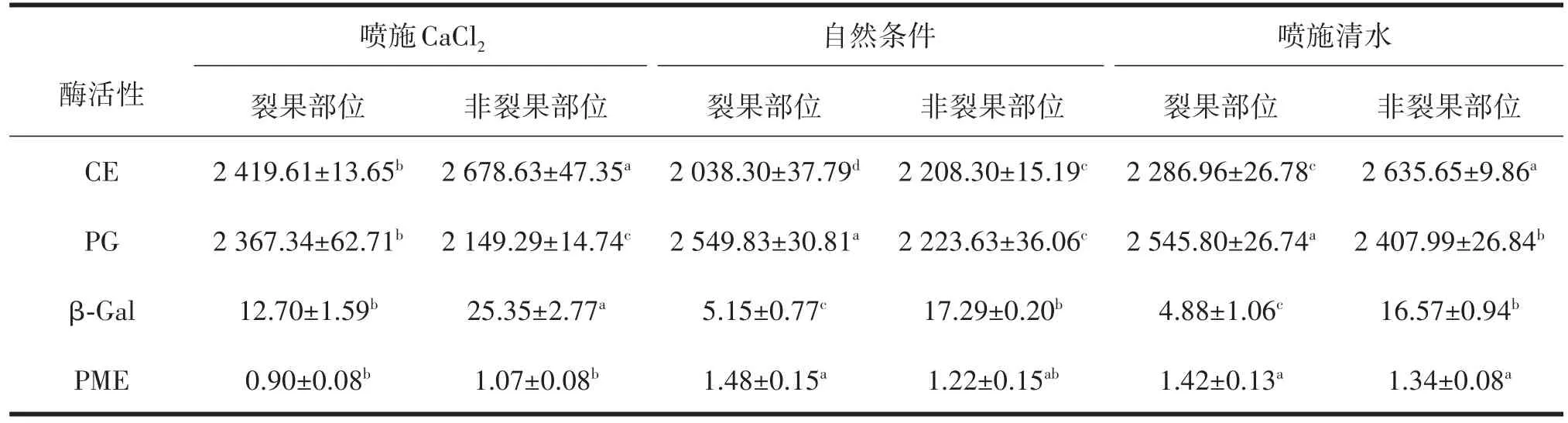
表2 不同處理對‘伏脆蜜’果皮細胞壁代謝酶活性的影響 U/g
2.3 不同處理對‘伏脆蜜’果皮細胞壁物質含量的影響
由表3分析可知,噴施CaCl2、噴施清水及自然條件下棗果皮裂果及非裂果部位細胞壁物質含量差異顯著,噴施CaCl2和噴施清水處理及自然條件非裂果部位的水溶性果膠、離子結合型果膠、共價結合型果膠、半纖維素及纖維素含量顯著高于裂果部位。噴施CaCl2后非裂果部位水溶性果膠、離子結合型果膠、共價結合型果膠、半纖維素及纖維素含量分別為2.75%、1.00%、1.86%、1.45%、2.65%,顯著高于噴施清水處理及自然條件裂果及非裂果部位酶活性。
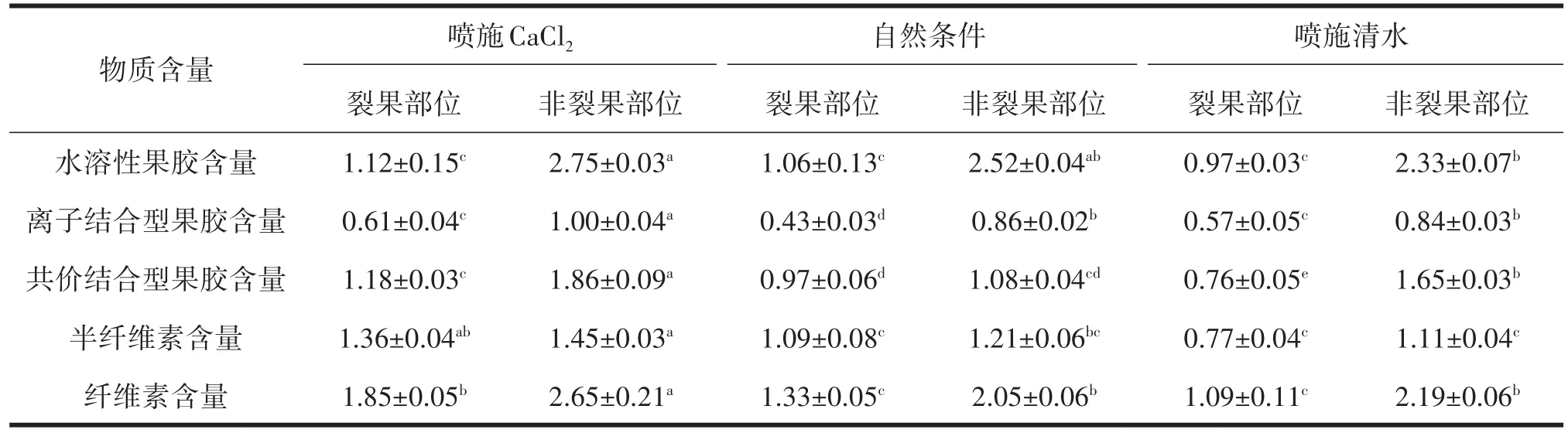
表3 不同處理對‘伏脆蜜’果皮細胞壁物質含量的影響 %
2.4 不同處理對‘伏脆蜜’果皮解剖結構的影響
由表4分析可知,噴施CaCl2、噴施清水及自然條件下非裂果部位蠟質層、表皮層及內表皮層厚度均顯著高于裂果部位,3個處理非裂果部位棗果皮蠟質層、表皮層、內表皮層厚度均表現為噴施CaCl2>自然條件>噴施清水,噴施CaCl2處理后非裂果部位蠟質層厚度相比自然條件及噴施清水非裂果部位高22.38%及25.73%;自然條件及噴施CaCl2、噴施清水后非裂果部位表皮層厚度差異不顯著;噴施CaCl2處理下非裂果部位內表皮層厚度分別是自然條件及噴施清水非裂果部位的1.05倍及1.14倍;噴施CaCl2處理后非裂果部位果肉空腔最小值為100.13μm。
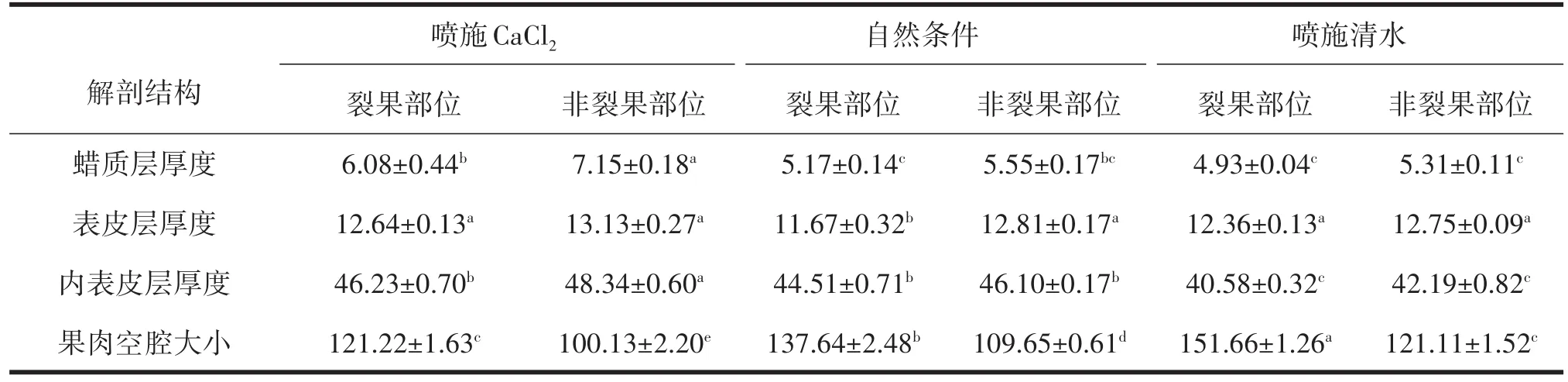
表4 不同處理對‘伏脆蜜’果皮細胞壁解剖結構的影響 μm
由圖1可知,非裂果部位相比裂果部位表皮層及內表皮層細胞排列緊密且整齊,噴施CaCl2后棗果皮細胞相比自然條件及噴施清水處理后裂果和非裂果部位棗果皮細胞結構較為完整,表皮細胞排列整齊;噴施清水后裂果部位表皮層有明顯龜裂現象,噴施CaCl2后裂果部位和非裂果棗果肉空腔相比自然條件和清水處理后的小且少。
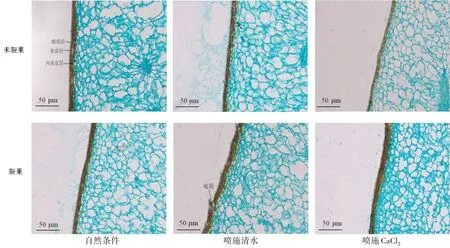
圖1 不同處理后‘伏脆蜜’果皮不同部位細胞結構的變化
3 討論
3.1 噴施CaCl2處理細胞壁代謝酶與裂果的關系
果膠酶分為多聚半乳糖醛酸酶、果膠甲酯酶、原果膠酶及果膠裂解酶,這四種酶可協同作用將復雜的果膠分解為小分子物質致使植物細胞壁被破壞,從而導致果皮細胞壁延展性降低,果實裂果率增加[20-21]。錦橙果皮中Ca2+含量較低會導致PG活性升高,裂果率升高,噴施CaCl2可顯著降低錦橙裂果率[4]。丁改秀等[22]研究結果表明降低PME活性可降低‘壺瓶棗’裂果率。β-Gal是一種存在于植物、動物、微生物的糖苷鍵水解酶[23],β-Gal水解以后,抑制番茄中β-半乳糖苷酶基因TBG6的表達,導致裂果率上升[24]。CE可將不溶性纖維素轉化為小分子物質,降低果皮機械強度[25]。本研究發現,噴施CaCl2后非裂果部位PG及PME活性顯著低于自然條件及噴施清水處理裂果及非裂果部位酶活性,β-Gal活性及CE活性高于自然條件及噴施清水處理裂果及非裂果部位酶活性,與王建宇等[18]對‘伏脆蜜’非裂果部位CE活性顯著高于裂果部位CE活性研究結果一致,郭紅彥等[6]認為噴施CaCl2可降低‘壺瓶棗’的CE活性,關于Ca2+對棗果CE活性的影響仍需進一步研究驗證。
3.2 噴施CaCl2處理細胞壁物質與裂果的關系
棗果皮細胞壁結構由果膠質、纖維素及半纖維素等多糖物質組成,細胞壁物質含量的變化及纖維素分子在細胞壁內的排列方式與裂果緊密相關[26]。當番荔枝果實中原果膠合成被抑制時,果皮容易開裂[27]。‘荔枝’[28]及‘壺瓶棗’[6]果皮中鈣含量較高時,纖維素、半纖維素及果膠質含量也高,與裂果率呈負相關。本研究發現,噴施CaCl2處理非裂果部位果膠類物質、纖維素及半纖維素含量都顯著高于噴施清水處理及自然條件裂果及非裂果部位細胞壁物質含量。王建宇等[18]研究也發現非裂果部位果膠質含量顯著高于裂果部位。可能是因為Ca素抑制了細胞壁代謝酶的活性,降低了纖維素及果膠類物質分解速度,最終導致裂果率下降。
3.3 噴施CaCl2處理細胞壁解剖結構與裂果的關系
果實的外表皮由角質層、表皮細胞和亞表皮細胞組成。棗果果皮角質層厚度、表皮層厚度及細胞排列的致密及均勻度與棗果的抗裂性密切相關[29-30]。角質層是植物與外界的第一接觸面,角質層蠟質是由位于角質層外的外層蠟質和深嵌在角質層中的內層蠟質兩部分構成[31]。‘靈武長棗’‘贊皇大棗’及其他鮮棗品種的果皮表皮層厚度、亞表皮層厚度、表皮層數均與裂果率呈負相關[32-34]。郗鑫等[35]通過對棗果表皮細胞研究發現,耐裂品種及正常果皮細胞排列緊密,易裂品種棗果皮呈長圓形或卵圓形且排列疏松無規則。本研究結果表明,噴施CaCl2處理非裂果部位蠟質層、表皮層、內表皮層厚度顯著高于自然條件及噴施清水處理,噴施CaCl2處理后棗果皮表皮細胞排列整齊,無明顯龜裂現象,且果肉空腔較小,這與郭紅彥等[6]對噴施CaCl2后可使棗果角質層保存完整、表皮細胞排列緊實規整、不發生龜裂且果肉空腔較小研究一致,因此噴施CaCl2可增強棗果抗裂性。
4 結論
噴施外源Ca可以顯著降低棗果皮非裂果部位PG及PME活性,提高CE及β-Gal活性,顯著提高纖維素、半纖維素、水溶性果膠、離子結合型果膠及共價結合型果膠含量,從而使棗果皮蠟質層、表皮層、內表皮層的厚度增加,維持棗果皮較好的穩定性及延展性。綜上所述,噴施CaCl2可顯著降低鮮食棗‘伏脆密’的裂果率。

