硬皮病樣表現伴關節攣縮的慢性移植物抗宿主病一例
李艷艷 張 帆 劉 紅 張福仁
山東第一醫科大學附屬皮膚病醫院(山東省皮膚病醫院),山東省皮膚病性病防治研究所,山東濟南,250022
移植物抗宿主病(graft-versus-host disease,GVHD) 是異基因造血干細胞移植后的一種較為常見的免疫性疾病,可累及多個器官和系統,皮膚是最早期和最常見的累及部位[1]。GVHD的臨床表現與一些皮膚病相似,如硬皮病、扁平苔蘚、麻疹、猩紅熱等。我院皮膚科收治1例硬皮病樣表現伴手足關節攣縮的慢性移植物抗宿主病,現報道如下。
臨床資料患兒,男,5歲。因“雙手足質硬、紅斑、攣縮變形2年”就診于我院皮膚科門診。患兒順產,自幼反復患肺膿腫伴發熱,4年前行基因檢測診斷為JAK3基因相關重型聯合免疫缺陷癥,2017年8月行異基因造血干細胞移植,后基因檢測示JAK3基因已修復。2019年2月先于足部出現脫皮,后雙手足背、腕部、肘、膝及髖關節處皮膚出現紅斑、脫皮、硬化,伴手足關節攣縮及甲改變。2020年4月組織病理檢查示:移植物抗宿主反應并病毒感染。體格檢查:系統查體未見明顯異常。皮膚科檢查:雙手足質硬、紅斑,攣縮伴部分指、趾甲增厚變形,腕、肘、膝及髖關節部位見片狀褐色質硬斑,左手中指遠端指節見2處黃豆大的灰白色疣狀增生物,表面粗糙,質硬(圖1a),未見黏膜受累。外院組織病理示:鱗狀上皮不典型增生,局部可見空泡化改變,真皮乳頭水腫伴血管擴張,間質均質化改變。特殊染色:PAS染色(-),EVG染色(-),苯胺藍染色(-),彈力纖維(-)(病理圖未展示)。
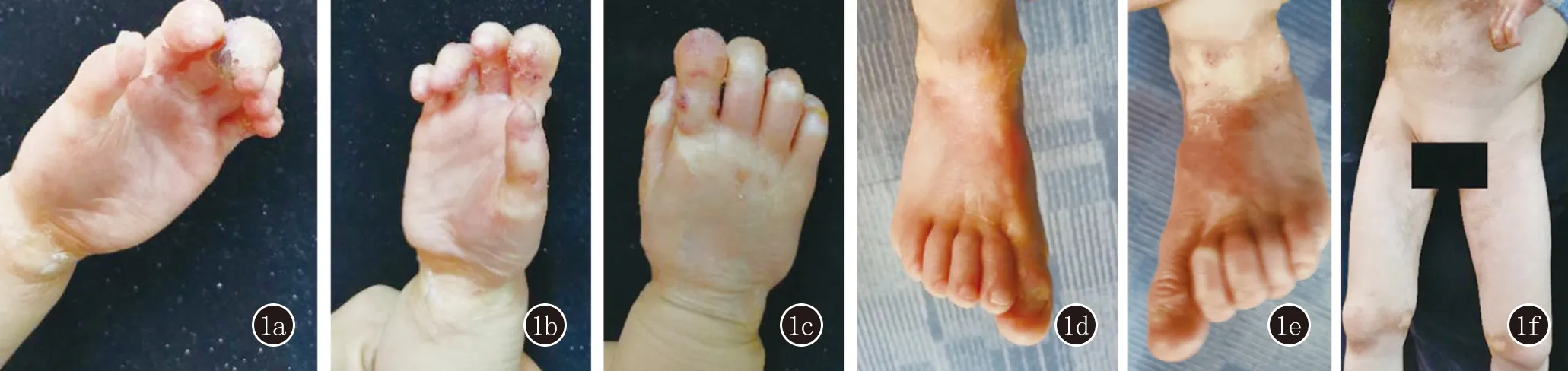
左手(1a)、右手(1b,1c)、右足(1d)、左足(1e)、腰腹部、髖部及下肢(1f)皮膚呈硬皮病樣表現,雙手指關節、腕關節、雙踝關節攣縮,變形;部分指、趾甲增厚變形;左手中指遠端指節見2處黃豆大的灰白色疣狀增生物
診斷:結合臨床表現和組織病理診斷為慢性移植物抗宿主病,病毒感染。治療:給予甲潑尼龍2 mg/d、甲氨蝶呤5 mg/d,外用咪喹莫特乳膏,每周3次;予二氧化碳點陣激光(10600 nm)治療關節及足背處的硬化斑,每月1次。治療2個月后,患者腰腹部、髖部及下肢的苔蘚樣斑塊輕度消退,關節、足背處的皮膚硬化及關節攣縮情況改善不明顯,患者已失訪。
討論異基因造血干細胞移植是治療血液系統疾病、先天性遺傳病、先天性代謝疾病、免疫系統疾病和部分惡性腫瘤的有效手段,包括骨髓移植、外周血及臍帶血移植等。移植物抗宿主病是異基因造血干細胞移植的主要并發癥,由移植物組織中的免疫活性細胞與免疫受抑制的、組織不相容性抗原受者組織之間的反應引起,根據起病時間分為急性(aGVHD)和慢性(cGVHD)兩種類型。據統計,異基因造血干細胞移植后受者GVHD的發病率高達40%~60%[2],GVHD在兒童中的發病率相對較低,但使用非相關供者干細胞的情況愈加常見,其發病率呈上升趨勢[3]。我們觀察到在不同研究中,由于納入患者的特點和類型不同,兒童GVHD的總體發病率有較大差異。
aGVHD常表現為紅色到紫紅色的麻疹樣皮疹,多發生于移植后1周至 3個月,易被誤認為藥疹或病毒疹,通常出現在手掌、腳掌、面部和軀干,其他皮損有皮膚剝脫、紅皮病等,可有大皰和脫屑,類似于中毒性表皮壞死松解癥[4],黏膜和結膜可受累。cGVHD多發生在移植后4個月至1年,主要影響皮膚、胃腸道和肝臟等[5]。cGVHD的皮膚表現以扁平苔蘚樣和硬皮病樣多見,扁平苔蘚樣cGVHD以紫紅色苔蘚樣丘疹或斑塊為特征,多出現在病程早期,初發皮損常見于口腔黏膜、外生殖器黏膜,多角形皮損可泛發融合,或分布在毛囊周圍,炎癥消退后留有色素沉著。硬皮病樣cGVHD出現在病程后期,呈硬斑樣、硬皮病樣表現,表皮萎縮,硬化以真皮中上部為主,常伴皮膚異色病樣皮疹,晚期改變包括不可逆的脫發、關節攣縮及疼痛、肌痛、活動受限[6]。cGVHD其他皮膚效應可有甲改變、黏膜效應和白癜風樣脫色。甲的改變包括甲營養不良、甲分裂和溶解等[7]。此外,在兒童人群中報道的較為罕見的cGVHD有銀屑病樣[8]、特應性皮炎樣[9]、多形紅斑樣[10]、干燥性魚鱗病樣[11]和病毒疣樣[12]等形態學表現。由于免疫抑制劑的長期應用,cGVHD患者合并單純皰疹病毒、人乳頭瘤病毒、機會性致病菌感染的風險明顯增加[13]。Williams等[14]報道了1例cGVHD患者的手足出現了大量疣狀丘疹,經病理檢查證實同時存在鱗狀細胞癌和尋常疣。
本例患者有異基因造血干細胞移植病史,術后16個月足部出現脫皮,后雙手、腕部、肘、膝及髖關節處皮膚出現紅斑、脫皮、硬化,呈硬斑樣,伴手足關節攣縮及甲改變。左手中指遠端指節見2處黃豆大灰白色疣狀增生物,質硬。皮膚組織病理呈現較為典型的硬皮病樣改變,符合皮膚硬皮病樣cGVHD,結合患者的病史、病程和臨床表現,診斷為硬皮病樣慢性移植物抗宿主病,同時考慮合并病毒感染,增加了治療難度。
全身使用糖皮質激素及免疫抑制劑仍是治療GVHD的一線治療方案。急性GVHD多給予甲潑尼龍聯合局部支持治療;慢性GVHD多聯合使用潑尼松和甲氨蝶呤、環孢素等免疫抑制劑,提高反應率,同時能減少糖皮質激素的使用劑量,減少其毒性。對于難治性GVHD患者,往往需要加用他克莫司、沙利度胺、嗎替麥考酚酯、西羅莫司等免疫抑制劑。光化學療法(PUVA)、中波紫外線(UVB)是治療硬皮病樣cGVHD的合適選擇。低強度激光、二氧化碳激光漸用于cGVHD潰瘍的治療以減輕疼痛癥狀[15,16],高強度激光對cGVHD硬皮病樣皮損和攣縮[17]有一定改善效果。本例患者常規服用甲潑尼龍,甲氨蝶呤治療,同時聯合二氧化碳點陣激光治療關節及足背處的硬化斑,治療2個月后,苔蘚樣斑塊輕度消退,短時間內皮膚硬化及關節攣縮情況改善不明顯。
近些年,一些頗具潛力的治療方法引起關注,特別是調節性T細胞(Tregs)、耐受性樹突狀細胞(TDCs)和骨髓間充質干細胞(MSC)在治療GVHD方面的獨特優勢。MSC是一種多功能的非造血干細胞,具有調節T細胞的免疫作用。臨床研究發現,造血干細胞移植中使用MSC可促進移植物的植入,并能夠減輕GVHD反應[18]。Peng等[19]報道使用MSC治療23例難治性cGVHD,效果顯著,總治療反應率達86%。靶向CD分子、抗TNF-α單克隆抗體、IL-2Ra和信號轉導分子也已被證實對GVHD有效。Zaja等[20]對11例接受利妥昔單抗治療的難治性cGVHD患者進行隨訪,中位隨訪時間11個月,總反應率65%,2年內存活率為76%,證實利妥昔單抗對cGVHD治療有效,且反應率較高。總之,根據移植物抗宿主病的病理生理機制、分期和亞型的特征,考慮個體化治療,這些新的治療靶點和治療策略有望改善GVHD的治療效果。
GVHD的預后與病情嚴重程度有關,皮膚受累范圍及程度、內臟器官受累情況將直接影響預后。兒童GVHD的及時診斷和治療至關重要,以預防該病對皮膚和其他內臟器官產生破壞性和進行性的終生后果。此外,由于糖皮質激素和免疫抑制治療仍然是治療慢性移植物抗宿主病的基石,對兒童患者的管理須認真考慮藥物的長期風險和益處。

