綠蘿組織培養和遺傳轉化條件優化
陸玉建,李雪晗,袁新惠,許悅,朱麗暉,田夢菲,田玉雪,邱欣欣
(1.濱州學院 生物與環境工程學院,山東 濱州 256603;2.山東省黃河三角洲野生植物資源開發利用工程技術研究中心,山東 濱州 256603;3.山東省黃河三角洲生態脆弱帶工程技術研究中心,山東 濱州 256603)
綠蘿為天南星科綠蘿屬常綠觀葉植物,具有較強的吸收甲醛的能力,主要通過扦插的方式進行繁殖[1-2]。綠蘿扦插繁殖時生長速度慢,繁殖系數低,難以進行優良品種的選育。而植物組織培養技術則可彌補上述不足。為此,郭英等[3]以莖段為外植體進行組織培養,結果表明,愈傷組織誘導最適培養基為MS+3.0 mg/L 6-BA+0.2 mg/L NAA+0.4 mg/L 2,4-D,分化培養基為MS+3.0 mg/L 6-BA+0.2 mg/L NAA,生根培養基為1/2 MS+0.2 mg/L NAA。范俊崗[4]以綠蘿葉片為外植體進行離體培養,結果顯示,愈傷組織誘導最適培養基為MS+0.2 mg/L TDZ+ 0.5 mg/L NAA,不定芽誘導培養基為MS+0.1 mg/L NAA+1.0 mg/L 6-BA和MS+0.5 mg/L NAA+2.0 mg/L 6-BA,生根誘導培養基為1/2 MS+0.1 mg/L NAA+0.2 mg/L IBA。陳廣玉[5]研究發現,綠蘿葉片愈傷組織誘導最適培養基為MS+2.0 mg/L 6-BA+0.5 mg/L NAA+0.5 mg/L 2,4-D,分化培養基為MS+2.0 mg/L 6-BA+0.5 mg/L NAA,生根培養基為1/2 MS+0.1 mg/L NAA。現階段,綠蘿高效穩定的再生體系尚未建立,轉基因方面的研究還較少。為提高外源基因的轉化效率,有必要繼續優化綠蘿組織培養條件。
甲醛是一種易揮發,帶有強烈刺激性氣味的氣體[6]。植物凈化法去除甲醛,不僅具有簡單、經濟、科學的優點,又有美學價值與生態功能,已成為備受青睞的綠色修復技術[7]。高等植物去除甲醛與甲醛脫氫酶(FALDH)密切相關,在FALDH的參與下,甲醛方可進入植物組織并最終轉化為CO2[8]。目前已經擬南芥、玉米、綠蘿等多種植物中分離獲得了FALDH[9-11]。擬南芥中AtFALDH過表達,擬南芥甲醛吸收能力明顯增強[12]。將綠蘿FALDH基因轉入擬南芥,擬南芥甲醛吸收效率同樣提高[11,13]。雖然綠蘿吸收甲醛的能力較強,但仍有待于進一步提高,而通過基因工程技術提高綠蘿吸收甲醛的能力無疑是一種非常有效的途徑。目前,有關FALDH基因轉化綠蘿的研究尚未見相關報道,本試驗在建立綠蘿高頻再生體系的基礎上,將AtFALDH導入綠蘿中,試圖實現外源基因的高效表達,進而增強綠蘿吸收甲醛的能力。
1 材料和方法
1.1 試驗材料
供試材料為小葉綠蘿(Eipremnum aureum),大腸桿菌DH5α和根癌農桿菌GV3101。
1.2 試驗方法
1.2.1 綠蘿離體再生 以綠蘿葉片和葉柄為外植體,分別用70%酒精消毒30 s,用0.1%升汞處理15 min,無菌水沖洗5~6次。將外植體接入愈傷組織誘導培養基(表1,共9個處理),30 d后觀察愈傷組織的誘導情況,統計葉片和葉柄愈傷組織誘導率。將葉片或葉柄誘導產生的愈傷組織接種入分化培養基(表2,共9個處理),30 d后觀察不定芽的分化情況,統計愈傷組織不定芽誘導率。將不定芽插入生根培養基中(表3,共6個處理),30 d后統計不定芽的生根率。
1.2.2 目的基因的克隆和表達載體構建 擬南芥甲醛脫氫酶基因AtFALDH引物序列(下劃線代表酶切位點的位置)如下,AtFALDHLP:5'-GGGGAG CTCATGGCGACTCAAGGTCAGGTTATCA-3'(SacⅠ),AtFALDHRP:5'-GGGTCTAGATTT GCTGGTATCGAGGACACAACG-3'(XbaⅠ)。提取擬南芥RNA,高保真PCR擴增AtFALDH基因。
將PCR擴增的AtFALDH基因插入pMD18-T載 體,用SacⅠ-XbaⅠ分 別 酶 切pMD18-TAtFALDH和p2300-gfp,將回收產物進行連接,從而構建p2300-AtFALDH-gfp表達載體。
1.2.3 綠蘿遺傳轉化 培養含p2300-AtFALDHgfp表達載體的農桿菌,使其OD600值分別為0.2、0.5和1.0,離心后用MS培養基重懸浮,將綠蘿葉柄愈傷組織置于菌液中侵染5、10 min或15 min,共培養1、2 d或3 d;然后轉入含抗生素的培養基中進行篩選,誘導抗性芽。根據綠蘿愈傷組織的分化率確定適宜的轉化條件。切取抗性不定芽,誘導生根,進而獲得轉基因綠蘿。
1.3 數據處理
利用Excel 2007進行數據統計,通過SPSS 17.0軟件中單因素方差分析對數據之間的差異性進行比較。
2 結果與分析
2.1 綠蘿再生體系優化
2.1.1 植物生長物質對外植體愈傷組織誘導的影響 統計分析結果表明(表1),綠蘿葉片在AC3、AC4、AC6、AC8和AC9培養基中均可誘導產生愈傷組織,其愈傷組織誘導率介于9.1%~61.5%。其中,AC9的效果最好,葉片產生愈傷組織的量也較多,與其他培養基相比,愈傷組織誘導率差異顯著。葉柄在9種愈傷組織誘導培養基中均可產生愈傷組織,其中效果最好的為AC4,愈傷組織的誘導率達到97.8%,不僅產生愈傷組織的量較多,而且生長比較旺盛;其次是AC3和AC9,愈傷組織的誘導率也在90%以上,這3種培養基中愈傷組織誘導率和其他大部分培養基相比,存在較顯著的差異;再次為AC6,其愈傷組織的誘導率接近90%;其他幾種培養基的誘導效果則稍差。

表1 綠蘿葉片和葉柄愈傷組織誘導率變化Tab.1 Callus induction rate change of leaves and petioles of Eipremnum aureum
2.1.2 植物生長物質對綠蘿不定芽誘導的影響 統計分析結果表明(表2),葉片誘導產生的愈傷組織只有在A4、A8、A9中方可誘導產生明顯的不定芽,其中,A8中不定芽生長良好,分化率可以接近100%,和其他8種培養基中不定芽誘導率之間存在顯著的差異;其次為A4和A9,分化率約為67%,其余培養基中無明顯不定芽產生。葉柄誘導產生的愈傷組織在這9種培養基中都有不定芽的分化,其 中,A2、A3、A4、A6、A8、A9的 分 化 率 均 接 近100%,和其他3種培養基中不定芽誘導率之間存在顯著的差異。其次為A5、A7,其芽的分化率也在50%~70%,芽分化明顯,但分化率較低。較差的為A1,芽分化率30%左右。總體來說,A9的效果最佳,不僅不定芽分化率較高,而且不定芽數量較多,生長旺盛;葉柄愈傷組織誘導不定芽效果明顯要優于葉片。
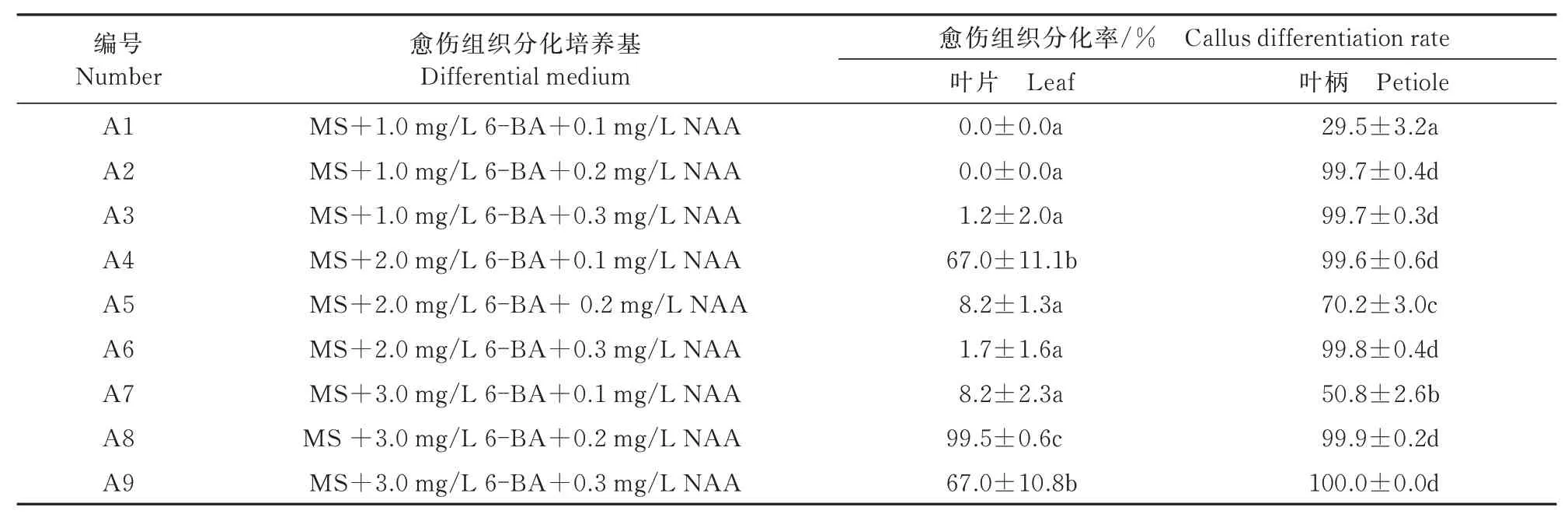
表2 綠蘿葉片和葉柄愈傷組織分化率變化Tab.2 Callus differentiation rate change of leaves and petioles of Eipremnum aureum
2.1.3 植物生長物質對綠蘿不定芽生根的影響 將葉片或葉柄誘導產生的不定芽切下,進行生根培養,30 d后統計不定芽的生根情況。結果表明,在6種培養基中均有根的生成,而且根的長勢較好,生根率都為100%,其中R2生根效果最好,根粗壯,長度合適,須根數量適宜,利于移栽成活(表3)。

表3 綠蘿不定芽生根率變化Tab.3 Rooting rate change of adventitious buds of Eipremnum aureum
2.2 綠蘿的離體再生
將綠蘿葉片接種到培養基AC9中,30 d后可誘導產生少量乳白色的愈傷組織(圖1-A)。繼代培養14 d后,愈傷組織的量明顯增加(圖1-B)。將愈傷組織轉入A8中進行分化培養,7 d左右即可有不定芽產生(圖1-C),30 d后可誘導產生明顯的不定芽,繼代培養后生長較壯(圖1-D)。將葉柄接種到培養基AC4中,30 d后可誘導出較多的愈傷組織,繼代培養14 d后愈傷組織的量明顯增加(圖1-E)。將愈傷組織轉入A9 中7 d后,愈傷組織開始分化;經14 d左右的分化培養,愈傷組織開始產生肉眼可見的不定芽(圖1-F)。增殖培養后,不定芽的數量明顯增多(圖1-G)。將不定芽轉入R2中誘導生根,經30 d培養可以獲得試管苗(圖1-H)。

圖1 綠蘿離體再生的過程Fig.1 The regeneration of Eipremnum aureum in vitro
2.3 p2300-AtFALDH-gfp表達載體的構建
為了轉化綠蘿,首先要進行表達載體p2300-AtFALDH-gfp的構建(圖2-A)。提取擬南芥RNA,反轉錄為cDNA,通過PCR擴增AtFALDH基因(圖2-B)。將回收的AtFALDH基因連入pMD18-T載體。通過PCR和酶切對重組質粒進行鑒定,顯示AtFALDH已插入pMD18-T(圖2-C、D)。分別酶切p2300-gfp和pMD18-T-AtFALDH,回收連接目的片段。PCR和酶切鑒定結果表明,AtFALDH基因已插入p2300-gfp,從而實現p2300-AtFALDHgfp載體的構建(圖2-E、F)。
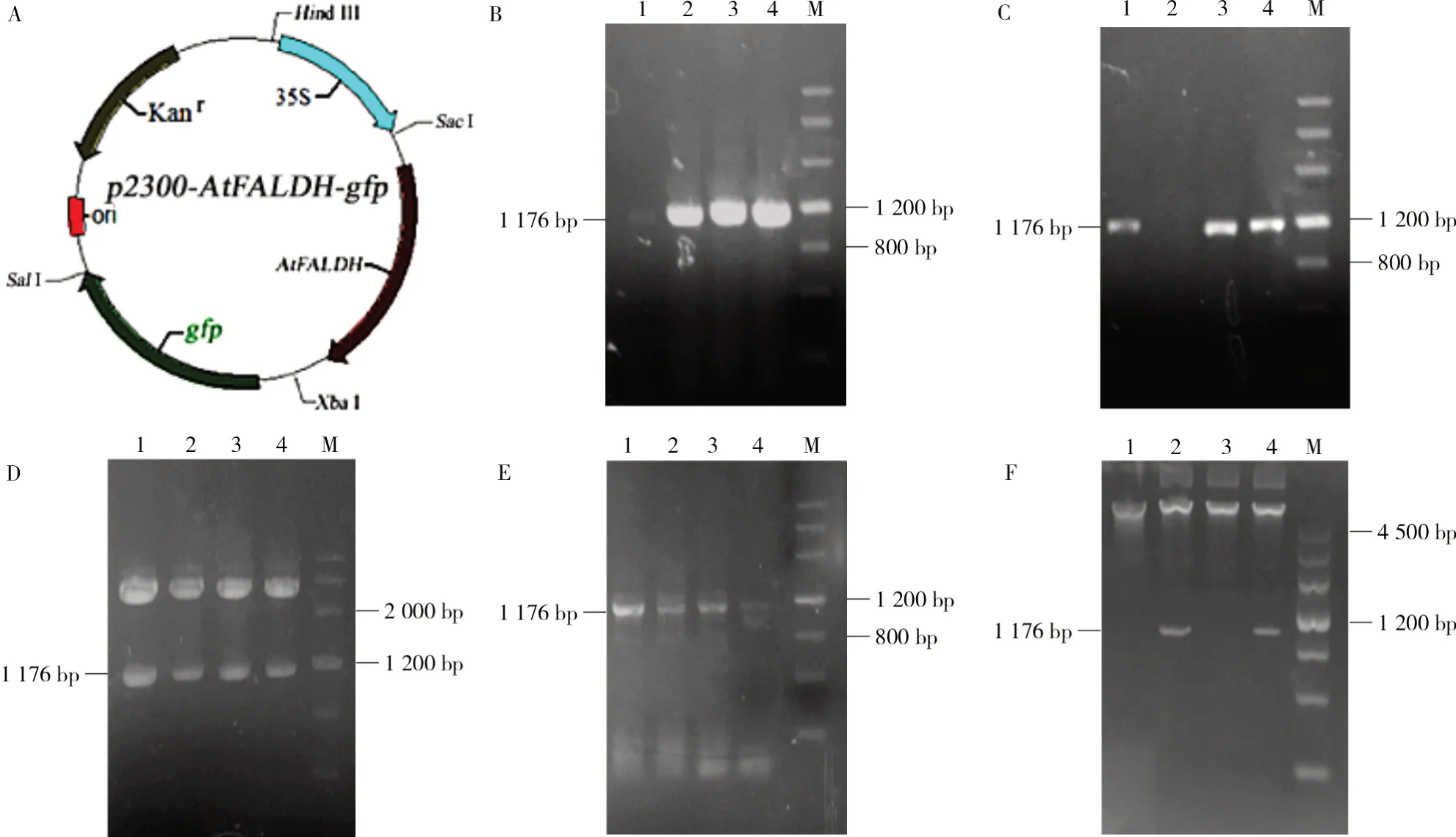
圖2 p2300-AtFALDH-gfp表達載體的構建Fig.2 Construction of p2300-AtFALDH-gfp expression vector
2.4 轉化條件的優化
不同處理條件下綠蘿的轉化率如表4所示。
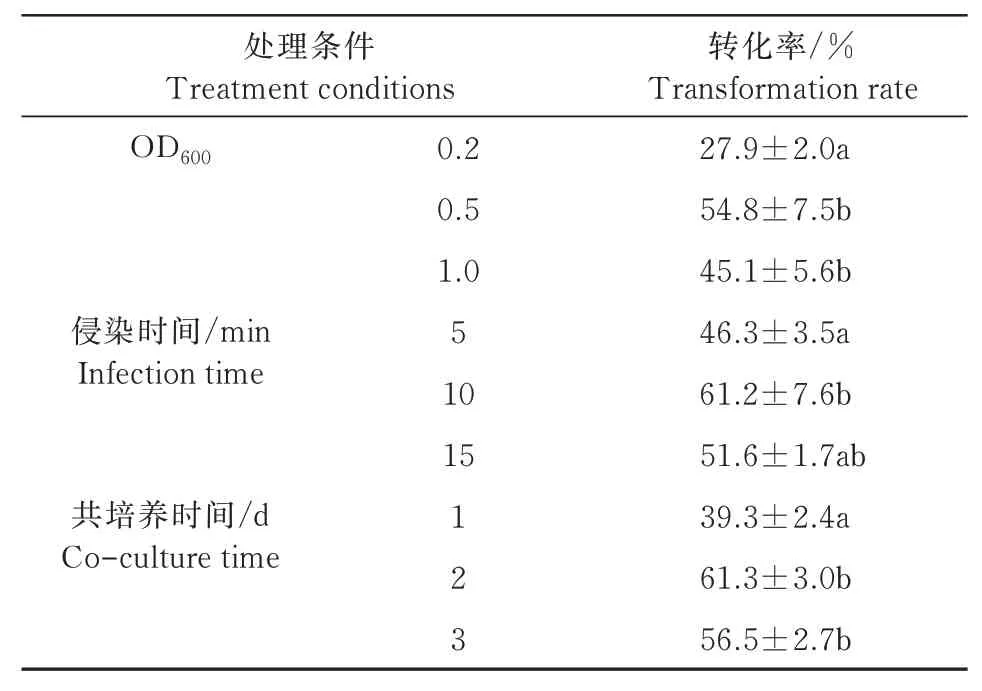
表4 不同處理條件下綠蘿的轉化率變化Tab.4 Transformation rate change of Eipremnum aureum under different treatment conditions
為了提高綠蘿的轉化效率,需對轉化條件進行優化,結果表明(表4),當農桿菌的OD600值為0.5時,葉柄愈傷組織的分化率較高,抗性芽較多,但和OD600值為1.0時區別并不顯著。侵染時間為5 min時,轉化率較低;侵染時間為10 min時,轉化率明顯提高;侵染時間為15 min時,轉化率有所降低,外植體污染率提高。綠蘿愈傷組織和農桿菌共培養2 d時,愈傷組織分化率較高,轉化效果較好,和共培養1 d時存在顯著的差異。
3 結論與討論
甲醛是室內裝修的主要環境污染物,具有強烈的致癌和促癌作用[14]。微生物應對甲醛毒性可歸納為2種機制:利用同化途徑固定甲醛以及通過異化途徑氧化甲醛最終生成CO2[15]。甲基營養細菌通過3種甲醛同化途徑去除甲醛,分別為核酮糖單磷酸途徑、絲氨酸途徑和核酮糖二磷酸途徑[16-17]。而在甲基營養酵母中,甲醛可與谷胱甘肽結合產生S-羥甲基谷胱甘肽,然后經依賴谷胱甘肽的氧化途徑形成CO2[6]。該途徑需FALDH、S-甲酰谷胱甘肽水解酶(FGH)和甲酸脫氫酶(FDH)共同參與完成[18]。高等植物去除甲醛高度依賴FALDH,在甲醛進入植物組織以及轉化為CO2的過程中FALDH都具有重要作用[8]。一些觀葉植物具有高效凈化甲醛污染的效果,因此,通過綠色植物清除甲醛成為人們首選的生態治理手段[7,19]。即便如此,綠色植物吸收甲醛的能力依然有限。因此,如何更有效的增強植物去除甲醛的能力受到了越來越多的關注。而通過基因工程技術將FALDH基因導入植物,是提高受體植物去除甲醛能力的重要途徑之一。高頻離體再生體系的建立是植物遺傳轉化的基礎,本研究以綠蘿葉片和葉柄為外植體,優化綠蘿離體再生條件。試驗結果顯示,葉片、葉柄都均可誘導產生愈傷組織,但葉柄形成愈傷組織的效果更佳,其中培養基添加0.5 mg/L TDZ和0.5 mg/L NAA有利于葉柄愈傷組織的誘導,這和郭英等[3]、范俊崗[4]、陳廣玉[5]的研究結果存在一定的差異,很可能是由于外植體不同造成的。影響愈傷組織分化最主要的植物生長物質是6-BA和NAA。當二者比例合適時,愈傷組織分化產生的不定芽數量較多,生長旺盛;反之,愈傷組織誘導產生的不定芽數量較少,生長遲緩。綠蘿葉片和葉柄誘導產生的愈傷組織均可分化為不定芽,但不定芽的分化效果葉柄愈傷組織明顯優于葉片。因此,不定芽的誘導率不僅與植物生長物質的比例有關,同時也與愈傷組織的來源有一定的關系。綠蘿葉柄愈傷組織分化最適培養基為MS+3.0 mg/L 6-BA+0.3 mg/L NAA。綠蘿比較容易生根,當培養基為1/2 MS,生根效果較好。添加一定濃度的NAA,可有效促進生根。由于綠蘿葉柄離體再生的頻率比較高,因此,本研究采用葉柄愈傷組織作為遺傳轉化的受體。在農桿菌介導的植物遺傳轉化中,菌液濃度、侵染時間和共培養時間等條件均會影響到受體的轉化效率[20-21]。本研究的結果表明,當農桿菌OD600值為0.5時,易和受體細胞接觸,侵染能力強,轉化率較高。農桿菌侵染葉柄愈傷組織10 min效果較好,侵染5 min時抗性芽分化率過低;侵染時間15 min時,葉柄愈傷組織容易褐化,污染比較嚴重。葉柄和農桿菌共培養2 d時效果較好,轉化效率高而污染率低。
本研究的結果表明,綠蘿葉片在MS+0.5 mg/L TDZ+0.5 mg/L NAA+1.0 mg/L 6-BA+1.0 mg/L KT培養基中愈傷組織誘導率為61.5%,葉柄在MS+0.5 mg/L TDZ+0.5 mg/L NAA培養基中愈傷組織的誘導率達到97.8%,并且產生愈傷組織的量較多。將葉片誘導產生的愈傷組織在MS+3.0 mg/L 6-BA+0.2 mg/L NAA中芽分化較明顯,而葉柄誘導產生的愈傷組織在MS+3.0 mg/L 6-BA+0.3 mg/L NAA中芽分化效果最佳,且葉柄愈傷組織誘導不定芽的效果要優于葉片。不定芽生根最適培養基為1/2 MS+0.05 mg/L NAA。用含p2300-AtFALDH質粒農桿菌轉化綠蘿,當農桿菌OD600值為0.5,侵染10 min,共培養2 d時,綠蘿愈傷組織分化抗性芽的效率較高,轉化效果較好。在最適轉化條件下,將AtFALDH基因導入綠蘿細胞中,經抗生素篩選,初步獲得了具有抗性的轉基因植株,但其吸甲醛功效還有待進一步驗證。

