不同劑量的枸杞沙棘配伍對小鼠免疫功能的影響
楊妮,李瑩,朱嘉文,周先加,白家瑞,劉洋,惠竹梅*
1(西北農林科技大學 葡萄酒學院,陜西 楊凌,712100)2(青海省輕工業研究所有限責任公司,青海 西寧,810001)
枸杞別稱茍起子、枸杞紅實、甜菜子等,味甘,性平,主要活性物質有枸杞多糖、類胡蘿卜素、黃酮類化合物,具有免疫調節、抗氧化、抗衰老、抗腫瘤等多種功能[1-6]。沙棘別稱黃酸刺、酸刺柳等,作為世界干旱地區中能夠將經濟、生態與社會效益有效結合的農作物,果實營養豐富,含有多種維生素、有機酸、微量元素、亞油素、沙棘黃酮、超氧化物等活性物質和人體所需的各種氨基酸,具有獨特的藥用和營養價值。研究表明,沙棘對心血管系統、消化系統、肝臟,以及抗氧化、免疫調節均有很好的效果[7-11]。枸杞、沙棘均具有提高免疫力的效果,但兩者配伍使用增強免疫力效果的研究尚未見報道。為此,本實驗通過分析高、中、低3種不同劑量的枸杞沙棘配伍對小鼠免疫功能的影響,探討其增強免疫力功能的相關機制,為后續產品的開發以及臨床應用提供科學依據。
1 材料與方法
1.1 實驗動物
SPF級雄性昆明種小鼠,由湖北省實驗動物研究中心提供,共200只,體重18~22 g,動物飼養室溫度為20~25 ℃,濕度為40%~70%。實驗動物及飼料生產許可證號:SCXK(鄂)2008—0005;實驗動物使用許可證號:SYXK(鄂)2012—0065;批準文號:2021-11-05。
1.2 材料與試劑
本研究所用的藥品為枸杞沙棘膠囊,由西安金牛生物工程有限公司提供,由枸杞子、沙棘、女貞子等為原料制成,人體推薦量2.1 g/d,折合沙棘生藥1.8 g/d,枸杞生藥2.4 g/d。
Hank′s液、RPMI1640培養基、臺酚藍,武漢普諾賽生命科技有限公司;刀豆蛋白(concanavalin A, ConA)、NP40,北京索萊寶科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽[3-(4, 5)-dimethylthiahiazo (-z-yl)-3,5-di-phenytetrazoliumromide, MTT],普洛麥格(北京)生物技術有限公司;乳酸脫氫酶(lactate dehydrogenase, LDH),杭州聯科美訊生物醫藥技術有限公司;甲醇,天津市富宇精細化工有限公司;丙酮、異丙醇、碳酸鈉、瓊脂糖、冰醋酸,合肥天健化工有限公司。
1.3 儀器與設備
YLS-25A打孔器,濟南益延科技發展有限公司;MK3酶標儀,Thermo Labsystems;PTF-A500電子天平、PTT-A+200千分之一電子天平,福州華志科學儀器;LDZX-50KB立式壓力蒸汽滅菌器,上海申安醫療器械廠;BPN-80CH CO2培養箱,上海一恒科學儀器有限公司;DHP-9162恒溫培養箱,上海慧泰儀器制造有限公司;TDL-50B低速臺式離心機,上海安亭科技儀器廠;BSC-1000生物安全柜,蘇州安泰空氣技術有限公司;UB203i顯微鏡,重慶奧普光電有限公司;T6-新世紀紫外分光光度計,北京普析通用儀器有限責任公司;等。
1.4 實驗方法
1.4.1 分組與給藥
將200只雌性小鼠隨機分為5組進行8項實驗,1組進行遲發型變態反應(delayed type hypersensitivity, DTH),2組為小鼠測定和淋巴器官/體重比值測定和碳廓清實驗,3組為ConA誘導的小鼠脾淋巴細胞轉化實驗和自然殺傷細胞(natural killer cell, NK細胞)活性測定,4組為抗體生成細胞檢測和血清溶血素測定,5組為小鼠腹腔巨噬細胞吞噬雞紅細胞實驗。每組40只小鼠隨機分為4小組,分別為枸杞沙棘膠囊粉低(0.35 g/kg·BW)、中(0.70 g/kg·BW)、高(1.05 g/kg·BW)3個劑量組,另設1個陰性對照組(蒸餾水),每小組10只小鼠[12]。各組動物按照劑量每天灌胃20 mL/kg枸杞沙棘膠囊粉1次,陰性對照組灌等量蒸餾水,連續灌胃30 d后開始實驗[13]。
1.4.2 ConA誘導的小鼠脾淋巴細胞轉化實驗
參考楊迪等[14]的方法并略作修改。小鼠經口灌服枸杞沙棘膠囊粉和蒸餾水30 d后,頸椎脫臼處死。在無菌的環境中取脾,置于含有無菌Hank′s液的培養皿中輕輕磨碎,制成單個樣品細胞懸浮液,過200目篩網進行篩選,用Hank′s液洗2次、離心10 min(1 000 r/min)后于1 mL的完全培養液中懸浮,計活細胞數(95%)并將細胞濃度調整為3×106個/mL。將每個樣品懸液分兩孔加入24孔培養板中,每孔1 mL,其中一孔加入75 μL ConA液,另一孔不加作為對照,于5% CO2的培養箱中37 ℃培養72 h。培養至68 h時,每孔吸取0.7 mL上清液的同時加入0.7 mL不含小牛血清的RPMI1640培養液和MMT(5 mg/mL)50 μL,之后繼續培養4 h至結束。結束后,每孔加入1 mL酸性異丙醇,使紫色結晶完全溶解,用分光光度計于波長570 nm處測定OD值。
1.4.3 二硝基氟苯(2,4-dinitrofluorobenzene, DNFB)誘導的小鼠遲發型變態反應
參考楊迪等[14]的方法,用1%的DNFB進行致敏,免疫后第5天用DNFB攻擊右耳,24 h后處死小鼠,用打孔器各取下左右耳殼直徑8 mm的耳片進行稱重,用左右耳重量差表示DTH的程度。
1.4.4 血清溶血素的測定
參考史頂聰等[15]的方法并略作修改。取適量羊血,用生理鹽水清洗3次后離心10 min(2 000 r/min),之后將羊血紅細胞[壓積綿羊紅細胞(sheep red blood cell,SRBC)]用生理鹽水配制成2%(體積分數)的細胞懸液,每只小鼠腹腔注射0.2 mL進行免疫,免疫后4~5 d摘眼球采血并分離血清,于微量血凝板內用生理鹽水稀釋,每孔100 μL,再加入100 μL 0.5%(體積分數)SRBC懸液混勻,之后將微量血凝實驗板裝入濕潤的平盤內加蓋,于37 ℃溫箱孵育3 h后進行血清溶血素測定。統計血球凝集度,計算相應抗體積數。
1.4.5 小鼠腹腔巨噬細胞吞噬雞紅細胞實驗(半體內法)
參考楊迪等[14]的方法并略作修改。小鼠經口灌服枸杞沙棘膠囊粉和蒸餾水30 d后,每只小鼠均腹腔注射20%(體積分數)的雞紅細胞懸液1 mL,頸椎脫臼處死后注射生理鹽水2 mL,轉動鼠板1 min后吸出腹腔洗液1 mL平均滴于2片載玻片上,放入濕潤的容器內37 ℃孵育30 min,之后用生理鹽水漂洗晾干,用1∶1(體積比)的甲醇丙酮溶液固定,4%(體積分數)Giemsa-磷酸緩沖液染色,再用蒸餾水漂洗晾干。鏡檢,油鏡下計數100個巨噬細胞,吞噬率和吞噬指數的計算分別如公式(1)、公式(2)所示:

(1)

(2)
1.4.6 小鼠碳廓清實驗
參考史頂聰等[15]的方法并加以修改。各組小鼠末次給藥1 h后,尾靜脈注射印度墨汁(生理鹽水稀釋4倍)10 mL/kg,2 min(t1)和10 min(t2)分別從小鼠內眥靜脈叢采血20 μL,并迅速加入到2 mL 0.1%(質量分數)碳酸鈉溶液中搖勻,于紫外分光光度計600 nm處測定吸光值。之后將小鼠處死后取肝臟和脾臟分別稱重,吞噬指數(α)的計算如公式(3)所示:
(3)
式中:K為未經校正吞噬指數;OD1為t1時(2 min)血標本光密度值;OD2為t2時(10 min)血標本光密度值。
1.4.7 抗體生成細胞檢測(Jerne改良玻片法)
參考楊迪等[14]的方法并略作修改。SRBC注射免疫方法同1.4。將SRBC免疫4 d后的小鼠處死,取出脾臟,脾臟處理方法同1.4.2,最后將細胞懸浮在5 mL RPMI1640培養液中計數,并將細胞濃度調整為5×106個/mL。
空斑的測定:將表層培養基(1 g瓊脂糖+雙蒸水至100 mL)加熱溶解后45~50 ℃保溫,與等量pH 7.2~7.4、2倍濃度的Hank′s液混合后分裝,每管0.5 mL,再向管內加50 μL 10%(體積分數)用SA緩沖液配制的SRBC和20 μL脾細胞懸液(5×106個/mL),迅速混勻,傾倒于已刷瓊脂糖薄層的玻片上做平行片,待瓊脂凝固后,將玻片水平扣放在片架上,放入二氧化碳培養箱中孵育1.5 h,然后用SA緩沖液稀釋補體(1∶8,體積比)加入玻片架凹槽內,繼續溫育1.5 h后,計數溶血空斑數。各劑量組結果與陰性對照組進行方差分析。
1.4.8 NK細胞活性測定
參考楊迪等[14]方法并略作修改,實驗前24 h將靶細胞進行傳代培養。使用前用Hank′s液洗3次、RPMI1640完全培養液將細胞濃度調整為4×105個/mL。
無菌取脾,脾臟處理方法同1.4.2,1 000 r/min離心10 min后棄上清液并彈起細胞漿,加入0.5 mL滅菌水20 s對紅細胞進行裂解,再加入Hank′s液8 mL和2倍的Hank′s液0.5 mL,1 000 r/min離心10 min,加入含10%小牛血清的RPMI1640完全培養液1 mL進行重懸,1%(體積分數)冰醋酸稀釋后計數,并調整細胞濃度為2×107個/mL。
取靶細胞和效應細胞各10 μL,加入U型96孔培養板中:靶細胞自然釋放孔加靶細胞和培養液各100 μL,靶細胞最大釋放孔加靶細胞和1% NP40各10 μL,分別設3個平行孔,于5%的CO2培養箱中37 ℃培養4 h,1500 r/min離心5 min,每孔吸取上清100 μL加入96孔平底培養板中,同時加入LDH基質液100 μL,反應8 min,每孔加入1 mol/L的HCL 30 μL,在酶標儀490 nm處測定光密度值(OD),NK細胞活性的計算如公式(4)所示:
(4)
2 結果與分析
2.1 各劑量組受試物對小鼠體重的影響
由表1可知,各組小鼠生長發育情況良好,體重穩定增加,與陰性對照組比較,各劑量組小鼠體重均無顯著變化,說明枸杞沙棘膠囊粉對小鼠體重影響不顯著。
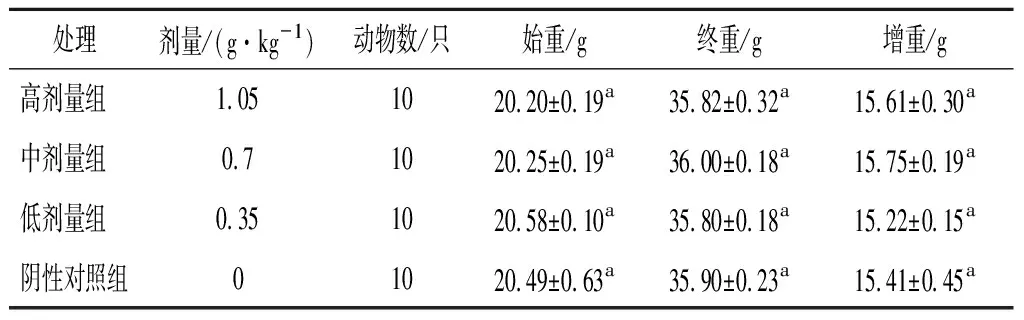
表1 各劑量組受試物對實驗組小鼠體重的影響Table 1 Effect of test substance in each dose group on body weight of mice in the test group
2.2 各劑量組受試物對小鼠淋巴器官/比重比值的影響
脾臟是人體最大的淋巴器官,參與機體多種免疫反應。T淋巴細胞是整個淋巴器官的發育和機體免疫不可或缺的,而胸腺產生T淋巴細胞,所以胸腺的損傷和退化會導致T淋巴細胞的減少,降低機體免疫力。由表2可知,小鼠經口灌服沙棘枸杞膠囊粉和蒸餾水30 d后,胸腺/體重的比值和脾臟/體重的比值均無明顯變化,且與陰性對照組比較無顯著差異(P>0.05),說明各劑量組受試物對小鼠免疫系統無損傷。
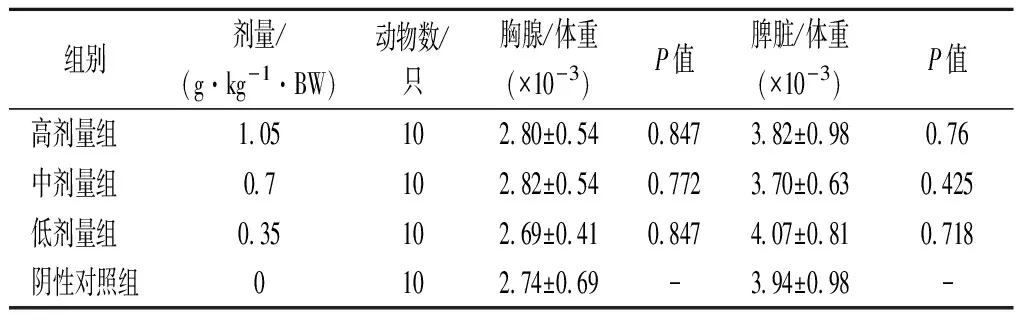
表2 各劑量組受試物對小鼠淋巴器官/體重比值的影響Table 2 Effect of test substance of each dose group on the ratio of lymphoid organs/specific gravity of mice
2.3 各劑量組受試物對小鼠脾淋巴細胞轉化能力及小鼠遲發型變態反應的影響
淋巴細胞的轉化可以在體外檢測淋巴細胞的應答能力。由表3可知,與陰性對照組相比,中、低劑量組均無顯著變化(P>0.05),而高劑量組能夠顯著增強ConA誘導的小鼠脾淋巴細胞轉化能力。
遲發型變態反應又稱“遲發型超敏反應”,是由T淋巴細胞介導的一種超敏反應。它的發生不需要抗體或補體參加,是在變應原作用下形成致敏淋巴細胞,當機體再次接觸相同變應原時,會表現出一種遲緩的、以單個核細胞浸潤和細胞變性壞死為特征的局部變態反應性炎癥。經口給予小鼠不同劑量的受試物30 d后,用耳腫脹法進行DNFB誘導的DTH實驗,結果表明,低、中、高劑量組的耳殼增重均高于陰性對照組,且與陰性對照組相比,中劑量組差異明顯(P<0.05),高劑量組差異顯著(P<0.01),具有統計學意義。
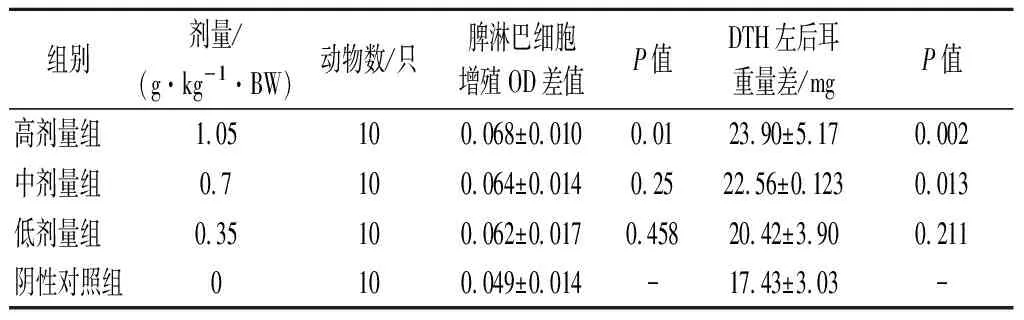
表3 各劑量組受試物對ConA誘導的小鼠脾淋巴細胞 轉化能力及小鼠遲發型變態反應的影響Table 3 Effects of test substances in each dose group on ConA induced splenic lymphocyte transformation ability and delayed allergic reaction in mice
2.4 各劑量組受試物對小鼠血清溶血素水平的影響
用綿羊紅細胞免疫小鼠,可以引發小鼠血清中的特異性抗綿羊紅細胞抗體的產生,該抗體是一種溶血素,能夠溶解綿羊紅細胞。由表4可知,與陰性對照組比較,各劑量組的小鼠抗體積數均增高,且中劑量組抗體積數最大,顯著高于陰性對照組(P<0.05)。由于在增強小鼠體液免疫功能方面,影響作用并不隨劑量增大而增強,中劑量組效果最佳,可能是因為劑量過大對機體產生其他作用而影響體液免疫功能,具體原因有待進一步研究證實。

表4 各劑量組受試物對小鼠血清溶血素水平的影響Table 4 Effect of test substance in each dose group on serum hemolysin level of mice
2.5 各劑量組受試物對小鼠腹腔巨噬細胞吞噬雞紅細胞能力的影響
巨噬細胞又稱組織細胞,主要功能是對細胞碎片和病原體進行識別、吞噬和消化,并激活淋巴球或其他免疫細胞對病原體作出反應。由表5可知,各劑量組受試物的吞噬率均大于陰性對照組,且隨著劑量的升高,吞噬率逐漸升高。與陰性對照組相比,高劑量組能提高吞噬指數,且差異顯著(P<0.05)。
2.6 各劑量組受試物對小鼠碳廓清功能的影響
由表6可知,經口給予小鼠不同劑量的受試物30 d后,與陰性對照組相比,低、中劑量組的吞噬指數α均無顯著變化(P>0.05),而高劑量組能顯著提高小鼠碳廓清吞噬指數(P<0.05)。

表5 各劑量組受試物對小鼠腹腔巨噬細胞吞噬雞 紅細胞能力的影響Table 5 Effects of test substances in each dose group on the ability of mouse peritoneal macrophages to phagocytize chicken erythrocytes
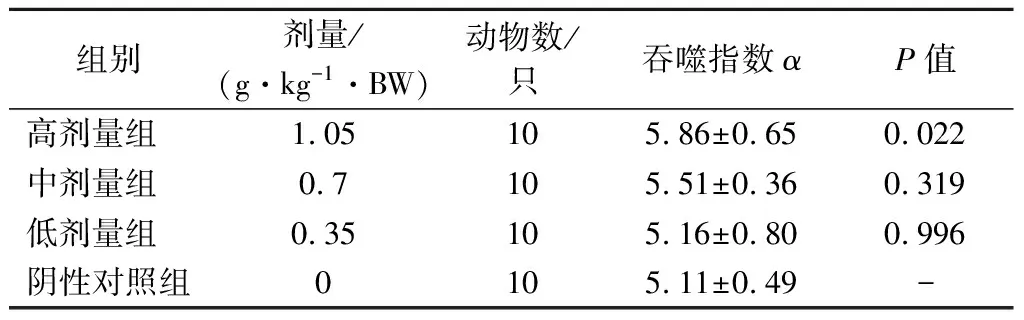
表6 各劑量組受試物對小鼠碳廓清功能的影響Table 6 Effect of test substance in each dose group on carbon clearance function of mice
2.7 各劑量組受試物對小鼠抗體生成細胞功能的影響
經口給予小鼠不同劑量的受試物30 d后,用半數溶血值法測定小鼠的血清半數溶血值(HC50),并進行統計學分析。由表7可知,與陰性對照組比較,低、中劑量組的溶血空斑數無顯著變化(P>0.05),而高劑量組能顯著提高抗體生成細胞數量(P<0.05),有統計學意義。
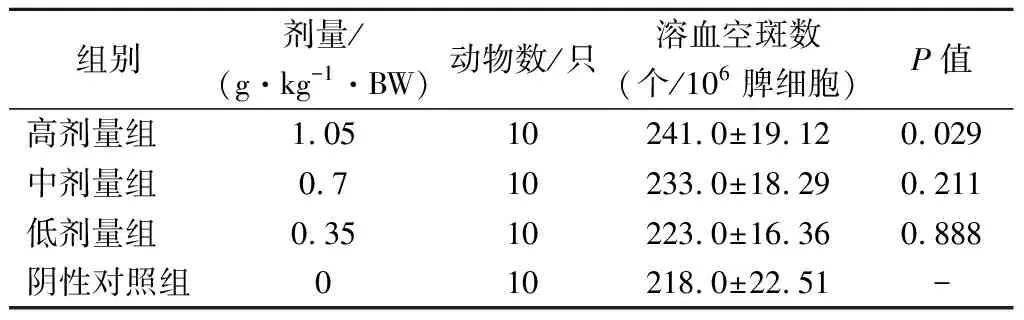
表7 各劑量組受試物對小鼠抗體生成細胞功能的影響Table 7 Effect of test substance in each dose group on the function of antibody producing cells in mice
2.8 各劑量組受試物對小鼠NK細胞活性的影響
NK細胞是機體重要的免疫細胞,不僅與抗腫瘤、抗病毒感染和免疫調節有關,并且能夠識別靶細胞、殺傷介質,在某些情況下參與超敏反應和自身免疫性疾病的發生。由表8可知,與陰性對照組比較,低、中劑量組的NK細胞活性均無顯著變化(P>0.05),高劑量組能夠增加小鼠NK細胞活性,且差異顯著(P<0.05)。
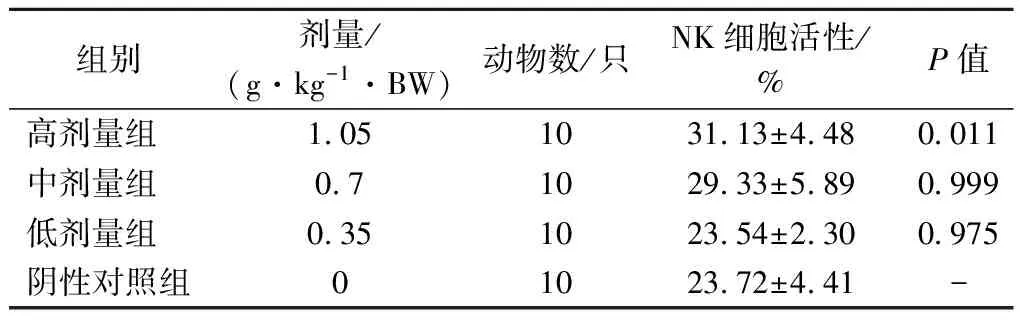
表8 各劑量組受試物對小鼠NK細胞活性的影響Table 8 Effect of test substance in each dose group on NK cell activity in mice
3 討論與結論
免疫功能是維護自身健康的重要的生理機能。機體的免疫功能由免疫系統擔任,與身體的健康狀態密切相關。免疫力低下是導致身體亞健康的重要原因之一,長期的亞健康狀態也會導致機體免疫功能的減退[16-17]。機體免疫功能低下會導致機體功能的衰退,可引發多種疾病,最主要表現為易感染、容易疲倦等。世界衛生組織調查數據顯示,全球有超75%的人群處于亞健康狀態[18],亞健康狀態現患率與年齡成正相關,目前我國老年人處于亞健康狀態者高達90%[19],亞健康問題已經成為全球流行的亟需解決的問題。黨的十九大提出“健康中國”戰略的重大決策部署,目前我國已經進入已預防為主,倡導健康文明生活方式,預防重大疾病。因此,如何減少亞健康的患病率,改善人體亞健康狀態,提高免疫力將會是未來研究的熱點問題[20-21]。
研究表明,枸杞和沙棘均具有很好的增強免疫力的功效。枸杞多糖能夠增強細胞介入免疫和體液免疫反應,進而提高機體免疫力;適當濃度的枸杞多糖或可促進免疫器官的發育。枸杞多糖通過下調衰老基因的表達、調控P13K/AKT信號通路抵抗細胞氧化等方法,增強免疫細胞抗氧化、抗疲勞的能力,減緩免疫細胞衰老。此外,枸杞多糖能夠通過調節凋亡相關分子的表達以調節老齡T細胞的凋亡,調節免疫活性;還可影響腸道通透性和組織學變化,增強腸道抗氧化能力,激活腸道中存在的T細胞、B細胞、巨噬細胞以及派氏結等免疫細胞[22]。
沙棘可以增加小鼠巨噬細胞的吞噬功能,促進體液免疫及淋巴細胞的轉化。沙棘粉具有調節血脂、減輕肝臟氧化損傷、預防血脂代謝紊亂的作用。沙棘多糖能夠顯著促進巨噬細胞的增殖、細胞因子的釋放;在體內,沙棘多糖能夠增強免疫低下小鼠的免疫器官指數、提升小鼠巨噬細胞的吞噬功能、提高脾臟組織中細胞因子的水平[23]。
本研究所用的受試物是由枸杞、沙棘配伍組成,對小鼠進行一系列提高免疫力的實驗,結果表明,與陰性對照組比較,高劑量組能夠顯著增強ConA誘導的小鼠脾淋巴細胞轉化能力及DNFB誘導的DTH反應、吞噬率、吞噬指數、小鼠碳廓清吞噬指數、NK細胞活性及抗體生成細胞數量,差異顯著(P<0.05);中劑量組可顯著提高小鼠抗體積數,差異顯著(P<0.05)。根據《保健食品檢驗與技術評價規范》(2003)版,該產品對細胞和體液免疫功能測定結果均為陽性,該產品具有增強免疫力的功效。且實驗結果顯示,由枸杞、沙棘配伍的產品不良反應較少,不會破壞機體正常的免疫功能,安全性高,且效果好,本研究可為后續枸杞沙棘的綜合利用開發提供思路。目前對于枸杞、沙棘提高免疫力的量效關系、構效關系仍不清楚,對于其調節免疫機制,還需進行大量實驗研究予以證實。因此,可加強對這2種中藥的基礎研究,為其進一步臨床應用及資源開發提供科學依據。

