聚己內酯-褪黑素支架治療骨缺損修復效果分析
王志鋒,趙 威,朱建華,侯林豪,楊哲豪,殷國輝,任炳宇,崔 巖
中國醫科大學附屬第四醫院 第一骨外科,遼寧 沈陽 110031
骨腫瘤、外傷、骨髓炎、骨壞死等原因均可引起不同程度的骨缺損。骨缺損主要通過骨移植術進行修復,但自體骨移植需要進行額外手術,增加了創傷與感染風險,同時其有限的材料來源限制了其可用性。同種異體骨移植與異種骨移植雖然無需額外手術且克服了材料限制,但會產生免疫排斥反應,影響移植骨的存活率及傳染疾病的潛在可能性[1-2]。聚己內酯(polycaprolactone,PCL)支架具有低成本、易加工與降解速率可控等優勢[3]。PCL支架逐步吸收的同時,可增強并刺激骨骼的生長及再生,從而為新組織的形成提供空間,但其生物活性較差,限制了新生骨的長入替代[4]。褪黑素(melatonin,MT)是由松果體分泌的一種重要的吲哚類激素[5]。有研究表明,在破骨細胞中,藥物劑量的MT可以下調核因子κB受體活化因子(nuclear factor κB receptor activator ligand,RANKL)的表達,提高骨保護素含量,抑制破骨細胞的形成及活化,從而抑制骨吸收,增加年輕小鼠骨小梁骨量及骨密度[6-7]。MT刺激體外培養的人骨細胞及成骨細胞系增殖與I型膠原合成[8-9]。本研究旨在探討PCL-MT支架治療骨缺損的修復效果。現報道如下。
1 材料與方法
1.1 實驗動物 選取6只8周齡SD雄性大鼠為研究對象。SD雄性大鼠購自吉林大學實驗動物中心。動物實驗得到中國醫科大學動物保護與利用委員會批準。
1.2 PCL支架的三維打印 利用3D打印機,通過SolidWorks 2017 軟件與Simplife 3D軟件,使用PCL進行打印,形成具有高多孔性、高機械強度的PCL支架。
1.3 三維PCL支架上的MT裝載 將MT與SUNP凝膠加入10 ml磷酸緩沖鹽溶液中,使混合物完全溶解。冷卻至室溫后,得到載MT凝膠。將載MT凝膠注入三維PCL支架的空隙中[10]。將支架置于室溫下進行液固轉化,得到負載MT的PCL支架。
1.4 動物模型構建 制備骨損傷模型:對大鼠進行適應性飼養后5 d,采用隨機數字表法將大鼠分為對照組與PCL-MT支架組,每組各3只。將大鼠常規麻醉, 固定于實驗臺上,雙側上肢備皮、鋪無菌巾。沿備皮區域縱行作一2 cm切口,在脛骨近段1/3處截除1 cm,PCL-MT支架組大鼠缺損處植入PCL-MT支架,對照組大鼠抽取骨缺損處0.1 ml自體血,形成小血凝塊,植入血凝塊,逐層縫合。術后注射抗生素預防感染。
1.5 PCL-MT支架特性研究
1.5.1 體外浸泡試驗 將PCL-MT支架放入清潔的浸泡瓶中,然后將Hank溶液加入到浸泡瓶,浸泡瓶置于37℃水浴恒溫器中。每天記錄pH值。30 d后,PCL-MT支架用吹風機干燥。采用鉻酸溶液、蒸餾水與乙醇對PCL-MT支架進行超聲清洗10 min。采用吹風機烘干PCL-MT支架后再次稱重。
1.5.2 CCK-8實驗及生物相容性 處理前,將細胞置于96孔板上24 h。培養72 h后,每孔加入CCK-8溶液,培養1 h。采用酶標儀在450 nm處測定吸光度。采用細胞骨架染色法,將細胞在12孔板上貼壁24 h,然后于37℃、CO2環境下培養7 d。采用4%多聚甲醛固定細胞30 min,0.5%Triton X-100滲透劑室溫下滲透5 min。通過加入4-6-二脒基-2-苯基吲哚染色細胞核,在熒光顯微鏡下觀察圖像。
1.6 體內外成骨性能
1.6.1 聚合酶鏈式反應法測定體外成骨性能 通用RNA提取試劑盒分離總RNA,并使用Primescript RT Master Mix逆轉錄。采用聚合酶鏈式反應(polymerase chain reaction,PCR)法檢測堿性磷酸酶(alkaline phosphatase,ALP)、骨保護素(osteocalcin,OCN)、骨鈣素(osteoprotegerin,OPG)在骨缺損細胞中的表達情況。每個實驗重復3次。
1.6.2 相對鈣沉積 成骨培養基培養14 d后,采用40 mmol/L茜素紅溶液染色,測定細胞外基質鈣沉積。細胞與結節形成采用相襯顯微鏡觀察。
1.6.3 顯微CT掃描 術后4周,無菌切除大鼠脛骨,并用MicroCT掃描評估,測定對照組與PCL-MT支架組骨缺損區的新骨形成情況及新生骨痂量。
1.6.4 伊紅染色 組織固定于4%多聚甲醛中。固定后,石蠟包埋前在10%乙二胺四乙酸中脫鈣21 d,然后顯微切片成一系列系統16 μm切片。標準伊紅染色并拍照。
1.7 統計學方法 采用GraphPad Prism 6.02統計學軟件對數據進行處理。以P<0.05為差異有統計學意義。
2 結果
2.1 體外浸泡試驗結果 體外浸泡試驗表明,支架的礦化厚度與腐蝕速率隨時間延長逐漸增加。體外浸泡試驗30 d后,PCL-MT支架仍具有清晰的輪廓。見圖1。
2.2 CCK-8實驗及免疫熒光結果 培養72 h后,兩組大鼠的CCK-8實驗檢測結果見圖2。PCL-MT支架組大鼠的相對細胞增殖率明顯高于對照組,差異有統計學意義(P<0.05)。使用熒光顯微鏡觀察與浸出液共培養24 h的細胞,兩組細胞均有良好的鋪展形態與顯著的肌動蛋白表達,表面修飾后細胞粘附行為不受影響。見圖3。

圖1 體外浸泡實驗結果
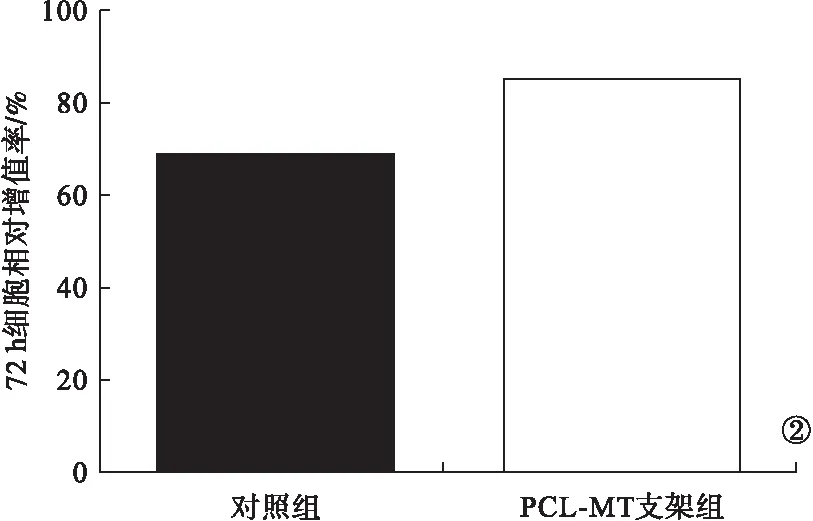
圖2 CCK-8實驗檢測結果
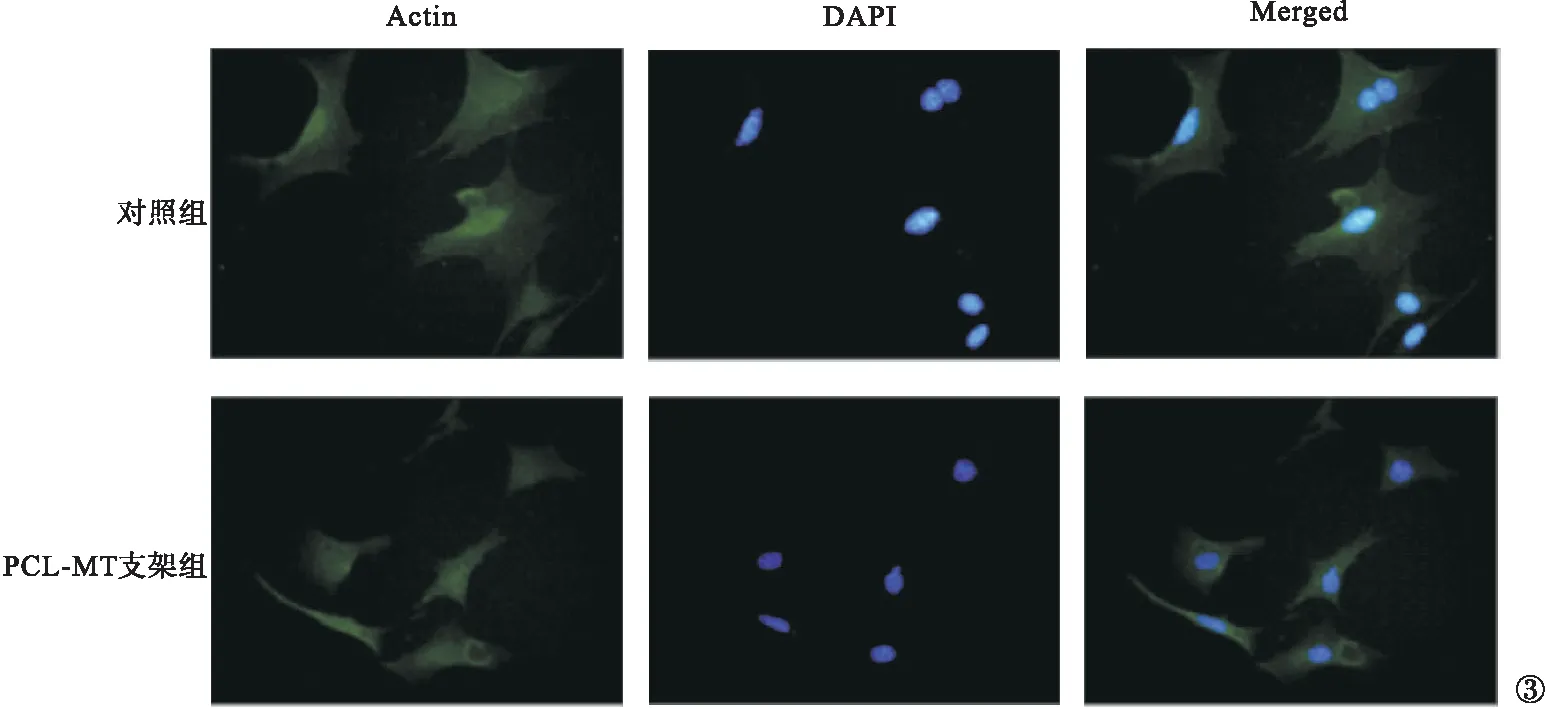
圖3 細胞免疫熒光結果
2.3 PCR法檢測與茜素紅染色法檢測結果 PCR法檢測結果顯示,PCL-MT支架組中的ALP、OCN、OPG mRNA表達高于對照組,差異均有統計學意義(P<0.05)。見圖4。茜素紅染色法檢測結果顯示,PCL-MT 支架組中的相對鈣沉積量遠高于對照組,差異有統計學意義(P<0.05)。見圖5。
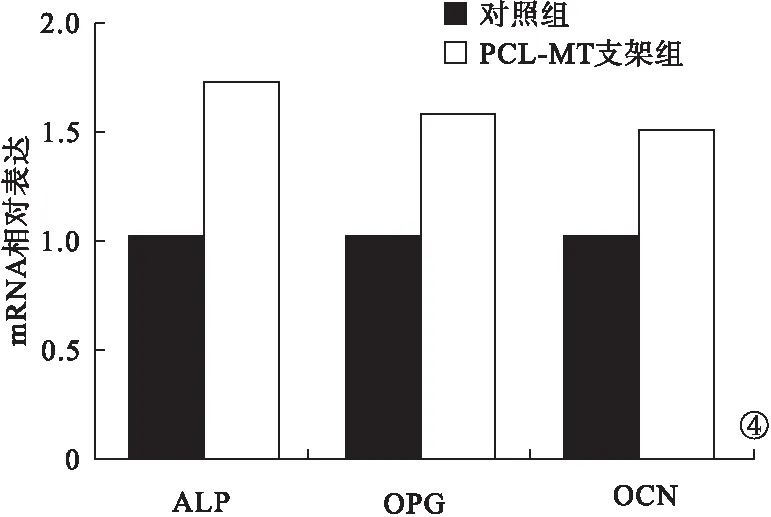
圖4 PCR法檢測結果

圖5 茜素紅染色法檢測結果
2.4 顯微CT掃描 顯微CT掃描結果顯示:對照組大鼠仍可見骨缺損區,周圍有少量新生骨痂;PCL-MT支架組大鼠骨支架旁明顯大量新生骨痂充填,色白微透明,表面不平整但較完整,質地較韌。見圖6。
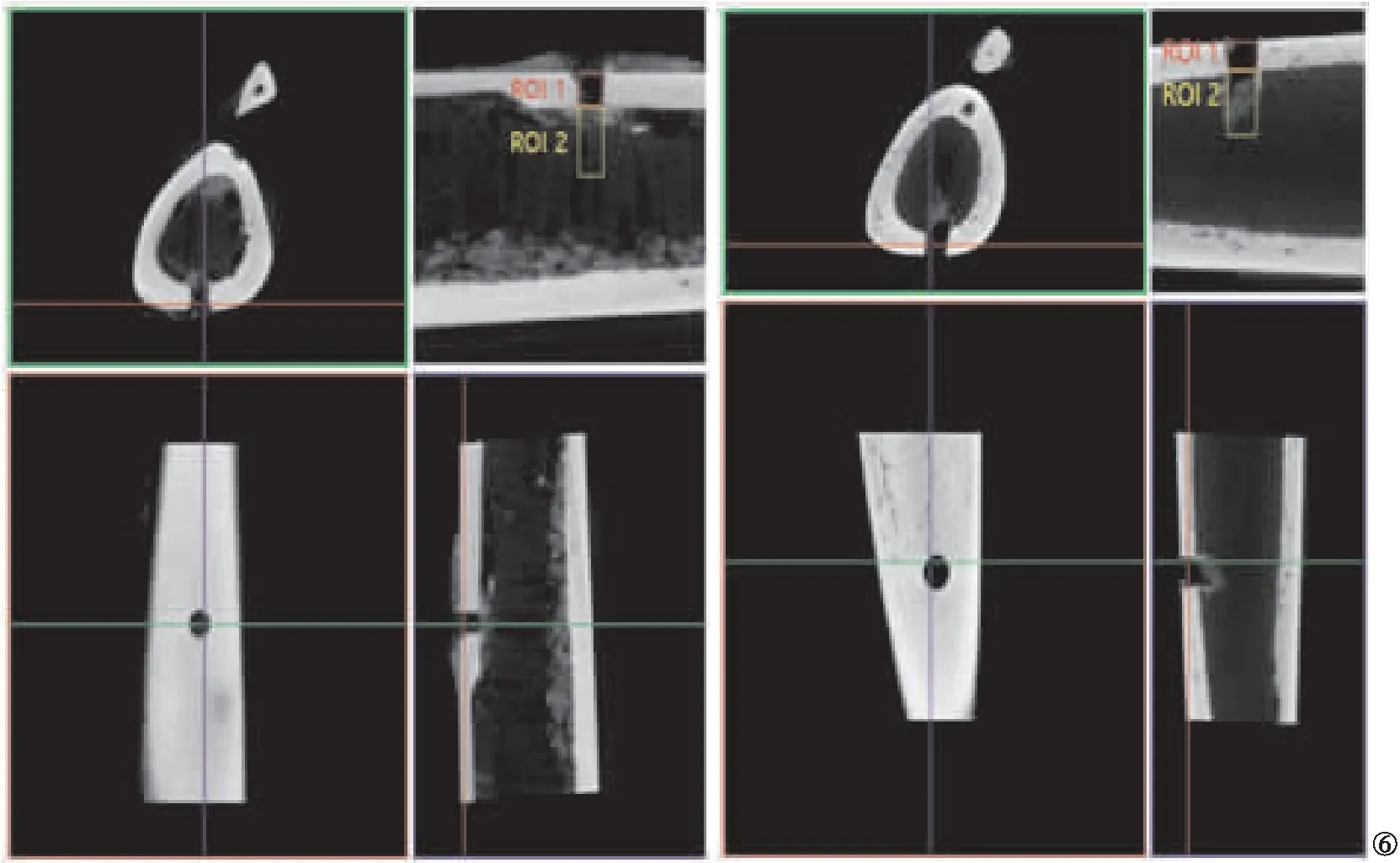
圖6 顯微CT掃描結果
2.5 骨小梁半定量分析結果 對照組大鼠中骨缺損區不均勻密度的新骨形成,骨小梁散在分布且體積不一,PCL-MT支架組大鼠可見大量纖維結締組織,以及連續排列的骨小梁,活躍的成骨細胞。骨小梁半定量分析結果顯示,PCL-MT支架組大鼠骨小梁數多于對照組,差異有統計學意義(P<0.05)。見圖7。
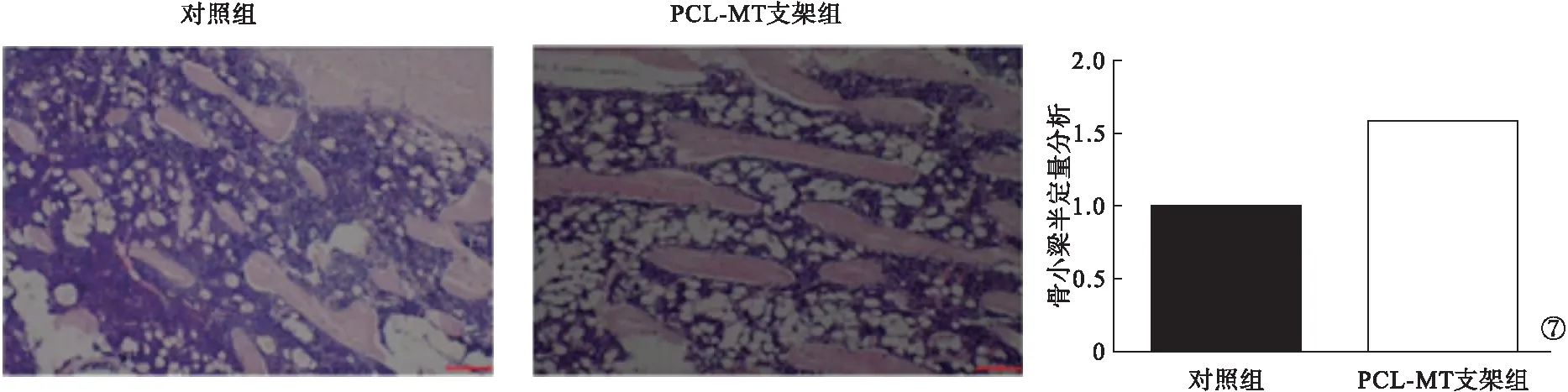
圖7 骨小梁半定量分析結果
3 討論
骨缺損發病率較高,主要通過骨移植術進行修復。自體骨移植雖然排異反應小,但來源有限且術后并發癥較多;異體骨移植雖然來源廣泛,但是排異反應較大,嚴重影響移植手術的成功率。PCL為一種生物可吸收聚合物,其性質穩定,價格低廉,但與其他復合材料相比,其生物活性較差,導致新的骨組織無法與聚合物表面緊密貼合,限制了新生骨在骨缺損部位的長入及替代[11-12]。有研究發現,MT具有下調RANKL抑制骨吸收的作用[13]。MT半衰期較短,阻礙了其在醫用材料中的臨床應用[14]。水凝膠具有高含水量和多孔結構的特點,能夠較好地模擬人體組織的細胞外基質,促進營養物質與代謝廢物的交換[15]。
本研究體外浸泡試驗表明,支架的礦化厚度與腐蝕速率隨時間延長逐漸增加,體外浸泡試驗30 d后,PCL-MT支架仍具有清晰的輪廓。這提示,PCL-MT支架具有良好的生物活性。CCK-8實驗檢測結果顯示,PCL-MT支架組的相對細胞增殖率明顯高于對照組。這提示,PCL-MT支架的細胞活力更強。PCL-MT支架組大鼠的相對細胞增殖率明顯高于對照組,差異有統計學意義(P<0.05)。使用熒光顯微鏡觀察與浸出液共培養24 h的細胞,兩組細胞均有良好的鋪展形態與顯著的肌動蛋白表達。這提示,PCL-MT支架具有良好的生物相容性。PCR法檢測結果發現,PCL-MT支架組中的ALP、OCN、OPG mRNA表達均高于對照組,差異均有統計學意義(P<0.05)。這表明,PCL-MT支架具有更好的促進骨形成的能力。此外,骨小梁半定量分析結果顯示,PCL-MT支架組大鼠骨小梁數多于對照組,差異有統計學意義(P<0.05)。提示PCL-MT支架對骨缺損具有良好的治療作用。干細胞的成骨分化和成脂分化受到多種轉錄因子的調控,這些轉錄因子為調節干細胞成骨分化與成脂分化的開關[16]。在脂肪分化過程中,磷酸化轉錄調節因子β抗體與過氧化物酶體增殖物激活受體γ均被MT抑制,MT下調終末脂肪細胞分化的標志物,如瘦素、脂蛋白脂酶、脂聯素與脂肪細胞蛋白,上調成骨細胞分化的標志物,如ALP、骨橋蛋白和骨鈣素[17-20]。
綜上所述,PCL-MT支架可有效促進骨缺損區新生骨組織生成。但關于MT介導成骨分化的促成骨誘導機制有待深入研究。

