基于肺癌放化療前增強CT圖像影像組學方法對非小細胞肺癌放化療敏感性評估
辛 迪,劉大治,佟 晶,王 聰,卑貴光
北部戰區總醫院1.放射診斷科;2.胸外科,遼寧 沈陽 110016
全球癌癥統計報告2020版數據庫顯示,全球新發癌癥1 929萬例,其中,肺癌占比11.4%;同年,全球約990萬例癌癥患者死亡,其中,肺癌占比18%[1-2]。因此需要更為精準的醫療手段對肺癌的分級分期、療效及預后作出評估,以降低肺癌的發病率及病死率。近年來,功能與解剖相結合的成像模式,整合了可視化腫瘤生物學與高分辨率結構成像的優點,徹底改變了腫瘤患者的臨床管理模式[3]。影像組學作為功能與解剖相結合的成像模式,是由計算機輔助診斷(computer aided diagnosis,CAD)發展而來,2012年由荷蘭學者Lambin等[4]首次提出,介紹了關鍵技術和應用前景;Kumar等[5]進一步擴展了定義,并分析了工作流程中的各個步驟。本研究旨在探討基于肺癌放化療前增強CT圖像的影像組學標簽,結合相關臨床信息,建立評估非小細胞肺癌(non small cell lung cancer,NSCLC)放化療敏感性的數據模型,并評估模型的效能。現報道如下。
1 對象與方法
1.1 研究對象 回顧性分析自2010年11月至2019年12月北部戰區總醫院經病理證實為NSCLC,具有完整的放化療前肺部增強CT影像數據的125例(共236個病灶)患者的臨床資料,其中,男性97例,女性28例;年齡32~92歲,中位年齡61歲;病理類型:鱗癌72例,腺癌42例,未特指的NSCLC 11例。納入標準:(1)治療前均經穿刺活檢或纖維支氣管鏡檢病理證實為NSCLC或NSCLC術后復發;(2)在我院首次進行放化療,治療前未進行過其他任何治療;(3)有完整的放化療前影像數據資料。排除標準:(1)臨床資料不全、離院或放棄治療;(2)病灶過小或病灶實性成分過少導致縱隔窗顯示不清;(3)圖像質量欠佳(圖像偽影),不能用于定量分析。本研究選擇總生存期作為隨訪終點,總生存期定義為從患者接受治療的日期起至死亡的日期或是最后1次隨訪日期(2020年3月25日)之間的差值。本研究經醫院倫理委員會批準。所有研究對象均對本研究知情同意。
1.2 CT掃描方法 使用HD750 64層螺旋CT機(GE公司),雙筒高壓注射器,18G套管針,經肘前靜脈以3.5 ml/s的速度注入生理鹽水16 ml,再以相同的速度注入碘帕醇(270 mgI/ml)0.5~2.0 ml/kg,自動觸發容積掃描,然后再以相同的速度注入生理鹽水20 ml沖洗。管電壓120 kV,自動毫安,矩陣512×512,將容積數據包上傳至PACS工作站。
1.3 治療方法 所有患者均參考腫瘤放射治療組[6]及美國國立綜合癌癥網絡[7]2020年發布的腫瘤臨床實踐指南,并對脊髓、臂叢神經、心臟/心包、食管、氣管/支氣管、皮膚和胸壁等正常器官進行保護及限量。鱗癌患者給予吉西他濱(1 000~1 250 mg/m2,第1、8天)加順鉑(75 mg/m2,第1天),化療2個周期(21 d為1個周期);非鱗癌患者給予多西他賽(75 mg/m2或60 mg/m2,第1天)加順鉑(75 mg/m2,第1天),化療2個周期。同步放療1個周期,腫瘤區60~66 Gy、臨床靶區50~54 Gy,每周第1至5天,連續治療,共30次。
1.4 實體瘤療效評價標準 根據實體瘤療效評價標準1.1(response evaluation criteria in solid tumors 1.1,RECIST 1.1)單徑測量法將療效反應分為4級。其中,完全緩解:所有靶病變消失,任何病理性淋巴結(無論是非靶向淋巴結還是靶向淋巴結)必須短軸縮小至<1.0 cm。部分緩解:靶病變總直徑減少≥30%。疾病進展:靶病變直徑總和增加≥20%,總和還必須要求絕對增加≥0.5 cm(發現1個或多個新的病變也被認為是進展)。疾病穩定:在研究期間,以總直徑為參考,既沒有足夠的減少符合部分緩解,也沒有足夠的增加符合疾病進展。把完全緩解和部分緩解歸類于對放化療敏感,疾病穩定和疾病進展歸類于非敏感。
1.5 CT圖像采集及分割 導出圖像前將所有圖像設置為統一的窗寬(400 HU)、窗位(40 HU),采用層厚5 mm的原始圖像,將所有數據以DICOM格式從PACS系統導出,上傳至Dr.Wise 1.6.2.1多模態科研平臺(北京深睿博聯科技有限責任公司,中國,以下簡稱Dr.Wise平臺)。由兩名擁有5年以上肺部影像診斷經驗的放射科主治醫師應用Dr.Wise平臺,采用雙盲法勾畫病灶。由平臺進行每一層面圖像的自動分割,勾畫出腫瘤的邊界,兩名醫師分別審閱工作站分割的圖像,并進行手動校正,勾畫感興趣區(region of interest,ROI),并避開囊變、鈣化、血管及壞死區,得到每一層的ROI。為了評估影像組學特征的測量者間的一致性,進行測量者間一致性評價(interclass correlation coefficients,ICC),也是間接評估提取的影像組學特征的穩定性和可重復性。當ICC>0.75認為其一致性較好。CT圖像選取ROI以及提取的相應圖像標簽見圖1、2。
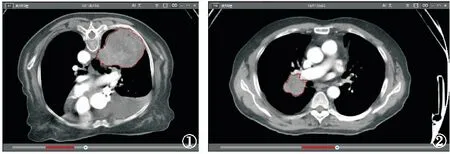
圖1 女性患者,77歲,鱗狀上皮異性增生癌變 圖2 男性患者,56歲,右肺鱗癌
1.6 影像組學特征提取、篩選 采用Dr.Wise平臺提取一致性較好的ROI圖像標簽,進行影像組學分析。通過經數據標準化的影像中提取組學特征,每個患者提取7類105個影像組學特征。
1.7 模型建立 以隨機分配原則將患者按照1∶4比例分為驗證組及訓練組(每組各25例)。采用決策樹(decision tree,DT)、支持向量機(support vector machine,SVM)、邏輯回歸(logistic regression,LR)、隨機森林(random forest,RF)、線性支持向量(liner support vector machine,LSVM)5種分類器方法建立模型。采用5折交叉驗證法進行學習(圖3)。

圖3 5折交叉驗證法
1.8 統計學方法 采用Medcalc 19.0.4統計學軟件進行分析,加載相應的程序包和函數庫進行計算。使用受試者工作特征(receiver operating characteristic,ROC)曲線分析各個分類器的預測效能,并分別計算其曲線下面積(area under curve,AUC)、準確度、靈敏度及特異度,并保留AUC最大且特異度較高的模型。分析評估模型的診斷性能。RECIST與最優預測效能的分類器統計采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 SVM模型提取的影像組學特征分析 為了降低提取的特征值之間的高度重復性,防止出現過擬合風險,需要對105個特征進行降維分析。首先進行單因素方差分析,然后采用基于方差分析的特征篩選(ANOVA F-value),具有顯著性差異的特征被認為對于分類具有區分度,將被保留。最終篩選出一階紋理特征、形狀特征、灰度共生矩陣、灰度級區域大小矩陣、灰度相關矩陣、灰度行程矩陣6類影像組學特征。
2.2 基于影像組學特征建立的預測模型結果 5種分類器通過學習從肺增強CT圖像中提取的特征值分別建立模型,對各自模型的訓練組及驗證組進行評價。用AUC、準確度、靈敏度及特異度對5種分類器的效能進行比較。基于肺增強CT圖像上的影像組學特征所建立的模型,以SVM分類器下的AUC面積最高,評估放化療敏感性的訓練組準確度為0.90,靈敏度為0.82,特異度為0.74,AUC為0.90(95%可信區間:0.860~0.935)。驗證組準確度為0.70,靈敏度為0.53,特異度為0.82,AUC為0.76(95%可信區間:0.700~0.824)。見表1、圖4~6。
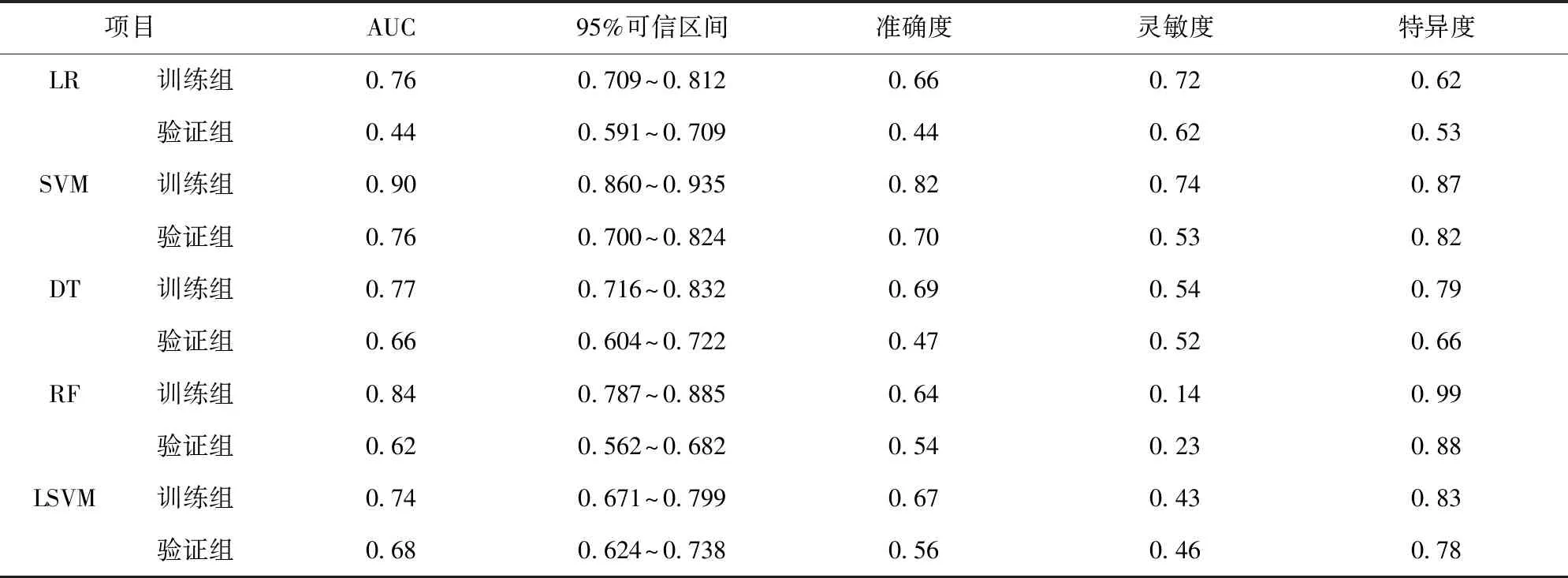
表1 基于肺CT圖像建立5種分類器模型的ROC曲線分析結果
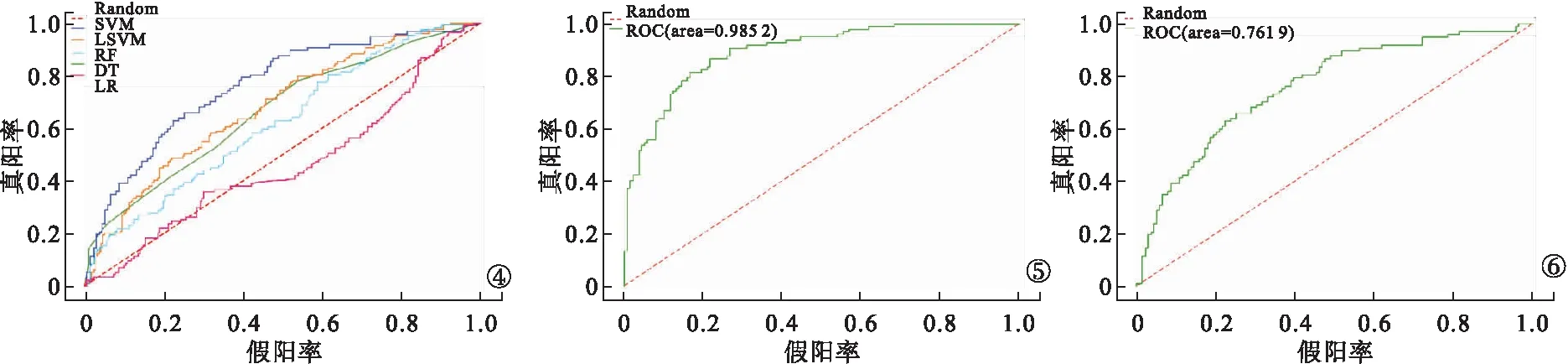
圖4 5種分類器模型驗證組ROC曲線 圖5 SVM模型訓練組ROC曲線 圖6 SVM模型驗證組ROC曲線
2.3 SVM模型與RECIST預測NSCLC放化療敏感性結果比較 SVM模型與RECIST預測NSCLC放化療敏感性的結果比較,差異無統計學意義(P>0.05),說明SVM模型與RECIST預測NSCLC放化療敏感性的效能相仿。見表2。
3 討論
NSCLC是最常見的肺癌類型之一,放化療是NSCLC治療的關鍵手段,主要目的是最大限度地控制腫瘤發展,同時盡量減少對患者正常組織的損傷,所以需要通過個體化治療來提高治療效果[8-9]。近年來,隨著大數據和各種信息技術的發展,基于影像組學的大數據研究可以通過結合患者的臨床信息來構建相應疾病模型,實現腫瘤的精準診斷,提高療效評估和預后判斷[10-11]。本研究基于肺癌放化療前增強CT圖像構建影像組學模型對NSCLC進行放化療敏感性的評估,輔助臨床醫師制定個體化治療方案,以降低不良結果的風險并提高患者的存活率。
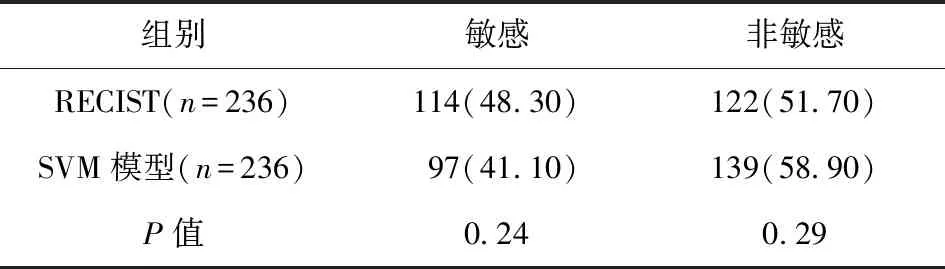
表2 RECIST與SVM模型預測NSCLC放化療敏感性的結果比較/例(百分率/%)
本研究結果顯示,影像組學特征可以作為評估放化療敏感性的指標,并且與傳統指南(RECIST 1.1)對敏感性的預測效能相似。在RECIST 1.1指南中,腫瘤對治療的反應是通過腫瘤大小的一維測量來衡量的。由于放化療后腫瘤細胞代謝變化要比形態學變化早,而腫瘤細胞受抑制,解剖結構變化過程相對緩慢,很難被影像學檢查發現。而影像組學分析所應用的數據是在治療前采集,因此,相比于傳統指南,影像組學可以實現治療前的放化療敏感性的評估,有望在制定NSCLC個體化治療方案方面起到更大的作用。Corolle等[12]的研究表明,影像組學能夠提供額外的表型信息,可以反映腫瘤對放化療的敏感性,這與本研究結論相仿。Farchione等[13]研究發現,提取NSCLC患者放療前增強CT圖像的影像組學特征后所建立的模型,準確地預測了化療后腫瘤的退縮情況。Yan等[14]認為,影像組學特征可以反映腫瘤細胞的放射敏感性。
在本研究中,5種分類器方法建立的模型最終依據AUC的差異,確定了SVM分類器法最優。SVM是Cortes和Vapnik于1995年提出的一種二分類模型[15]。SVM分類器被廣泛地用于分類任務,因為,其設計不太容易過度擬合,即使在沒有特征空間降維的情況下也能在一定程度上獲得良好的泛化性能[16-17]。并且,SVM可以解決小樣本下機器學習問題,對訓練集之外數據的預測性能好、計算開銷小、泛化錯誤率低,在二分類領域具有一定的優勢。
本研究方向的影像組學研究還有很多價值。首先,影像組學特征建立的組學模型可以快速、無創地全面提取腫瘤內部的全部癌癥特征信息、包括腫瘤內部的異質性[18],而通過活檢從整個腫瘤提取一部分的生物樣本反映的生物標記物信息是有限的。其次,相對于簡單的腫瘤密度、大小指標,影像組學特征所建立的組學模型可以提供更加全面、詳實的腫瘤信息,不僅可以反映整個腫瘤的生物學特性,還可以從定量影像中挖掘更多的信息并量化,為調整和定制個體化治療方案提供更有價值的參考信息[19]。
影像組學在NSCLC治療療效評估中的前景可觀,但在實踐中仍有一些挑戰。CT除了簡單的描述性征象外,還包含了數量龐大的可深度探索的數字化信息。如果能夠解碼隱藏在影像圖像中的因患者遺傳變異、生理、細胞等多種因素共同決定的綜合影像信息,并能定量化且客觀的將其“內涵”呈現在臨床診斷、治療及預后評估分析的整個過程,這無疑會成為無創檢測發展的革命,為臨床醫學帶來重大意義[20]。
本研究存在一些局限性。首先,本研究是一項回顧性研究,所有患者均來自同一中心,還需要多中心、大規模及前瞻性的驗證隊列,以評估本研究提出模型的臨床應用的潛力和通用性,并可以添加分子生物學標志物、基因表達特征等,將其納入預測模型,從而為患者提供個性化的治療方案。其次,本研究僅限于一個機構對腫瘤的描繪和驗證,而不同機構的影像采集參數標準、圖像組學特征提取和模型建立方法等方面都存在差異,導致臨床結果評估可能存在差異[21]。
綜上所述,SVM模型與RECIST預測NSCLC放化療敏感性的效能相仿。基于NSCLC放化療前增強CT圖像獲得的影像組學標簽建立的影像組學模型對NSCLC放化療敏感性的評估具有一定的應用價值。

