高遷移率族蛋白1對系統性紅斑狼瘡腎損傷腎小球內皮細胞通透性影響
田 玉,楊玉淑,韓玉祥,丁 萌,彭晨星
河北醫科大學第二醫院 風濕免疫科,河北 石家莊 050000
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種累及多器官、多系統,具有高異質性特征的自身免疫性疾病[1-2]。炎癥反應和免疫紊亂是SLE發生發展的病理基礎[3]。腎小球濾過屏障(glomerular filtration barrier,GFB)受損所導致的蛋白尿是SLE腎損傷的重要臨床表現,而人腎小球內皮細胞(human glomerular endothelial cell,HRGEC)是GFB的重要組成部分。因此,探討HRGEC在SLE腎損傷中的作用十分重要。高遷移率族蛋白1(high mobility group box 1,HMGB1)是一種存在于真核細胞核中的非組蛋白核蛋白,細胞損傷后,HMGB1可大量釋放至細胞外,除直接刺激細胞,還會與DNA、細胞因子、外源性因子、核小體等形成免疫刺激復合物,在自身免疫性疾病和炎癥的發生發展中具有重要作用[4]。有研究表明,狼瘡性腎炎(lupus nephritis,LN)患者血清HMGB1水平明顯升高,且與蛋白尿、狼瘡活動指數呈正相關[5],提示HMGB1可能參與了SLE患者腎損傷的發生過程。但HMGB1是否參與了SLE中HRGEC的損傷尚未明確。本研究以SLE腎損傷患者血漿刺激HRGEC來模擬疾病的微環境,旨在探討HMGB1在SLE中對HRGEC通透性的影響,以期為臨床治療提供理論依據。現報道如下。
1 資料與方法
1.1 一般資料 選取自2020年1月至2022年3月于河北醫科大學第二醫院行血漿置換術治療的50例SLE患者為研究對象。以24 h尿蛋白定量0.5 g為標準將患者分為A組(無蛋白尿,n=27)和B組(有蛋白尿,n=23)。另選取同期于我院體檢的50例健康者納入健康組。SLE患者納入標準:(1)符合SLE診斷標準[6];(2)未合并血液系統疾病或惡性腫瘤;(3)未合并重要器官嚴重損傷;(4)臨床資料完整。排除標準:(1)合并糖尿病;(2)妊娠或哺乳期女性;(3)精神狀態較差,無法配合本研究。A組中,男性3例,女性24例;年齡29~53歲,平均40.90歲。B組中,男性5例,女性18例;年齡20~56歲,平均37.80歲。健康組中,男性11例,女性39例;年齡25~62歲,平均40.92歲。各組研究對象年齡、性別比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準。所有研究對象均簽署知情同意書。
1.2 研究方法
1.2.1 血清學檢查 采集所有研究對象空腹靜脈血,離心收集血漿,采用酶聯免疫吸附法檢測血漿HMGB1、內皮素-1、溶性血管細胞黏附分子(soluble vascular cell adhesion molecule,sVCAM-1)水平,所有操作均按照試劑盒說明書進行。HMGB1、sVCAM-1、內皮素-1酶聯免疫吸附試劑盒均購自上海碧云天生物技術有限公司。
1.2.2 HRGEC培養 原代HRGEC購自美國sciencell公司。使用含10% FBS、Penicillin、Streptomycin、生長添加劑的ECM培養基培養HRGEC,每2~3 d換液1次,將細胞置于含5%二氧化碳的細胞培養箱中,37℃靜置培養。
1.2.3 CCK8檢測細胞活力 將HRGEC分為control組與LN組。control組以健康者血漿刺激細胞,LN組以SLE腎損傷血漿刺激細胞,刺激濃度分別為0、5%、10%、15%和20%,孵育24 h后利用CCK8試劑盒檢測各組細胞的增殖活力。
1.2.4 跨膜電阻檢測 利用transwell小室構建HRGEC單層,應用跨細胞電阻儀測定control組與LN組SLE腎損傷血漿刺激6 h、12 h、18 h、24 h細胞層的跨膜電阻(transepithelial electrical resistance,TEER)。Transwell小室使用前給予牛纖維連接蛋白包被,加入全培養基在培養箱平衡過夜。將HRGEC細胞懸液以1×105個/ml接種于transwell小室上室,下室加入培養基,另設只有培養基的空白孔。鏡下觀察細胞呈融合狀態,且反復多次跨膜電阻儀測定TEER值穩定24 h以上,提示HRGEC單層構建成功。測量空白孔的電阻值,連續測量3次,取平均值。TEER值=(各孔電阻值-空白孔電阻值)×transwell上室底面積,結果重復5次。
1.2.5 FITC-BSA法檢測HRGEC單層的通透率 測定control組與LN組SLE腎損傷血漿刺激6 h、12 h、18 h、24 h的HRGEC單層的通透率。在transwell小室上室接種細胞,待TEER值穩定24 h后,PBS漂洗小室,根據分組在上室分別加入相應的試劑,同時加入5 mg/ml的FITC-BSA 0.1 ml,下室加入等摩爾、無標記的BSA 0.3 ml,避光環境下37℃細胞培養箱孵育。按照實驗設計要求孵育不同時間后,分別從上室及下室吸取培養基,倍比稀釋,利用熒光分光光度計檢測上室、下室樣品的熒光強度(激發波長495 nm,發射波長520 nm)。FITC-BSA購自北京索萊寶科技有限公司。
采用通透系數(P)表示內皮細胞單層對BSA的通透性大小,通透率的計算公式:P=[F](1/A)(v/[L])。[F]為下室FITC-BSA的熒光強度,A為transwell上室底面積,v為下室溶液體積,[L]為上室熒光強度。每組實驗重復5次,取平均值。
通透率=(LN組P/control組P)×100%
1.2.6 細胞免疫熒光法檢測血管內皮細胞鈣黏蛋白的表達 以冰生理鹽水沖洗LN組與control組細胞,4%多聚甲醛室溫固定10 min,PBS洗后給予0.5% Triton 100打孔,再次PBS沖洗,正常山羊血清封閉后滴加兔抗血管內皮細胞鈣黏蛋白(VE-cadherin)一抗(1∶200), 4℃過夜,滴加FITC-羊抗兔IgG,37℃孵育后PBS沖洗,防淬滅封片劑封片,激光共聚焦顯微鏡觀察,拍照。兔抗VE-cadherin單克隆抗體購自CST公司。
1.2.7 HMGB1對HRGEC單層的通透率的影響 細胞分組:control組、LN組、LN+HMGB1中和抗體(LN+H ab)組、LN+對照IgG抗體(LN+IgG ab)組。control組給予健康血漿刺激細胞,LN組給予SLE腎損傷血漿刺激細胞,LN+H ab組及LN+IgG ab組分別給予HMGB1中和抗體(沈陽萬類生物)及對照IgG抗體預處理細胞30 min,然后給予SLE腎損傷血漿刺激細胞12 h,其他操作同1.2.5。
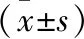
2 結果
2.1 各組研究對象血漿HMGB1、內皮素-1、sVCAM-1水平比較 A組和B組血漿HMGB1、內皮素-1、sVCAM-1水平均明顯高于健康組,且B組高于A組,差異均有統計學意義(P<0.05)。見表1。
表1 各組研究對象血漿HMGB1、內皮素-1、sVCAM-1水平比較
2.2 CCK8細胞活力檢測結果 CCK8結果顯示,隨著血漿刺激濃度的增加,control組細胞活力無明顯改變(P>0.05);當刺激濃度為10%、15%、20%時,LN組細胞活力明顯下降(P<0.05),因此在后續的試驗中選取10%作為刺激濃度。見圖1。
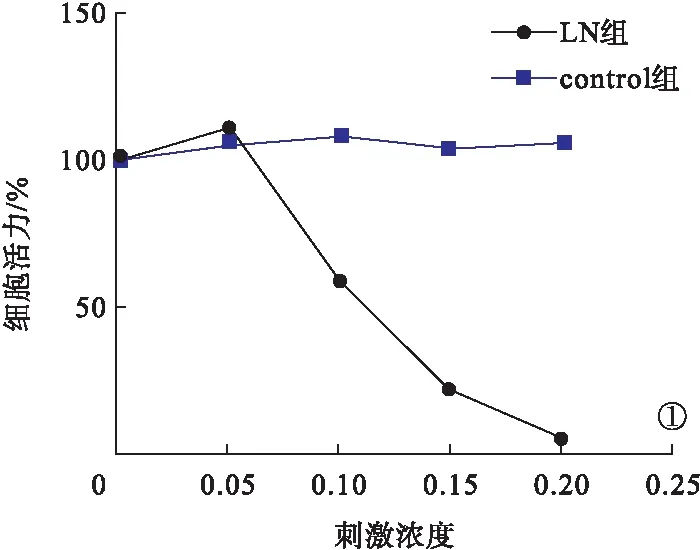
圖1 CCK8細胞活力檢測結果
2.3 SLE腎損傷血漿刺激HRGEC不同時間TEER值變化 LN組刺激12 h、18 h、24 h的TEER分別為(7.33±1.03)Ω·cm2、(6.15±1.18)Ω·cm2、(4.77±1.32)Ω·cm2,均顯著低于control組的(11.23±0.58)Ω·cm2,差異有統計學意義(P<0.05)。LN組刺激6 h的TEER為(11.03±1.40)Ω·cm2,與control組比較,差異無統計學意義(P>0.05)。
2.4 SLE腎損傷血漿刺激HRGEC不同時間通透率變化 LN組刺激6 h時HRGEC的熒光通透率為(104.27%±6.59%),與control組的100.00%比較,差異無統計學意義(P>0.05)。LN組刺激12 h、18 h、24 h的通透率分別為(137.22%±14.88%)、(156.92%±14.28%)、(200.06%±10.08%),均顯著高于control組,差異有統計學意義(P<0.05)。
2.5 SLE腎損傷血漿刺激HRGEC細胞間VE-cadherin表達結果 免疫熒光結果顯示,control組VE-cadherin于細胞間緊密連接處連續表達,而LN組VE-cadherin的分布不連續,細胞間隙增大,部分VE-cadherin表達在細胞漿,提示細胞間緊密連接受損。見圖2。
2.6 HMGB1中和抗體預處理后各組HRGEC細胞TEER值及熒光通透率變化 與control組比較,LN組的TEER值明顯下降、熒光通透率明顯增加,差異有統計學意義(P<0.05);與LN組比較,LN+H ab組TEER值明顯升高、熒光通透率明顯降低,差異有統計學意義(P<0.05)。見圖3~4。
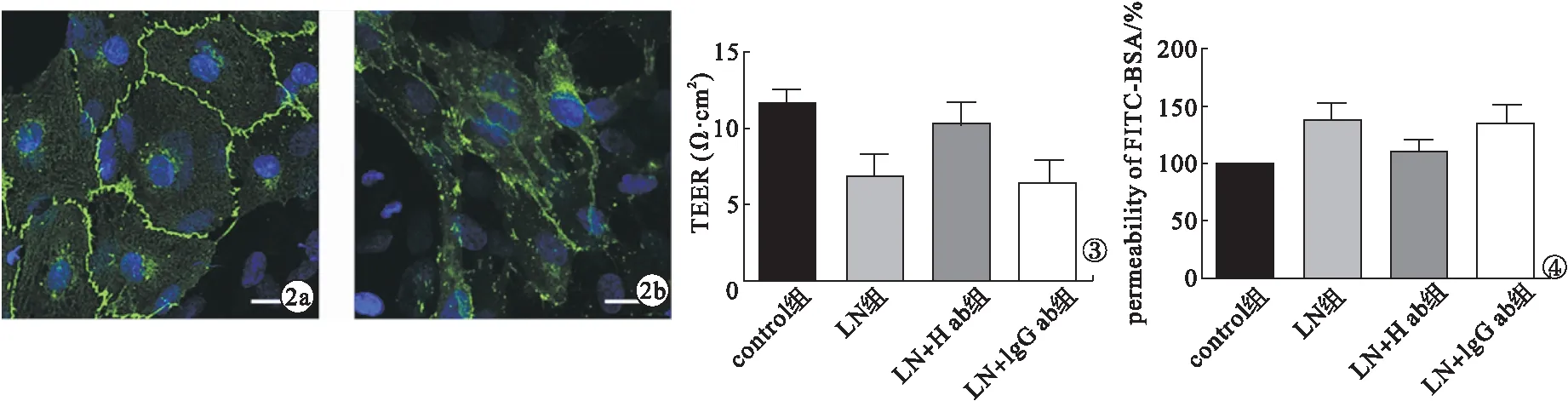
圖2 免疫熒光檢測HRGEC細胞膜上的VE-cadherin表達(a.control組;b.LN組;bar=25 μm) 圖3 各組HRGEC細胞TEER值檢測結果 圖4 各組HRGEC細胞熒光通透率檢測結果
2.7 HMGB1中和抗體預處理后各組HRGEC細胞間VE-cadherin表達 免疫熒光結果顯示,LN+H ab組細胞間VE-cadherin的表達較LN組有所增加,提示細胞間緊密連接有所改善。見圖5。
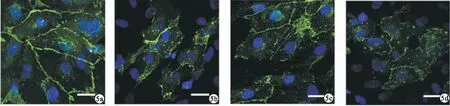
圖5 免疫熒光顯示各組HRGEC細胞間VE-cadherin表達的情況(a.control組;b.LN組;c.LN+H ab組;d.LN+IgG ab組;bar=25 μm)
3 討論
HRGEC是一種高度分化的內皮細胞,位于GFB的最外層。GFB的屏障功能和完整性對于維持血管穩態至關重要,當內皮細胞受損,細胞間的緊密連接松散,細胞形態收縮,一些大分子物質如白蛋白從細胞旁漏出,導致腎小球毛細血管通透性增加,進而出現蛋白尿。有研究報道,SLE患者存在內皮細胞損傷,且SLE與動脈粥樣硬化進展及心血管事件風險有關[7]。內皮素-1是一種由血管內皮細胞產生的高效內源性血管收縮肽,參與了慢性腎病的發生發展,且與SLE活動度有關[8-9]。sVCAM-1已被證實在LN患者的血清中明顯升高,且與內皮細胞損傷有關[10]。本研究結果顯示,A組和B組患者血漿內皮素-1、sVCAM-1水平均明顯升高,且B組升高更為明顯,提示SLE腎損傷患者存在更嚴重的內皮血管病變。此外,在體外試驗中,筆者利用transwell小室構建HRGEC單層模型以模擬腎小球內皮屏障,以SLE腎損傷血漿刺激HRGEC,結果顯示,HRGEC單層的跨細胞電阻降低、熒光通透率增加,細胞間VE-cadherin表達減少,細胞間緊密連接破壞,提示SLE腎損傷患者HRGEC單層的通透性增加。
HMGB1是高遷移率族蛋白家族成員,具有25 kda的分子量和2個帶正電荷的核酸結合序列。細胞外的HMGB1作為一種損傷相關分子模式,會激活免疫系統并促進炎癥發生[11]。有研究報道,活動性LN的SLE患者血液及尿液中HMGB1水平較健康者明顯升高[12-13]。本研究結果顯示,血漿HMGB1在SLE患者中明顯升高。這提示,HMGB1可能在SLE腎損傷中發揮重要作用。HMGB1可以與TOLL樣受體2和4結合,誘導腎小球系膜細胞的增殖[14-15],沉默HMGB1基因可以減少過敏性紫癜患兒血管內皮細胞凋亡,改善血管的通透性[16-18]。HMGB1可能參與了SLE腎血管內皮的病理過程[19-20]。為進一步探討HMGB1在SLE腎損傷中對HRGEC單層通透性的影響,本研究應用HMGB1中和抗體預處理細胞,然后再給予SLE腎損傷血漿刺激,結果顯示,HMGB1中和抗體部分逆轉了HRGEC單層的跨膜電阻及熒光通透率,改善了細胞間VE-cadherin的表達。
綜上所述,SLE患者血清中HMGB1水平明顯升高,且存在腎損傷者更為明顯,HMGB1中和抗體能夠部分逆轉HRGEC單層的通透性,改善細胞間的緊密連接,HMGB1可能參與了SLE的HRGEC損傷。

