噬菌體在防控魚類細菌性病害中的作用機制及其應用
周方方,胡勝標,張友明,夏立秋
(淡水魚類發育生物學國家重點實驗室,微生物分子生物學湖南省重點實驗室,湖南師范大學生命科學學院,長沙 410081)
水產品可為人體提供豐富的營養物質,如優質蛋白質、脂肪酸、維生素等[1],能帶來顯著的營養成效,在人類飲食中不可或缺。聯合國糧食與農業組織(Food and Agriculture Organization of the United Nations,FAO)的數據顯示,水產品是世界上貿易量最大的食品種類之一,水產養殖產量占供人類消費的水生動物食品產量的56%[2],其中,魚類養殖是水產養殖的重要組成部分,提高魚類養殖產量及水產品質量對人類健康飲食具有重要意義。
隨著魚類養殖規模的不斷擴大及養殖模式的集約化,養殖密度的增大為條件性致病菌提供了有利的生存和繁殖條件,進而導致魚類細菌性疾病的暴發。引起魚類細菌性病害的病原菌主要有氣單胞菌(Aeromonas)、假單胞菌(Pseudomonas)、愛德華氏菌(Edwardsiella)、弧菌(Vibrio)等革蘭陰性菌,以及鏈球菌(Streptococcus)、乳球菌(Lactococus)等革蘭陽性菌[3]。常見的魚類細菌性疾病主要包括由嗜水氣單胞菌(Aeromonas hydrophila)及溫和氣單胞菌(Aeromonas sobria)等病原菌引起的敗血癥[4]、由柱狀黃桿菌(Flavobacterium columnare)等病原菌引起的細菌性爛鰓[5]和由腸型點狀氣單胞菌(Aeromonas punctta)等病原菌引起的細菌性腸炎[6]。抗生素作為水產養殖中防治細菌性病害的重要手段,主要通過飼料攝入等方式進入養殖生物體內發揮作用。但有研究表明,30%~90%的抗生素未被生物體吸收,而是殘留在水產環境中或通過生物廢物排放到養殖環境中[7],使得抗生素和耐藥基因在水體、沉積物中積累,這導致水產環境中耐藥菌的大量繁殖以及耐藥基因在微生物群落中的轉移[8-9]。Chen 等[10]在我國東南部13 個主要海水養殖場的水體和沉積物中發現了11 種抗生素化合物以及9 種耐藥基因。嗜水氣單胞菌是魚類細菌性病害的主要致病菌。Peng 等[11]在我國四川多個地區分離到64 株嗜水氣單胞菌,分離株對紅霉素、復方新諾明、磺胺呋唑、阿莫西林等常見抗生素的耐藥率高達60%~98%,其中15 株具有多耐藥性,并從分離株中鑒定出63 個耐藥基因。抗生素的濫用使得養殖場沉積物成為水生生物的耐藥基因庫,若養殖場的水體未經有效處理通過地球水循環流入海洋、地表水等,將會對人類的生活質量造成惡劣的影響[9]。
抗生素在魚類細菌性病害的防治中發揮了重要作用,但抗生素的濫用會帶來病原菌耐藥性增強增加防治難度、藥物殘留積累在水產品中危害人類健康、污染水體和破壞生態平衡等一系列問題[12-13]。因此,魚類養殖產業亟待尋求新方法,在保護生態環境的同時防治魚類細菌性病害,以提高魚類養殖產量和產品質量。噬菌體(Phage)作為一種天然、無殘留的細菌殺手,具有特異性強、裂解效率高等特點,因此,利用噬菌體防治魚類細菌性病害是一種重要的對環境友好的綠色防控技術,對魚類健康養殖和加快發展水產養殖業具有重要意義。
1 噬菌體及其作用機制
1.1 噬菌體裂解宿主細菌的類型
噬菌體是一種能夠特異性侵染、裂解細菌的病毒,廣泛地存在于自然界中,甚至在南極土壤、沙漠等極端環境中也有分布[14]。噬菌體主要由核酸和蛋白質構成,根據噬菌體的生長周期可將其分為烈性噬菌體和溫和噬菌體。烈性噬菌體的繁殖包括特異性吸附、侵入、核酸復制及蛋白質合成、噬菌體裝配、子代病毒釋放5 個階段。當子代噬菌體在宿主菌中裝配完成達到一定量時會裂解宿主細菌,同時,釋放的子代噬菌體可以繼續感染鄰近的宿主細菌,從而殺死細菌并抑制細菌的繁殖。溫和噬菌體侵入宿主細菌后,一般以其核酸插入到宿主的基因組中[15],并隨宿主基因一起復制,此時的噬菌體稱為前噬菌體,并不會引發宿主細菌的裂解,但當受到外部壓力刺激時,如紫外線和絲裂霉素[16]等,前噬菌體脫離基因組被誘導進入裂解周期。目前,利用噬菌體治療防控魚類細菌性病害更傾向使用烈性噬菌體,主要是為了避免溫和噬菌體基因組攜帶抗生素耐藥基因或毒力基因整合到細菌基因組中,從而導致宿主細菌的毒力增強[17]。
1.2 噬菌體的裂解機制
噬菌體的裂解系統主要有兩種,“穿孔素(holin)-內溶素(endolysin)”裂解系統和“針穿孔素(pinholin)-SAR內溶素”裂解系統,如圖1所示。噬菌體裂解宿主菌主要依賴于其侵染宿主菌后在宿主菌中表達的裂解蛋白,主要包括穿孔素、內溶素,一些革蘭陰性菌還需要穿膜蛋白(spanin)[18-19]。
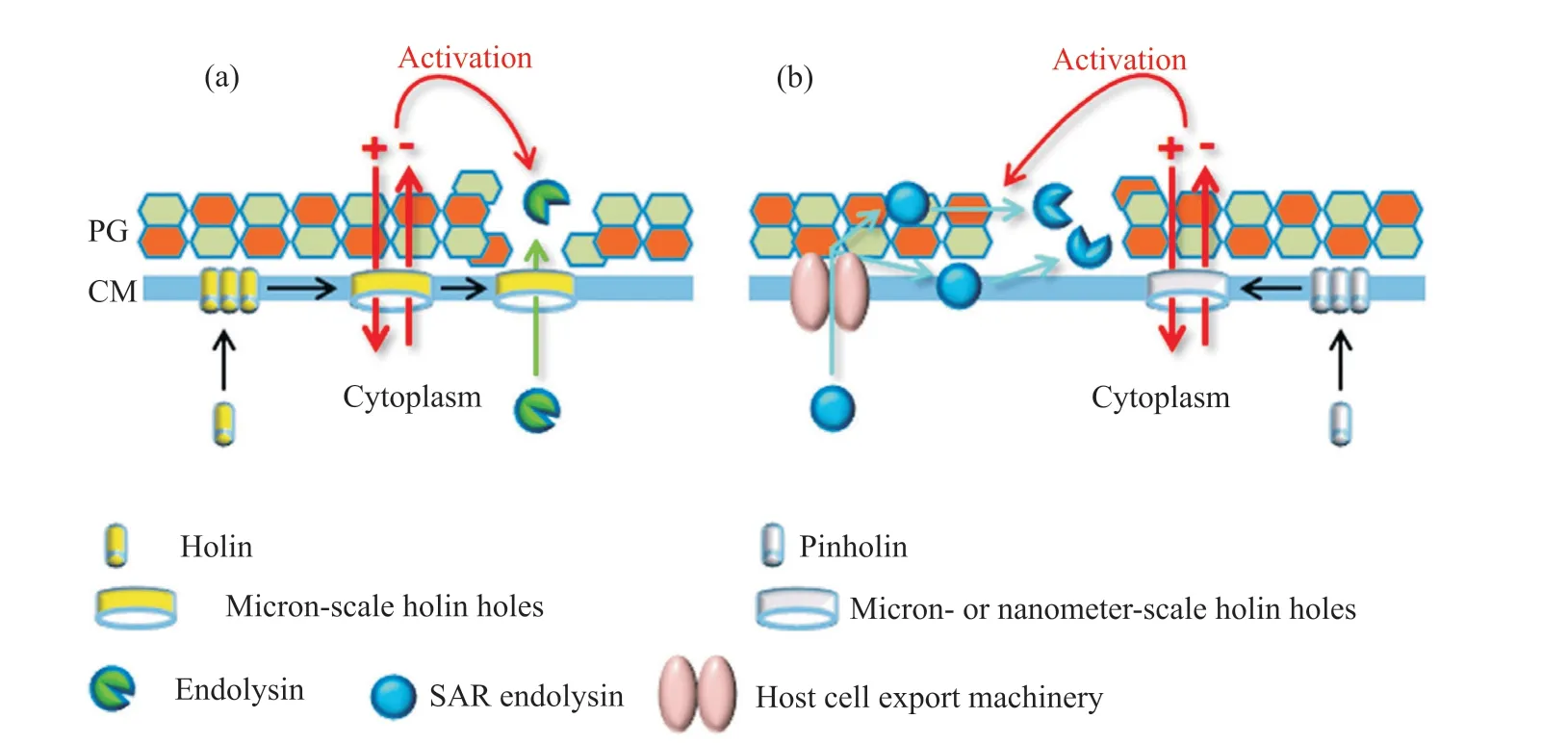
圖1 噬菌體裂解系統的主要特征[29]Fig.1 Key feature of phage lysis system[29]
穿孔素是一類能夠在細菌內膜上形成“孔”的較小的跨膜蛋白[20],根據其跨膜結構域(transmembrane domain,TMD)數量可分為3 類[21]:Ⅰ類含有3 個TMD,如λ 噬菌體的穿孔素;Ⅱ類含有2 個TMD,如P21 噬菌體的穿孔素;Ⅲ類含有1 個TMD,如T4 噬菌體的穿孔素。穿孔素在宿主菌內表達后會在內膜聚集,達到一定濃度后會在內膜上形成跨膜的管狀通道,使得內溶素通過管狀通道作用于外部的肽聚糖[22]。針穿孔素屬于穿孔素,在內膜上形成的通道更小、似針孔,可使內膜質子動勢上升,激活SAR內溶素[23]。
內溶素又稱裂解酶,是噬菌體在宿主菌中表達的一類細胞壁水解酶,主要有葡糖苷酶、酰胺酶、肽鏈內切酶和轉糖基酶。在噬菌體裂解后期,內溶素通過穿孔素形成的通道作用于肽聚糖,最后裂解細菌[24]。革蘭陽性菌的內溶素N 端通常含有酶活性結構域(enzymatically active domains,EAD)、C 端通常含有細胞壁結合結構域(cell walls binding domains,CBD),革蘭陰性菌內溶素通常只有一個EAD而不含CBD[25]。SAR 內溶素是一種胞壁酸酶,其N端含有一個介導酶的跨膜分泌的SAR 序列,可介導SAR 內溶素分泌至細胞周質,此時的SAR 內溶素無活性[26]。
穿膜蛋白能夠破壞革蘭陰性菌的外膜,由一個小的外膜脂蛋白和一個完整的細胞質膜蛋白組成,分別被稱為o-spanin 和i-spanin,跨膜蛋白破壞外膜的可能機制是催化內外膜的融合[27-28]。
1.3 噬菌體治療
早在20 世紀初期,噬菌體被Twort 發現能夠裂解細菌,D’Herelle 嘗試將噬菌體應用于臨床治療,并將噬菌體成功地用于治療4 例兒童細菌性痢疾[30]。但由于當時技術方法和基礎認知的限制,噬菌體治療并沒有被廣泛地接受和應用,直到青霉素的發現。20 世紀40 年代,抗生素被廣泛地應用于治療細菌性感染,并取得顯著成效,人們更是忽略了噬菌體治療[31]。抗生素在魚類養殖業中的大量使用導致魚類致病菌耐藥性增強、藥物殘留積累,這給人類的健康飲食帶來了巨大的隱患。2022 年,世界衛生組織首次全面評估了抗生素耐藥性給全球人類健康帶來的影響,耐藥性對發病率、死亡率和致殘率的影響至少與人類免疫缺陷病毒和瘧疾一樣大。因此,發現、設計和開發新的替代性抗菌療法并將其應用于魚類養殖至關重要,而最有希望的途徑之一是噬菌體療法[32]。
噬菌體治療主要包括單個噬菌體治療[33]、噬菌體雞尾酒治療[34]、噬菌體-抗生素協同治療[35]、噬菌體衍生的裂解酶治療[36]4 種手段。噬菌體治療在多個鄰域得到了實際應用,噬菌體有希望成為抗生素替代抗菌劑,特別是對于一些由耐藥性細菌引起的細菌性疾病。噬菌體對侵染的宿主細菌具有專一性,即只能侵染某一種或親緣關系較近的幾種細菌,具有一定的安全性。將噬菌體應用于魚類養殖防治魚類細菌性病害是一種對環境友好的綠色防治手段,這對提高水產品質量、保護養殖環境具有重要意義。
2 噬菌體治療在魚類細菌性病害中的研究現狀
2.1 魚類病原菌噬菌體的分離純化
現有魚類病原菌噬菌體的分離方法大同小異。以魚類病原菌作為指示菌,將其與取自魚塘[37]、養殖場污水排出口[38]、水產市場[39]、魚體腸道[40]等處的水樣用培養基共培養過夜后離心,上清液用0.22 μm 濾頭過濾除去菌體,將濾液滴在涂有指示菌的平板上,若出現透明的裂解區,則刮取其上的菌斑到含有相應指示菌的液體培養基中擴大培養;最后,通過雙層平板法分離、純化單個噬菌體,直至雙層板上的噬菌斑大小相近[41]。
2.2 應用
相比抗生素,噬菌體具有對宿主細菌特異性侵染、繁殖快、不易產生耐藥性等優點,在大型養殖業中用于防治細菌性病害具有顯著優勢。1981 年,Wu 等[42]分離到了嗜水氣單胞菌噬菌體AH1,并通過注射噬菌體到感染了嗜水氣單胞菌的泥鰍[Misgurnus anguillicaudatus(Gantor)]體內,結果表明,其具有較好的治療效果。現有研究表明,噬菌體用于防治魚類細菌性病害主要通過注射、侵浴、飼喂等給藥方式(表1)。
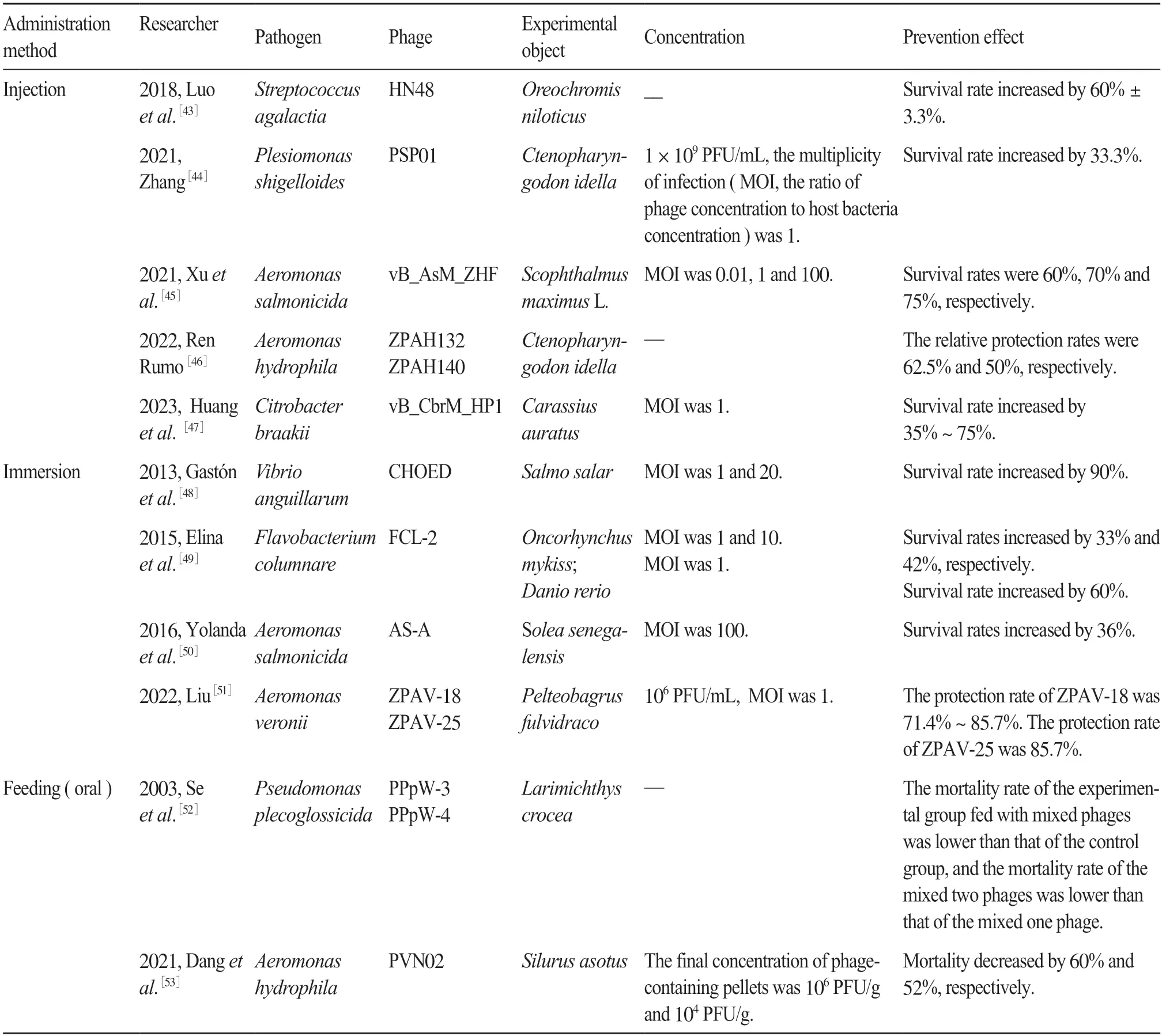
表1 噬菌體不同給藥方式在魚類細菌性病害防治中的應用Tab.1 Application of different phage administration methods in the prevention and treatment of bacterial diseases in fish
綜上所述,噬菌體對于魚類細菌性病害具有一定的防治效果,但噬菌體不同的給藥途徑、給藥濃度等因素會導致防治效果有一定的差異。因此,結合養殖條件、防治成本等實踐因素,研究噬菌體的最佳給藥途徑、給藥濃度對于噬菌體在魚類養殖中防治細菌性病害具有重要意義。在2021 年,崔惠敬[54]通過飼喂、注射和浸浴等給藥方式,研究了3 株噬菌體對由遲緩愛德華氏菌(Edwardsiella tarda)、哈維氏弧菌(Vibrio harveyi)引起的大菱鲆腹水癥的防治效果,發現腹腔注射和浸浴噬菌體的最佳時間是感染當天,MOI=100,大菱鲆的存活率分別為67%和60%;飼喂噬菌體對大菱鲆具有較好的保護效果,且相比于腹腔注射和浸浴,飼喂噬菌體能讓噬菌體在動物腸道存留時間更長。Kunttu等[55]通過浸浴和口服的給藥方式探究了3 種噬菌體FCOV-S1、FCOV-F2 和FCL-2 對感染柱狀黃桿菌虹鱒魚魚苗的預防和治療效果,發現在細菌感染之前和疾病癥狀出現時進行浸浴治療是預防虹鱒魚柱狀黃桿菌感染的最有效方法。
在魚類養殖中大范圍地應用噬菌體還需要考慮養殖環境對噬菌體治療效果的影響、噬菌體在魚體內的安全性、合理的給藥方式等因素。Silva等[56]通過研究表明,噬菌體的治療效果主要受鹽度和有機質含量的影響,即噬菌體治療的有效性在一定范圍內隨著水鹽含量的增加而增加。因此,在魚類養殖中,可以在不影響魚類生長的條件下通過添加鹽來提高噬菌體治療的成功率。Chamilani 等[57]通過實時熒光定量PCR(quantitative real-time PCR,qRTPCR)檢測了浸浴于遲緩愛德華氏菌噬菌體ETP-1的斑馬魚中IL-β、TNF-α、IL-6、和IL-10 等相關炎癥因子mRNA 的表達量,發現其與未浸浴噬菌體的對照組相似。Christiansen 等[58]和Madsen 等[59]量化了虹鱒魚魚苗經腹腔注射后嗜冷黃桿菌(Flavobacterium psychrophilum)噬菌體和宿主細菌在魚體內的擴散。在注射后的第10 天仍然能從魚的器官中分離出噬菌體和細菌,與只注射噬菌體相比,細菌和噬菌體同時注射能使噬菌體在魚的器官中停留時間更長。噬菌體和細菌在腎臟和脾臟的發生率最高,在腦部的發生率較低。試驗表明,注射的噬菌體在沒有細菌的情況下也能在魚的內臟中迅速擴散。由此可見,噬菌體在魚體內應用具有一定的安全性。
水產養殖在實際應用噬菌體的過程中,為了確保噬菌體防治魚類細菌性病害效果的最大化,在進行噬菌體治療之前,要針對不同的養殖魚和相應的病原菌及其噬菌體,研究出噬菌體的最佳給藥濃度、給藥方式以及噬菌體在魚體內的安全性等條件。
3 總結與展望
水產品在人類飲食中占有重要地位,魚類養殖是水產養殖的重要組成部分,而細菌性病害是影響魚類養殖產量、質量的重要威脅之一。抗生素作為魚類養殖中防治細菌性病害的主要手段,不合理的使用會造成耐藥菌的大量繁殖,從而大大增加防治難度。噬菌體是重要的抗生素潛在替代劑,相比于抗生素等有殘留化學藥物,噬菌體在宿主細菌的存在下能夠自我復制進行繁殖,在大自然中大量存在,對宿主細菌具有特異性,這些優勢使得噬菌體治療在這個抗生素濫用的時代逐漸被重視。噬菌體治療作為一種對環境友好的綠色防治技術在魚類養殖細菌性病害的防治中具有重要意義。
噬菌體廣泛地存在于自然界中。取水樣或土樣,與相應病原菌共培養富集、雙層平板法檢測和純化可得到單個噬菌體。噬菌體侵染宿主細菌后,利用宿主物質和能量表達穿孔素和內溶素。穿孔素在細胞膜聚集達到一定濃度后形成管狀通道,內溶素通過該通道作用于肽聚糖,一些革蘭陰性菌還需要穿膜蛋白作用于外膜,最后裂解宿主細菌,釋放的子代噬菌體還可以繼續侵染周圍的宿主細菌。在魚類養殖中實際應用噬菌體防治常見的魚類致病菌時,研究人員參考噬菌體的最佳MOI 探究給藥濃度,常使用的給藥方式有注射、浸浴和飼喂(口服),通過qRT-PCR檢測噬菌體進入魚體后相關炎癥因子的表達量、魚內臟組織病理切片蘇木精-伊紅(hematoxylin-eosin,HE)染色觀察[44]等方法探究噬菌體在魚體內應用的安全性。
隨著噬菌體對宿主細菌侵染時間的延長,宿主細菌會逐漸對噬菌體產生抗性,抗性菌的生存繁殖給噬菌體帶來一定的阻礙。因此,研究人員基于單個噬菌體治療研究出了噬菌體雞尾酒、噬菌體裂解酶、工程噬菌體等技術,彌補了這一不足。
噬菌體雞尾酒即將某一種或一類病原菌的2 種或多種噬菌體混合,用于治療相應細菌性病害,并且在一定程度上可以延緩抗性菌的產生和繁殖[60-61]。Se 等[52]發現,使用2 種噬菌體對感染香魚假單胞菌大黃魚的治療效果優于只使用1 種噬菌體的治療效果。
革蘭陽性菌細胞壁缺乏外膜,內溶素可以從外部作用接觸肽聚糖裂解細菌[62]。革蘭陰性菌細胞壁外側的外膜阻礙了內溶素直接從外部作用肽聚糖,降低抑菌效果[63]。對內溶素進行改造可以提高內溶素的活性、擴寬裂菌譜、提高溶解度等[64]。Son 等[65]將蠟樣芽孢桿菌(Bacillus cereus)噬菌體內溶素LysB4 與金黃色葡萄球(Staphylococcus aureus)菌噬菌體內溶素LysSA11 融合在一起,既可以裂解蠟樣芽孢桿菌,又可以裂解金黃色葡萄球菌。研究人員通過添加乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、有機弱酸等可以增強內溶素穿透革蘭陰性菌外膜的能力。Jiang 等[66]將沙門氏菌(Salmonella)噬菌體SLMP1的內溶素與5 mmol/L EDTA 搭配使用,發現其能夠裂解多種革蘭陰性菌和革蘭陽性菌。相較于抗生素,噬菌體裂解酶具有不易使細菌產生耐藥性、在環境中易降解、裂解范圍較廣等優點,在魚類養殖中對于防治細菌性病害具有很大的潛力,但體內應用噬菌體裂解酶還需要考慮裂解酶的安全性、包埋方法等因素[67-68]。
噬菌體治療在防治魚類細菌性病害的應用中,主要是通過注射、浸浴或飼喂(口服)一種噬菌體或噬菌體雞尾酒。隨著基因組測序技術、生物信息學、多組學的發展,研究人員對噬菌體結構、裂解機制有了進一步了解,噬菌體裂解酶[35,69]、工程噬菌體[70-72]等也逐漸被研究并應用于實踐中。噬菌體裂解酶相較于噬菌體裂解細菌的范圍更廣,是一種潛在的抗菌劑。對于革蘭陰性菌的外膜,還可以通過在噬菌體裂解酶的N 端添加穿膜肽(membrane-permeable peptide)[73-74]、抗菌肽(antibacterial peptide)[75-76]等多肽以協助裂解酶穿過外膜,增強其抗菌效果。在噬菌體基因組上通過基因編輯使其上攜帶編碼抗菌物質的基因,當噬菌體侵入宿主病原菌中時,可在宿主細菌中編碼一些抗菌物質,如酸溶性孢子蛋白(small acid-soluble spore protein,SASP)[70]、細菌素(bacteriocin)[71]等,增強噬菌體的裂解效果并延緩噬菌體抗性的產生。噬菌體裂解酶和工程噬菌體實際應用于防治魚類細菌性病害的相關研究報道不多,但具有一定的潛力。相信未來噬菌體治療在防控魚類細菌性病害的應用會給魚類養殖產業帶來光明的前景。

