從市場抽驗角度探討中藥配方顆粒質量標準相關問題
王 趙,金紅宇,馬雙成
中國食品藥品檢定研究院,北京 102629
中藥配方顆粒是由單味中藥飲片經水提、分離、濃縮、干燥、制粒而成的顆粒,在中醫藥理論指導下,按照中醫臨床處方調配后,供患者沖服使用。其質量監管納入中藥飲片管理范疇[1]。因其具有使用方便、快速,便于儲存運輸,更適應現代化生活節奏,且保持一定中醫特色,便于隨癥加減,有利于實現中藥的標準化等優點,中藥配方顆粒在突發的新型冠狀病毒感染防疫、抗疫應急過程中,發揮了中流砥柱的作用,發展前景廣闊[2]。其在我國主要經歷了3 個發展時期[3]:第1 個時期為研究起步階段,從1992 年中藥配方顆粒正式立項到2001 年首批中藥配方顆粒試點生產企業建立,歷經9 年時間;第2 個時期為市場試點期,為2001—2021 年,主要特點是只允許6 家國家級試點企業及部分省級試點企業生產銷售中藥配方顆粒,歷經20 年;第3個時期為中藥配方顆粒后試點期,也被稱為“中藥配方顆粒快速或全面發展期”,從2021 年2 月1 日國家藥品監督管理局、國家中醫藥管理局、國家衛生健康委員會、國家醫療保障局等聯合發布《關于結束中藥配方顆粒試點工作的公告》[1](簡稱《公告》)至今,中藥配方顆粒行業全面放開,面向更多的企業和醫院。然而,現階段中藥配方顆粒仍面臨不少未解決的問題,如煎煮過程不可改變,無法兼顧“諸藥共煎”的優勢;失去了明顯外形特征,不易通過性狀識別區分,易摻偽;不少品種不適宜制成中藥配方顆粒[4],小劑量處方不方便調配,導致無法實現中藥的全面配伍;而且,迄今為止,其質量標準仍然有待完善。
“國家藥品評價性抽檢項目”(簡稱“國抽項目”)是一項由國家藥品監督管理局組織、各藥檢機構承擔實施的,對上市后藥品進行全面質量評價,以促進藥品質量提升,保障人民用藥安全的重要舉措,為標準完善及藥品監管提供了有力支持。為配合中藥配方顆粒的標準制定,2018 年至今,中國食品藥品檢定研究院及各級藥監部門在國家藥品監督管理局領導下積極參與中藥配方顆粒的抽檢工作。本文從市場抽驗角度探討中藥配方顆粒質量標準的相關問題。
1 中藥配方顆粒標準制定情況
中藥配方顆粒的標準制定過程主要分為3 個歷史階段[5]:第1 階段是2001 年1 月5 日國家藥品監督管理局頒布《中藥配方顆粒管理暫行規定》(附《中藥配方顆粒質量標準研究的技術要求》簡稱“技術要求”)[6],開啟了以企業為主體的自發研究階段,主要以6 家國家級試點企業為主,其監管主體并不明晰。第2 階段是自2012 年8 月起,國家藥典委員會開始嘗試探索6 家企業標準的統一工作,在其組織下,以藥檢機構為主體,共對12 個中藥配方顆粒標準進行了研究。直到2016 年8 月,在前期研究的基礎上,國家藥典委員會發布了《中藥配方顆粒質量控制與標準制定技術要求(征求意見稿)》[7],標志著中藥配方顆粒標準制定工作進入了第3 階段,在“技術要求”中國家藥典委員會明確開創了以企業為標準起草主體,各藥檢機構負責標準復核,然后經過專家審評,制定標準的新模式。截至2022 年10 月,已頒布中藥配方顆粒國家標準有200 個[8-10]。根據《公告》要求,國家標準沒有規定的品種,應制訂中藥配方顆粒省級標準,否則不能上市。據不完全統計,目前各地已頒布的省級標準有6000 多個。另外,配套的還有5 個管理要求。中藥配方顆粒標準制定情況見表1~3。
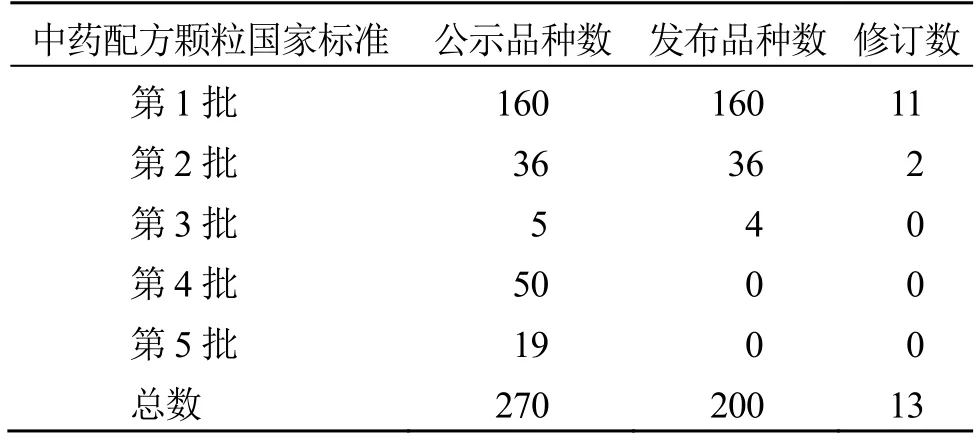
表1 中藥配方顆粒國家標準數量統計 (2022 年10 月前)Table 1 Statistics of national standards of TCM formula granules (before October 2022)

表2 中藥配方顆粒管理要求統計 (2022 年10 月前)Table 2 Statistics of management requirements of TCM formula granules (before October 2022)
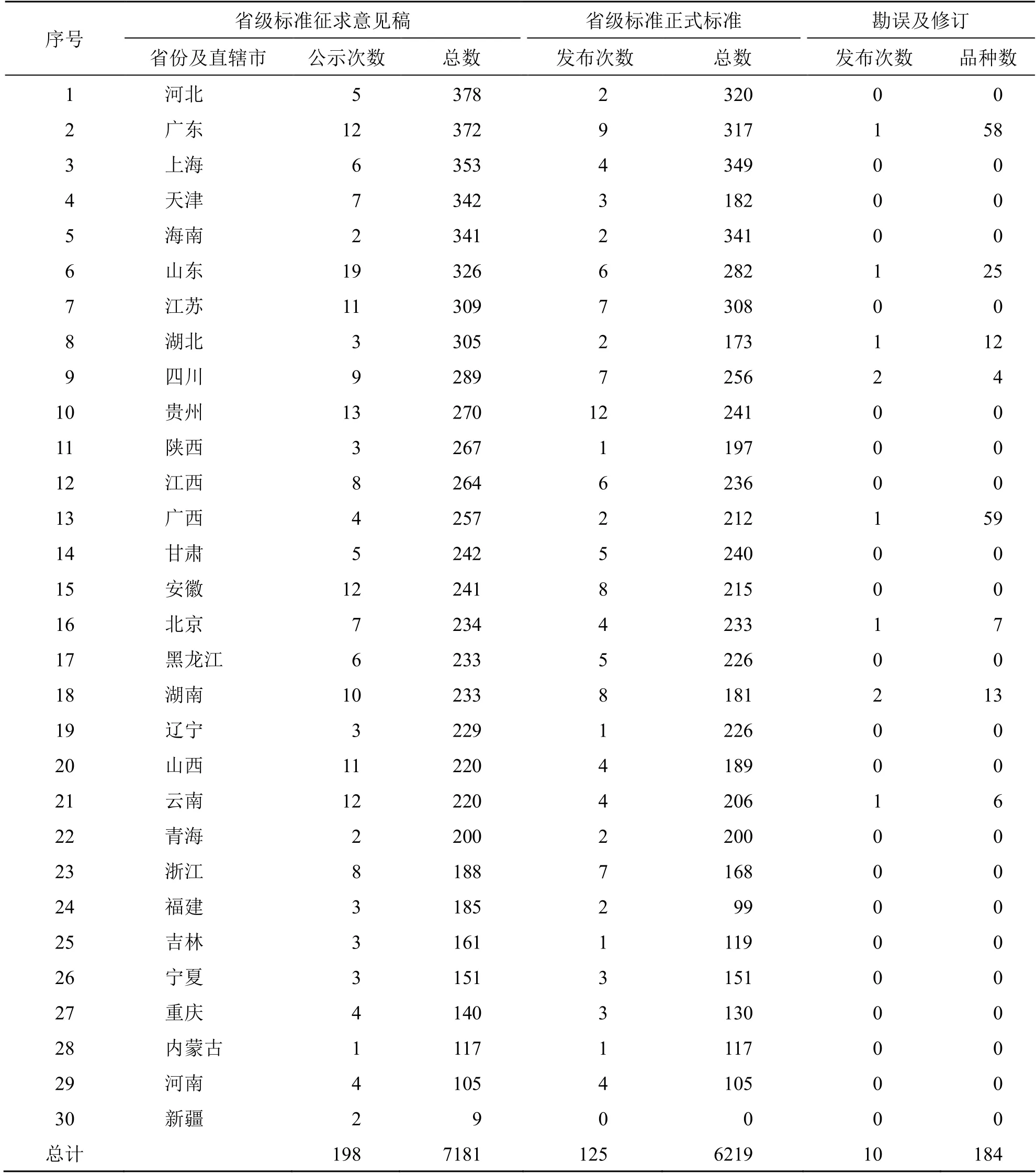
表3 30 個地區頒布實施中藥配方顆粒省級標準的數量統計 (2022 年10 月前)Table 3 Statistics of provincial standards of TCM formula granules issued and implemented in 30 regions (before October 2022)
在2018 年的“國抽項目”中,中國食品藥品檢定研究院對金銀花配方顆粒、大黃配方顆粒2 個品種進行了全面質量考察。彼時中藥配方顆粒處于試點時期,尚無統一的國家標準,執行的是各自的企業標準。通過抽檢,發現除去某些企業標準制定的不規范、不合理問題以外,中藥配方顆粒最為突出的4 個問題是:當量規格不統一;不同企業樣品含量差異大;各企業中藥配方顆粒所含化學成分、各成分的含量以及相對比例都有一定的差異;且未對不同基原大黃配方顆粒進行區分[15-17]。針對這些問題,現行相關標準已做出完善,如已頒布的國家標準品種都依據《技術要求》,按“制成量”(實際原料藥材投料量與制成總量的比值)統一了產品規格;突出水煎煮傳統工藝,通過對標準湯劑研究,規定出膏率范圍、轉移率以及含量上下限,縮小產品差異;并采用特征圖譜或指紋圖譜等檢驗項目,保障相對的“全成分”檢驗,避免摻偽;還要求對藥材基原進行相關研究,明確原料藥材單一基原、藥用部位等。
2 各級部門抽檢及調研反饋情況
為進一步了解中藥配方顆粒進入后試點時期,對國家標準和新省級標準的適應情況及質量控制現狀,在2022 年“國抽項目”飲片項目下組織了相應中藥配方顆粒的抽檢工作,包括菊花配方顆粒、金銀花配方顆粒和川牛膝配方顆粒3 個品種。據了解,抽檢合格率為100%。但對菊花配方顆粒的抽檢以及相關調查研究中,發現中藥配方顆粒質量標準仍存在部分問題。
2.1 抽樣情況
中藥配方顆粒按照備案制管理,經檢索國家藥品監督管理局網站,截至2022 年10 月,菊花配方顆粒備案的企業有40 家,但本次共抽檢到菊花配方顆粒7 批,只占全國備案企業總數的4.4%。且其中2 批為統一標準前生產,執行企業標準。僅有5批執行國家標準,涉及3 家企業。據悉,本次共抽川牛膝配方顆粒4 批,2 批執行國家標準;共抽到金銀花配方顆粒7 批,5 批執行國家標準。
總體抽樣量偏低,原因可能為現階段正處于新舊標準切換的交匯期,部分企業雖然有備案但并沒有生產相關產品。另外,本次抽驗原則上為2021 年11 月之后生產執行國家標準的中藥配方顆粒樣品,時間較短,符合要求的在售產品較少。值得關注是部分企業或醫療機構可能存在趕在國家標準實施前大量生產或囤積產品的問題,有可能造成相關品種未來出現“斷檔期”的情況,需要警惕。
2.2 性狀項
菊花配方顆粒標準性狀項規定“本品為棕色至棕褐色的顆粒;氣清香,味甘、微苦”。從圖1 可以看出6 批菊花配方顆粒樣品顏色仍有一定跨度,不同企業,以及同一企業不同批次的樣品顏色仍有差異。建議在其他項目研究充分確保質量安全的前提下,適度調整相關標準規定以涵蓋各廠家樣品的顏色范圍。

圖1 6 批菊花配方顆粒的顏色和性狀Fig.1 Colors and characters of six batches of Chrysanthemi Flos formula granules
2.3 特征圖譜項
《中國藥典》2020 年版菊花項下,按產地和加工方法不同,將其分為亳菊、游菊、貢菊、杭菊、懷菊5 類,并對5 類菊花性狀進行詳細描述。據文獻報道,5 類菊花所含化學成分存在一定差異[18-20]。但因為這5 類菊花屬于同一基原,目前技術手段難以準確區分,因此菊花配方顆粒并未區分這5 類菊花。在菊花配方顆粒國家標準特征圖譜項下規定了11 個特征峰,對照特征圖譜見圖2,其中峰1、3~5、8 分離度不是很佳。在檢驗過程中,主要發現了2 個問題:(1)中國食品藥品檢定研究院目前在售的2 批菊花對照藥材(批號121384-201504、121384-201805)中,有1 批(批號121384-201805)10 號蒙花苷色譜峰缺失,不能完全符合標準中規定的對照圖譜(圖3)。檢驗過程中只能使用舊批號(批號121384-201504)菊花對照藥材。(2)由于不同企業所用菊花產地不同,其所生產菊花配方顆粒色譜峰的比例和個數均有差異,在11 個特征峰分離度不佳的情況下,即使固定色譜柱,也較難判定相關色譜峰(圖4)。
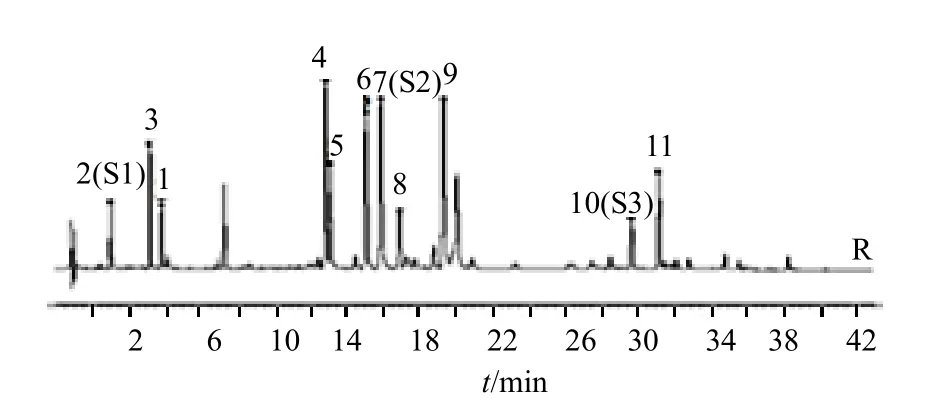
圖2 菊花配方顆粒國家標準項下所附對照特征圖譜Fig.2 Control characteristic chromatogram of Chrysanthemi Flos formula granules attached by national drug standards
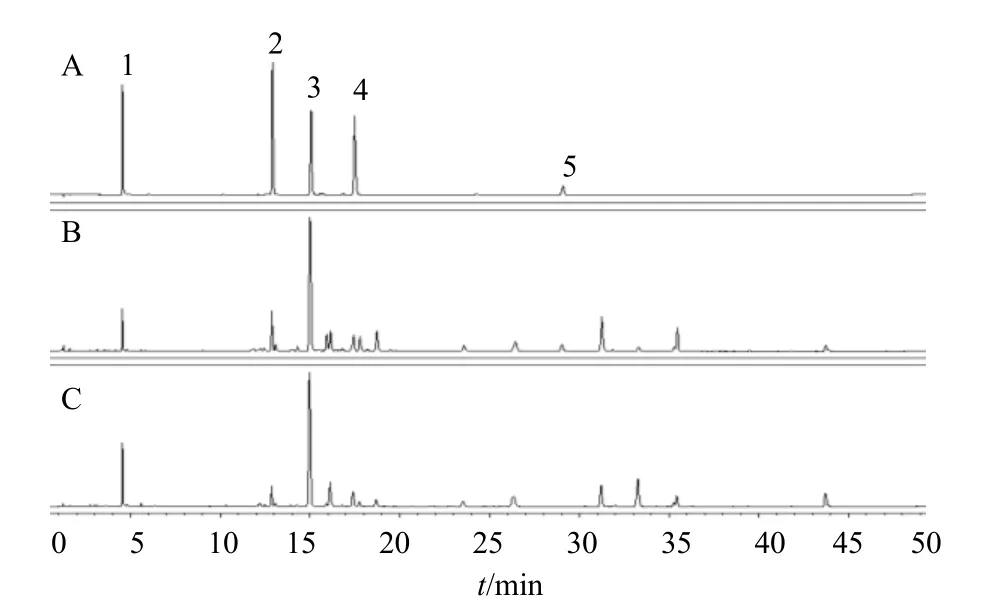
圖3 混合對照品及菊花對照藥材特征圖譜Fig.3 Characteristic chromatograms of mixed reference substance and Chrysanthemi Flos references

圖4 4 批不同企業生產菊花配方顆粒特征圖譜Fig.4 Characteristic chromatograms of four batches of Chrysanthemi Flos formula granules produced by different enterprises
綜上,菊花配方顆粒特征圖譜指標成分的專屬性不足,無法體現5 類菊花的共有特征,其色譜條件也有待進一步改進。
經調研及文獻分析,部分品種國家標準或省級標準指紋圖譜或特征圖譜問題也比較突出,如企業反饋部分標準使用固定的特殊儀器或色譜柱,像玉竹配方顆粒和青葙子配方顆粒的某些省級標準用到超高液相電霧式檢測器并固定特殊色譜柱,利用率低,成本高,增加了生產企業和日常檢驗的經濟負擔,不具可及性。部分品種在不同色譜柱和儀器條件下,某些特征峰不宜辨識;部分藥材煎煮后一些峰不穩定,方法的重現性差,標準執行困難等。
2.4 溶化性檢查項
溶化性檢測過程中發現,目前中藥配方顆粒溶化性檢查取樣量不甚明確。中藥配方顆粒國家標準【檢查】項下均規定:“應符合顆粒劑項下有關的各項規定(《中國藥典》2020 年版通則0104)”。根據通則顆粒劑項下要求,其溶化性檢查法取樣量為10 g或單劑量包裝1 袋[21]。其中單劑量包裝定義為1 次服用的包裝劑量,但中藥配方顆粒小包裝使用依具體處方而定,使用范圍較為寬泛,其是否滿足單劑量包裝要求暫不明確。實際檢驗中的合規性有待討論。對于大包裝(自動調配機用罐裝等包裝方式)的中藥配方顆粒,按10 g 進行取樣的合理性也應加以討論。建議參考《中國藥典》2020 年版中對應飲片項下的用量進行規格折算后取樣。
《中國藥典》2020 年版一部菊花項下用法與用量為9~18 g,菊花配方顆粒【規格】為“每1 克配方顆粒相當于飲片3.5 g”,按中間用量折算,應取菊花配方顆粒4 g,取樣量調整見表4。
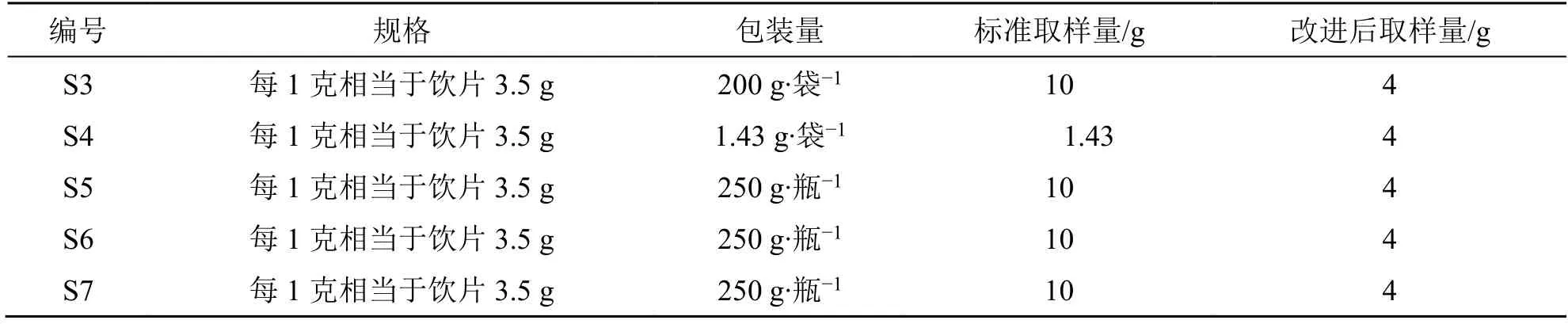
表4 菊花配方顆粒溶化性檢查取樣量調整Table 4 Adjustment of sampling amount for solubility test of Chrysanthemi Flos formula granules
“取菊花配方顆粒4 g,加熱水200 mL,攪拌5 min,立即觀察”,結果顯示不同產品的溶化速度和溶化程度不同,結合性狀項顯示不同產品的顏色和顆粒硬度不同分析原因可能為其添加了不同輔料。目前,國家標準以按照輔料“最少化原則”,限制了輔料的添加量,但是并未對添加輔料種類做出規定。在對部分品種的標準復核工作中,筆者發現標準湯劑與其成終產品會有差異,原因可能為所添加輔料造成。不同輔料的添加會造成溶出、吸收等的不同,是否需要對不同中藥配方顆粒所用輔料進行固定,也有待討論。
2.5 含量測定和浸出物項
菊花配方顆粒國家標準規定“每1 克含綠原酸(C16H18O9)應為 3.0~8.0 mg,含木犀草苷(C21H20O11)應為4.0~13.0 mg,含3,5-O-二咖啡酰基奎寧酸(C25H24O12)應為5.0~19.0 mg”。浸出物項規定“質量分數不得少于30.0%”。檢驗樣品編號為S3~S7,結果見表5,樣品合格率為100%,但3家企業樣品的測定結果具有一定的差異,其中浸出物以及木犀草苷含量差異較大,可能為不同企業所用菊花原料及生產工藝差異所導致。
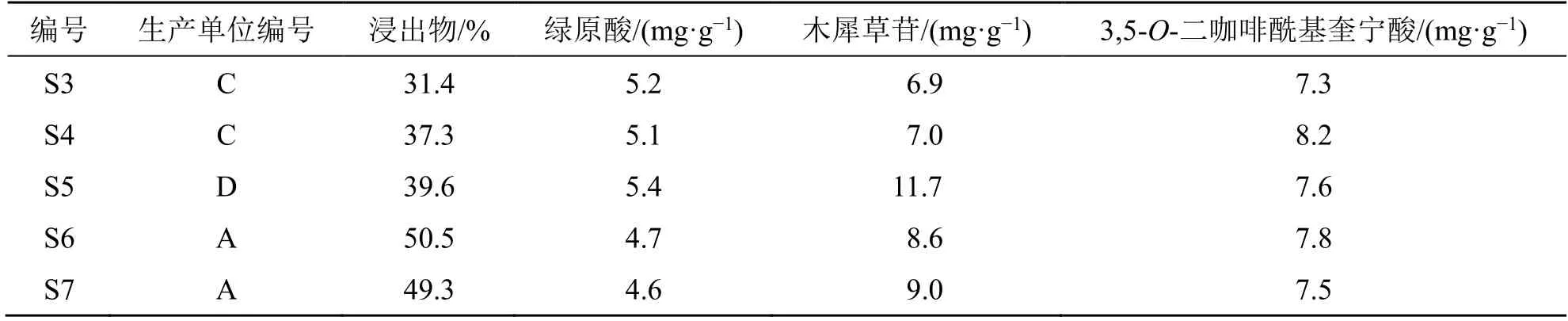
表5 5 批菊花配方顆粒浸出物及主要成分含量結果Table 5 Content results of extract and main constituents of five batches of Chrysanthemi Flos formula granules
中藥配方顆粒國家標準制定最突出的特點就是按照標準湯劑的實際情況對其含量進行了“區間化”(規定上下限)管理,對中藥配方顆粒質量保持穩定有重要意義。部分省級標準也按照相關技術要求制定標準,但是由于中藥個體化差異大等本身的原因,以及原料藥材或飲片處理方法、生產工藝、企業內部管理等環節差異,各企業申報范圍不同,以致同一品種不同省級標準出現不同限度,或部分品種的含量限度范圍制定過大。這就失去了中藥配方顆粒“標準化”“統一化”的意義。導致所生產產品質量依舊參差不齊,給臨床配伍造成困難。
此外,部分企業反饋某些中藥配方顆粒含量檢測指標制定并不合理,存在對原料飲片入藥標準和中藥配方顆粒含量檢測指標數量要求過高,導致生產成本加大的情況[22],或含量檢測指標不具專屬性、太過單一等問題[23-24]。另外,針對添加揮發油卻不制定揮發成分檢測指標的品種[25],可能存在由于揮發油中多類成分比例不同,造成添加成分與標準湯劑所含揮發油成分不同等問題。
2.6 安全性相關問題
在抽驗探索性研究方面,首先,對7 批菊花配方顆粒中的244 種農藥進行了篩查測定,結果見表6。7 批樣品都有農藥殘留檢出,包括禁用和常用農藥共11 種,但均處于痕量水平,對于《中國藥典》2020 年版“0212 藥材和飲片檢定通則”項下規定的33 種禁用農藥均未出現超標現象,遠低于菊花藥材中檢出的農藥殘留。表明菊花配方顆粒由農藥殘留引起的安全風險較低。提示菊花配方顆粒與菊花藥材的農藥殘留標準可區別對待。其次,建立了輻照篩查方法,對7 批菊花配方顆粒進行篩查,結果7批配方顆粒均為陰性,表明菊花配方顆粒由輻照殺菌帶來的安全風險較低。此外,本課題組在2018 年也對20 多批金銀花配方顆粒、18 批大黃配方顆粒進行了微生物檢測、輻照篩查、農藥多殘留檢測[26]、重金檢查等多項安全性探索研究,均發現中藥配方顆粒經過水煎提濃縮制粒后,安全性風險較低。原因可能為中藥配方顆粒生產工藝要經過水煮,高溫可殺菌,微生物超標風險降低,輻照殺菌的可能性減小,且經過水煎煮,大部分農藥轉移率較低或發生降解。但是部分中藥配方顆粒品種中有害殘留物可能會隨水煎液轉移富集。如燙水蛭(螞蟥)配方顆粒申報材料中顯示,其標準湯劑中砷的含量為同批次飲片含量的2.8~12.5 倍,按出膏率折算后砷含量基本全部轉移[24]。
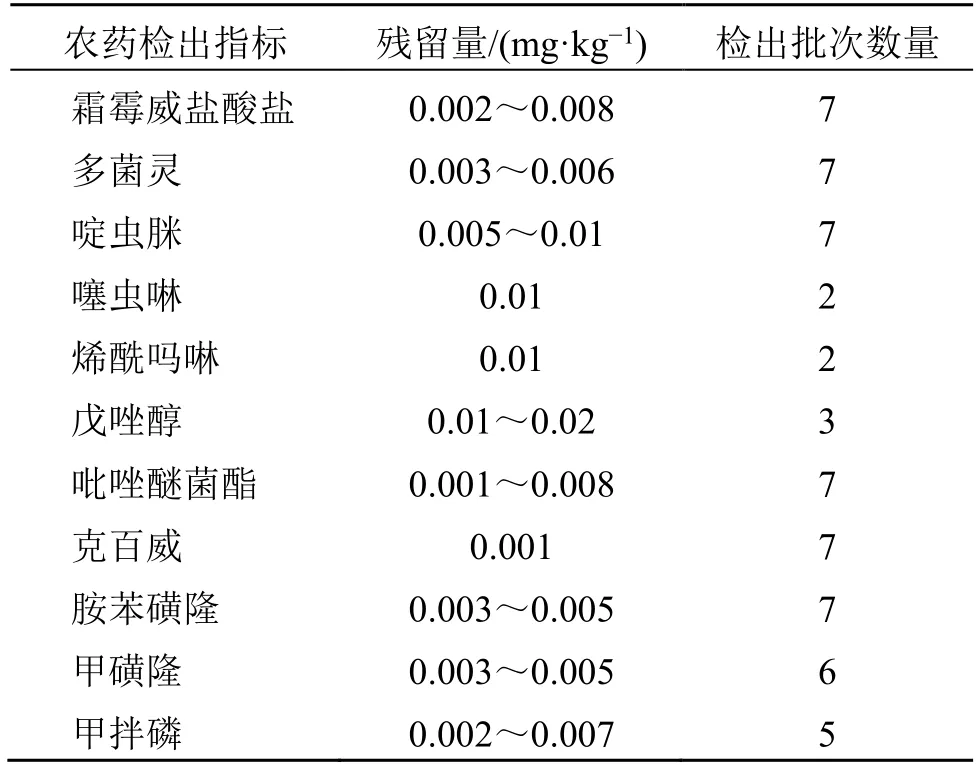
表6 7 批菊花配方顆粒農藥多殘留檢測結果Table 6 Results of pesticide residue detection of seven batches of Chrysanthemi Flos formula granules
目前,按照《公告》相關要求,中藥配方顆粒外源性有害殘留等同飲片法定標準執行。而且《技術要求》規定,中藥配方顆粒均應進行有毒有害物的檢查研究,經考察無特殊風險品種一般沿用飲片的安全性檢查項目及限度規定。為了從外源性有害殘留物上保障用藥安全,部分省級標準在【檢查】項中對不少品種都增加了黃曲霉毒素、重金屬及有害元素等外源性有害殘留物的測定[18]。這些措施確實有利于保證臨床用藥安全,但同時也會增加質量控制成本。是否有必要完全按照或嚴于飲片檢查項目及限度制定中配方顆粒標準,有待討論。
2.7 其他問題
2.7.1 標準制定問題 現階段,對于沒有國家標準的中藥配方顆粒,需要按照“屬地化”管理原則,執行各省頒布的省級標準。調研過程中,部分生產企業反映,一部分品種各省標準差異較大,同一品種在不同省級標準中可能出現性狀、出膏率范圍、生產規格、特征圖譜方法、有效成分含量測定指標及含量限度范圍不一致等現象(表7),導致出現同品種多標準的混亂局面,稱其為“一品多標”[22]。可能造成市場上中藥配方顆粒質量依然參差不齊,臨床使用也得不到有效保障。而且也有一部分省級標準很快又被國家標準取代。不利于生產企業規模化生產,造成大量人力物力浪費。
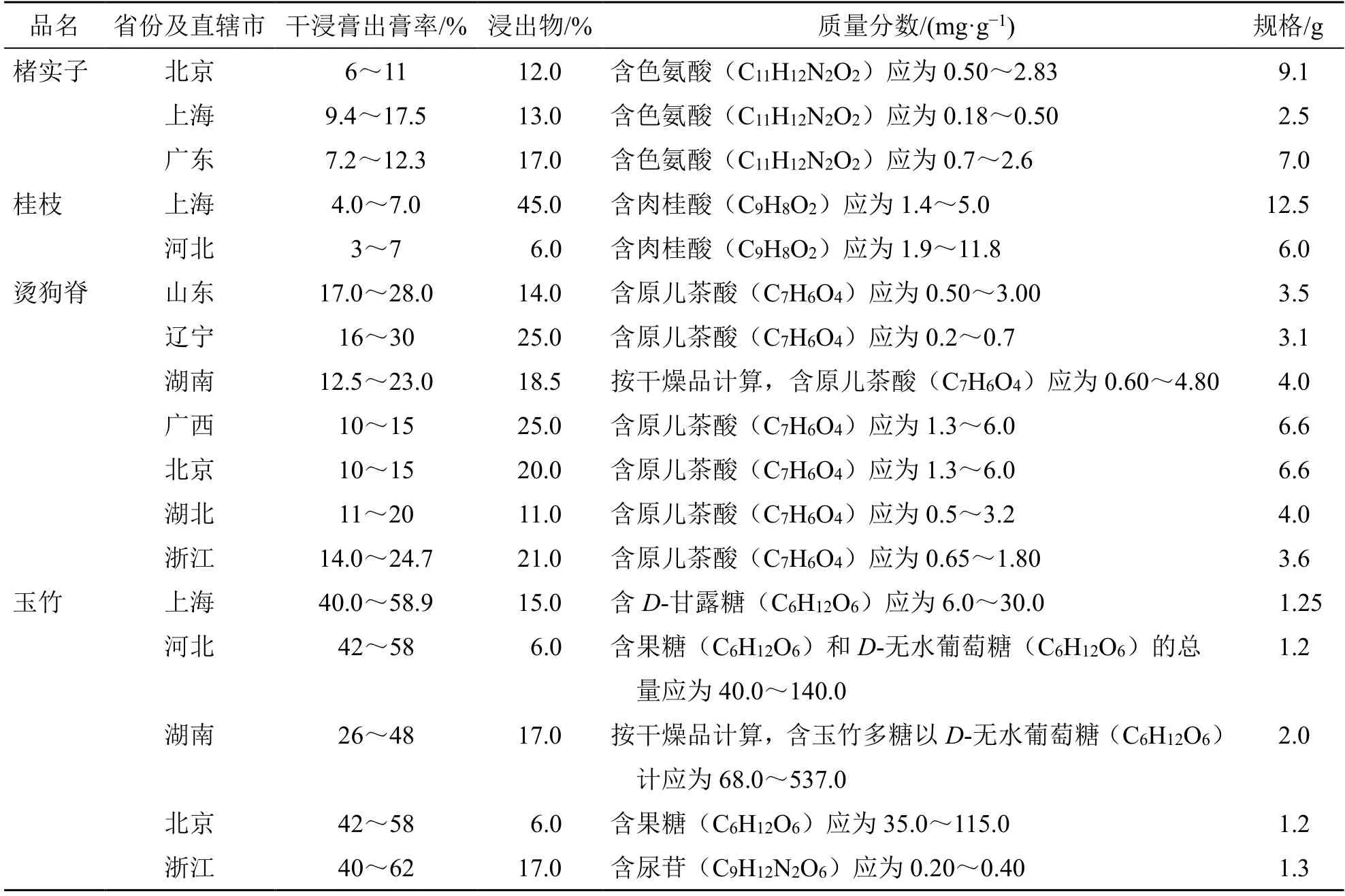
表7 中藥配方顆粒“一品多標”的標準實例Table 7 Examples of TCM formula granules varieties supervised by a number of different standards
醫療機構也反映,目前中藥配方顆粒國家標準、省級標準公布及備案品種不足,無動物、礦物類標準,且中藥配方顆粒正處在國家標準和省級標準產品的匹配應用,以及執行舊標準和新標準的產品切換使用的磨合期。品種不足、規格變換和質量差異給處方調配帶來一定挑戰。影響到中藥配方顆粒的臨床使用以及患者的就醫體驗[27-29]。
2.7.2 對照物質問題 中藥配方顆粒調研過程中企業普遍反映對照物質缺乏問題,主要體現為2 個方面:(1)因為配方顆粒標準項下大都設立了特征圖譜項,使得所用標準物質數目激增,甚至用到不少尚未發行的法定標準物質,而第三方價格較貴,部分品種示例見表8,生產企業反映增加了日常檢驗成本。(2)因為中藥配方顆粒為單味飲片加工而成,所以最為合適的對照物質應該是由相應飲片制備的對照藥材(為區別方便暫稱為“對照飲片”)而不是現行發放的藥材類對照物質。但是因為飲片要經過炮制等一系列過程影響因素復雜,制備技術困難,因此目前官方并未發布相關“對照飲片”。但是在麩炒蒼術(北蒼術)配方顆粒和燀桃仁(桃)配方顆粒的國家標準特征圖譜項下,分別使用了麩炒蒼術(北蒼術)對照藥材和燀桃仁對照飲片。因此造成缺乏“對照飲片”的問題。

表8 部分缺乏法定對照物質的中藥配方顆粒品種示例Table 8 Examples of TCM formula granules varieties lacking legal reference substances
3 監管及發展建議
3.1 加快國家標準制定進度
針對臨床處方品種缺失、國家標準數量少、備案品種不足等問題,從根本上還是要加快國家標準的制定進度。目前,國家標準的品種制定是由企業的申報決定的,可能會受經濟利益驅使,帶有一定的盲目性。張伯禮院士在全國人民代表大會上提到希望在品種上優先考慮臨床使用頻率高、使用量大的常用品種。故建議國家局統籌考慮,發揮藥品監管的專業性和權威性,以及相關行業協會的積極溝通協調作用,鼓勵企業間建立生產、技術聯盟,整合現有資源,注重尚未滿足的臨床需求,引導其優先臨床需求品種,加快中藥配方顆粒國家標準的研究與發布。
另外,不可否認,省級標準在一定程度上彌補了國家標準的空白,為各省中藥配方顆粒的生產、檢驗、使用和監督管理提供了強有力的技術支撐。對于現存多省級標準的品種,推行標準互認是一條經濟有效的途徑。建議各省級標準盡快達成共識,加快互認,推動省級標準升為國家標準,完善中藥配方顆粒的國家標準[22]。對于尚在標準制定過程中的品種,建議在中藥配方顆粒標準體系的建設過程中建立一個統一的規劃思路,各地建立的中藥配方顆粒標準要跟國家標準相統一匹配,加強區域協作配合,凝聚各區域的綜合優勢,促進標準制定更加科學、全面、高效,為未來中藥配方顆粒的創新發展和標準轉化奠定基礎。
3.2 加強基礎研究
針對中藥配方顆粒的質量相關問題,建議首先要對原料藥材和飲片炮制進行規范化研究,由于中藥材種植的不確定性特點,部分藥材存在基原混亂、基原標準不統一等現象,對藥材的進一步加工造成困難[4]。因此應加強對基礎藥材的研究,強化中藥質量源頭管理。在對藥材詳細研究的基礎上,鼓勵推行中藥材種植養殖規范化基地的建設,固定中藥配方顆粒所用藥材基原及產地。檢測技術方面可以結合DNA 條形碼等新技術,多維度對原料基原及質量進行綜合評價。對炮制方法也要深入研究,科學合理細化炮制規范。保障中藥配方顆粒原料藥材質量的一致性和穩定性。
其次,要結合標準湯劑,加強對中藥配方顆粒化學成分的研究,中藥配方顆粒失去了飲片原本的性狀、顯微特征,對化學成分的測定成為辨別其質量的重要手段。需要持續進行【指紋圖譜】或【特征圖譜】項的研究,識別共有成分或有效成分,致力尋求更加專屬、經濟、可行的指紋或特征圖譜鑒別方法。可在研究中引入一些新方法,如基于中藥質量標志物提出的化學標識物,提高方法專屬性,有效保障所用原料藥材的真偽。同時加強對中藥配方顆粒生產工藝的研究,在保障其質量的前提下,合理制定其原飲片入藥標準和中藥配方顆粒含量檢測指標數量及含量區間。制定合理的指標成分含量區間對保證中藥配方顆粒質量穩定具有重要意義。若指標成分含量波動幅度過大,則會導致市場上的中藥配方顆粒雖符合含量要求,但其質量卻參差不齊;若波動幅度太小,則對其生產企業要求會過于嚴苛。
此外,對常用藥材,基礎方要開展單煎與合煎的對比研究,如有可能對于單煎和共煎有區別的中藥材、貴細中藥材及含有毒成分中藥材開創復方模式。并開展新工藝新輔料的研究,開放性對待水不溶性中藥有效成分。對動物藥、礦物藥、樹脂類藥材開展攻關,建立技術要求。
3.3 加強對照物質研發
首先,建議相關部門加快對照物質的研制,目前中藥配方顆粒的質量標準薄層圖譜、指紋或特征圖譜項下多使用對照藥材替代相關飲片衡量中藥配方顆粒的質量,其合理性有待考察。建議相關部門探索研制中藥飲片類對照藥材的可行性。
此外,要加快研制中藥配方顆粒用對照提取物,并應用于中藥配方顆粒的質量標準中。中藥飲片類對照藥材制備難度大,中藥對照提取物是目前最佳的替代方式。此類標準物質在專屬性、耐用性、重現性上優于傳統對照藥材和對照品,是中藥行業發展的趨勢。但是目前所發放的對照提取物大都為有機溶劑提取,與水煎煮的中藥配方顆粒化學成分有差異,在現行標準中并未受到重視,國家標準項下為數不多的幾個品種采用了對照提取物,如廣陳皮配方顆粒、枳殼配方顆粒,但也僅用于薄層鑒別。其實,中藥配方顆粒用對照提取物應不同于一般藥材對照提取物,應基于配方顆粒特殊水煎煮工藝,采用道地、優質、規范的原料藥材或飲片,在對不同基原、生長采收期、野生栽培區別、產地加工、炮制工藝、生熟異制差異、外源性有毒有害物質等考察研究的基礎上,遵循中醫藥理論,嚴格按照標準湯劑制法和生產工藝規程,對關鍵工藝參數(如投料方案、煎煮次數、加水量、煎煮時間、固液分離、濃縮、干燥、輔料添加、揮發油添加等)進行考察,并遵循藥品生產質量管理規范進行制備而成的實物對照物質。實際上應該是標準湯劑的實體物質。標準湯劑作為衡量中藥配方顆粒的標準參照物,能夠反映藥材的整體物質基礎,也體現了制備工藝過程的影響因素[30]。以中藥標準湯劑為標尺,標化生產過程,衡量產品質量,建立中藥配方顆粒相應的質量標準,是保證中藥配方顆粒質量穩定均一、臨床應用安全有效的有效措施之一。建議基于標準湯劑制備對照提取物,用于中藥配方顆粒質量控制,主要作用是隨行進行指紋圖譜、特征圖譜、薄層鑒別,半定量檢測等,也可進行對原料藥材-飲片-標準湯劑-中間體-配方顆粒成品的質量傳遞一致性溯源評價,簡化檢驗操作,大幅提升特征圖譜及指紋圖譜測定的可操作性,解決化學對照品短缺、昂貴、不穩定等問題。并有效評價配方顆粒產品批次間的一致性,保證產品的質量穩定性。
3.4 重視中藥配方顆粒臨床使用數據
臨床療效是衡量中藥配方顆粒是否發揮作用的最終判定形式,因此要重視臨床價值評估,做到中醫理論、人用經驗,臨床數據“三結合”。標準制定部門應以臨床價值為導向,建立完善質量標準。
有條件的生產企業應開展臨床試驗研究,以確保中藥配方顆粒療效。積極與醫療機構合作,獲取大量臨床數據,建立臨床療效與不良反應監測數據庫。醫療機構應積極開展收集中藥配方顆粒湯劑和傳統湯劑(飲片與中藥配方顆粒,合煎與分煎)及不同企業的中藥配方顆粒之間的臨床反饋,進行系統分析整理、深化研究,對中藥配方顆粒使用管理的科學性、有效性和安全性進行全面、客觀的評價,并以此為基礎逐步構建科學、有效的臨床應用數據庫,完善不良反應的收集與應對措施。提升合理用藥能力,高質量滿足公眾用藥需求。
其次,大力倡導各科研機構采用多種形式考察中藥配方顆粒的有效性以及最佳使用方案。利用分子生物學、組學、生物信息學等現代藥理學研究技術與方法,開展多學科綜合的藥效及作用機制研究。
3.5 基于風險評估和轉移率建立安全性指標
對于含有內源性毒性成分(既是有效成分又是毒性成分,或僅是毒性成分)的品種,要理性看待,綜合評判療效-毒性的關系,通過風險評估制定合理的限量標準。有些毒性成分,如烏頭堿等,可通過炮制和配伍,保證療效降低毒性。有些毒性成分,可以通過降低劑量,減少使用周期,制定合理的質量標準,控制有毒成分的含量。
對于外源性安全性指標,針對易發生重金屬、有害元素和真菌毒素(黃曲霉毒素等)富集的品種,其檢驗項目限度設定的安全性和合理性應結合轉移率、制成量及藥動學結果慎重評判。但針對一般品種的重金屬、農藥殘留、黃曲霉毒素檢查等安全性指標,不建議直接沿用藥材或飲片項下的安全性檢查項目及限度規定,也不應該盲目擴大檢測范圍,增加質量控制成本。企業應在標準研究中按相關指導原則要求,考察外源有害殘留的轉移情況,充分考慮中藥配方顆粒的使用量、服用頻率和期限等因素,按照殘留成分毒性程度和暴露水平等影響,進行充分風險評估并建立模型,設定合理質控項目及限度,并列入標準正文。
4 結語
中藥配方顆粒的國家標準經歷了從無到有的構建,對中藥配方顆粒生產、使用、檢驗等環節進行了技術規范,為其行業監督管理提供了依據。省級標準也彌補了國家標準的空白,為各省中藥配方顆粒發展提供技術支撐。雖然現階段仍然存在一定的問題,但是隨著科學技術的不斷發展,對中藥配方顆粒質量控制的認識也會不斷提高,在各方的共同努力下,中藥配方顆粒各項標準將會越來越完善。未來中藥配方顆粒將向基于藥品全生命周期的、開放性的質量控制模式發展[31-32],為中藥配方顆粒提供更大的發展空間,使其呈現多維度的創新局面。
利益沖突所有作者均聲明不存在利益沖突

