肌電與血氧信號同步采集系統設計與實驗研究
【作 者】 臧夢潔,邢麗冬,錢志余,姚柳葉
南京航空航天大學 自動化學院,南京市,210016
0 引言
運動疲勞防治是運動人體科學研究領域的熱點,肌肉疲勞的現象主要涉及神經性和代謝性的生理因素[1]。從神經系統看,肌肉在逐漸疲勞時,動作電位發生變化,導致sEMG變化。從生理代謝看,肌肉中血管活性增強,局部組織內血氧的消耗量變大,會使組織中血氧含量減少到另一個平衡點,監測肌肉組織的缺氧程度可用來判斷肌肉疲勞程度[2-3]。
目前已有針對肌肉疲勞時sEMG與近紅外信號特征的變化規律的相關研究。1923年,COBB和FORBES證實在肌肉靜態收縮刺激下,肌電信號的幅值有明顯增加的趨勢。1962年,KOGI和HAKAMADA首次實驗證實肌肉疲勞過程中肌電信號的功率譜向低頻方向移動[4]。1981年STULEN等[5]研究肌肉疲勞過程頻率特征對于肌電傳導速度(conduction velocity,CV)的影響,發現頻譜的低頻與高頻分量的比值對CV值更為敏感,中值頻率在噪聲的影響下表現出較強的魯棒性。2016年譚啟濤等[1]借助近紅外光譜技術觀測左腿外側腓腸肌的血氧波動,發現疲勞狀態下肌源生理代謝活動加強,從而導致組織對血氧量的需求增加。
當前研究主要基于單元信號,但采集的信號較為單一,無法全面反映肌肉疲勞過程中內在的物理參數的變化特點。多通道多元信號融合實現多維度分析肌肉疲勞的研究較少。我們設計了一種軟硬件結合的肌電與血氧同步采集系統,實時采集目標肌群疲勞過程中的sEMG與血氧信號,并通過提取變化較為明顯的特征參數進行分析,為后續對目標肌肉群的實時定量的肌肉疲勞評估奠定基礎。
1 sEMG分析方法
根據相關研究結論,肌肉在發生疲勞的過程中,由于肌肉纖維中的運動單元(motor unit,MU)的同步化程度加強并在時空上疊加,使得sEMG幅值明顯增大。同時高頻單元的活性降低,低頻單元的活性被激發,表現為頻譜特征的左移[6-7]。下面利用這兩種維度特征交叉分析系統所采集到的肌電信號進行研究。
1.1 時域分析
相較于空間維度,時域分析以時變函數的方式反映肌電信號在時間維度的變化,得到該信號的數學統計特性。肌電信號經預處理后常用的時域特征有均方根值(root mean square,RMS)和積分肌電值(integrated electromyography,iEMG)。
RMS的計算公式:

iEMG的計算公式:

式中:T為選取的信號窗內幀數長度;VEMG(t)為t時刻采樣的sEMG的幅值。
1.2 頻域分析
通過頻域分析可以反映全局頻率特征、能量分布以及運動單元被募集的情況[7]。常用的頻率特征參數計算包括信號的平均功率頻率(mean power frequency,MPF)、中值頻率(media frequency,MF)等。
MPF的計算式:
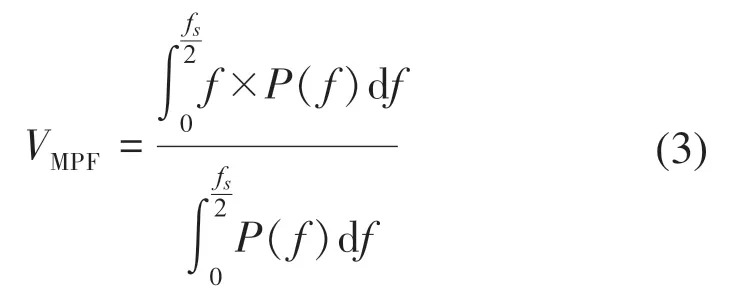
MF的計算式:
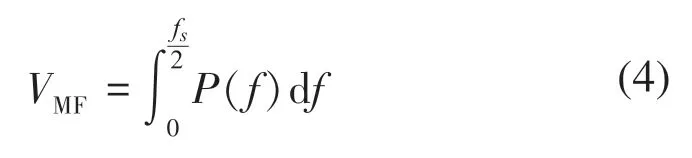
式中:f為信號的頻率;fs為信號的采樣率;P(f)為功率譜密度函數。
2 血氧檢測原理
本系統根據氧合血紅蛋白(oxyhemoglobin,HbO2)和脫氧血紅蛋白(deoxyhemoglobin,Hb)在600~900 nm波段的 光窗口 有不同的吸收特征,以朗伯-比爾定理為理論基礎[8],朗伯-比爾定律公式可表示為:
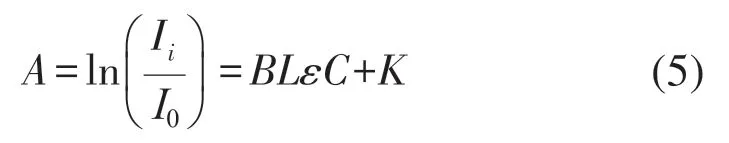
式中:A為光密度;Ii、I0分別為光源入射光強和出射光強;C為待測物質濃度,單位為mol/L。L為光穿過組織的路徑長度;B為差分路徑因子(differential pathlength factor,DPF),用來描述光子實際傳播的路徑與L的數學關系;ε為待測成分的摩爾吸光系數,單位為mM-1cm-1;K為光子散射過程產生的耗散常量。
雙波長血氧檢測模型如圖1所示:雙波長(735 nm/850 nm)LED光源發出的近紅外光Ne和紅光Re,a和b為到光源距離不同的兩個光電傳感器。光子穿透由皮膚、皮下組織等多組分混合體系后由光電傳感器 a和b接收。
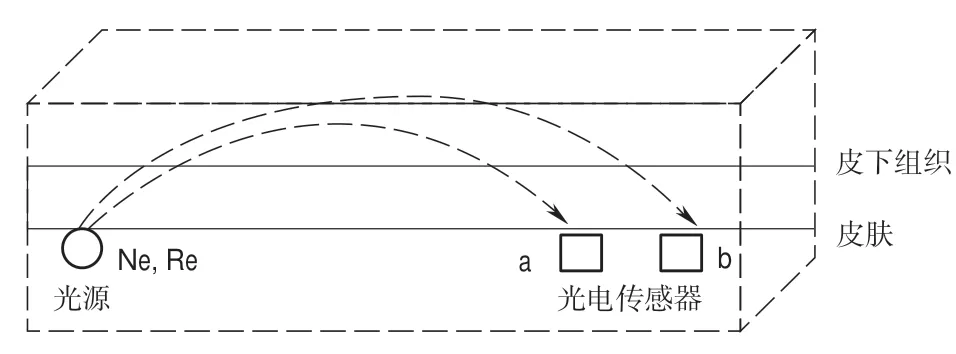
圖1 雙波長血氧檢測模型Fig.1 Dual wavelength blood oxygen detection model
由于光子在傳播的過程中引起的損失K無法直接計算,因而考慮計算組織血氧濃度的相對變化。具體計算式如下[9-10]:
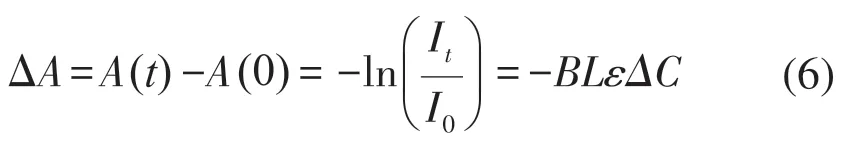
在調整雙波長光源的發射光強度后,A(0)表示肌肉組織在靜息狀態下探測器采集到的光強度;A(t)表示肌肉狀態改變后探測器采集到的光強度;ΔC表示t時刻吸收物質的濃度變化;ΔA表示t時刻光密度的變化。對于本系統所使用的光電傳感器,光密度的變化與所采集的電壓成正比,因此ΔA可由電壓值反映,計算式如下:
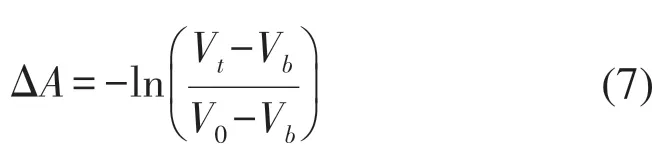
式中:V0代表初始狀態下的電壓值;Vt代表t時刻的電壓值;Vb為暗電壓值。
在雙波長血氧檢測模型中每一種波長對應光密度變化量的具體式如下:

雖然式(8)中L的值會引起差分路徑因子B的變化,但是根據已有的研究表明當L大于一定值(2.5 cm)后,B值會趨于穩定不變[11]。依據現有研究的結果,并結合插值法確定符合本系統的B值,式(8)中的摩爾吸光系數ε也可由文獻查閱得到[12-13],至此就可以定量地計算組織中兩種血紅蛋白的濃度相對變化,計算式如下:
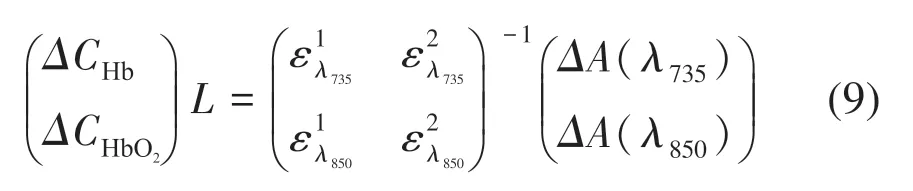
3 系統硬件設計
sEMG-NIRS采集系統硬件架構如圖2所示。系統采集端主要包括兩個模塊:①sEMG采集模塊:前端凝膠電極采集前臂原始的sEMG,經過調理電路之后,由微處理器進行處理。微處理器對信號調理電路輸出的信號進行平滑和軟件濾波處理,從而得到污染較小的信號;②肌肉血氧采集模塊:光電探頭中的光電傳感器接收到從人體組織內部吸收之后散射出來的光信號,并將該信號轉換成電信號,經放大濾波、分離后由STM32處理。
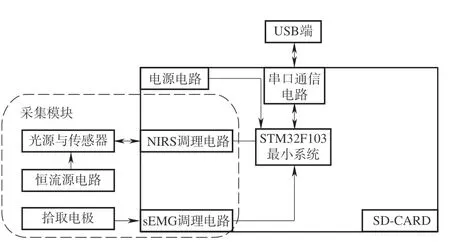
圖2 sEMG-NIRS采集系統硬件設計框架Fig.2 sEMG-NIRS acquisition system hardware design block framework
3.1 sEMG采集電極選取
sEMG的幅值在微伏級別[14],信號頻率為10~500 Hz,其中50~150 Hz能量較高[15-16]。需要考慮探頭在使用的過程中如何減小偽跡,另外導聯線的選擇應滿足有一定的抗干擾和屏蔽作用。我們選用Ag/AgCl凝膠電極,相比于針電極,凝膠電極具有無創、使用方便等特點適用于受試者在運動情況下采集sEMG。采用三點式放置電極,其中兩個作為sEMG的差分輸入端,另一個電極接地保護以提高信號采集的準確性。
3.2 信號處理電路設計
信號處理電路在sEMG傳感器模塊中至關重要,根據sEMG在傅里葉變換之后的頻譜分布特點,該信號調理電路設計如圖3所示,主要由雙輸入單輸出的差分放大電路、RC低通濾波、高通濾波以及次級放大器4個部分組成。由于差分模擬輸入電路的設計對sEMG的品質的影響非常大,為實現輸入端的阻抗趨近于無窮大同時對于共模信號表現出較為出色的抑制效果,本系統選用INA128集成芯片。另外由于在工作時芯片自身會存在射頻整流,其產生的射頻干擾(radio frequency interference,RFI)會使采集到的sEMG混有直流輸出失調誤差。因而在INA128的前端放置RC低通濾波器進行射頻濾波。其截止頻率計算式如下:
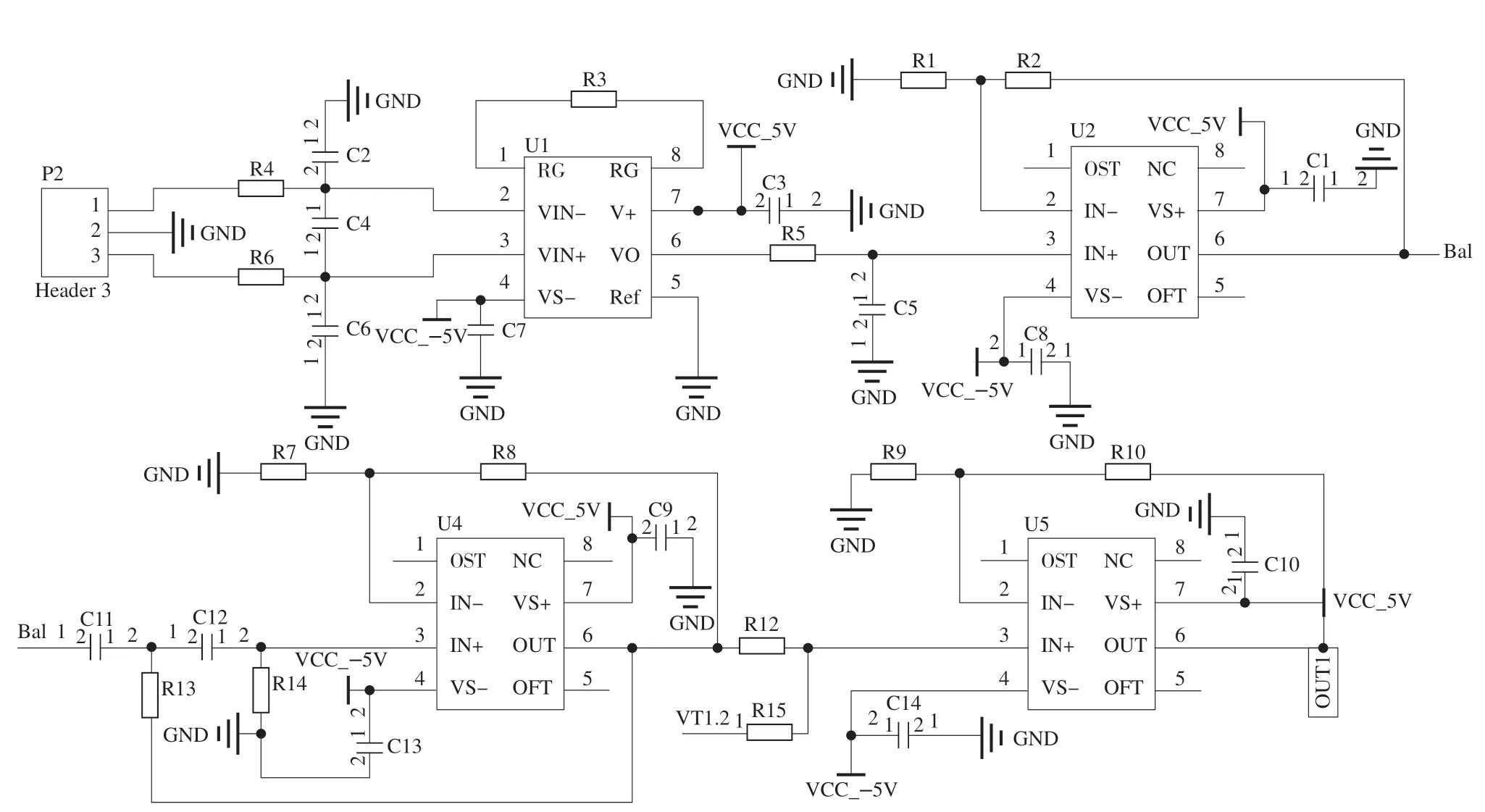
圖3 sEMG信號調理電路Fig.3 sEMG signal conditioning circuit
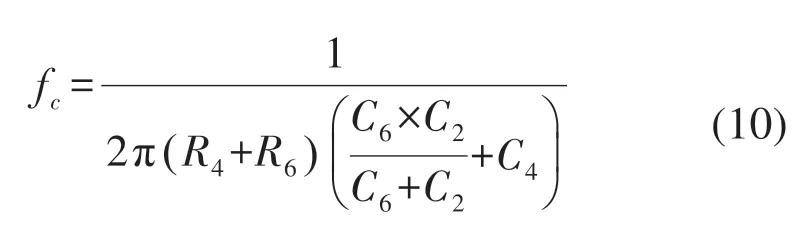
為滿足采樣信號既有合適的電壓增益又不會因正反饋過強而產生自激振蕩,因而設計由C11、C12、R13以及R14組成的壓控電壓源二階RC高通濾波器。最后經OPA604集成運放芯片組成的同相加法電路實現輸出電壓信號的抬升從而能更加準確地被微處理器采集并進行后續處理。
3.3 近紅外光源驅動電路設計
為保證發射近紅外光源有穩定的發光功率,采用具有恒流輸出功能的集成芯片進行驅動,并且設計恒流源電路以滿足其特定的工作需求。電路輸出的驅動電流大小可通過外接電阻R3調節,電容C2的作用為抑制高次諧波干擾。另外,為確保輸入與輸出電壓幅值相同,增加外接電阻R1以減弱模擬開關通道開通期間阻抗分壓的影響。使用微處理器的定時器功能產生具有恒定相位差和頻率的PWM波分時控制模擬開關芯片MAX323的導通和關斷進而使得雙波長LED以恒定頻率交替工作,設計的恒流源驅動電路如圖4所示。
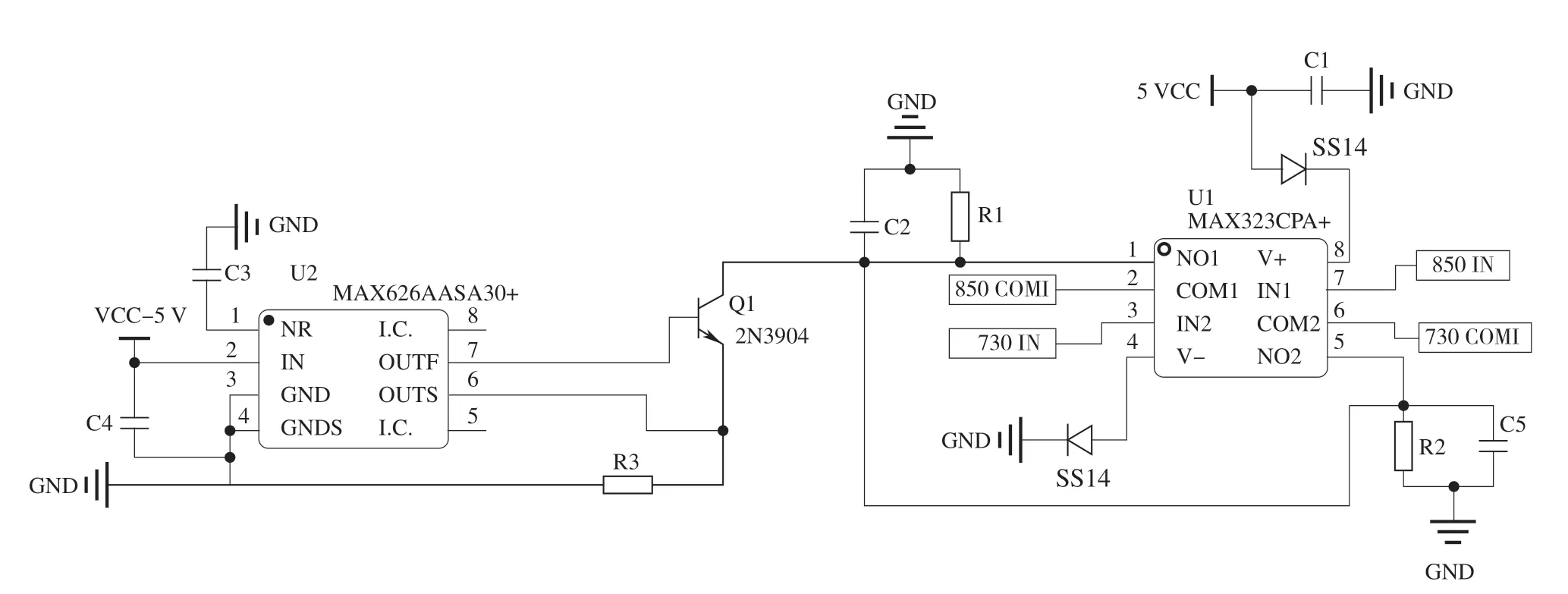
圖4 恒流源驅動電路Fig.4 Constant current source drive circuit diagram
3.4 柔性探頭設計
依據蒙特卡羅仿真(Monte-Carlo simulation,MC)模擬光子散射的路徑結果[17],光子通過多次散射而返回到組織表面,在人體組織中傳播的路徑近似為月牙形態。因而在與光源同平面的另一個位置安放信號接收器,則一定能夠探測到經過散射后的光子。若要達到采集到深層肌肉的血氧變化信息的目的,傳感器與光源發射極的最大距離一般在4 cm[18]。圖5所示是前置探頭的布局圖,系統選擇發射極到光電傳感器間距分別為3 cm和4 cm,光電傳感器之間的間距為1 cm,通過測試當肌肉收縮時這兩處位置均能準確地探測到信號強度的改變。
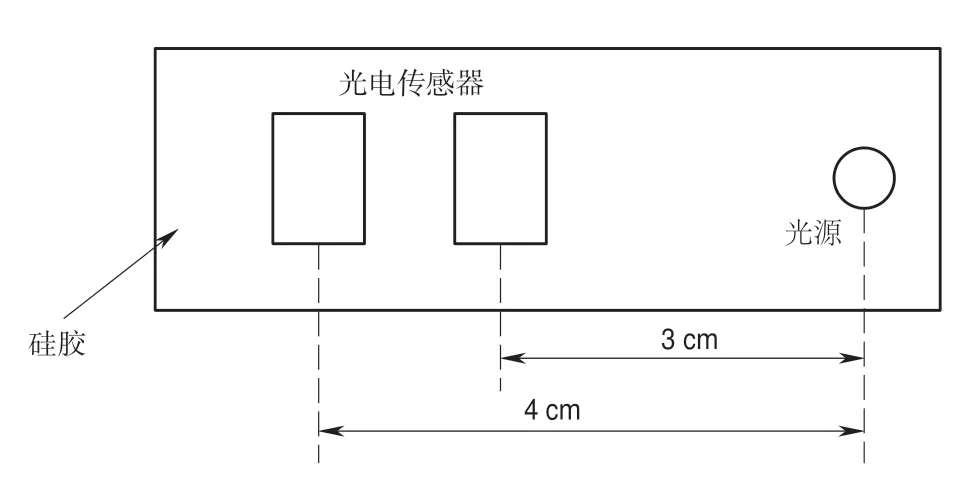
圖5 柔性探頭布局Fig.5 Flexible probe layout
3.5 信號調理電路
信號調理電路系統框架如圖6所示,主要由時序開關電路、前級放大、濾波電路這三部分組成。前端探頭上的每個傳感器接收的光電信號經過雙路模擬開關MAX323組成的時序開關電路后將混疊的兩波長電壓信號以與光源相同的驅動頻率切分開變為兩路信號,因此整個調理模塊存在4個獨立的放大濾波電路對切分后的電壓信號分別進行處理。
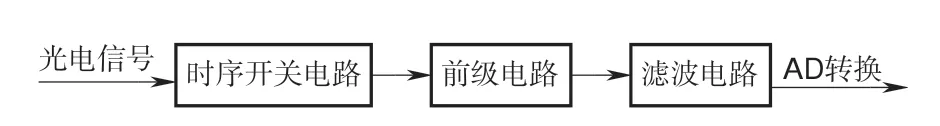
圖6 信號調理電路系統框架Fig.6 Signal processing circuit system framework
4 系統軟件設計
硬件采集平臺所采到肌電以及血氧信號由STM32的AD功能模數轉換后再計算相應值。系統為了并行完成多個任務,包括分時驅動模擬開關、ADC采集、數據計算、數據通信以及存儲,同時方便設置每個任務的優先級,采用 uC/OS-III實時操作系統,它具有可剝奪多任務管理,極短的關中斷時間以及直接向任務發送信號等優點,可對微處理器中的各項任務進行高效的資源管理。系統軟件運行流程如圖7所示。
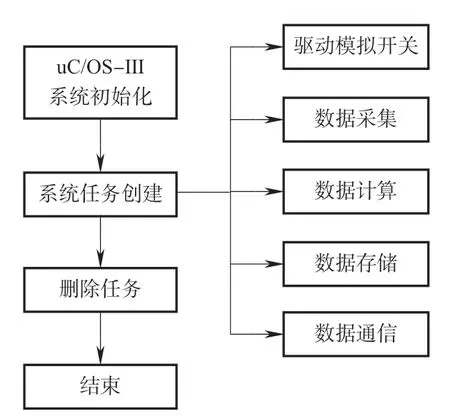
圖7 系統軟件流程Fig.7 System software flow
STM32啟動之后,系統對 uC/OS-III 進行初始化,完成對各個參數初始化配置、內存空間的分配,接著創建系統任務,在系統任務中創建分時驅動模擬開關任務、數據采集任務、數據通信任務等。待每個任務創建完畢,根據某一任務對數據實時性準確性的要求以及CPU對任務的執行周期,為該任務設置不同的優先級并為每個任務配置所需的堆棧空間。當所有任務創建完畢時,啟動操作系統從而保證各部分有序執行,最后釋放存儲塊刪除開始任務。
5 實驗驗證
5.1 等長收縮下局部肌肉疲勞實驗
本研究選取人體右臂肱橈肌中部進行實驗,實驗對象在溫度恒定的實驗室內靜坐5 min,將人體狀態調整至平靜適宜的狀態。使用醫用酒精棉將實驗對象右前臂肱橈肌位置擦凈,去除皮膚上的灰塵角質等,保證表面肌電極與受試者皮膚之間有效的接觸。使用5 kg啞鈴加速肌肉疲勞的進程。首先采集在無負重狀態下3 s的數據,隨后觀察者將啞鈴放于實驗對象手中,保持90e靜態等長收縮狀態,采集過程實驗對象恒力保持25 s后結束,重復以上實驗。
取結束6 s之前的數據對信號經過小波軟閾值降噪預處理,分別提取時域特征參數RMS、iEMG,以及頻域特征參數MPF結果,如圖8所示。研究發現,隨著肌肉負重時間的持續,sEMG的時域特征參數RMS、iEMG有增大的趨勢,而頻域特征參數呈現相反的變化,即頻譜發生了左移。這說明sEMG與肌肉疲勞有很強的相關性,與現有的研究結論相吻合,同時也表明本系統中的sEMG信號采集模塊有效。

圖8 sEMG原始信號與特征參數提取Fig.8 sEMG original signal and feature parameter extraction
5.2 前臂阻斷實驗
為了驗證系統檢測人體組織的血氧濃度變化的有效性,使用商用設備OxiplexTS組織血氧儀與本系統做對比實驗。本系統與該商用設備采集血氧的原理相同,根據Hb和HbO2對紅光和近紅外光吸收差異的特性計算血氧蛋白濃度變化。
在前臂阻斷的實驗中,將傳感器探頭緊密貼合在前臂的內側,將水銀血壓計的繃帶綁于上臂后,被測手臂水平放于桌面并開始實驗。等待系統采集穩定后,將袖帶內的壓力迅速增加到110 mmHg(1 mmHg=133.32 Pa)。由于阻斷了局部血液循環且前臂的生物組織又在不斷耗氧,從而前臂的HbO2濃度呈現降低趨勢,Hb的濃度逐漸上升。袖帶內的壓力持續一段時間后迅速釋放,前臂血液循環正常,前臂血液中的氧含量將迅速增加,恢復原有狀態,導致兩種血紅蛋白濃度逐漸變為初始狀態。
圖9(a)、(b)中兩種曲線分別是本系統和OxiplexTS組織血氧儀在某一次前臂阻斷實驗中測得的數據。可以看出,本系統在前臂阻斷情況下得到ΔHbO2、ΔHb的變化趨勢和幅度與標準的商用儀器采集的兩種血紅蛋白濃度相對變化一致。
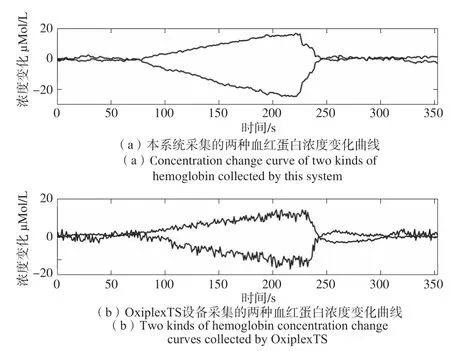
圖9 本系統與OxiplexTS設備采集兩種血紅蛋白濃度變化曲線Fig.9 This system and OxiplexTS equipment collect two kinds of hemoglobin concentration curve
6 結論
以 STM32 芯片為核心,基于sEMG和NIRS設計了一種針對目標肌群的肌電和血氧信號實時監測設備,介紹了其硬件和軟件部分,設計了等長收縮局部肌肉疲勞實驗以及前臂阻斷實驗來驗證本系統的有效性。系統為探究肌肉疲勞與目標肌群的sEMG以及血氧信號相關性提供了便利,為后續研究肌肉疲勞評估奠定基礎。

