廣西地不容和地楓皮內生真菌對羅漢果土傳病原真菌的抑制活性
馮蓓蓓, 鄧業成, 盧丹丹, 湯夏安, 鄧志勇, 駱海玉
(廣西師范大學生命科學學院,廣西桂林 541006)
羅漢果(Siraitiagrosvenorii)是葫蘆科羅漢果屬植物的果實,很早就被發現是藥食兩用的植物[1-2]。羅漢果植株的主要土傳病害有根腐病[3-4]、白絹病[5]、青枯病[6]、根結線蟲病[7]、芽枯病[8]等。研究發現,齊整小核菌(SclerotiumrolfsiiSacc.)是羅漢果白絹病的致病菌,通過侵害羅漢果的莖基部和根部,使羅漢果莖葉萎蔫,最后枯萎而死[9]。羅漢果根腐病的致病菌是鐮刀菌根腐類病菌[10],通過侵染羅漢果根部,使根腐爛,造成植株枯萎死亡。目前,化學防治是最廣泛應用的防治方式,但人們越來越注重隨之而來的環境、食品等問題,所以研究出更加科學安全的防治方法迫在眉睫。隨著技術的發展和人們對殺菌劑要求的日益提高,農業病害的防治提倡采用更加安全、低污染的生物防治,所以植物內生真菌及其產生的抗菌物質成為植物病害防治相關研究的熱門方向[11]。植物內生菌是不危害植物宿主,存在于健康宿主細胞間或細胞內的一大類未完全開發的微生物[11-13]。
廣西地不容(Stephaniakwangsiensis)是中國特色千金藤屬植物[14],有著廣泛的藥用價值,比如清熱解毒、消腫去瘀等[15]。目前對廣西地不容的殺蟲活性[16]和抑菌活性[17]等已有研究報道。地楓皮(Illiciumdifengpi)為木蘭科八角屬植物,具有豐富的藥用價值,常用于風濕疼痛類疾病的治理,也是跌打損傷藥品的主要藥物原料[18]。
筆者所在課題組經過多年研究得出,廣西地不容和地楓皮的內生真菌對多種植物病原真菌有抗菌活性[19-22]。基于此,進一步研究2種植物內生真菌對羅漢果3種土傳病原真菌的抗菌活性,旨在為其在殺菌劑領域的開發利用提供依據。
1 材料與方法
1.1 試驗材料
1.1.1 供試植物內生真菌 廣西地不容內生真菌:DBR-3、DBR-5、DBR-15;地楓皮內生真菌:DFP-G-5、DFP-G-7、DFP-G-9、DFP-P-7.1。上述內生真菌均由筆者所在實驗室保存并提供的菌種中篩選取得,見表1。
1.1.2 供試羅漢果病原真菌 3株羅漢果病原真菌為GFB-G10、GFB-G15和BJB。上述病原真菌均由筆者所在實驗室保存并提供的菌種中篩選取得,見表1。

表1 內生真菌和病原真菌種類
1.1.3 供試培養基和發酵液 菌株活化、制作大量培養基。拮抗試驗培養基:馬鈴薯葡萄糖瓊脂培養基(PDA,含馬鈴薯200 g、葡萄糖20 g、瓊脂25 g、蒸餾水1 L)。液體發酵培養基:馬鈴薯葡萄糖液體培養基(PDB,含馬鈴薯200 g、葡萄糖20 g、蒸餾水1 L)。
1.2 試驗方法
1.2.1 內生真菌發酵產物制備 所有試驗在廣西師范大學雁山校區珍稀瀕危動植物生態與環境保護省部共建教育部重點實驗室開展,時間為2021年1—5月。在無菌超凈臺內活化7種純化好的植物內生真菌,在PDA 平板上培養3 d后使用。用 0.4 cm 打孔器在每種內生真菌菌落邊緣打取菌餅。分別放入已準備好的滅菌PDB培養基中,每瓶放15個菌餅。放置于(27±1) ℃恒溫培養箱中培30 d,每天振蕩3次。
采用液-液萃取法分離出內生真菌發酵液中的粗提物,操作如下:首先,將內生真菌發酵液與之等體積的乙酸乙酯連續萃取3次,將萃取液合并,得到乙酸乙酯層和萃余層。然后,使用旋轉蒸發器,分別得到發酵液乙酸乙酯萃取物以及發酵液萃余物的膏體。最后,將分離出的菌絲體烘干、碾碎后,用甲醇浸提[23]。反復多次浸提直至浸提液無色為止,每次浸提時間為2 d。通過抽濾把菌絲體與甲醇浸提液分開,使用旋轉蒸發儀處理甲醇浸提液得到膏體,即菌絲體甲醇粗提物。
1.2.2 抑菌活性測定
1.2.2.1 內生真菌對羅漢果病原真菌的拮抗試驗 在無菌超凈臺內使用平板對峙法[24-25]完成拮抗試驗。操作如下:分別活化7種植物內生真菌和3種植物病原菌,培養3 d。在培養皿底面做記號,以培養皿直徑畫線,以圓心為對稱點,2點之間間距 3 cm 取點,做標記。用直徑為0.4 cm的打孔器分別在內生真菌和病原菌的菌落邊緣打取菌餅,依次接種于標記的2點,并在培養皿底面寫好對應的菌種名稱。對照組除不接內生真菌外,其他與試驗組相同,且處理組、對照組都做3個重復。于恒溫箱(27±1 ℃)中培養1~9 d,同時每天觀察菌絲生長速度、邊緣菌絲是否變形、抑菌帶是否產生等。測量每個菌落的半徑,按照下面公式計算得出抑制率:
抑制率=(對照組菌落半徑-處理組菌落短半徑)/對照組菌落半徑×100%。
1.2.2.2 發酵產物對羅漢果病原真菌菌絲生長的抑制活性測定 在無菌工作臺中操作,使用菌絲生長速率法[26]完成活性的測定。首先將7株內生真菌的發酵液乙酸乙酯萃取物膏體、發酵液萃余物膏體及菌絲體粗提物膏體配制成質量濃度分別為20、100、100 g/L的藥液,溶劑為丙酮,然后活化內生真菌和植物病原菌3 d。在9 cm直徑的培養皿中同時加入1 mL藥液(對照組藥液用丙酮代替,其他與處理組相同) 與9 mL熱熔的PDA培養基,輕微晃動使其混合均勻,制成帶藥培養基(質量濃度分別為:2、10、10 g/L)。用直徑為0.4 cm的打孔器分別在3種羅漢果病原真菌的菌落邊緣打取菌餅。菌餅貼于之前做好的已凝固帶藥培養基上,且菌餅成“品”字排列[白絹病菌病原菌(BJB)的對照組除外,由于BJB生長速度過快,因此BJB的對照組每皿只接1個菌餅],在恒溫培養箱(27±1 ℃)中培養3 d。BJB的對照組重復3次。使用十字交叉法[27]測量每個菌落的直徑,按照下面公式計算得出抑制率:
抑制率=(對照組菌落直徑-處理組菌落直徑)/(對照組菌落直徑-0.4)×100%。
配制一系列質量濃度的帶藥培養基,計算得出各個質量濃度的抑菌率。用最小二乘法求出毒力回歸方程、相關系數(r) 、有效中濃度(EC50)及EC50的95%置信限。
2 結果與分析
2.1 植物內生真菌對羅漢果病原菌的拮抗活性
由表2可知,7種植物內生真菌對3種羅漢果病原真菌有不同程度的抑制效果。其中DBR-15對GFB-G10和GFB-G15的拮抗作用最大,抑制率達到60.00%~70.77% 。DFP-G-9對GFB-G10的拮抗作用最小,抑制率只有2.86% 。

表2 7株內生真菌對3種羅漢果病原真菌的拮抗活性
2.2 植物內生真菌發酵產物對羅漢果病原真菌的抑制活性
2.2.1 2 g/L植物內生真菌發酵液乙酸乙酯萃取物對羅漢果病原真菌的抑制活性 如表3所示,6種植物內生真菌DBR-3、DBR-5、DBR-15、DFP-G-7、DFP-G-9、DFP-P-7.1的發酵液乙酸乙酯萃取物對3種病原菌抑菌活性好(除DBR-15對GFB-G10的抑菌活性一般),抑制率均大于50%。DFP-G-5發酵液乙酸乙酯萃取物抑菌活性差,抑制率均小50%。根據此結果,接下來研究2種羅漢果內生真菌(DBR-3、DBR-5)、3種地楓皮內生真菌(DFP-G-7、DFP-G-9、DFP-P-7.1)的發酵液乙酸乙酯萃取物對3種羅漢果病原真菌的毒力和DBR-15的發酵液乙酸乙酯萃取物對 GFB-G15、BJB的毒力。
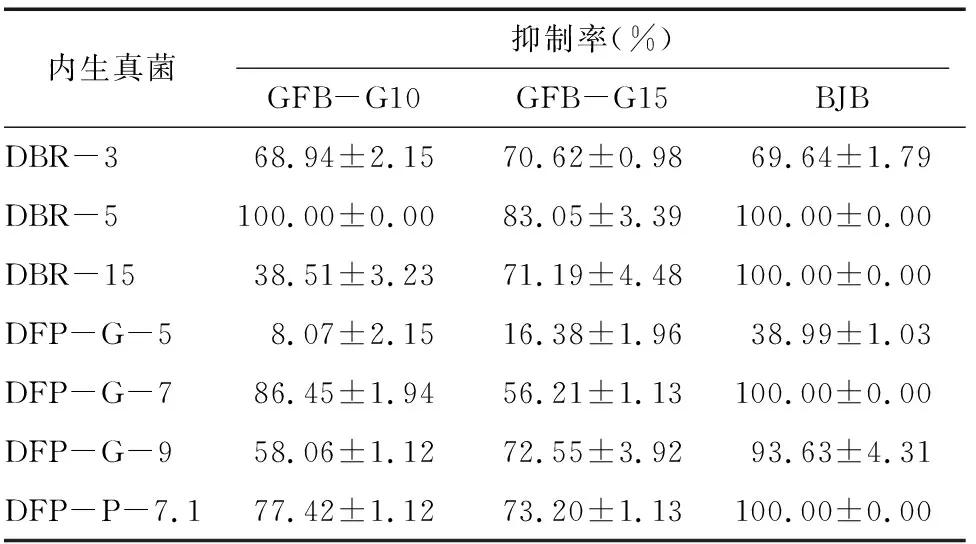
表3 7株內生真菌發酵液乙酸乙酯萃取物對3種羅漢果病原真菌菌絲的抑制活性
2.2.2 10 g/L植物內生真菌發酵液萃余物對羅漢果病原真菌的抑制活性 如表4所示,4種植物內生真菌DBR-5、DFP-G-5、DFP-G-7、DFP-P-7.1的發酵液萃余物對BJB的抑菌活性好,抑制率均大于50%。其他植物內生真菌的發酵液萃余物對羅漢果病原真菌抑菌活性差,抑制率均小于50%。得出結論,這7種植物內生真菌的發酵液萃余物對3種羅漢果病原真菌幾乎沒有抑制活性。可以確定,抑菌物質主要存在于這7種植物內生真菌的發酵液乙酸乙酯萃取物中。根據此結果,接下來研究4種內生真菌DBR-5、DFP-G-5、DFP-G-7、DFP-P-7.1的發酵液萃余物對BJB的毒力。

表4 7株內生真菌發酵液萃余物對3種羅漢果病原真菌菌絲的抑制活性
2.2.3 10 g/L植物內生真菌菌絲體甲醇提取物對羅漢果病原真菌的抑制活性 如表5所示,DBR-5的菌絲體甲醇粗提物對3種病原菌的抑菌活性較好,抑菌率均大于70%。DBR-15、DFP-G-9的菌絲體甲醇粗提物對GFB-G10、BJB的抑菌活性好,抑菌率均大于50%。DFP-P-7.1的菌絲體甲醇粗提物對GFB-G15、BJB菌絲的抑菌活性好,抑菌率均大于50%。DBR-3的菌絲體甲醇粗提物對GFB-G15的抑菌活性好。DFP-G-7的菌絲體甲醇粗提物對BJB的抑菌活性好。DFP-G-5菌絲體甲醇提取物抑菌活性差,抑菌率均小于50%。根據此結果,接下來研究DBR-5的菌絲體甲醇提取物對3種羅漢果病原真菌的毒力,DBR-15、DFP-G-9的菌絲體甲醇粗提物對 GFB-G10、BJB的毒力,DFP-P-7.1的菌絲體甲醇粗提物對GFB-G15、BJB的毒力,DBR-3的菌絲體甲醇粗提物對GFB-G15的毒力,DFP-G-7的菌絲體甲醇粗提物對BJB的毒力。
2.3 廣西地不容內生真菌發酵產物對羅漢果病原真菌的毒力
為進一步確定廣西地不容內生真菌發酵產物的抑菌效果,根據上文抑菌活性測定結果,選取3株地不容內生真菌DBR-3、DBR-5、DBR-15的發酵液乙酸乙酯萃取物、發酵液萃余物、菌絲體甲醇提取物對羅漢果原真菌抑菌率達到50%以上的相應病原菌作為供試菌株,進一步測定其對供試菌株菌絲的毒力,結果見表6。3種病原菌中,DBR-3的發酵液乙酸乙酯萃取物對GFB-G10的毒力最高,EC50為 0.334 0 g/L;對BJB的毒力最低,EC50為1.064 5 g/L。DBR-5的發酵液乙酸乙酯萃取物對BJB的毒力最高,EC50為0.120 8 g/L;對GFB-G10的毒力最低,EC50為0.379 9 g/L。DBR-15發酵液乙酸乙酯萃取物對BJB的毒力比對GFB-G15的毒力高。DBR-5的菌絲體甲醇提取物對GFB-G15的毒力最高,EC50為0.270 8 g/L;對GFB-G10的毒力最低,EC50為0.957 8 g/L。DBR-15的菌絲體甲醇提取物對BJB的毒力比對GFB-G10的毒力高。

表5 7株內生真菌菌絲體甲醇提取物對3種植物病原真菌菌絲的抑制活性
2.4 地楓皮內生真菌發酵產物對羅漢果病原真菌的毒力
為進一步確定地楓皮內生真菌發酵產物對3種羅漢果病原真菌菌絲生長的抑制活性, 根據上文抑菌活性測定結果,選取4株地不容內生真菌DFP-G-5、DFP-G-7、DFP-G-9、DFP-P-7.1的發酵液乙酸乙酯萃取物、發酵液萃余物、菌絲體甲醇提取物對羅漢果原真菌抑菌率達到 50%以上的相應病原菌作為供試菌株,進一步測定其對供試菌株菌絲的毒力,結果見表7。3種病原菌中,DFP-G-7、DFP-P-7.1的發酵液乙酸乙酯萃取物對BJB的毒力最高,EC50分別為0.172 4、0.186 1 g/L;對GFB-G15的毒力最低,EC50分別為2.911 7、0.878 9 g/L。DFP-G-9的發酵液乙酸乙酯萃取物對BJB的毒力最高,EC50為0.426 9 g/L;對 GFB-G10 的毒力最低,EC50為1.545 4 g/L。DFP-G-9 菌絲體甲醇提取物對BJB的毒力比對GFB-G10的毒力高。DFP-P-7.1菌絲體甲醇提取物對BJB的毒力比對GFB-G15的毒力高。
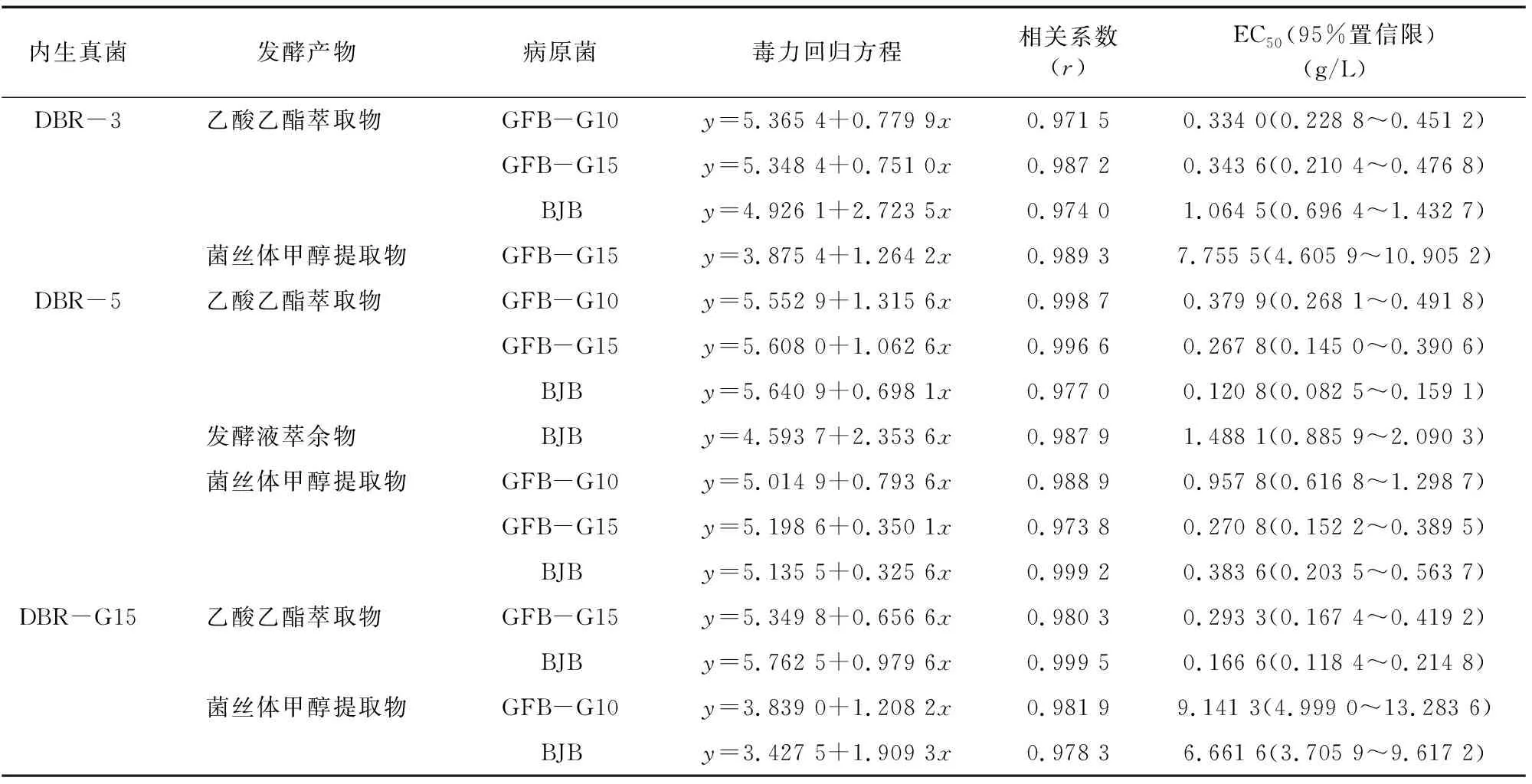
表6 廣西地不容內生真菌發酵產物對3種羅漢果病原真菌的毒力

表7 地楓皮內生真菌發酵產物對3種羅漢果病原真菌的毒力
3 討論與結論
目前對地楓皮內生真菌的研究較少,已知地楓皮的根、莖、葉中具有大量的內生真菌[28],其中一些內生真菌對植物病原菌和動物病原菌有較為廣泛的抑菌性,所以研究廣西特色植物地楓皮的有利于抗菌植株的培養和生物抗菌劑的研發。
目前對廣西地不容內生真菌的研究已初具規模,研究發現其塊莖中有多種內生真菌具有很強的抗菌性且有較強的普適性[29]。現已有以廣西地不容為原料的生物殺菌劑研發。
隨著羅漢果種植的加大,如何防治羅漢果土傳病害成為當務之急。目前大多用化學防治,但是隨后帶來的環境污染不可忽略。所以對羅漢果土傳病害的生物殺菌劑的研發迫在眉睫。
在拮抗試驗中供試廣西地不容和地楓皮內生真菌對3種羅漢果病原真菌有抑制活性普遍偏低。為了節省時間,減少不必要的步驟, 先要初步判斷7種植物內生真菌對3種病原真菌是否有抑菌活性,所以采用了平板對峙法。但拮抗試驗中抑制效果不好的菌株并不能說明其沒有抑菌活性,可能是本試驗方法的局限性造成的,比如由于培養時間太短,抑菌物質尚未產生等。所以應該進一步測定內生真菌發酵產物對病原真菌的抑制活性,從而篩選優良的抑菌菌株。
有大量的研究證明,植物內生菌發酵產物的乙酸乙酯萃取物有廣泛的抑菌活性[27-29]。本試驗結果也顯示,6種植物內生真菌DBR-3、DBR-5、DBR-15、DFP-G-7、DFP-G-9、DFP-P-7.1的發酵液乙酸乙酯萃取物具有很好的抑菌活性,在質量濃度為2 g/L時,其對3種羅漢果病原真菌BJB、GFB-G10、GFB-G15的抑制率均在50% 以上(除DBR-15發酵液乙酸乙酯萃取物對GFB-G10的抑菌活性一般),其中DBR-5的發酵液乙酸乙酯萃取物對BJB的毒力最高,EC50為0.120 8 g/L。
這6種植物內生真菌的菌絲體甲醇提取物對病原菌的抑制活性一般,質量濃度為10 g/L時,對3種羅漢果病原真菌其中的一種或多種的抑制率均在50%以上,其中DBR-5的菌絲體甲醇提取物對GFB-G15的毒力最高;EC50為0.270 8 g/L。
4種植物內生DBR-5、DFP-G-5、DFP-G-7、DFP-P-7.1的發酵液萃余物對病原菌的抑制活性一般,質量濃度為10 g/L時,對BJB的抑菌率在50%以上,其中DBR-5的發酵液萃余物對BJB的毒力最高,EC50為1.488 1 g/L。
6種植物內生真菌DBR-3、DBR-5、DBR-15、DFP-G-7、DFP-G-9、DFP-P-7.1的發酵產物乙酸乙酯萃取物有較好的抗菌活性,有很大的研究價值與潛在價值,可以推進研究這6種植物內生真菌,探究其活性物質的組成。

