醬香型大曲貯存初期微生物及風味物質變化的分析研究
沈世明,何猛超,劉桂珍,潘學森,王邦坤,張嬌嬌,陳禹锜,5,阿如汗,劉金龍,韓興林
(1.河北科技大學食品與生物學院,河北石家莊 050018;2.山東青州云門酒業(集團)有限公司,山東青州 252500;3.中國食品發酵工業研究院有限公司,北京 100015;4.國家酒類品質與安全國際聯合研究中心,北京 100015;5.廣西大學生命科學與技術學院,廣西南寧 530004)
中國白酒歷史悠久,源遠流長,是我國特有的傳統酒種之一,深受廣大消費者的喜愛[1-2],是以糧谷原料,結合大曲、小曲、麩曲作為糖化發酵劑,經過蒸煮、糖化、蒸餾而成的蒸餾酒。大曲在整個白酒發酵過程中占據舉足輕重的作用,根據其制作工藝和溫度可分為高溫大曲、中高溫大曲、中溫大曲。不同大曲參與釀造的白酒香型有所不同,不同大曲中富含的微生物各不相同,功能也有所差異[3]。
高溫大曲在制作過程中微生物極為豐富,對溫度、濕度等指標要求極為嚴格,主要分為培養和貯存兩個階段,是功能微生物的定向及其相應代謝產物、酶類調控的關鍵過程。大曲貯存過程是最關鍵、最復雜的環節,主要體現在微生物的差異上,不同時期曲坯的微生物種類和數量呈動態變化趨勢,在外界環境脅迫作用下(特別是溫度)不斷演替而逐漸平衡,最后微生物種類趨于平穩,數量變化較小,形成質量穩定、風味獨特的醬香型高溫大曲。HU 等[5]揭示了白云邊高溫大曲140 d 周期內的變化趨勢,結果表明,高溫期時耐熱微生物是優勢菌,貯存期時的溫度相對穩定,但微生物的群落結構變化顯著,貯存后,群落演變得更適合白酒多邊發酵,不愉快的風味物質消失,獨特風味物質增多。宋瑞濱等[6]通過研究濃香型大曲在貯存6 個月、12 個月、18 個月、24 個月不同貯存期理化指標與微生物數量以及所產酒質的變化規律,為提高制曲質量、提升酒體風格打好了堅實基礎。迄今為止對高溫大曲在貯存初期微生物的演替以及醬香風味物質的相關性研究鮮有報道,本研究旨在為企業提供科學的高溫大曲最佳貯存時間及進一步提升醬香型白酒品質。
1 材料與方法
1.1 材料、試劑及儀器
1.1.1 樣品制備和收集
大曲的制備:高溫大曲,生產于山東青州云門酒業(集團)有限公司大曲生產曲房,分別取貯存初期0 d、30 d、60 d 的高溫大曲,按照文獻[7]所述方法從曲堆上、中、下層取樣粉碎,混合均勻,每次取200 g,送至實驗室保藏(4 ℃和-20 ℃)至檢測。
1.1.2 試劑及耗材
無水乙醇、濃硫酸、氫氧化鈉等(均為分析純),天津市福晨化學試劑廠;乙酸乙酯、己酸乙酯、乙酸戊酯等標準品(均為色譜純),美國Sigma-Aldrich公司;TAE 緩沖液,北京索萊寶科技有限公司;引物,上海生物工程股份有限公司;DNA Marker,Takara;瓊脂糖,南京生興生物技術有限公司;核酸染料Gengreen,上海賽百盛有限公司;土壤DNA 提取試劑盒(E.Z.N.A.Soil DNA Kit),Omega Bio-Tek公司。
1.1.3 儀器設備
CP1502 電子天平,上海奧豪斯儀器有限公司;HH-S6A 電熱恒溫水浴鍋,北京利偉永興儀器有限公司;PX2 型聚合酶鏈式反應(polymerase chain reaction,PCR)儀,上海賽默生物科技有限公司;DYY5 穩壓電泳儀,北京六一儀器廠;GeI Image System Tanon 1600 凝膠成像儀,上海天能科技有限公司;微量分光光度計,賽默飛世爾科技(中國)有限公司;Agilent 1200 高效液相色譜儀(紫外檢測),安捷倫科技(中國)有限公司;AutoSystem XL 氣相色譜儀,珀金埃爾默(中國)股份有限公司;ICS-3000 離子色譜儀,戴安(中國)有限公司;Clarns 600氣相色譜質譜聯用儀,珀金埃爾默(中國)股份有限公司;BSA224S 電子分析天平,德國sartorius 公司;固相微萃取頭(2 cm 50/30 μ m DVB/CAR/PDMS),美國Supelco 公司;Clarus 680-Clarus 600T 型氣相色譜-質譜聯用儀,Perkin Elmer公司。
1.2 實驗方法
1.2.1 大曲微生物群落組成檢測
(1)總DNA 的提取[8-9]。稱取不同類型高溫大曲5 g 液氮速凍后迅速研磨。大曲總DNA 提取方法按照土壤DNA 提取試劑盒(E.Z.N.A.Soil DNA Kit)說明書操作。為了保證所提取基因組的濃度及純度,對其進行PCR 擴增及產物純化,對細菌16S rRNA 基因的V3—V4 高變區進行擴增,所用引物為338F/806R(5ACTCCTACGGGAGGCAGCA-3/5-GGACTACHVGGGTWTCTAAT-3),對真菌的內部轉錄間隔區(ITS1)進行擴增,所用引物為ITS5F/ITS1R(5-GGAAGTAAAAGTCGTAACAAGG-3/5-GCTGCGTTCTTCATCGATGC-3)。擴增后用1%瓊脂糖凝膠電泳進行檢測。
(2)高通量測序。將檢測合格樣品送往蘇州帕諾米克生物醫藥科技有限公司,通過高通量測序(Illumina Miseq PE250)平臺進行高通量測序。
1.2.2 大曲風味物質檢測
每組曲樣中各取1.00 g 放入20 mL 頂空瓶,加入7.5 μ L 乙酸正戊酯內標溶液(質量濃度為0.8365 mg/g),在70 ℃條件下振搖15 min,萃取45 min,直接進樣。
GC 條件:色譜柱為Elite WAX ETR(30 m×0.25 mm×0.5 μ m);升溫程序,35 ℃保留2 min,以3 ℃/min升溫至120 ℃,保留2 min,以5 ℃/min升溫至200 ℃,以10 ℃/min 升溫至230 ℃,保留5 min;載氣為高純氦氣(純度99.999 %);載氣流量1.0 mL/min;不分流進樣;溶劑延遲時間1 min。MS 條件:離子源為電子轟擊離子源;離子源溫度230 ℃;傳輸線溫度230 ℃。萃取頭:50/30 μ m DVB/CAR/PDMS Stableflex(2 cm)。定性分析方法:未知化合物經計算機檢索的同時與標準譜庫對比鑒定,保留正負匹配度大于800 的組分。定量方法:根據內標峰面積與風味物質峰面積的比值,計算風味物質的相對濃度。
1.2.3 數據分析
每個樣品至少3 次重復,實驗數據以平均數±標準差(mean±SD)表示,顯著性差異以p<0.05 為標準。典范對應分析(Canonical correspondence analysis,CCA)和冗余分析(Redundancy analysis,RDA)采用CAVOCOV45軟件。Spearman指數采用SPSS 25 軟件分析,并采用Gephi 軟件繪制形成氣泡圖。
利用Excel 2019、IBM SPSS Statistics 25 等統計軟件進行數據處理和分析,利用Origin pro 2021、Excel 2019和網站https://www.omicstudio.cn/tool 進行作圖。
2 結果與分析
2.1 大曲貯存過程中微生物群落結構變化
2.1.1 大曲貯存過程中細菌群落變化
表1 為高溫大曲在貯存過程中的細菌群落α-多樣性,在貯存0 d、30 d、60 d的大曲中細菌群落豐富度和多樣性呈上升趨勢,說明高溫大曲在貯存過程中細菌群落的豐富度和多樣性顯著改變。

表1 貯存過程不同大曲微生物群落α-多樣性指數差異
從圖1a、圖1b 可以看出,貯存0 d 時高溫大曲的優勢細菌在門水平上主要是變形桿菌門(Proteobacteria),占總豐度的72.32%,貯存30 d、60 d 高溫大曲的優勢細菌在門水平上主要是厚壁菌門(Firmicutes),分別占總豐度的94.68%、93.23%。在細菌屬水平上,貯存0 d 時的優勢細菌屬是鹽單胞菌屬(Halomonas),而經過貯存30 d、60 d 后高溫大曲的細菌群落發生顯著變化,逐漸趨于穩定,在30 d時,鹽單胞菌屬(Halomonas)逐漸減少甚至消失,克氏假單胞菌(Kroppenstedtia)、枝芽孢菌屬(Virgibacillus)、海洋桿菌屬(Oceanobacillus)、芽孢桿菌屬(Bacillus)等對大曲、白酒香氣貢獻較突出的細菌微生物開始出現并逐漸成為優勢菌屬,尤其是芽孢桿菌屬(Bacillus)在貯存30 d 時占總豐度的1.21%,貯存60 d 后變為14.27%。研究表明,芽孢桿菌屬(Bacillus)能夠產生蛋白酶、淀粉酶、糖化酶來水解原料,形成豐富的發酵前體物質,有利于醬香風味物質的形成,是產醬香風味的重要貢獻菌株,如地衣芽孢桿菌、枯草芽孢桿菌等發酵能生成如吡嗪類、酸類、芳香類等風味物質,為醬香型白酒賦予了獨特風格,吡嗪類物質作為一種健康因子也是醬香型白酒優勢風味物質之一。

圖1 細菌門/屬水平相對豐度圖
2.1.2 大曲貯存過程中真菌群落變化
表2 所示為高溫大曲在貯存過程中的真菌群落α-多樣性,在貯存0 d、30 d、60 d 時真菌群落豐富度和多樣性呈上升趨勢,尤其在貯存0 d 到30 d時上升較為明顯,貯存30 d 到60 d 時略微上升,這可能與貯存的溫度與水分有關。
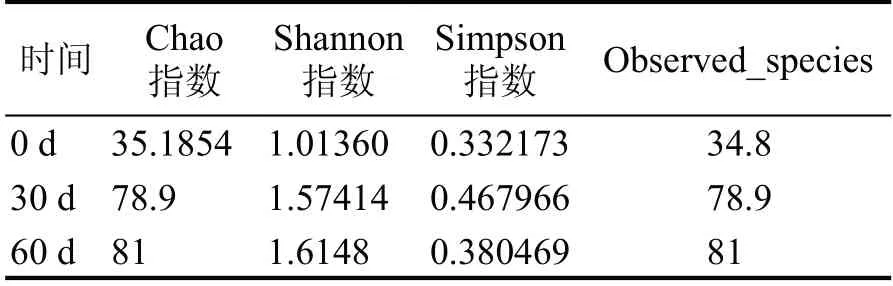
表2 貯存過程不同大曲微生物群落α-多樣性指數差異
3 種不同貯存期的高溫大曲共檢出170 個真菌屬OTU,如圖2a、圖2b 所示,貯存0 d、30 d、60 d 的優勢真菌門是子囊菌門(Ascomycota),在屬水平上貯存0 d、30 d、60 d 的優勢真菌屬分別是嗜熱真菌屬(Thermomyces)、嗜熱子囊屬(Thermoascus)、曲霉屬(Aspergillus)。嗜熱真菌屬(Thermomyces)是醬香型白酒發酵過程及清香型白酒曲曲心的優勢真菌,是白酒釀造過程中重要酶類的來源,大多能產生高活力且耐熱的纖維素酶、蛋白酶等,有利于微生物的繁殖生長及產酒產香[12-13]。貯存30 d 后,絲衣霉菌屬(Byssochlamys)、畢赤酵母屬(Pichia)開始出現,畢赤酵母屬屬于耐高溫酵母菌,是酒醅發酵過程中常見的能產乙醇和產酯的酵母菌屬之一。當貯存60 d 后,曲霉屬(Aspergillus)、絲衣霉菌屬(Byssochlamys)有所減少,曲霉屬(Aspergillus)逐漸趨于穩定。隨著貯存時間的延長,微生物結構在真菌水平上也逐漸達到穩定合理,證明了大曲貯存的重要性。

圖2 真菌門/屬水平相對豐度圖
2.2 大曲貯存初期風味物質變化
對不同貯存期(0 d、30 d、60 d)醬香型大曲進行風味物質檢測,3 種大曲共確定了39 種風味物質,如表3 所示,共分為8 類,其中醇類6 種、酸類7種、醛類4 種、酮類2 種、吡嗪類2 種、酯類11 種、烯烴類2 種、芳香族類5 種。醇類物質中異戊醇含量相對較高,在0 d 時最高為2.880 μ g/g;酸類物質中亞油酸含量相對較高,在60 d時最高為1.907 μ g/g,這可能與脂質的分解有關;醛類物質中2-吡咯甲醛含量相對較高,在60 d時最高為1.309 μ g/g;酮類物質中香葉基丙酮含量相對較高,在30 d 時最高為0.168 μ g/g;吡嗪類物質中2,3,5,6-四甲基吡嗪含量相對較高,在60 d 時最高為15.580 μ g/g,吡嗪類物質的形成可能與美拉德反應有關,可以賦予醬香型大曲堅果香和烘焙香等;酯類物質中棕櫚酸乙酯、3-羥基-2,2,4-三甲基戊基異丁酸酯、苯乙酸乙酯含量相對較高,均在60 d 時最高,分別為4.023 μ g/g、3.948 μ g/g、1.915 μ g/g;烯烴類物質中2,3-壬二烯含量相對較高,在0 d 時最高為1.000 μ g/g;芳香類物質中苯乙醇相對較高,在60 d 時最高為2.347 μ g/g。

表3 不同貯存時間大曲風味物質含量 (μ g/g)
2.3 貯存初期醬香型大曲風味物質的差異性分析
根據不同貯存時間醬香型大曲風味物質的種類和含量做韋恩圖和聚類分析熱圖,如圖3 所示。由圖3a 可知,不同貯存時間(0 d、30 d、60 d)醬香型大曲風味物質的共同成分有24 種,占風味物質總種類的61.54%。進一步分析發現,貯存時間0 d 和30 d 大曲共同成分有4 種,貯存時間30 d 和60 d 大曲共同成分3 種,0 d 和60 d 共同成分有1 種,貯存時間0 d、30 d 和60 d 醬香型大曲的獨有成分分別為1 種、3 種、3 種。由此可見,隨著貯存時間的延長,不同貯存時間大曲中共同成分減少,部分風味物質發生了轉化,但不同貯存階段的醬香型大曲均有其特有的風味物質,與柳習月等[18]的研究結果一致。
由圖3b 可知,貯存30 d 和60 d 的大曲聚為一類,貯存0 d的大曲單獨聚為一類。在貯存過程中,正戊醇、仲戊醇、2-丁基辛醇、糖醇、亞麻醇等醇類物質含量上升,異戊醇含量下降;亞油酸、草莓酸、異亞麻酸含量上升,癸酸和壬酸的含量下降;醛酮類物質中只有癸醛含量下降;吡嗪類物質中2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪含量均上升;酯類物質中正己酸乙酯、3-羥基-2,2,4-三甲基戊基異丁酸酯、十五烷酸、2,6,10,14-四甲基甲酯、苯乙酸乙酯、丁酸庚酯、硬脂酸乙酯、棕櫚酸乙酯、月桂酸乙酯、油酸乙酯等酯類含量上升,其余酯類含量下降;貯存過程中烯烴類物質含量均下降;芳香類物質中苯酚含量下降,其余物質含量上升。整體上看,貯存過程中大曲風味物質含量整體上升,60 d時最高。
由圖3c 可知,在貯存過程中,大曲中醇類、酸類、醛類、吡嗪類、酯類、芳香類等物質含量均增加,除酮類物質在30 d 時最多外,其余風味物質均在60 d 時含量最高。風味物質中含量最高的三類分別是醇類、酯類和酸類。醇類物質含量范圍為3.389~6.089 μ g/g,酸類物質含量范圍為0.685~3.483 μ g/g,醛類物質含量范圍為0.607~2.453 μg/g,酮類物質含量范圍為0.020~0.267 μ g/g,吡嗪類物質含量范圍為1.596~16.654 μ g/g,酯類物質含量范圍為4.651~47.777 μ g/g,芳香類物質含量范圍為0.810~4.782 μ g/g。

圖3 不同貯存期大曲風味物質分析
2.4 貯存初期醬香型大曲微生物與其風味物質的關聯性分析
醬香型高溫大曲以小麥為原料,富含蛋白質和酶,在微生物的作用下產生各種風味物質。貯存是醬香型高溫大曲的必要階段,探究在貯存階段大曲中微生物群落和風味物質的變化,有利于加深對醬香型高溫大曲的認識,了解風味物質與微生物間的潛在聯系,從而更好調控大曲的貯存和生產。本文在分析了醬香型大曲貯存初期差異微生物和差異風味的基礎上,利用spearman 相關系數分析醬香型大曲貯存初期優勢差異菌屬間與特征風味物質間的互作關系,若相關系數大于0.6 且P<0.05,則定義為具有顯著相關性。如圖4 可知,苯乙酸乙酯、丁酸乙酯、硬脂酸乙酯等酯類物質主要與細菌屬存在關聯性,如芽孢桿菌屬(Bacillus)、海洋桿菌屬(Oceanobacillus)、鹽單胞菌屬(Halomonas)等細菌屬,除此之外,酯類物質還與真菌屬、畢赤酵母屬(Pichia)等酵母屬存在強正相關性。前人研究發現酯類主要合成途徑是醇和酸在酯化酶的作用下合成,都需要真菌和細菌在白酒發酵過程中參與完成的。芽孢桿菌屬(Bacillus)、海洋桿菌屬(Oceanobacillus)等細菌屬與亞油酸、草莓酸、癸酸等酸類物質存在正相關性,與之前文獻報道的相似。芽孢桿菌屬(Bacillus)、海洋桿菌屬(Oceanobacillus)與四甲基吡嗪、三甲基吡嗪等吡嗪類化合物存在正相關,與醬香型大曲高溫制曲發生的美拉德反應有關系,也是醬香型高溫大曲的標記性微生物和優勢微生物。

圖4 微生物和風味成分的相關性網絡圖
3 結論與展望
基于高通量測序技術和色譜分析技術探究了醬香型高溫大曲在貯存初期微生物結構組成以及風味物質變化,并通過關聯性分析解析了造成高溫大曲在貯存過程中特征風味差異的內在原因。從微生物層面來看,貯存初期高溫大曲的微生物群落結構在細菌和真菌上均存在顯著差異。在細菌方面,海洋桿菌屬(Oceanobacillus)、芽孢桿菌屬(Bacillus)等耐高溫細菌屬隨著貯存時間的延長逐漸占據優勢,與亞油酸、草莓酸、癸酸等酸類物質存在正相關;畢赤酵母屬(Pichia)等優勢酵母屬與酯類物質合成存在正相關性,主要是結合產酸細菌通過酯化反應生成大量的酯類物質,與微生物及風味的相關性分析結果相符合;芽孢桿菌屬(Bacillus)與四甲基吡嗪、三甲基吡嗪等吡嗪類物質存在正相關性,醬香型大曲總體氨基酸代謝程度在貯存初期時比較強烈,主要是醬香型高溫大曲在制作和貯存過程中溫度較高,使耐高溫的微生物存活下來,并隨著貯存時間的延長逐漸成為優勢菌屬,從而形成了醬香型大曲區別與其他香型大曲的獨特風味。
本試驗通過研究醬香型大曲在貯存初期主要優勢微生物與典型風味物質的變化,通過關聯性分析解釋其潛在聯系。本研究對醬香型大曲貯存初期的微生物變化進行了探討分析,解析了微生物群落結構隨著貯存時間的變化所帶來的大曲風味成分的變化,對于企業在制作醬香型高溫大曲時最佳貯存時間的確定提供了參考性建議和指導,受大曲樣品取樣及數量的局限性和風味檢測的不穩定性等影響,還需要在大曲實際生產中進行追蹤和確定;對于利用大曲中主要功能微生物的強化提高醬香型中主要風味以及提升大曲的典型性提供了一定的理論基礎,并對其進行功能微生物的篩選和功能驗證對大曲進行強化,將其應用到實際的白酒釀造中。基于此研究期望能夠在保證醬香型白酒特征風味的基礎上,提高整體品質和質量。

