鐵絲網強化陰極電化學系統的構建及硝酸鹽去除性能研究
安曉茹,劉恒源,趙晶,康佳美,張若男,于亞楠
(赤峰學院 化學與生命科學學院,內蒙古 赤峰 024000)
作為水資源的重要組成部分,地下水已成為世界上大部分地區工業、農業和城市重要的用水來源,尤其是在我國北方地表水較為稀缺的部分地區,地下水已經作為居民的重要飲用水來源[1]。2016 年1 月水利部發布的《地下水動態月報》顯示,我國農村以及城市近郊地區,地下水污染問題已經變得越來越嚴重。例如,施肥農田排水、大多數生活污水、工業廢水中含有氮,這些水直接用于灌溉引起的地下水中硝酸鹽污染日益嚴重[2]。地下水氮污染不僅對生態環境造成影響,還危害人體健康[3]。此外,亞硝酸鹽還會影響智力,引起反應遲鈍,甚至誘發消化系統癌變[4]。因此,采取有效的防治與保護措施以降低地下水中硝酸鹽含量,對于保障人們的日常生活十分重要。
目前去除水中硝酸鹽的方法主要有生物法[5]、物理法[6]和化學法[7]。生物反硝化法的條件極為嚴苛,需要缺氧或者厭氧環境,在微生物的作用下將NO3--N 或者NO2--N 還原成氮氧化物或N2,且此法運行周期長,操作非常復雜。物理法包括蒸餾法、反滲透法和離子交換法等[8-11],也存在處理費用較高、選擇性不確定、會對環境造成二次污染等缺點[12]。
與傳統的物理化學以及生物處理技術相比較,電化學去除硝酸鹽技術主要通過電子傳遞過程實現硝酸鹽陰極還原及其副產物的陽極氧化,經過連續的還原氧化循環過程,最終將硝酸鹽轉化去除。與其他化學還原硝酸鹽技術相比較,電化學處理技術具有不需要添加其他藥劑、操控性強、可以通過開關快速開啟或者停止化學反應、操作方便、設備簡單、受外界環境影響較小等優點[13]。
李敏[14]研究了7 種電極材料(Fe-Si 電極、Ti-Pd 電極、Ti-Pd-Cu 電極、Cu-Ni-Zn 電極、Ni-S 電極、Fe 電極、Cu 電極)作為陰極,Pt 絲作陽極,在不同電位下對硝酸鹽的脫氮效果,該研究對于去除硝酸鹽污染經濟有效,但還存在一些技術問題。丁夢等[15]構建分別以鈦板和鋁板作為電極板的電化學體系,探究串聯電池板數量、pH 以及能量消耗與太陽光利用效率等對硝酸鹽氮的去除效果。研究表明,在一定范圍內增加太陽能板的數量,在最佳pH 下可以有效去除硝酸鹽氮,但過程耗時且操作繁瑣。劉芳等[16]探究了電化學系統中反應器、電極、電源、電解液等對硝酸鹽去除的影響,結果表明,無參比電極、無隔膜、無攪拌器的反應器效率大幅提高,但在實驗過程中存在副反應以及電力消耗大等問題。匡珮菁[12]構建了一種添加鐵絲網的三維高效電化學系統進行實驗,結果表明硝酸鹽還原效率可提高至90%,但反應結束后有氨氮積累。
針對以上研究及影響,本研究通過改進傳統的電化學去除方法,在陰陽極之間加入鐵絲網強化電化學系統用于去除地下水中的硝酸鹽。主要探究陰陽極(鐵板和鐵絲網、釕銥鈦板與釕銥鈦網)、二維體系及三維體系、電解質的量等因素對去除硝酸鹽的影響。
1 實驗部分
1.1 實驗用水
采用人工配制的硝酸鹽污染模擬地下水為實驗用水,在水中加入0.3036 g/L 的硝酸鈉(NaNO3),使溶液中硝酸鹽含量達到約50.00 mg/L。同時,將氯化鈉(NaCl)添加到溶液中,以增加溶液的導電性。實驗用水配制和藥品使用參考前期研究[17]。
1.2 實驗裝置
電化學反應器裝置主要由電解池反應器(長方形單室電解槽的有效容積為300 mL)、直流電源(PS-3005D,兆信,中國)、陽極和陰極構成(圖1)。實驗中選取釕銥鈦板/網為陽極材料(基材:鈦板,涂層:二氧化銥、二氧化釕)、鐵板/鐵絲網作為陰極材料,極板尺寸均為11 cm×6 cm。
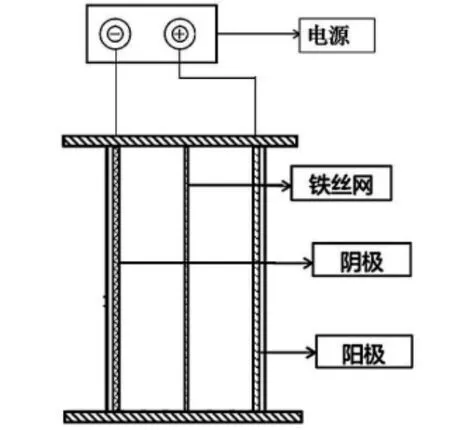
圖1 電化學反應器裝置圖
1.3 實驗過程
每次將300 mL 硝酸鹽污染模擬地下水添加到反應器內,以探究不同的實驗條件下(陰陽極材料、不同電解質的添加量和三維電化學體系中鐵絲網的位置和數量)硝酸鹽的去除效果。每組電化學反應器運行時間為120 min,每隔20 min 用注射器從反應器內取出液體,測量NO3--N、NO2--N以及NH4+-N 的濃度。
1.4 水質檢測和分析方法
用紫外分光光度計測量水樣中硝酸鹽氮(NO3--N)、亞硝酸鹽氮(NO2--N)以及氨氮(NH4+-N)化合物中氮的含量。具體方法參考相關文獻[12,17]。
1.5 動力學擬合
為了進一步量化硝酸鹽還原過程中NO3--N濃度隨時間的變化情況,采用動力學方程對過程中的反應速率常數進行計算,NO3--N 的還原過程符合偽一級動力學過程,反應式如下[13]:

式(1)中:C 為t 時刻的硝酸鹽濃度,mg/L;C0為初始硝酸鹽濃度,mg/L;k 為反應速率常數,min-1;t 為反應時間,min。
2 實驗結果與討論
2.1 陽極對硝酸鹽還原的影響
以鐵板作陰極,釕銥鈦網和釕銥鈦板分別作陽極,探究硝酸鹽、亞硝酸鹽和氨氮的濃度變化。如圖2 所示,在電流為0.75 A、電解質NaCl 濃度為1 g/L 的條件下,電解120 min 后,釕銥鈦網作陽極和釕銥鈦板作陽極硝酸鹽氮的濃度分別從50.01 mg/L 和50.08 mg/L,下降至25.12 mg/L 和26.07 mg/L,去除率分別為49.77%和47.94%。以上結果顯示,硝酸鹽氮的去除效果相差不大,但對于亞硝酸鹽,使用釕銥鈦板作為陽極反應過程中亞硝酸鹽產生的量多,且亞硝酸鹽是一種毒性較大的副產物,因此在評估經濟、環保、硝酸鹽的去除效率和亞硝酸鹽的生成等因素后,后續實驗使用釕銥鈦網作陽極。此外,以釕銥鈦網和釕銥鈦板分別作為陽極進行實驗后,兩組電化學反應器中均沒有氨氮的產生。
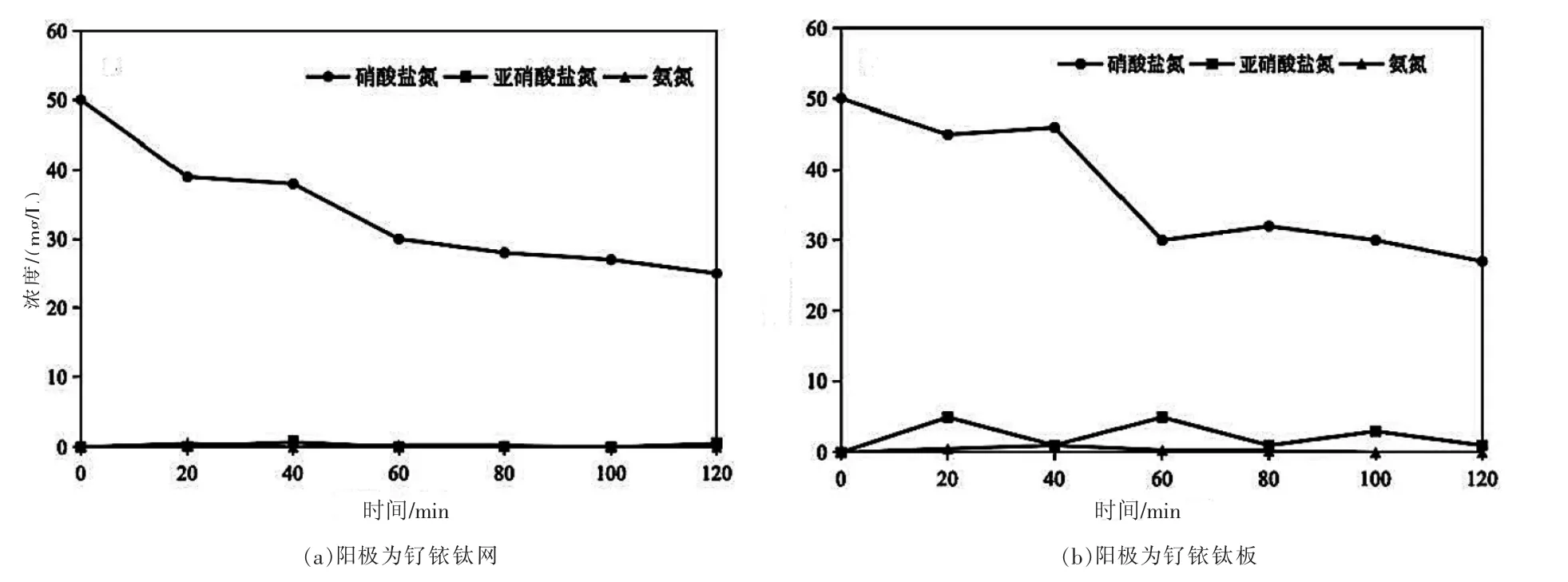
圖2 不同陽極下硝酸鹽氮、亞硝酸鹽氮和氨氮濃度隨時間變化圖
2.2 鐵絲網和鐵板陰極對硝酸鹽還原的影響
以釕銥鈦網作為陽極,鐵板和鐵絲網分別作為陰極進行對比實驗。如圖3 所示,在電流為0.75 A、電解質NaCl 濃度為1 g/L 的條件下,電解120 min 后,陰極為鐵板的一組,硝酸鹽氮濃度由49.06 mg/L 下降到26.70 mg/L,去除率達45.57%;當以鐵絲網作為陰極,硝酸鹽氮濃度由52.81 mg/L 下降到30.40 mg/L,去除率達42.43%。從圖3 可以看出,鐵板和鐵絲網對硝酸鹽去除率的影響并無太大差別,且兩組實驗條件下反應器內均無亞硝酸鹽和氨氮積累,但從經濟角度考慮,鐵絲網比鐵板成本更低,因此后續實驗使用鐵絲網作為陰極構建電化學反應器。
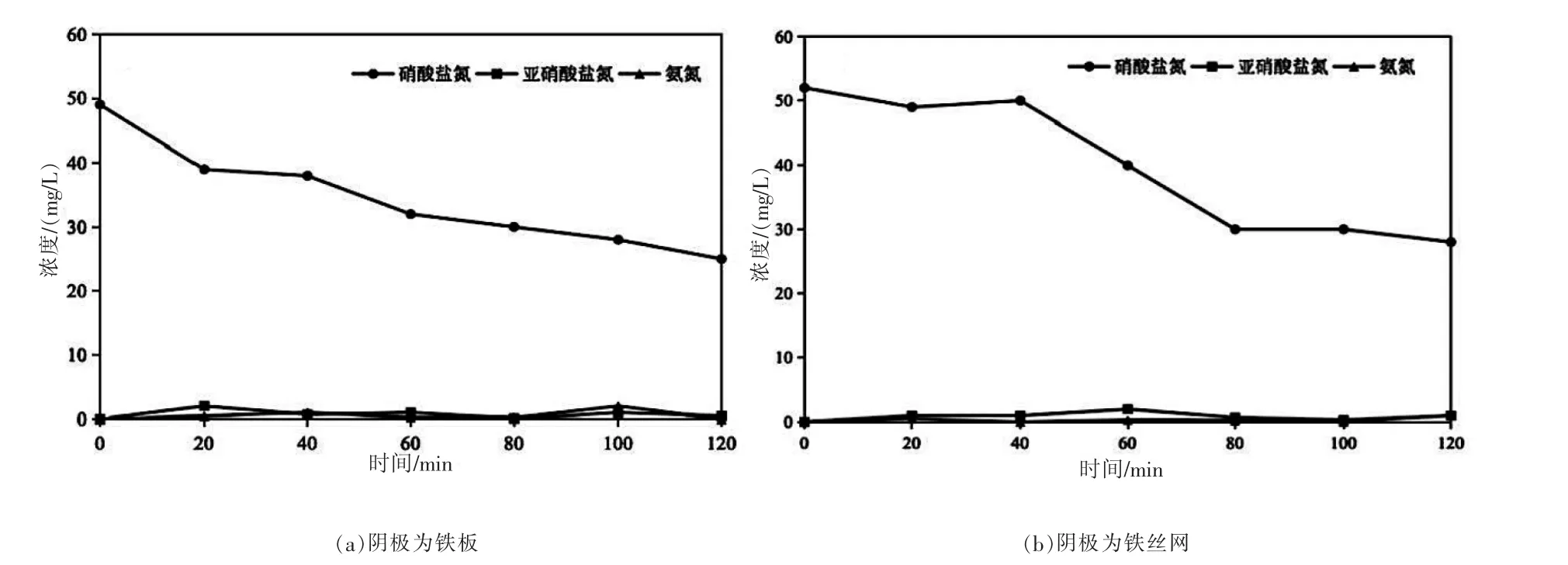
圖3 不同陰極下硝酸鹽、亞硝酸鹽和氨氮鹽濃度隨時間變化圖
2.3 三維體系中鐵絲網位置對硝酸鹽還原的影響
將一片鐵絲網放置于陰、陽極之間的不同位置會對硝酸鹽電化學還原行為產生影響。以圖4(a)鐵絲網作陰極,釕銥鈦網作陽極,陰陽極中間無鐵絲網添加的二維體系為對照組;圖4(b)將一片鐵絲網放置于陽極附近構建三維電化學體系,圖4(c)將一片鐵絲網放置于陰極附近構建三維電化學體系。在電流為0.75 A、電解質NaCl 濃度為1 g/L 的條件下,電解120 min 后,硝酸鹽的濃度分別下降至32.21 mg/L、9.14 mg/L 和17.83 mg/L(p<0.05),去除率分別為39.79%、82.56%和68.32%,表明改變陰極結構對硝酸鹽還原效率具有顯著影響。
從圖4 中可以很明顯地看出三,維體系比傳統二維體系還原硝酸鹽的效果更為顯著,且鐵絲網靠近陽極比靠近陰極時硝酸鹽的去除效率更高。在鐵絲網添加存在的傳統電化學還原系統中,硝酸鹽在向陽極遷移的過程中無法被還原,同時陰、陽極之間較長的距離也會降低物質傳遞速率,導致硝酸鹽還原效率較低[12]。而由于鐵絲網夾在兩電極之間會形成導體,促進電子傳遞。鐵絲網靠近陽極時,聚集在陽極附近的硝酸鹽因濃度過高,使鐵絲網成為極化電極,硝酸鹽在其表面即可被還原,相當于縮短了電極間距,降低了電阻率,提高了硝酸鹽還原速率,并且在實驗過程中觀察到鐵絲網在靠近陽極的一側會生成大量氣泡,有文獻表明該氣體為氫氣[18],氫氣也會參與硝酸鹽的還原過程。此外,放置于陽極附近的鐵絲網可為硝酸鹽還原提供更多反應位點,提高系統內傳質速率,從而促進硝酸鹽還原。而鐵絲網靠近陰極時,因陰極的還原反應大大降低了硝酸鹽的濃度,鐵絲網在低導電性下無法被極化,也就無法達到鐵絲網靠近陽極時的效果。同時,在實驗結束后,觀察到置于陽極附近的鐵絲網在電解后相對系統陰極一側的表面粗糙,且出現結晶和腐蝕現象,而置于陰極附近鐵絲網無明顯腐蝕現象。對陽極附近鐵絲網表面物質進行XRD分析并對沉淀物不同成分的質量分數進行計算分析如圖4(d),結果表明鐵絲網上出現的結晶為FeOOH、Fe3O4和少量的Fe(OH)3,且FeOOH 所占比例最大,為62.5%,其次為Fe3O4,所占比例為21.8%,Fe(OH)3所占比例為15.7%。這一結果與前期的研究結果一致,鐵腐蝕后所形成的腐蝕產物通常為二價鐵和三價鐵的混合物[18]。
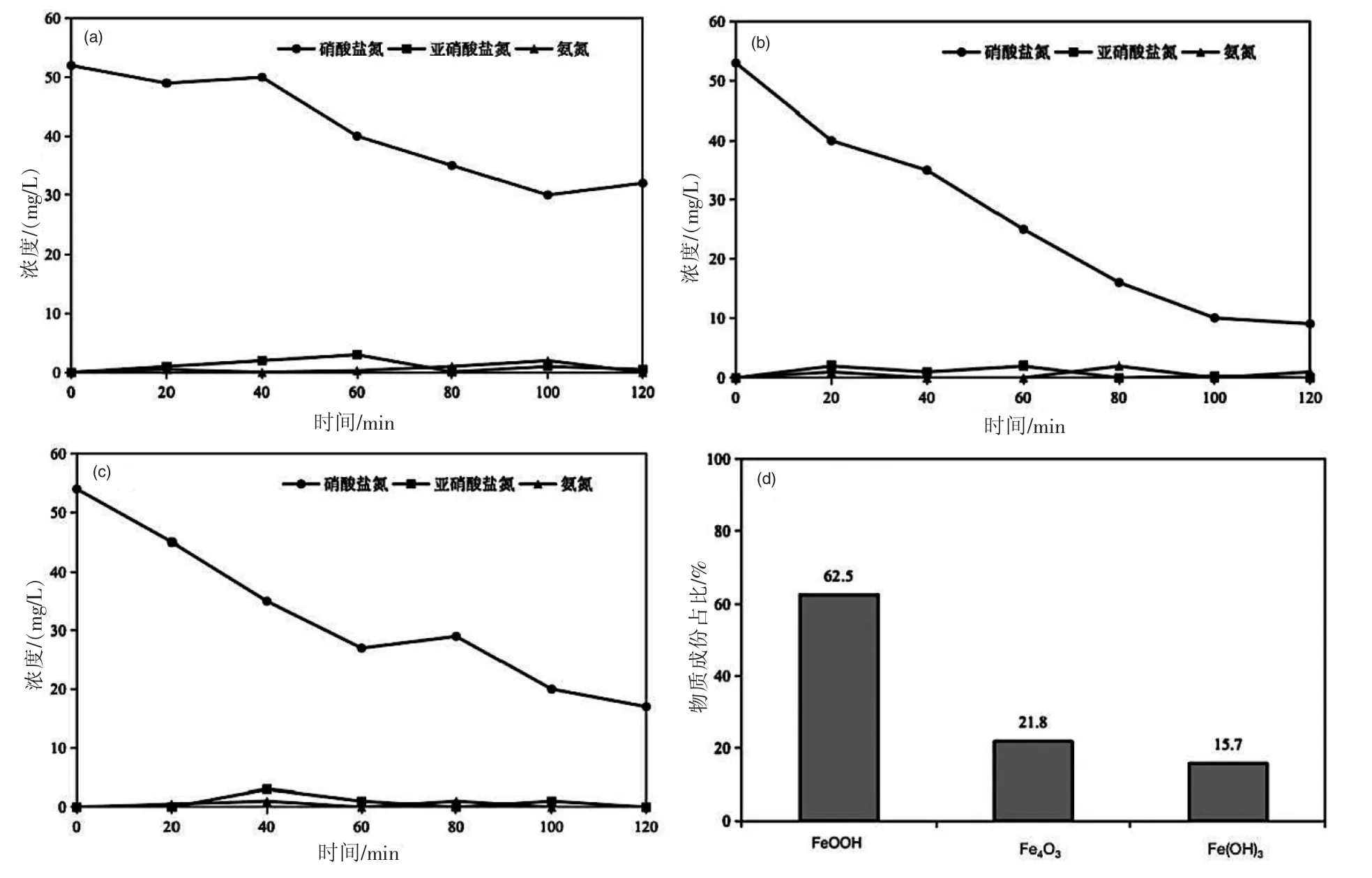
圖4 (a)~(c)無鐵絲網和不同位置鐵絲網電解過程中硝酸鹽、亞硝酸鹽和氨氮鹽濃度隨時間變化圖((a)無鐵絲網添加;(b)鐵絲網靠近陽極的三維體系;(c)鐵絲網靠近陰極的三維體系);(d)陽極附近鐵絲網表面沉淀物主要成分及其所占比例分析圖
在利用具有不同結構的鐵陰極電解過程中幾乎無亞硝酸鹽積累,這是由于亞硝酸鹽是一種不穩定的副產物,會在電解過程中快速轉化為氨氮或硝酸鹽,亞硝酸鹽的轉化過程不會受到電解條件的顯著影響。
2.4 鐵絲網數量對硝酸鹽還原的影響
如圖5 所示,以鐵絲網作陰極,釕銥鈦網作陽極時,分別在靠近陽極一側放置1 片鐵絲網、2片鐵絲網、3 片鐵絲網和4 片鐵絲網,探究鐵絲網數量對硝酸鹽還原的影響。在電流為0.75 A,加入1 g/L 電解質的條件下,電解120 min 后,陽極附近加入1 片鐵絲網時,硝酸鹽氮去除率為81.13%;加入2 片鐵絲網時,硝酸鹽氮去除率為83.67%;加入3 片鐵絲網時,硝酸鹽氮去除率為89.79%;加入4 片鐵絲網時,硝酸鹽氮去除率在80 min 時為89.58%,在100 min 時達到100%。從實驗結果可以看出,當放置3 片、4 片鐵絲網時對硝酸鹽的還原效果最好,這是由于鐵絲網數量的增加,促進了電子轉移及氫氣的生成,進而提高了硝酸鹽氮的還原速率。作為一種中間產物,亞硝酸鹽不穩定易被轉化為其他含氮產物,因此在各組實驗中均不存在亞硝酸鹽積累。此外,不同實驗條件下電化學系統中均未檢測到氨氮,說明本系統中硝酸鹽通過電化學還原可能轉化為含氮氣體。同時,本研究所構建的三維多孔陰極廉價易得,有利于實際應用。
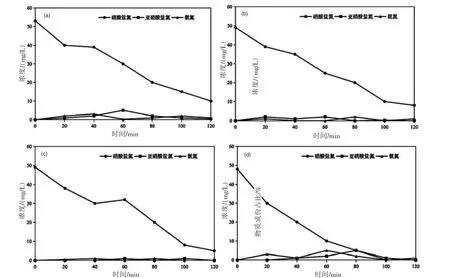
圖5 陽極附近不同數量鐵絲網硝酸鹽、亞硝酸鹽和氨氮鹽濃度隨時間變化圖((a) 1 片鐵絲網;(b) 2 片鐵絲網;(c) 3 片鐵絲網;(d) 4 片鐵絲網)
表1 比較了在陽極附近加入不同數量鐵絲網時系統的硝酸鹽去除率、去除速率和能耗。當陽極附近分別放置0、1、2、3 和4 片鐵絲網時,在電流為0.75 A,電解120 min 后,硝酸鹽的去除速率分別為0.19 mg/(L·min)、0.35 mg/(L·min)、0.34 mg/(L·min)、0.37 mg/(L·min)和0.48 mg/(L·min),說明本研究利用鐵絲網串聯所構建的三維多孔鐵陰極具有較好的連通結構,減少擴散阻力并提高反應動力學。因此,本研究所構建的三維多孔陰極具有較完善的三維傳質體系,使硝酸鹽轉化過程的傳質阻力較低,有利于提高硝酸鹽還原速率。反應器的能耗分別為29.36 kWh/n-nitrate-N、31.67 kWh/n-nitrate-N、27.77 kWh/n-nitrate-N、27.60 kWh/n-nitrate-N 和30.36 kWh/n-nitrate-N。表明增加陰、陽極之間鐵絲網片數可縮短電極間距,促進電子傳遞,提高硝酸鹽還原效率和去除速率,但同時會增加反應器內能耗,因而在以后實驗中應采用響應曲面設計分析,綜合考慮能耗和硝酸鹽去除率,選取最佳鐵絲網放置數量。
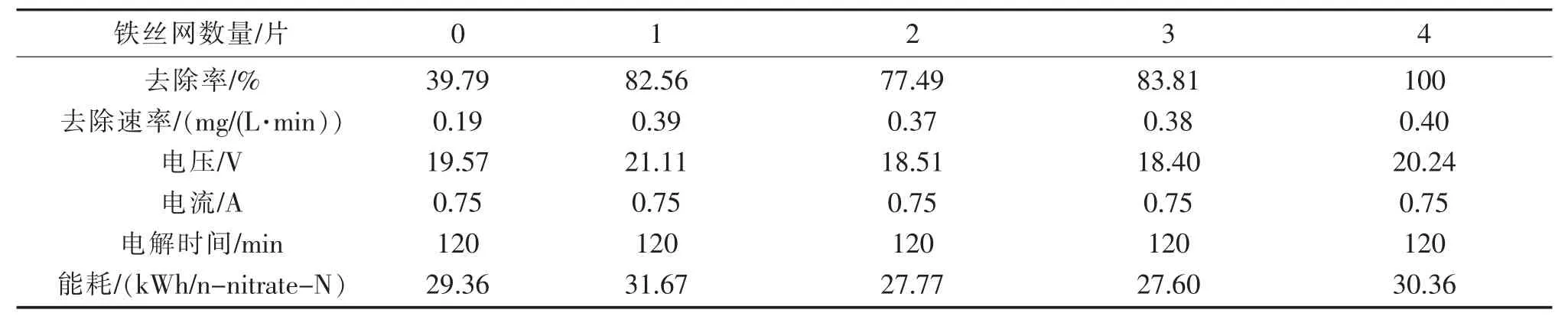
表1 陽極附近加入不同量鐵絲網后在系統內硝酸鹽的去除率、去除速率、電壓和能耗
2.5 電解質濃度對硝酸鹽還原的影響
在陰極為鐵絲網,陽極為釕銥鈦網,兩電極之間放置4 片鐵絲網的體系中,控制電流為0.75 A,進行兩組電解質濃度對硝酸鹽還原影響的對比實驗。如圖6 所示,當系統中NaCl 濃度分別為1 g/L和2 g/L 時,電解120 min 后,兩組電解裝置中的硝酸鹽氮去除率分別為100%和62.52%。電解質的作用是增加溶液的導電性,以提高硝酸鹽的還原速率,然而NaCl 中的Cl-會與NO3-發生競爭吸附,從而減少接近于電極表面的硝酸鹽數量,降低還原速率。同時,當NaCl 濃度為2 g/L 時,隨著硝酸鹽的還原形成了NH4+-N 積累,在電解120 min 過程中,NH4+-N 濃度逐漸升高至8.91 mg/L。同時,NO2--N 在電解過程中逐漸積累至電解結束,其濃度在最初的60 min 內增加至最高值4.12 mg/L,隨后逐漸減少。

圖6 不同電解質濃度反應器內硝酸鹽、亞硝酸鹽和氨氮鹽濃度隨時間變化圖
2.6 溫度對硝酸鹽去除的影響
通常情況下,溫度對溶液中離子的傳輸速率具有顯著影響,進而影響物質的反應速率。本研究構建的強化電化學系統針對地下水中的硝酸鹽污染,而實際地下水溫度較低,且溫度隨季節和地域變化較大,因此有必要探究溫度對硝酸鹽去除的影響,為電化學去除地下水中硝酸鹽的實際應用提供依據。在不同溫度條件下(0 ℃、15 ℃、30 ℃和45 ℃),在0.75 A 的恒電流條件下,對初始濃度為50 mg/L 的硝酸鹽氮溶液進行電解,硝酸鹽氮的濃度隨反應的變化見圖7。從圖7 可以看出,硝酸鹽氮的濃度隨電化學反應的進行逐漸降低。溫度分別為0 ℃、15 ℃、30 ℃和45 ℃時,電解120 min 后,硝酸鹽氮的濃度由50 mg/L 分別降為31.16 mg/L、19.32 mg/L、0.12 mg/L 和0.05 mg/L,此時去除率分別為37.68%、61.63%、99.76%、99.90%。這是由于在較高溫度下,硝酸鹽在溶液中的傳質效率較高,且在電極表面的吸附強度增大,因此具有較高的硝酸鹽還原性能[19-20]。結果表明,在溫度較低(15 ℃)環境下,硝酸鹽的去除率也能達到61.36%,說明本研究所構建的強化電化學系統具有較高的適應性,既能在較高溫度的環境中保持近100%的去除,也能在較低的地下水環境中有效去除硝酸鹽。
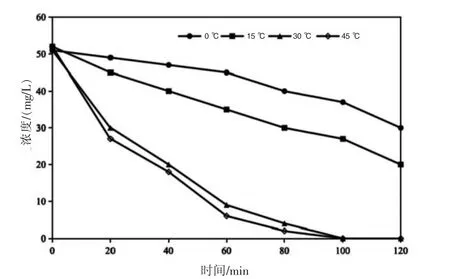
圖7 不同溫度下硝酸鹽氮濃度隨時間變化圖(陰極為鐵絲網,陽極為釕銥鈦網,4 片鐵絲網)
3 結論
本實驗構建電化學裝置,探究其對于地下水中硝酸鹽的還原效果,通過不同電極材料、不同維度體系、不同鐵絲網數量和不同電解質濃度進行實驗,結果表明,使用鐵絲網作陰極、釕銥鈦網作陽極,在陽極附近放置4 片鐵絲網及電解質為1 g/L NaCl 時反應器的性能最好,電解100 min 時硝酸鹽的去除率可達100%,無副產物亞硝酸鹽和氨氮的積累,且能夠適應較低溫度的地下水環境。本研究所構建的三維多孔鐵陰極具有較大比表面積和良好的三維網孔結構,為硝酸鹽還原提供較多反應位點,同時降低傳質阻力,可將硝酸鹽還原效率有效提高,且該方法具有運行成本較低和操作簡便等優勢,有利于實際應用。

