P300介導VEGF下調致孕期酒精暴露模型子代小鼠宮內生長受限*
倪美艷 王一清 付虎 向龍 周瑜
(1.成都市第一人民醫院新生兒科,四川 成都 610016;2.成都市第一人民醫院產科,四川 成都 610016;3.四川大學華西第二醫院兒童重癥醫學科,四川 成都 610041)
孕期酒精攝入可引起胎兒酒精綜合征(Fetal alcohol syndrome,FAS),其主要以宮內發育遲緩、神經系統發育遲滯、心臟及顱面發育畸形為主要臨床特征[1-3]。目前存在飲酒習慣的女性人數日趨上升,有研究[4]證實,即使在孕早期聚會飲酒也可導致FAS發生。因此FAS發生機制的探討仍然十分重要。在FAS眾多并發癥中,出生低體重常被忽視,因為嬰兒生后多數會出現體重追趕。但出生低體重提示胎兒宮內生長受限,目前肥胖、糖尿病、高血壓等代謝性疾病與宮內發育相關的學說已被學者所接受,出生低體重與成年后代謝性疾病發生密切相關[5-8]。已有研究[9]發現孕期酒精暴露可致子代心臟發育過程中組蛋白乙酰化修飾紊亂,而P300是介導組蛋白乙酰化修飾的關鍵酶之一,其對基因轉錄調控的作用已為學者所公認[10],因此p300介導的組蛋白修飾為FAS的病理機理研究提供新方向。孕期酒精攝入可致后代宮內發育遲緩而出現出生低體重,因此本研究構建了FAS模型小鼠,以組蛋白乙酰化修飾為研究切入點,探討孕期酒精暴露致子代宮內生長受限的可能機制。
1 材料與方法
1.1 動物模型構建 選取SPF級c57小鼠(購于四川大學華西基礎醫學院動物中心)60只。按照雌雄2:1合籠,次日清晨觀察雌鼠陰栓,有陰栓者即為妊娠成功(妊娠成功30只),記妊娠0.5 d,即胎鼠胎齡E 0.5 d。此時開始給予孕鼠50%酒精灌胃,劑量為5 μL/g/d,連續灌胃14 d,設為實驗組,酒精灌胃劑量參照文獻設定[10-11],灌胃14 d后小鼠處于胚胎14.5 d,此時期四腔心結構已形成;另設對照組,予生理鹽水(0.9% NaCl)灌胃。實驗組及對照組每組各12只(6只雌鼠灌胃失敗未納入實驗)。實驗終點(E 19.5 d)利用二氧化碳(CO2)處死實驗動物,隨即取出胎盤組織。本研究符合動物倫理要求,通過醫院倫理委員會審核批準(批準號:2020028)。
1.2 主要試劑和儀器 100%乙醇(Sigma試劑,上海);抗VEGF小鼠抗體(Abcam,ab46154);抗β-actin小鼠抗體(Abcam,ab8227 );ChIP級抗p300小鼠抗體(Abcam,ab54984)、染色質免疫功共沉淀試劑盒(Abcam,ab500);HDAC酶及HAT酶活性檢測試劑盒(Biovision);二抗IgG(Abcam190475);全蛋白提取試劑盒(凱基生物,KGP250);RNA提取試劑盒(Solabio,R1200);逆轉錄試劑盒(Qiagen 205111);熒光定量PCR試劑盒(賽默飛 A25741)。
1.3 方法
1.3.1 檢測E19.5 d胎鼠重量 孕鼠分娩期為妊娠后20~21 d,故在妊娠19.5 d,剖宮產獲取胎鼠及胎盤組織。對E19.5 d胎鼠進行體重稱量,小鼠生后每周稱量體重至4周。本次研究中無早產小鼠。
1.3.2 化學比色法及熒光檢測法 獲取新鮮胎盤組織后隨即予以勻漿,勻漿后按照HDACs和HATs活性測定試劑盒指示,對胎盤組織中HATs和 HDACs活性進行檢測。
1.3.3 實時定量PCR實驗 按照RNA提取試劑盒說明提取組織中總RNA,定量1ug,進行逆轉錄獲得cDNA,進行后續熒光定量PCR實驗。各基因引物序列:p300上游5′-GAGACGCATAGGAATTTGC-3′ 下游5′-AGAGGCCTGGG TCTGACAT-3′,產物136 bp;PCAF的上游5′-ATACCTTCTCGGATGTCTGAT-3′,下游5′-TGGAGCTAACGATAAGTACCA-3′,產物133bp;VEGF上游5′-CGTGAATCAGTACACTAGT-3′ 下游5′-ACTGCTTAAGTCGTGCTCATG-3′,產物長度為125 bp;β-actin作為內參基因。Bio-Rad-CFX96 熒光定量PCR 儀器“gene expression”模塊(基于Pfaffl 原理)對各基因相對β-actin表達量進行統計、分析。
1.3.4 Western blot實驗 利用前文所及全蛋白提取試劑盒對組織中總蛋白,利用BCA法進行標準曲線繪制,并計算各組蛋白濃度。SDS-聚丙酰胺凝膠選擇濃度未10%,蛋白上樣量為30 μg,90v電泳30 min后換電壓至120 v電泳至溴酚藍接近膠底部。250mA濕轉1.5 h至0.22 μm的PVDF膜上。封閉液(5%脫脂奶粉)1 h后孵育一抗,4 ℃ 16 h;洗膜后孵育 二 抗(1∶3000)1.5 h(室溫),PBST洗膜后發光成像。統計各組條帶灰度值,β-actin為內參,計算蛋白的相對表達量(利用Quantity one軟件)。
1.3.5 染色質免疫共沉淀(Chromatin immunoprecipitation,ChIP)實驗 按試劑盒指示進行染色質免疫共沉淀實驗:①稱取胎盤組織100 mg,充分勻漿,棄上清后加入1%的甲醛進行交聯反應。②利用超聲將大片段DNA進行切割,片段長度介于200~1000 bp為宜。③加入p300 ChIP 級抗體,在4 ℃下沉淀目的DNA。④65 ℃條件下進行逆轉交聯,并進行DNA純化,所得DNA進行后續PCR實驗。
1.3.6 ChIP-qPCR實驗 針對VEGF基因啟動子區域利用Primer Premier 5.0軟件進行引物設計。引物blast比對無誤后送公司合成。VEGF的上游序列:5′-GCCGTAATTACGCTGGCTTACCA-3′,下游序列:5′-CGCATATGACGCGATGACATGGT-3′,產物大小為169 bp。
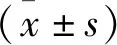
2 結果
2.1 子代小鼠出生重量及生后體重 新生小鼠生后當天即進行稱重,實驗組小鼠E19.5 d體重(0.93±0.12)g,較對照組(1.33±0.13)g明顯降低(P<0.01)。小鼠生后每周稱量體重至4周,生后1周、2周實驗組小鼠體重仍落后于對照組(P<0.05),提示生長發育落后。見表1。

表1 子代小鼠體重Table 1 F1 birth weight
2.2 胎盤組織中HATs及HDACs酶活性 胎盤組織中HATs酶活性實驗組明顯低于對照組(P<0.01);總HDACs酶活性兩組比較差異無統計學意義(P>0.05),見圖1。

圖1 兩組HATs及HDACs活性檢測Figure 1 HATs and HDACs activities in different groups注:與對照組比較,①P<0.05
2.3 VEGF、p300和PCAF 基因轉錄表達水平 VEGF在實驗組胎盤組織中mRNA水平較對照組顯著降低(P<0.01);與對照組相比,p300在實驗組胎盤中表達顯著降低(P<0.05);而PCAF表達在兩組間差異無統計學意義(P>0.05)。見圖2。

圖2 p300、PCAF和VEGF mRNA相對表達量Figure 2 mRNA expression levels in different groups注:A.VEGF mRNA相對表達量在實驗組中明顯下降;B.p300 mRNA相對表達量在實驗組中明顯下降;C.PCAF mRNA相對表達量在兩組間無統計學差異。與對照組比較,①P<0.05
2.4 VEGF蛋白在各組間表達水平 實驗組中VEGF蛋白較對照組顯著降低(P<0.01),見圖3。

圖3 VEGF蛋白表達量水平Figure 3 VEGF protein levels in trial and control group注:與對照組比較,①P<0.05
2.5 p300與VEGF啟動子結合水平 P300與VEGF啟動子結合區域水平實驗組較對照組顯著降低(P<0.05),見圖4。

圖4 p300與VEGF啟動子結合水平Figure 4 Binding level of p300 with promoter of VEGF注:與對照組比較,①P<0.05
3 討論
隨著科學研究的不斷深入,諸多代謝性疾病宮內發育起源的學說逐漸為學者所認可,目前人群及動物研究均已證實宮內發育遲緩與成年期諸多代謝性性疾病相關,如高血壓、肥胖、II型糖尿病、高脂血癥等[11]。孕期酒精暴露是導致宮內生長受限的重要原因,本研究成功構建胎兒酒精綜合征動物模型,子代小鼠體重顯著降低。這與以往FAS研究[12-13]報道相符。
胎盤是維系子代宮內發育的重要紐帶,其宮內的正常維系是子代發育的決定性因素之一。有報道[14-16]顯示饑餓、孕期藥物濫用等等孕期不良因素暴露均可引起胎盤損傷。而胎盤損傷是胎兒宮內生長遲緩(IUGR)發生的關鍵因素之一[17-18]。數據首次提示孕期酒精干預可致胎盤組織中VEGF表達明顯降低,而VEGF在血管發生中的關鍵作用已得到公認[19-21]。本研究結果發現VEGF的下降存在于mRNA和蛋白質層面,這提示其降低是發生在轉錄層面的。近10年陸續有研究[22-23]提示胎兒酒精綜合征動物模型中肝臟、心臟組織中組蛋白乙酰化失衡,進而引起發育異常。組蛋白乙酰化于基因轉錄調控影響重大,通過影響染色質結構的穩定而動態且可逆的調控基因轉錄[24-25]。組蛋白乙酰化受HAT酶及HDAC酶動態調控。所以同時檢測了胎盤組織中HATs和HDACs的總體活性,結果發現HATs酶活性顯著下降,而HDACs酶活性無明顯改變,這提示孕期酒精暴露可能通過HATs酶而影響胎盤中基因轉錄表達。因此在后續實驗中,我們分別檢測了HATs酶的重要亞型--p300及PCAF的表達情況,其在胎兒FAS模型小鼠心臟中均出現表達異常[23]。數據提示僅有p300在酒精暴露組及對照組之間存在差異,這提示HATs酶的重要亞型p300很有可能介導了胎盤組織的組蛋白乙酰化失衡。P300作為重要HAT酶,可通過直接調控靶基因啟動子區域組蛋白乙酰化水平影響該基因表達[26],因此實驗中檢測了p300與VEGF啟動子區域的結合水平,數據證實孕期酒精暴露導致胎盤組織中p300活性降低,其可能介導了重要血管發生因子VEGF的低表達,引起胎盤受損而帶著胚胎宮內生長受限。
胎兒宮內生長受限受多因素影響[27],胎兒宮內生長受限會引起圍生兒發生不良妊娠結局,應加強胎兒宮內生長受限的早期篩查,解除高危因素,改善妊娠結局。本研究從表觀遺傳角度探討了宮內生長發育遲緩的可能機理,組蛋白乙酰化酶p300可能在此病理發生中扮演重要角色。鑒于組蛋白乙酰化修飾具有可逆的特點,因此這為孕期酒精暴露的早期干預提供了可能理論靶點。然而在這一病理過程中,是否存在其他胎盤受損,如凋亡等因素存在以及能否利用p300為切入點改善宮內生長受限,這些問題仍需擴大樣本量要進一步深入研究。
4 結論
本研究結果提示,孕期酒精暴露通過p300介導組蛋白乙酰化修飾下調胎盤組織中VEGF表達,進而引起子代宮內發育受限。目前妊娠后發現有飲酒史的婦女逐漸增多,因此本研究有望對備孕家庭咨詢以及誤飲酒孕婦咨詢提供一定借鑒,同時有望為胎兒酒精綜合征的臨床治療轉化提供可能靶點。

