發展證據推理水平的主題教學實踐與思考*
——以氯化銅和氨水反應為例
何銀華 肖中榮
(1.杭州市余杭第二高級中學 浙江 杭州 311100;2.杭州市基礎教育研究室 浙江 杭州 310000)
《普通高中化學課程課標(2017版)》要求教師積極開展素養為本的課堂教學實踐,主動探索素養為本的有效課堂教學模式和策略,[1]“我們已經確定了8項核心素養,目前的關鍵是如何評價它們,這方面的工作還很薄弱”[2]。證據推理是化學學科核心素養,其內涵如何解構,如何基于主題教學發展學生證據推理水平,本文以氯化銅和氨水反應為例進行研究。
一、證據推理的內涵解構
證據推理的內涵為具有證據意識,能基于證據對物質組成、結構及其變化提出可能的假設,通過分析推理加以證實或證偽;建立觀點、結論和證據之間的邏輯關系。[3]本文從上述描述抽提出關鍵詞:證據意識、提出假設、分析推理、邏輯關系。“證據意識”是科學的循證思維,指說話辦事不能主觀臆測,要講事實、有根據。“提出假設”是發現問題的意識、提出觀點的能力。“分析推理”是由一個或幾個已知的判斷,推導出一個未知結論的思維過程。“邏輯關系”指事物或活動間的依賴關系,“觀點、結論和證據之間的邏輯關系”是指觀點、證據、結論之間要相互支持,形成關聯規則和因果機制,[4]符合科學論證的“相關性、充分性和可接受性的論證評價三角標準”[5]。
總之,化學學科核心素養證據推理是基于證據進行推理,本質是科學論證,涉及識別、篩選證據,轉換、形成證據,應用、評價證據,推理、形成結論的高級思維過程,[6]它強調收集證據的必要性、突出分析推理的過程性,彰顯觀點、結論和證據之間的邏輯性。
二、證據推理的水平解構
研究表明,證據、推理和結論都具有復雜性。[7]證據的復雜性表現為熟悉與陌生、顯性與隱性等,證據呈現的方式越陌生越隱性,對思維能力要求越高。推理的復雜性表現為推理前提的多少、推理步驟的長短,推理前提越多、步驟越長,對思維能力要求越高。證據推理形成結論的過程具有科學性、準確性、充分性和相關性。證據來源應該科學、準確,收集過程應體現“科學性和準確性”;要收集不同類型的證據、從不同的角度證明結論,體現證明的“充分性”;推理過程要體現證據和結論的緊密關系、因果關系等“相關性”。
《普通高中化學課程課標(2017版)》將證據推理劃分為4級水平,本文基于收集證據的類型、推理形成結論的過程,從操作性角度解構證據推理的4級水平,如表1。

表1 證據推理的4級水平
本文將收集證據類型分為如下水平:熟悉宏觀→熟悉宏觀和陌生微觀→顯性定性和隱性定量→多元證據、解釋證據。推理形成結論過程分為如下水平:一步推理,科學地得出結論→多步推理,科學地、準確地得出結論→多步推理,科學地、準確地、充分地得出結論→多步推理,科學地、準確地、充分地得出結論,解釋證據和結論的相關性。低級的證據推理水平主要側重某個角度和能力,高級的證據推理水平包含低級的水平要求。
三、發展證據推理水平的主題教學實踐——以氯化銅和氨水反應為例
主題教學活動指課堂教學以項目式探究形式或問題解決形式統整書本知識和現實生活、生產和社會中的學科問題,以教學主題為樞紐,在系統內各要素相互聯系、作用和運行中達成學習主體心理結構的完善和自我實現的整體性教學設計。[8]如何判斷物質發生了化學反應、為什么發生化學反應,這是化學研究的中心問題。本文以氯化銅和氨水反應為教學主題,以判斷化學反應是否發生為教學背景,以學科方法逐漸深化為教學線索,設置4個關聯的教學環節,發展學生從低級到高級的證據推理水平。
【環節1】收集宏觀證據推理發生反應
【教師】演示實驗1:將5mL0.1mol/LCuSO4溶液和10mL0.1mol/LNH3·H2O混合,生成藍色絮狀沉淀,久置后上清液幾乎為無色。CuSO4和NH3·H2O發生了化學反應嗎,證據是什么?
【學生】觀察、回答:因為溶液混合生成藍色沉淀、溶液顏色變淺,證明發生了化學反應,方程式為:CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4
【總結】化學反應常常伴隨發光、放熱、產生氣體、生成沉淀、變色等現象,可以根據上述宏觀現象判斷是否發生了化學反應。
設計意圖:本環節中,學生收集熟悉的宏觀證據證明硫酸銅和氨水發生化學反應。推理路徑為:觀察藍色絮狀沉淀,證明硫酸銅和氨水發生化學反應。學生分析顯性的宏觀證據,經過一步推理,科學地證明發生化學反應,發展水平1。
【環節2】收集微觀證據推理發生反應
【教師】提問:實驗1硫酸銅溶液和氨水混合,溶液為什么由淺藍色褪為無色?反應前后體系離子濃度如何變化,如何設計實驗證明?
【學生】討論、回答:因為生成氫氧化銅沉淀導致c(Cu2+)減小、溶液褪為無色。根據方程式判斷反應前后不變增大。證明不變的方案:向濾液中加入足量BaCl2溶液,稱量生成的m(BaSO4),證明反應前后溶液中m()不變。證明c(N)增大的方案:向濾液中加足量NaOH溶液并加熱、收集生成的NH3,證明增大。教師分別測如下溶液的電導率:取25mL0.1mol/LNH3.H2O于50mL小燒杯中,磁力攪拌下逐滴加入蒸餾水,溶液電導率變化如圖1所示(注:蒸餾水體積約為16mL)。

圖1 氨水稀釋電導率的變化
取25mL0.1mol/LCuSO4溶液于50mL小燒杯中,磁力攪拌下逐滴加入蒸餾水,溶液電導率變化如圖2所示(注:蒸餾水體積約為16mL)。

圖2 硫酸銅溶液稀釋電導率的變化
取25mL0.1mol/LNH3.H2O于50mL小燒杯中,磁力攪拌下逐滴加入0.1mol/LCuSO4溶液,溶液電導率變化如圖3所示(注:CuSO4溶液體積約為16mL)。

圖3 氨水和硫酸銅溶液混合電導率的變化
【學生】分析解釋:圖1說明氨水稀釋電導率減小、圖2說明硫酸銅溶液稀釋電導率減小,圖3說明硫酸銅和氨水混合后溶液發生化學反應,c(N)增大是電導率增大的主要原因,查閱離子的摩爾電荷電導率(描述物質中電荷流動難易程度的參數):

【總結】溶液中發生離子反應,參與反應的某些離子濃度會發生變化(增加或減少),可以比較反應前后離子濃度變化判斷是否發生了化學反應。
設計意圖:本環節中,學生收集陌生的微觀證據證明硫酸銅和氨水發生化學反應。學生需要將可觀察的溶液藍色褪去與c(Cu2+)減小建立關聯,將看不見的轉化為可稱量的硫酸鋇沉淀、將看不見的轉化為可測的電導現象,推理路徑為:溶液顏色變淺→c(Cu2+)減小;混合前后m(BaSO4)不變不變;設計對照實驗、分析溶液電導率變化變大。學生分析顯性宏觀證據和隱性的微觀證據,經過多步推理,科學地、準確地證明離子濃度變化可以作為化學反應發生的證據,發展水平2。
【環節3】收集定量證據推理發生反應
【教師】演示實驗2:向1000mL蒸餾水分別加一滴0.0001mol/LCuSO4溶液、0.0001mol/LNH3·H2O,無沉淀生成,思考為什么。設1滴液體體積約為0.04mL、溶液總體積為1000mL,KspCu(OH)2=2.2×10-20,KbNH3·H2O=1.75×10-5。
【學生】討論,當Q>KspCu(OH)2生成沉淀;Q=KspCu(OH)2建立沉淀溶解平衡;Q<KspCu(OH)2不生成沉淀。估算如下:c(Cu2+)=0.0001×0.04/1000=4×10-9mol/L,c(OH-)2=[(0.0001×0.04×kb/1000)]=[(0.0001×0.04×1.75×10-5/1000)]=7×10-14mol/L,Q=c(Cu2+)×c(OH-)2=2.8×10-22<KspCu(OH)2,實驗2不能生成Cu(OH)2沉淀。
實驗1中,將5mL0.1mol/LCuSO4溶液和10mL 0.1mol/LNH3·H2O混合,c(Cu2+)=0.1×5/15=0.03mol/L,c(OH-)2=[(0.1×10×Kb/15)]=[(0.1×10×1.75×10-5/15)]=0.12×10-5mol/L,Q=c(Cu2+)×c(OH-)2=3.6×10-8>KspCu(OH)2,所以能生成Cu(OH)2沉淀。
【總結】CuSO4與NH3·H2O能否反應生成沉淀Cu(OH)2,需要通過定量計算、比較Q與KspCu(OH)2大小進行判斷。溶液中生成沉淀的條件遵守溶度積規則,當難溶物的濃度商大于溶度積才能生成沉淀,發生化學反應。
設計意圖:本環節中,學生需要通過收集隱性的定量證據證明硫酸銅和氨水能否發生化學反應。學生根據硫酸銅和氨水混合c(Cu2+)、c(OH-)計算濃度商,充分證明實驗1能生成沉淀、實驗2不能生成沉淀。推理路徑為:計算混合溶液的c(Cu2+),估算稀氨水中的c(OH-)→計算Q=c(Cu2+)×c(OH-)2→比較Q和KspCu(OH)2大小→解釋能否發生反應。學生收集定量證據,經過多步推理,科學地、準確地、充分地證明溶度積規則可以作為化學反應發生的證據,發展水平3。
【環節4】收集多元證據推理發生反應
【教師】演示實驗3:將2mol/LNH3·H2O逐滴加入0.5mol/L5mLCuSO4溶液,生成藍色沉淀,滴加過量氨水、振蕩試管沉淀不消失,如何解釋現象呢?
【教師】演示實驗4:向0.5mol/L5mLCuSO4溶液加入氯化銨固體,再滴加2mol/LNH3·H2O,生成藍色沉淀,滴加過量氨水、振蕩試管,沉淀消失,最終生成深藍色溶液。[9]如何解釋現象呢?
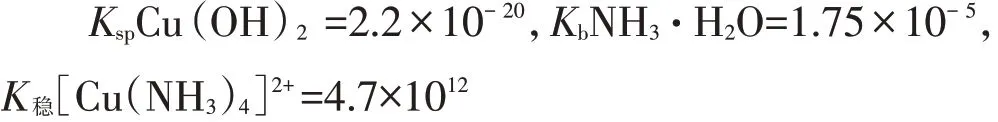
【學生】討論,分析如下:實驗3中,淺藍色溶液→藍色沉淀,證明氫氧化銅不溶于氨水。實驗4中,淺藍色溶液→藍色沉淀→深藍色溶液。兩個實驗現象為什么不同?學生計算實驗3中反應①的平衡常數K:

K很小,從限度上判斷氫氧化銅不能溶于氨水(實際上溶解速率很慢)。
實驗4涉及如下反應:

則①+②=反應③:
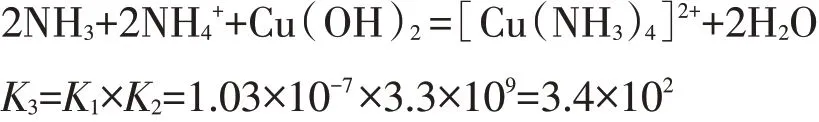
向氨水、氫氧化銅加入足量銨鹽,NH4+耦合OH-,使平衡常數增加3.24×109倍,有效促進了氫氧化銅的溶解、生成更穩定[Cu(NH3)4]2+,減少c(Cu2+)。
【總結】Cu(OH)2與NH3·H2O不能反應生成銅氨絡離子,向溶液中加入足量的銨鹽,銨鹽和OH-反應耦合,極大增加化學反應平衡常數,生成深藍色、更穩定的銅氨絡離子。沉淀能否有效轉化為絡離子,可以通過耦合反應等條件調控增大反應常數、發生化學反應。
設計意圖:本環節中,學生需要收集多元證據判斷氫氧化銅和氨水能否發生化學反應。學生要根據宏觀證據判斷氫氧化銅不能溶于氨水、加入銨鹽可以生成銅氨絡離子,然后收集微觀證據書寫氫氧化銅和氨水、銨鹽反應的離子方程式,最后通過定量計算解釋原因。推理路徑為:沉淀顏色是否變化→基于多重平衡規則計算簡單反應和復雜反應的平衡常數→比較K的變化→解釋能否發生反應→基于“N和OH-耦合”解釋氫氧化銅與氨水發生反應的原因。學生收集多元證據,經過多步推理,科學地、準確地、充分證明耦合反應可以拉動化學反應,解釋證據對結論形成支撐的因果關系,發展水平4。
【課堂作業】
問題1將0.1mol/L5mLCuSO4溶液和0.1mol/L 10mLNH3·H2O混合,生成藍色沉淀常含有堿式硫酸銅CuSO4·Cu(OH)2,如何證明沉淀中含有硫酸根?
問題2[Cu(NH3)4]2+是穩定存在的絡離子,你能否從結構的角度收集證據說明原因?
設計意圖:問題1基于沉淀的復雜性,培養學生設計實驗方案、收集熟悉證據的能力:加足量鹽酸溶解、再加氯化鋇檢驗。問題2培養學生收集結構證據理解[Cu(NH3)4]2+穩定存在原因:基于晶體場理論知Cu2+形成的八面體場,失去能量較高、z軸方向的2個配體水分子,4個氨分子在x軸和y軸方向成平面正方形,獲得更多的晶體場穩定化能(John-Teller效應)。上述2個問題是主題教學內容的延伸,培養學生從實驗探究、文獻查閱的角度進行科學論證的能力,發展學生證據推理的綜合素養。
四、結束語
證據推理是重要的學科思維方法,本文解構了證據推理的內涵,從收集證據的類型、推理形成結論的過程劃分證據推理的水平。教學中以氯化銅和氨水反應為例,基于真實的實驗情境,以學生活動為主體,采取多樣的教學活動,基于宏觀沉淀顏色變化、微觀粒子濃度變化、溶度積規則、耦合反應等證據判斷化學反應是否發生,促進學生認識思路的結構化發展,提升學生的證據推理水平。

