2型糖尿病患者血糖控制情況與顱內動脈粥樣硬化斑塊特征相關性的高分辨率MRI研究
李樂, 韓曉明, 李艷, 姚林艷, 張蘭花
糖尿病是一種慢性代謝性疾病,可通過多種復雜的機制誘發和促進動脈粥樣硬化的發生和發展,是動脈粥樣硬化性腦卒中的獨立危險因素,空腹血糖及糖化血紅蛋白水平與腦卒中的發病風險增加密切相關[1-2]。目前,對血糖控制與頸動脈和冠狀動脈斑塊特征關系的研究較多[3-5]。以往對糖尿病與顱內動脈粥樣硬化血管關系的研究多數是采用MRA和CTA來觀察顱內狹窄血管的數量和管腔狹窄程度,而高分辨率磁共振成像(high resolution magnetic resonance imaging,HR-MRI)要優于傳統MRA及CTA,能夠更清晰地顯示顱內動脈管壁斑塊的數量、形態和大小等,是目前無創性評估顱內動脈疾病的最佳成像技術[6-7]。本研究應用HR-MRI來探討血糖控制水平與顱內動脈粥樣硬化斑塊形態學特征的相關性,并分析了顱內動脈粥樣硬化斑塊的臨床風險因素,旨在了解血糖控制不良和顱內動脈粥樣硬化斑塊形態學特征之間的關系。
材料與方法
1.臨床資料
本研究為回顧性研究,研究方案經本院倫理委員會審查批準(2022-7th-HIRBSR-038)。
回顧性搜集2020年4月-2022年1月在本院行頭顱HR-MRI檢查且符合本研究要求的82例患者的臨床和影像資料。82例中62例(75.6%)因急性腦梗死相關癥狀就診且影像診斷為急性腦梗死,14例(17.1%)因頭暈、頭脹而就診,6例(7.3%)因其它原因就診。納入標準:①HR-MRI顯示顱內動脈管壁至少有一個斑塊;②臨床資料完整。排除標準:①顱外段頸部動脈(包括頸內、頸外動脈及椎動脈)狹窄率大于50%;②有頭頸部動脈夾層;③有動脈炎或自身免疫性疾病;④圖像質量不佳。
記錄每例患者的臨床資料,包括性別、年齡、身體質量指數(body mass index,BMI)及糖化血紅蛋白、總膽固醇(totalcholesterol,TC)、總甘油三酯(total triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDLC)和高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDLC)水平、既往有無腦梗死、高血壓和糖尿病史。2型糖尿病診斷標準為空腹血糖≥7.0 mmol/L、或隨機血糖≥11.1 mmol/L、或正在服用降糖藥物。糖尿病患者中糖化血紅蛋白<7%為血糖控制良好,糖化血紅蛋白≥7%為血糖控制不良[8]。本研究中糖化血紅蛋白檢測時間與HR-MRI檢查時間間隔不超過2周。根據臨床資料將患者分為無糖尿病組、血糖控制良好組和血糖控制不良組。
2.HR-MRI檢查方法
使用Siemens Magnetom Skyra 3.0T磁共振儀和16通道頭部線圈,采用三維T1加權可變反轉角快速自旋回波序列(three dimensional T1-weighted sampling perfection with application-optimized contrasts by using different flip angle evolutions,3D T1-SPACE)進行HR-MRI掃描,掃描參數:TR 900 ms,TE 11 ms,層厚0.72 mm,層間距0.00 mm,視野230 mm×230 mm,矩陣320×320,掃描時間8 min 29 s。
3.圖像后處理和分析
將每例患者的HR-MRI原始圖像導入Simens syngo.via工作站,由一位具有7年放射診斷經驗的主治醫師在不知道患者臨床資料的情況下進行圖像分析和斑塊特征指標的測量。因為顱內血管較細,本研究僅觀察大腦前動脈A1和A2段、大腦中動脈M1和M2段、大腦后動脈P1和P2段、基底動脈及椎動脈V4段,如患者有多支顱內血管存在斑塊和血管狹窄病變時,僅測量血管最狹窄處斑塊和局部血管的特征指標值。在工作站上根據最狹窄部位顱內血管的走行方向進行血管長軸和短軸方位的圖像重建,在血管長軸位重組圖像上測量斑塊的長度,在血管短軸位重組圖像上測量斑塊最大厚度及狹窄處管腔內徑,每個指標重復測量3次,每2次測量的時間間隔為2周,最后取3次測量值的平均值作為每個指標的最終值。管腔狹窄率的計算公式為(1-血管最狹窄層面管腔內徑/狹窄處近端或遠端正常血管的內徑)×100%[9]。
4.統計分析方法
所有數據采用SPSS 26.0軟件進行統計學分析。符合正態分布的計量資料采用均值±標準差來描述,偏態分布的計量資料采用M(P25,P75)來描述。分類數據采用例數和構成比來描述。采用組內相關系數(intraclass correlation coefficient,ICC)分析各項斑塊定量指標3次測量值之間的一致性。無糖尿病組、血糖控制良好組及血糖控制不良組之間呈正態分布的計量資料的比較采用單因素方差分析,三組之間呈偏態分布的計量資料的比較采用Kruskal-Wallis檢驗,三組之間計數資料的比較采用卡方檢驗。分別按照顱內動脈最狹窄處斑塊的長度和厚度及局部管腔狹窄率的中位數將82例患者分成兩組(即將3項指標作為二分類變量),采用logistic回歸分析研究這3項指標的臨床風險因素。在進行此分析的過程中,將臨床資料中的實驗室檢查資料也進行二分類處理,包括高總膽固醇水平(≥5.69 mmol/L)、高甘油三酯水平(≥1.47 mmol/L)和高糖化血紅蛋白水平(≥7%)。以P<0.05為差異有統計學意義。
結 果
1.臨床資料
所有入組患者HR-MRI圖像質量佳,斑塊顯示清晰(圖1)。82例患者的年齡為34~90歲,平均(65.76±12.06)歲。三組患者的基線臨床資料的比較見表1。三組之間各項基線臨床資料間的差異均無統計學意義(P>0.05)。
2.顱內動脈粥樣硬化斑塊的特征
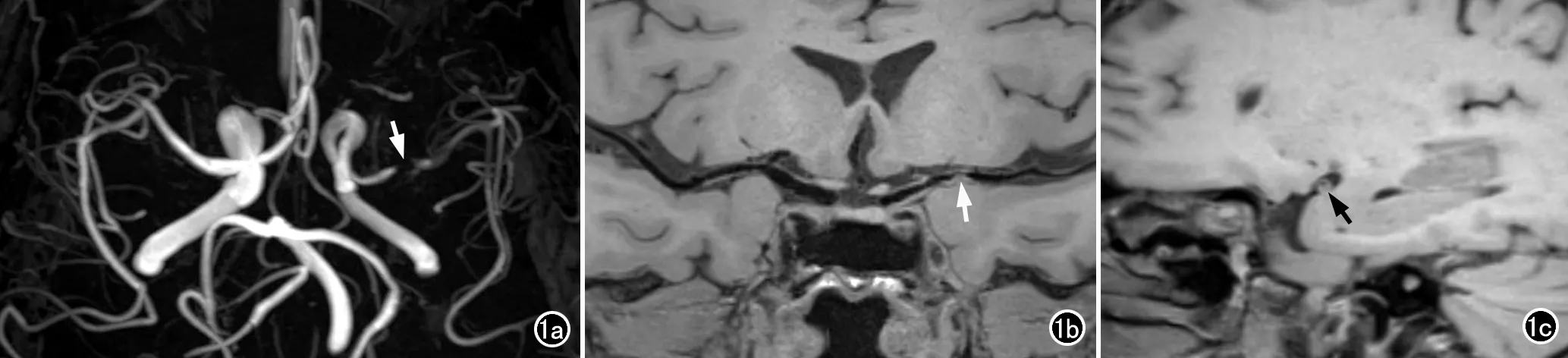
圖1 糖尿病患者,男性,51歲,糖化血紅蛋白為9.1% 。a)MRA顯示左側大腦中動脈M1段局部重度狹窄(箭);b)3D T1-SPACE 曲面重組圖像顯示左側大腦中動脈M1近段局部管壁明顯增厚(箭);c)左側大腦中動脈M1近段狹窄處血管短軸位重組圖像,顯示局部管壁偏心增厚(箭),管腔重度狹窄。

表1 三組患者基線臨床資料的比較
三組患者顱內斑塊的長度和厚度及局部管腔狹窄率的比較見表2。三組之間顱內斑塊長度的差異有統計學意義(P<0.001)。采用Bonferroni方法進一步進行組間兩兩比較,血糖控制不良組的斑塊長度顯著大于無糖尿病組(P<0.05);血糖控制不良組斑塊長度的中位數大于血糖控制良好組,但其在兩組間的差異無統計學意義(P>0.05)。三組之間顱內斑塊厚度和管腔狹窄率的差異均無統計學意義(P>0.05)。
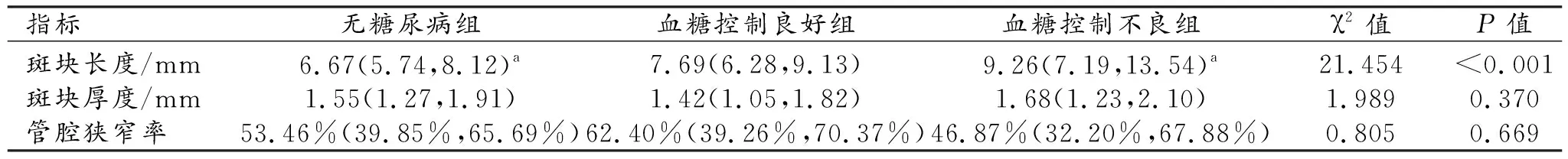
表2 三組患者的顱內動脈粥樣硬化斑塊長度、厚度及管腔狹窄率的比較
3.斑塊特征和管腔狹窄程度的風險因素分析
對斑塊特征和管腔狹窄程度的單因素和多因素logistic回歸分析結果見表3。
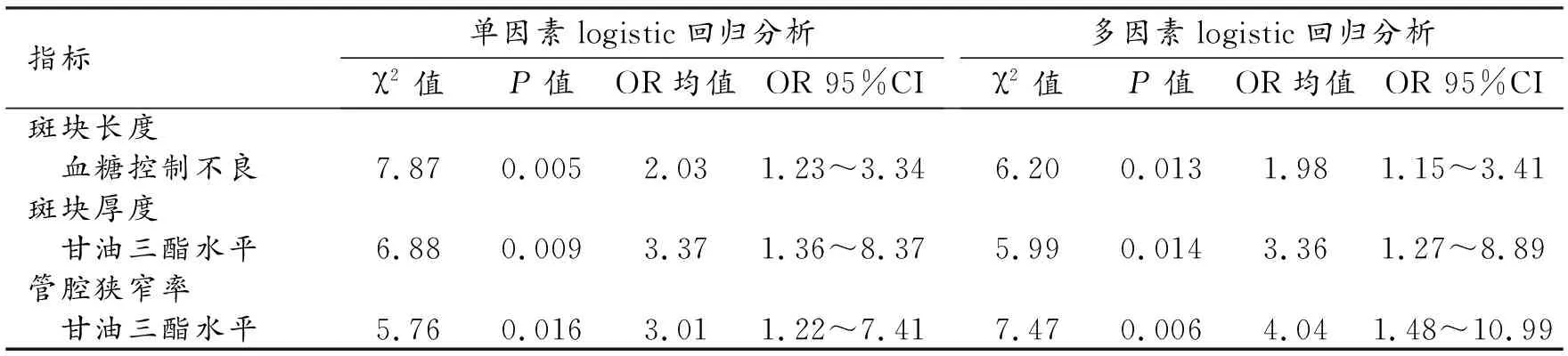
表3 顱內動脈粥樣硬化斑塊特征的logistic回歸分析
單因素logistic回歸分析結果顯示,血糖控制不良對顱內斑塊長度的影響具有統計學意義(OR=2.03,95%CI:1.23~3.34,P=0.005),甘油三酯升高對顱內斑塊厚度的影響具有統計學意義(OR=3.37,95%CI:1.36~8.37,P=0.005),甘油三酯升高對顱內動脈粥樣硬化管腔狹窄率的影響具有統計學意義(OR=3.01,95%CI:1.22~7.41,P=0.016)。
納入年齡、有無高血壓、血糖控制情況和甘油三酯水平四項指標分別構建預測各項斑塊特征的多因素logistic回歸方程,結果顯示,血糖控制不良是顱內斑塊長度的獨立風險因素(OR=1.98,95%CI 1.15~3.41,P=0.013),甘油三酯水平是顱內斑塊厚度和管腔狹窄率的獨立風險因素(OR=3.36,95%CI:1.27~8.89,P=0.014;OR=4.04,95%CI:1.48~10.99,P=0.006)。
4.一致性分析
顱內斑塊長度、厚度和管腔狹窄率的重復測量一致性均很高, ICC值分別為0.987(95%CI:0.959~0.997,P<0.001)、0.921(95%CI:0.800~0.976,P<0.001)和 0.954(95%CI:0.866~0.989,P<0.001)。
討 論
糖尿病致動脈粥樣硬化的發病機制非常復雜且目前尚未完全闡明,相關機制包括巨噬細胞極化、糖基化終產物途徑、胰島素抵抗、泛素-蛋白酶體系統激活和血小板源性生長因子激活途徑等[10]。長期高血糖可通過多種機制損傷血管內皮細胞,導致內皮功能障礙,在氧化應激和炎性反應的刺激下血管內皮細胞表達黏附分子并分泌趨化因子,促進白細胞和血小板等黏附浸潤至血管壁的內膜層,誘發動脈粥樣硬化的形成[11]。糖尿病復雜的病理機制導致患者多合并血壓和血脂的異常,這些影響累積增加,損傷動脈管壁的結構和功能,促進動脈粥樣硬化的發生和發展,增加各種血管疾病的發生風險[12]。糖化血紅蛋白是血液中紅細胞內的血紅蛋白與血糖結合的產物,可以反映患者在過去幾個月的血糖控制情況,糖化血紅蛋白水平的升高與顱內狹窄血管的數量密切相關[13]。糖化血紅蛋白水平越高,患者發生顱內動脈粥樣硬化和腦卒中的風險越高[14]。HR-MRI能比較直觀地顯示顱內動脈粥樣硬化斑塊,可以準確評估糖尿病患者顱內動脈粥樣硬化程度。
本研究結果顯示血糖控制良好組和血糖控制不良組的顱內動脈斑塊長度的中位數均大于無糖尿病組,其中血糖控制不良組與無糖尿病組之間該指標值的差異有統計學意義(P<0.05),血糖控制不良是顱內斑塊長度的獨立影響因素(OR=1.98,95%CI:1.15~3.41,P=0.013),上述結果表明顱內動脈管壁斑塊長度與血糖控制水平相關。一項回顧性研究結果亦顯示糖尿病患者的顱內斑塊最大長度明顯高于非糖尿病患者(P<0.001),而血糖控制不良患者與血糖控制良好患者之間顱內斑塊長度的差異無統計學意義(P=0.117)[15]。但是,Li等[16]的研究結果顯示糖尿病組與非糖尿病組之間顱內斑塊長度的差異無統計學意義,與本研究結果相反。筆者分析兩個研究結果不一致的原因,可能是本研究與Li等[16]的研究中納入的急性缺血性腦卒中患者的占比不同,本研究82例患者中急性缺血性腦卒中患者62例,占75.6%,而Li等[16]的研究中全部為急性缺血性卒中患者,總體上而言其納入的患者動脈粥樣硬化病變的程度更嚴重一些。
最近的一項研究結果顯示血糖控制水平與顱內動脈管腔狹窄率和斑塊厚度相關[17],但本研究中并未發現血糖控制水平與顱內斑塊厚度和管腔狹窄率有顯著相關性。本研究結果顯示甘油三酯升高是顱內血管管腔狹窄率和斑塊厚度的獨立危險因素。多項研究結果表明甘油三酯水平與動脈粥樣硬化水平顯著相關,甘油三酯水平的升高可能通過直接或間接的作用機制加速動脈粥樣硬化[18]。Huang等[15]的研究亦顯示血糖控制不良組與血糖控制良好組之間顱內動脈管壁厚度和管腔狹窄率的差異均無統計學意義。Du等[3]的研究結果顯示在同時患有高血壓和糖尿病的老年患者中,頸動脈內膜-中膜(肌層)厚度與血壓控制水平顯著相關,而與血糖控制水平無顯著相關性,與本研究結果基本一致。
本研究具有一定的局限性:一、本研究為回顧性研究,研究對象的納入存在選擇偏倚;二、未考慮顱內動脈粥樣硬化斑塊的數量和斑塊體積等因素,這些都可能與2型糖尿病患者血糖控制水平相關;三、本研究的樣本量較小,研究結論尚需在大樣本量的前瞻性研究中進一步驗證。
綜上所述,2型糖尿病患者血糖控制和顱內動脈粥樣硬化斑塊特征有一定的相關性,血糖控制不良是影響顱內動脈粥樣硬化斑塊長度的獨立風險因素,甘油三酯升高是影響顱內動脈粥樣硬化斑塊厚度和管腔狹窄率的獨立風險因素。HR-MRI可以幫助我們更好的了解血糖控制不良與顱內動脈粥樣硬化斑塊特征的關系。