PGM5-AS1抑制miR-4728-5p對宮頸癌細胞侵襲、轉移的影響
余萍 楊銀 楊發珍
(青海紅十字醫院婦科,青海 西寧 810000)
宮頸癌是全球最常見的婦科癌之一,2018年總共報告了570 000例宮頸癌新病例和311 000例死亡病例,成為癌癥相關死亡的第四大主要原因〔1〕。在過去的幾十年中,宮頸癌的預防和治療取得了巨大的進步,特別是人乳頭瘤病毒(HPV)疫苗的出現〔2〕。然而中晚期宮頸癌患者的5年生存率并沒有顯著提高〔3〕。因此,進一步探索宮頸癌發生和轉移的分子生物學機制對于其早期預防和精準治療具有重要意義。長非編碼RNA(lncRNA)是一類長度超過200個核苷酸的內源非編碼RNA。新興證據表明,lncRNA可作為微小RNA(miRNA)海綿,參與各種重要的生理和病理調節,在人類癌癥的發生發展過程發揮關鍵作用〔4,5〕。葡萄糖磷酸變位酶樣蛋白5反義(PGM5-AS)1在食管鱗狀細胞癌組織、血漿和細胞系中表達下調,其過表達顯著抑制了體外食管鱗狀細胞癌細胞的增殖、遷移、侵襲及體內腫瘤的生長,作用機制與調節miR-466/第10號染色體同源丟失性磷酸酶-張力蛋白基因(PTEN)軸有關〔6〕。但尚不清楚PGM5-AS1在宮頸癌組織中的表達和確切作用。本研究的生物信息學預測表明,PGM5-AS1與miR-4728-5p存在靶向結合位點。miR-4728-5p已被證明在乳腺癌組織中高表達,可作為癌基因調控乳腺癌細胞的增殖和遷移〔7〕。因此,本實驗針對PGM5-AS1是否通過靶向miR-4728-5p,從而影響宮頸癌細胞的增殖和轉移進行研究,以期為宮頸癌發病機制的深入探討提供新的啟示。
1 材料與方法
1.1組織、細胞與試劑 從青海紅十字醫院獲得42對經病理學確認的宮頸癌樣本及其相鄰的無腫瘤宮頸組織(距離腫瘤部位>5 cm處的癌旁組織)。將這些樣本在液氮中快速冷凍并保存,直至提取總RNA。獲取所有患者的知情同意書,并通過醫院臨床倫理委員會批準。宮頸腫瘤細胞系SiHa獲自美國典型培養物保藏中心ATCC。RPMI1640培養基獲自美國Gibco公司,Lipofectamine 2000試劑、TRIzol試劑盒獲自美國Invitrogen公司,pcDNA3.1-PGM5-AS1質粒和對照空載質粒pcDNA3.1、miR-4728-5p模擬物/抑制劑及各自陰性對照miR-NC、anti-miR-NC獲自上海GenePharma公司,放射免疫沉淀(RIPA)緩沖液、二喹啉甲酸(BCA)蛋白檢測試劑盒獲自Beyotime生物技術研究所,鼠抗細胞增殖抗原Ki67抗體獲自美國Santa Cruz公司,鼠抗E鈣黏蛋白(E-cadherin)抗體、鼠抗N鈣黏蛋白(N-cadherin)抗體獲自美國Cell Signaling Technology公司,山羊抗鼠IgG二抗獲自美國Abcam公司,雙熒光素酶報告試劑盒獲自美國Promega公司。
1.2細胞培養 將SiHa細胞在RPMI1640培養基中培養,并將1%青霉素/鏈霉素和10%胎牛血清添加到該培養基中。細胞生長于37℃,5% CO2/95%空氣的培養箱。
1.3細胞分組與轉染 將對數生長期的SiHa細胞分為pcDNA3.1組(轉染pcDNA3.1),pcDNA3.1-PGM5-AS1組(轉染pcDNA3.1-PGM5-AS1),anti-miR-4728-5p組(轉染miR-4728-5p抑制劑anti-miR-4728-5p),anti-miR-NC組(轉染anti-miR-NC)。細胞轉染時,遵循Lipofectamine 2000試劑說明書的步驟進行。在6孔板中接種1×105個SiHa細胞,待其生長至60%匯合時,根據上述分組將pcDNA3.1-PGM5-AS1、pcDNA3.1、anti-miR-4728-5p、anti-miR-NC轉染到細胞中,48 h后進行各項指標的檢測。
1.4實時定量PCR(qRT-PCR)檢測組織或細胞中PGM5-AS1、miR-4728-5p表達 根據制造商的說明,使用TRIzol試劑盒從組織或SiHa細胞中提取用于lncRNA或miRNA測定的總RNA。使用2 μg RNA合成互補DNA(cDNA)。按照制造商的說明,使用SYBR試劑盒與ABI PRISM 7500序列檢查系統來進行qRT-PCR分析。甘油醛-3-磷酸脫氫酶(GAPDH)或U6分別用作PGM5-AS1和miR-4728-5p標準化的內源對照。PGM5-AS1、miR-4728-5p的相對表達水平由2-ΔΔCt定量。使用的引物:PGM5-AS1 5′-GCCCTACCAGGAGTGAATGA-3′(正義鏈)和5′-TTCCTGGTTTTGGAGTTTGG-3′(反義鏈)。miR-4728-5p 5′-GTGGGAGGGGAGAGGCA-3′(正義鏈)和5′-GTCAGCATGCTAGTCCCAGG-3′(反義鏈)。GAPDH 5′-ACCCAGAAGACTGTGGATGG-3′(正義鏈)和5′-TTCAGCTCAGGGATGACCTT-3′(反義鏈)。U6 5′-CTCGCTTCGGCAGCACA-3′(正義鏈)和5′-AACGCTTCACGAATTTGCGT-3′(反義鏈)。
1.5噻唑藍(MTT)法檢測SiHa細胞的增殖 將轉染的SiHa細胞以1×104個細胞/孔的密度接種在96孔板中。培養48 h后,加入20 μl MTT溶液孵育4 h,之后加入二甲基亞砜,劇烈震蕩10 min,于酶標儀測定細胞在490 nm處的吸光度OD值,計算細胞存活率(%)。
1.6平板克隆形成實驗檢測SiHa細胞的克隆形成 將轉染的SiHa細胞以500個細胞/孔的密度接種在6孔板中。培養2 w后,將克隆的細胞用4%多聚甲醛固定20 min,并在室溫下用0.5%結晶紫染色15 min。在Olympus倒置顯微鏡下計數大于50的細胞克隆形成數。
1.7Western印跡檢測SiHa細胞中Ki67、E-cadherin、N-cadherin蛋白表達 收集轉染的SiHa細胞,用RIPA緩沖液裂解,獲得細胞蛋白。根據制造商的協議,使用BCA試劑盒對蛋白進行定量。通過12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白質(30 μg/泳道)。將分離的蛋白轉移到聚偏二氟乙烯膜上,并在室溫下用5%封閉液封閉1 h。用相應的Ki67、E-cadherin、N-cadherin和對照GAPDH一抗(均為1∶1 000稀釋)標記膜,并在4℃下孵育過夜。第2天將膜與山羊抗鼠IgG二抗(1∶10 000稀釋)在室溫下孵育1 h。使用電化學發光(ECL)液顯示蛋白條帶,分析Ki67、E-cadherin、N-cadherin蛋白表達。
1.8Transwell小室法檢測SiHa細胞的遷移、侵襲 將轉染后的SiHa細胞懸浮于無血清的RPMI1640培養基中,并調節至3×104個細胞/ml的密度。在Transwell小室的上腔室中接種100 μl細胞懸液,下腔室中添加600 μl含10%胎牛血清的RPMI1640培養基,在5% CO2下于37℃孵育。細胞培養24 h后,將遷移細胞在室溫下用100%甲醇固定20 min,并用0.5%結晶紫染色10 min,在光學顯微鏡觀察遷移細胞的數目。對于侵襲測定,實驗前,上室用與無血清培養基混勻的Matrigel基質膠涂覆,其余步驟同遷移測定。
1.9雙熒光素酶報告實驗驗證PGM5-AS1對miR-4728-5p的靶向調控 通過Starbase(http://starbase.sysu.edu.cn/)預測了PGM5-AS1與miR-4728-5p結合序列。將含有假定的miR-4728-5p結合位點的PGM5-AS1片段克隆到pmirGLO載體中,構建野生型PGM5-AS1(WT-PGM5-AS1),同樣構建帶有突變位點片段的突變型PGM5-AS1(MUT-PGM5-AS1)報告基因。然后將構建的報告基因分別與miR-4728-5p模擬物或miR-NC共轉染到SiHa細胞中,分別記為miR-4728-5p組或miR-NC組。48 h后通過雙熒光素酶報告試劑盒測定相對熒光素酶活性。
1.10統計學分析 采用SPSS22.0軟件進行獨立樣本t檢驗。
2 結 果
2.1PGM5-AS1在宮頸癌中的表達 如表1所示,與癌旁組織組(1.04±0.12)相比,42例宮頸癌組織中PGM5-AS1的表達水平明顯降低(0.20±0.01,P<0.05)。
2.2PGM5-AS1對SiHa增殖的影響 如表1、圖1所示,與pcDNA3.1組相比,pcDNA3.1-PGM5-AS1組SiHa細胞中PGM5-AS1表達量明顯增加,細胞存活率和克隆形成數顯著減少,并且Ki67蛋白表達水平明顯降低(P<0.05)。
2.3PGM5-AS1對SiHa遷移、侵襲的影響 如表1、圖2所示,與pcDNA3.1組相比,pcDNA3.1-PGM5-AS1組的SiHa細胞遷移細胞數和侵襲細胞數明顯減少,E-cadherin蛋白表達量顯著增加,N-cadherin蛋白水平明顯降低(P<0.05)。
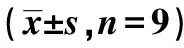
表1 PGM5-AS1對SiHa增殖、遷移、侵襲的影響

圖1 兩組Ki67蛋白的表達

圖2 兩組E-cadherin、N-cadherin蛋白的表達
2.4PGM5-AS1靶向miR-4728-5p Starbase在線預測結果如圖3所示,PGM5-AS1與miR-4728-5p具有靶向結合位點。雙熒光素酶報告實驗結果如表2所示,與轉染miR-NC相比,轉染miR-4728-5p明顯降低轉染WT-PGM5-AS1的SiHa細胞熒光素酶活性(P<0.05),對轉染MUT-PGM5-AS1的SiHa細胞熒光素酶活性無顯著影響(P>0.05)。qRT-PCR檢測結果顯示,與轉染pcDNA3.1相比,轉染pcD-NA3.1-PGM5-AS1后SiHa細胞中miR-4728-5p表達水平明顯降低(1.02±0.04 vs 0.38±0.02,P<0.05)。

圖3 PGM5-AS1靶向miR-4728-5p
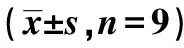
表2 雙熒光素酶報告實驗
2.5抑制miR-4728-5p對SiHa增殖的影響 如圖4、表3所示。與anti-miR-NC組相比,anti-miR-4728-5p組明顯減少miR-4728-5p表達量、細胞存活率、克隆形成數、Ki67蛋白表達量(P<0.05)。

圖4 兩組Ki67蛋白的表達
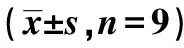
表3 抑制miR-4728-5p對SiHa增殖、遷移、侵襲的影響
2.6抑制miR-4728-5p對SiHa遷移侵襲的影響 如表3、圖5所示,與anti-miR-NC組相比,anti-miR-4728-5p組SiHa細胞遷移細胞數、侵襲細胞數、N-cadherin蛋白表達量降低,E-cadherin蛋白水平提高,差異均有統計學意義(均P<0.05)。

圖5 兩組E-cadherin、N-cadherin蛋白的表達
3 討 論
子宮切除術及放化療是治療早期宮頸癌的最廣泛的治療手段〔8〕。然而,由于復發和轉移,宮頸癌患者的預后仍然不能令人滿意〔9〕。現階段,宮頸癌的分子基礎尚未得到很好的闡明。更深入地了解宮頸癌發生和發展的分子機制將有助于發現新型的分子治療靶標。越來越多的數據突出了lncRNA在宮頸癌腫瘤進展,侵襲和轉移,細胞凋亡和放射抵抗等方面的重要性〔10,11〕。本研究揭示了宮頸癌組織中lncRNA PGM5-AS1表達水平的變化及對宮頸癌SiHa細胞增殖、遷移和侵襲的影響,結果證實,PGM5-AS1具有抑制宮頸癌進展的作用,另外,其機制與抑制miR-4728-5p表達有關。
lncRNA是癌癥發展和進展的基本調節劑,可能在宮頸癌進程中充當癌基因或抑癌基因。本項研究發現PGM5-AS1在宮頸癌組織中表達下調。最近,PGM5-AS1被發現參與乳腺癌〔12〕、胃癌〔13〕、黑色素瘤〔14〕等一些腫瘤的進展。例如,Qian等〔15〕報告,透明細胞腎細胞癌組織中PGM5-AS1的表達低于匹配的非腫瘤標本,其下調與淋巴結轉移和遠處轉移密切相關,PGM5-AS1是透明細胞腎細胞癌患者的獨立預后因素。張霖等〔16〕證明PGM5-AS1在非小細胞肺癌中表達下調,可以抑制細胞的克隆增殖能力,發揮一定抗癌作用。與相應的正常組織相比,結直腸癌組織中PGM5-AS1的表達水平顯著下調,在功能上,PGM5-AS1的過表達可誘導結直腸癌細胞的凋亡和細胞周期停滯,還可抑制體內腫瘤的生長〔17〕。這些研究證實,PGM5-AS1可能是潛在的腫瘤抑制劑。然而,PGM5-AS1在宮頸癌中的功能和機制尚不清楚。本研究的功能實驗測定顯示,PGM5-AS1過表達抑制宮頸癌SiHa細胞的增殖、遷移和侵襲,并抑制細胞增殖抗原Ki67和遷移侵襲相關蛋白N-cadherin表達,促進E-cadherin蛋白表達。這表明,PGM5-AS1在宮頸癌中起著抑癌lncRNA的作用,與前人報道〔16,17〕相同。
證據表明,lncRNA可作為miRNA海綿調節腫瘤進展〔18〕。如lncRNA PTENP1通過競爭性結合miR-106b抑制宮頸癌的進展,導致細胞增殖減少和細胞凋亡增加〔19〕,lncRNA CRNDE通過海綿化miR-183調節CCNB1表達,在宮頸癌中起癌基因的作用,促進細胞增殖、遷移和侵襲〔20〕。本研究生物信息學預測和雙熒光素酶報告實驗闡明了miR-4728-5p是PGM5-AS1的靶基因,并且宮頸癌SiHa細胞miR-4728-5p的表達水平被PGM5-AS1所抑制。提示宮頸癌中的PGM5-AS1可能通過調控miR-4728-5p發揮抗腫瘤活性。近年來,一些研究表明了miR-4728-5p可能在腫瘤進展中起促癌作用〔7〕。但是,其對宮頸癌細胞增殖和轉移的作用仍然未知。在這項研究中,顯示抑制miR-4728-5p減少SiHa細胞的增殖、遷移和侵襲,與其在乳腺癌〔7〕中的作用相同。
綜上所述,PGM5-AS1是宮頸癌中的一種新型腫瘤抑制因子,可以靶向抑制miR-4728-5p的表達,從而抑制宮頸癌細胞的增殖和轉移。

