紅平菇鋅化多糖制備工藝優化及抗氧化活性研究
時煥軍陳婕妤高鑠皓崔明晨林嘉龍何建昆賈樂張建軍
(山東農業大學生命科學學院,山東 泰安 271018)
食用菌多糖系由10個以上的單糖以糖苷鍵連接而成的高分子多聚物,是從子實體、菌絲體、發酵液等組織中分離出的,具有控制細胞分裂分化、調節細胞生長衰老[1]、抗氧化[2]、抗腫瘤[3]、降血糖[4]等多種生物活性,成為近年來生物醫學研究領域的熱門。自由基學說是Denhan Harman提出的有關衰老的氧自由基理論,其研究表明自由基是具有高度活性的物質,能夠使細胞和細胞器膜脂類產生過氧化損傷,進而導致細胞膜功能喪失。伴隨人體內抗氧化系統能力下降,自由基可對組織器官造成傷害,危害人類健康,因此尋找外源性自由基清除劑具有十分重要的意義[5]。鋅作為人體的必需微量元素,與300多種酶的活性密切相關,在免疫反應中起著非常重要的作用[6]。鋅缺乏會導致機體出現發育遲緩、免疫和抗氧化防御功能紊亂、學習記憶能力下降和皮膚不完全角化等癥狀。人體主要是從藥物或食物中獲取鋅元素,但補鋅藥物價格偏高,而提高鋅在食物中的富集度可改善鋅攝取不足。食用菌多糖具有良好的抗氧化活性[7]和自由基清除能力[8],且真菌多糖配合鋅化合物修飾的抗氧化能力更強[9]。
紅平菇(Pleurotus djamor)是食用菌中的珍稀菌類[10],具有較大的開發潛力。本試驗以經過液體發酵和固體富鋅培養的紅平菇為材料,在預試驗基礎上,選擇對鋅化多糖得率影響大的鋅濃度、培養時間、接種量3因素利用響應面法進行優化,確定最佳制備工藝,并評估鋅化多糖在體內外的潛在抗氧化能力,為紅平菇在大健康領域的應用提供理論參考。
1 材料與方法
1.1 材料與儀器
紅平菇菌種為本實驗室自主分離、鑒定并保存。Kunming雄性小鼠50只[(20±2)g],購于泰安泰邦生物制品有限公司。其他常規試劑均為化學純。
1.2 試驗方法
1.2.1 紅平菇鋅化多糖制備工藝優化 采用液體發酵和固體培養技術,在單因素預試驗基礎上,選擇鋅濃度、培養時間和接種量3個因素,以多糖得率為指標,利用響應面法優化紅平菇鋅化多糖的制備工藝。3因素及水平見表1。

表1 多糖得率的Box-Behnken試驗設計
工藝流程:以醋酸鋅為鋅源配制不同鋅濃度培養基,按設計接種量將菌塊接入盛有相應鋅濃度的150 mL培養基的三角瓶中,25℃靜置24 h,130 r/min振蕩培養相應培養時間。離心,將菌絲體60℃烘干至恒重,備多糖提取。
1.2.2 紅平菇鋅化多糖提取 參照張建軍[11]的方法,將烘干的菌絲體放入離心管內,加入20倍體積的去離子水,90℃水浴鍋內水浴2 h,3 000r/min離心10 min,將上清液轉移到250 mL三角瓶中,反復浸提2次,加入3倍體積的乙醇進行醇沉,冷凍干燥。
1.2.3 多糖含量測定 采用苯酚-硫酸法。標準曲線制作方法:將葡萄糖置于100℃烘箱中干燥2h,準確稱取干燥后的葡萄糖20 mg,加水定容至500 mL,分別精確量取0.4、0.8、1.0、1.2、1.6、1.8、2.0 mL葡萄糖溶液于10 mL具塞試管中,補水至2 mL,加入5%苯酚溶液(現配現用)1 mL后立即加入5 mL濃硫酸,沸水浴20 min后冷卻至室溫,于490 nm下測吸光值。以葡萄糖濃度為橫坐標、吸光值為縱坐標,建立標準曲線,曲線R2值大于0.9900方可使用。準確量取2 mL樣品按上述方法測定吸光值,并根據標準曲線計算多糖含量。
1.2.4 紅平菇鋅化多糖的紅外光譜掃描分析利用傅里葉紅外光譜分析方法。取1 mg干燥紅平菇鋅化多糖樣品,加150 mg KBr充分研磨后壓片,使用Nicolet Nexus 470紅外光譜儀在500~4 000 cm-1范圍內掃描,根據紅外光譜中各特征峰的位置和形狀,推斷多糖官能團的特征。
1.2.5 紅平菇鋅化多糖的體內抗氧化能力評估
(1)小鼠衰老模型:將Kunming種雄性小鼠隨機分為空白組、模型組、陽性對照組、鋅化多糖高劑量組和鋅化多糖低劑量組,每組10只小鼠。其中,空白組:腹腔注射pH為4.5的檸檬酸緩沖液10 mL/kg+灌胃去離子水10 mL/kg;模型組:腹腔注射D-半乳糖(D-gal)0.2 mL+灌胃去離子水10 mL/kg;陽性對照組:腹腔注射D-半乳糖0.2mL+灌胃葡萄糖酸鋅10 mL/kg;高劑量組:腹腔注射D-半乳糖0.2 mL+灌胃鋅化多糖溶液400 mg/kg;低劑量組:腹腔注射D-半乳糖0.2 mL+灌胃鋅化多糖溶液200 mg/kg。
每天小鼠自由飲食和飲水,定時腹腔注射和灌胃各1次,持續45 d。每日記錄小鼠的體重及飼料和水的消耗量。
(2)樣品制備:所有小鼠禁食過夜后稱量體重,麻醉處死后眼眶取血,5 000 r/min離心5 min后取上清液(血清)備用。取血后將小鼠在無菌環境中解剖,摘取肝、腎、腦等組織放進0.9%的生理鹽水中進行清洗,用濾紙吸干表面水分,稱重并記錄。取1 g組織迅速加入9 mL預冷的PBS緩沖液(0.2 mol/L,pH 7.4,4℃)進行研磨,于5 000 r/min離心20 min,取上清即得組織勻漿,冷藏保存待用。另外取小鼠的肝、腎、腦組織,浸泡于4%的中性甲醛溶液進行固定,進行組織病理標本及切片的制備。
(3)指標分析:利用全自動生化分析儀測定小鼠血清中谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、尿素氮(BUN)、肌酐(CREA)。通過紫外可見分光光度計平行測定各組小鼠組織勻漿液中過氧化氫酶(CAT)活性和丙二醛(MDA)的含量。
1.3 數據處理
用SPSS 22.0軟件(IBM Institute,USA)進行顯著性分析。試驗數據以3次獨立平行試驗的平均值±標準差表示,同時采用單因素方差分析(ANOVA)及LSD、Tukey事后多態性檢驗來評估組間差異,P<0.05為差異顯著。
2 結果與分析
2.1 紅平菇鋅化多糖制備工藝優化
2.1.1 響應面優化試驗結果 對表2中各組合鋅化多糖得率進行Design-Expert 7.0數據分析,獲得多糖得率與鋅濃度(X1)、接種量(X2)、培養時間(X3)的二次擬合回歸方程:

表2 響應面試驗設計及結果
由方程中3因素的一次項數值可以得出,鋅濃度、接種量和培養時間的正向變化在一定程度上可以引起多糖得率的增加;3因素的二次項系數為負值,開口向下,說明該模型條件范圍內能夠得到最大值。因此,可以利用該模型對多糖的得率進行優化。
表3、表4顯示,該模型的F值為464.09,P值<0.0001,說明模型極顯著,可用來進行響應面預測。失擬值的F值為0.21,P值為0.8860(>0.05),表明失擬項與純誤差之間差異不顯著。模型的R2值為0.9983,說明模型的擬合程度良好;噪聲比為54.725,PRESS為0.68,表明該模型自變量與響應值之間的線性關系顯著。綜上所述,模型的擬合程度很好,誤差較小,可以用此模型對紅平菇鋅化多糖的制備工藝進行優化。

表3 BBD的中心組合設計模型及方差分析

表4 多糖得率擬合方差分析
二次模型中回歸系數的顯著性分析結果見表5。可知,一次項中X1、X3及交互項、二次項均在P<0.01水平上對多糖得率有顯著影響,其中X3、的影響較大。一次項因素對多糖得率的影響順序依次是X3>X1>X2,即培養時間>鋅濃度>接種量。

表5 多糖得率二次模型回歸系數的顯著性檢驗
2.1.2 模型的準確性和異常值分析 多糖得率正態概率隨機分布在直線的兩側,并且靠近直線,表明該模型的方差無偏差(圖1A);殘差與方程預測值的對應關系(圖1B)顯示,響應值隨機分布在限定線(紅色)以內。綜上說明模型設計精確度高,可用于多糖得率的響應分析。

圖1 多糖得率模型準確性分析
如圖2所示,所有多糖得率的外部學生化殘差分析均落到限制線(圖2A中的紅線)內,杠桿值遠遠低于1(圖2B)。可用該模型分析影響多糖得率變量之間的關系。

圖2 不同多糖得率間異常值的分析
2.1.3 因素間交互作用分析 從圖3和表5看出,鋅濃度和接種量交互作用對多糖得率影響顯著,曲面較緩和并且隨著鋅濃度的上升,多糖得率先升高后降低。軸向等高線密集變化顯示鋅濃度對多糖得率的影響較接種量更大,這與方差分析結果一致。

圖3 鋅濃度和接種量對多糖提取率交互作用影響的等高線圖及響應面圖
由圖4和表5看出,鋅濃度和培養時間交互作用對多糖得率影響顯著,鎖定一個變量可以看出另一個為先增加后平緩的趨勢。軸向等高線密集變化顯示培養時間對多糖得率的影響較鋅濃度更大,這與方差分析結果一致。

圖4 鋅濃度和培養時間交互作用對多糖提取率影響的等高線圖及響應面圖
由圖5和表5可知,接種量和培養時間交互作用對多糖得率影響顯著,隨著培養天數增加,多糖得率緩慢上升。軸向等高線密集變化顯示培養時間對多糖得率的影響較接種量更大,這與方差分析結果一致。

圖5 接種量和培養時間交互作用對多糖提取率影響的等高線圖及響應面圖
綜合上述分析,通過回歸方程可得鋅濃度為163.90 mg/L、接種量為2.39 cm2、培養時間為8 d時,鋅化多糖理論得率最高,為6.70%。對該條件下的富鋅率進行火焰原子吸收分光光度法檢測,結果為(90.22±4.35)%,富鋅率較高,可用于后續動物實驗。
2.2 紅平菇鋅化多糖體內抗氧化能力評估
2.2.1 血清生化指標分析 血清中CREA、BUN為檢測腎功能是否被損傷的生化指標。由圖6可知,注射D-gal后模型組小鼠CREA、BUN含量比空白組顯著升高,表明小鼠腎臟發生了損傷,腎小球過濾能力下降,無法正常代謝,導致血清中CREA、BUN積累,造成機體器官組織功能障礙。當灌胃紅平菇鋅化多糖后,小鼠腎臟中CREA、BUN含量降低,說明紅平菇鋅化多糖對衰老引起的腎臟損傷有一定緩解作用。
ALT、AST被臨床認為是監測肝損傷的生化指標。由圖6可知,注射D-gal后模型組小鼠ALT、AST活性比空白組明顯升高,表明發生了特征性肝臟損傷。當灌胃紅平菇鋅化多糖后,小鼠肝組織中ALT、AST活性分別有不同程度降低,但差異不顯著(P>0.05)。結果表明紅平菇鋅化多糖可一定程度上減輕衰老引起的肝臟損傷。
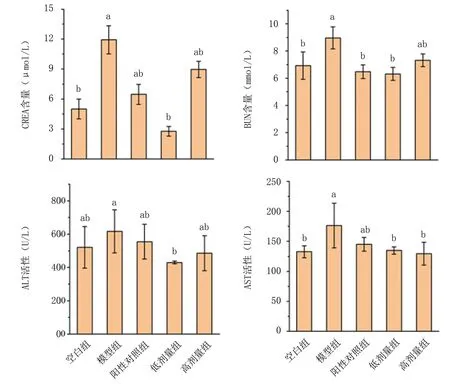
圖6 紅平菇鋅化多糖對衰老小鼠血清生化指標的影響
2.2.2 體內抗氧化指標分析 由圖7可知,模型組腎組織和肝組織CAT活性比空白組明顯降低,表明小鼠產生了不同程度的肝損傷。灌胃鋅化多糖后CAT活性皆有明顯提高,且高于陽性對照,可以證明紅平菇鋅化多糖能夠提高D-gal誘導的衰老小鼠肝組織及腎組織中CAT活性,緩解氧化應激損傷。
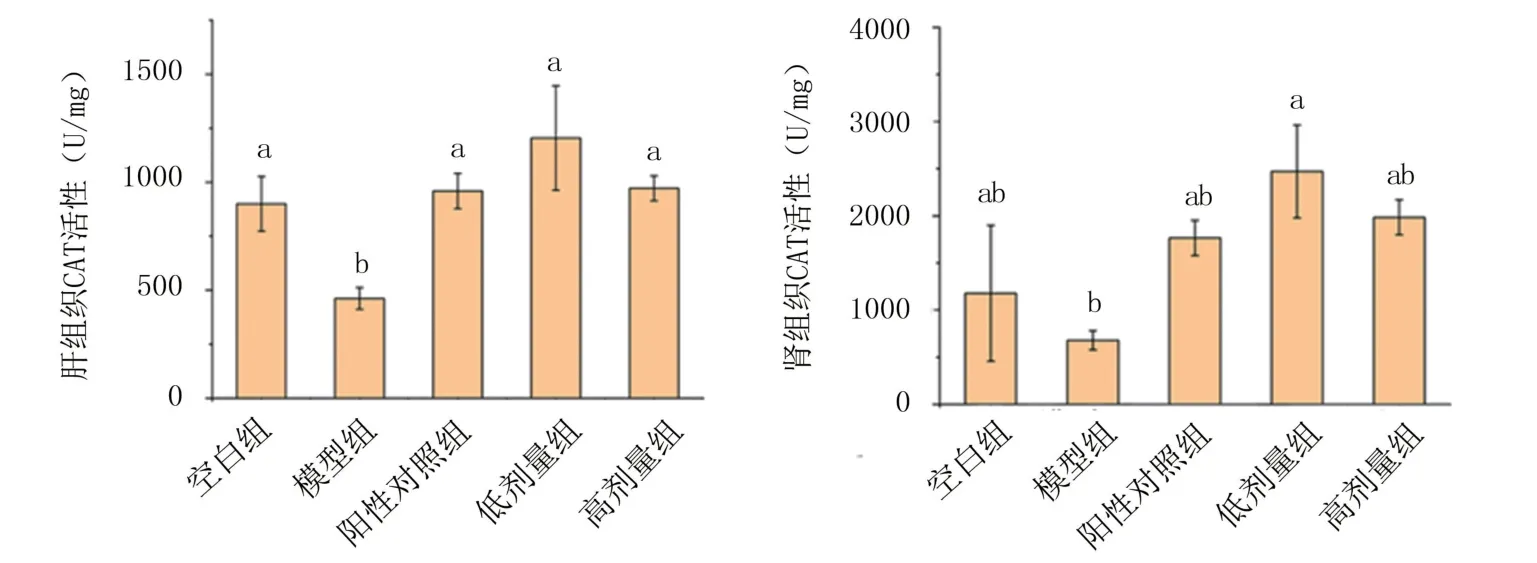
圖7 紅平菇鋅化多糖對衰老小鼠組織內CAT活性的影響
由圖8可知,相比空白組,D-gal誘導的衰老模型組小鼠肝、腎組織中MDA含量升高,且肝組織中升高顯著(P<0.05)。鋅化多糖處理組MDA含量顯著降低,說明紅平菇鋅化多糖能有效降低肝及腎組織中MDA含量,有效抑制D-gal誘發的衰老,且效果高于陽性對照組。
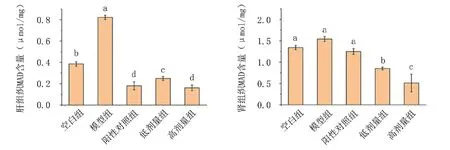
圖8 紅平菇鋅化多糖對衰老小鼠組織內MDA含量的影響
2.3 紅平菇鋅化多糖的紅外光譜掃描分析
掃描結果(圖9)顯示,在光譜3 278.17 cm-1處出現多糖特征吸收峰,由羥基(-OH)伸縮振動引起;在2 917.94 cm-1附近的吸收峰是糖類C-H鍵伸縮振動;在1 644.49 cm-1處出現顯著吸收峰,由多糖中乙酰胺基(-NHCOCH3)的(C=O)非對稱伸縮振動引起;在1 324.10 cm-1附近是糖醛酸特征吸收峰,以上幾組吸收峰結果表明該物質屬于糖類化合物。在光譜1 024.51、888.84、666.10 cm-1處出現吸收峰,推測為Zn-O的外彎彎曲振動峰,因此紅平菇鋅化多糖為β-呋喃糖。由于紅外光譜給出的結構信息僅為相關官能團連接方式及類型,對紅平菇鋅化多糖的結構反映并不全面,因此,還需對其具體結構進一步研究。

圖9 紅平菇鋅化多糖紅外光譜分析結果
3 討論與結論
多糖是生物體的重要組成成分,是具有抗衰老、抗病毒、增強機體免疫力等功能的天然活性物質[12]。MDA是氧自由基損傷和脂質過氧化作用的主要代謝產物,存在于血清和組織中的MDA含量高低能反映機體自由基代謝的情況[13]。CAT存在于機體過氧化物體內,其活性高低間接反映細胞遭到自由基攻擊的受損程度[14]。本試驗結果表明紅平菇鋅化多糖相比于同濃度的未富鋅多糖[15]及其他部分側耳屬多糖有更好的抗氧化能力[16],且抗氧化能力隨著多糖濃度的增加而增加,可在一定程度上緩解氧化應激所帶來的肝損傷和腎損傷,從而抑制衰老,延長壽命。
本試驗采用醇沉浸提方式,在單因素預試驗基礎上,通過響應面法確定了紅平菇鋅化多糖的最佳提取條件為鋅濃度163.90 mg/L,接種量2.39 cm2,培養時間8 d。在此條件下,紅平菇鋅化多糖提取率可以優化至6.70%。本研究結果可為建立紅平菇有機鋅轉化、鋅化多糖制備生產體系以及補鋅食物、藥物開發提供參考和依據。

