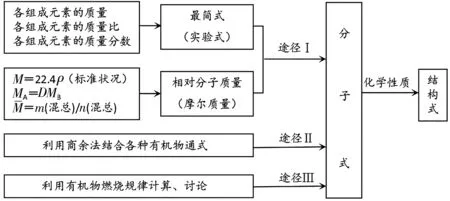
確定有機物分子式的三個途徑
■廣西柳州市第二中學 黃 穎
有機物分子式求解方法較多,現歸納如下:
其中,ρ:標準狀況下氣體的密度;D:氣體A對氣體B的相對密度:混合氣體的平均摩爾質量。
途徑Ⅰ
若題目給出元素的質量分數、相對密度等,可以先求出相對分子質量,再確定分子中各元素的原子個數,求出分子式;也可先求出最簡式,再根據相對分子質量,確定分子式。
此途徑可分為“單位物質的量”法和最簡式(實驗式)法兩種:
“單位物質的量”法:根據有機物的摩爾質量(或相對分子質量)和有機物中各元素的質量分數(或質量比),求算出1 mol 該有機物中各元素原子的物質的量,從而確定分子中的各原子個數,進而確定有機物的分子式。
最簡式法(實驗式法):先求出有機物中各元素原子個數比,然后根據該有機物的摩爾質量或相對原子質量求出分子式。
例1某化合物由碳、氫兩種元素組成,其中碳的質量分數為85.7%,在標準狀況下11.2 L該化合物氣體的質量為14g。則該化合物的分子式為_____。
解析:①“單位物質的量”法:該化合物的摩爾質量28g·mol-1。
1mol該化合物中碳原子和氫原子的物質的量分別為:
故該化合物的分子式為C2H4。
②最簡式(實驗式)法:
該化合物的最簡式為CH2,設分子式為(CH2)n,14n=28,n=2。因此烴的分子式為C2H4。
途徑Ⅱ
若題目給出(或能計算出)相對分子質量的話可用商余法直接求得分子式。
商余法(只適用于烴的分子式的求解):設烴的相對分子質量為M。

例2①某烴相對分子質量為42,則其分子式為_____。
②相對分子質量為128的烴的分子式為_____。
解析:①=3余6,即C3H6。
途徑Ⅲ
解方程式法:若題目給出燃燒產物的質量,可通過燃燒通式列方程式求出分子式。
燃燒通式:CxHy+(x+CxHyOz+
例31體積某烴的蒸氣完全燃燒生成的CO2比水蒸氣少1體積(在同溫同壓下測定),0.1 mol 該烴完全燃燒的產物被堿石灰吸收,堿石灰增重39g,該烴的分子式為____。
解析:設烴的分子式為CmHn,完全燃燒的反應為
依題意CO2比水蒸氣少1體積,堿石灰增重39g為CO2和H2O的質量和,得方程組:
解得m=6,n=14。
因此該烴的分子式為C6H14。
守恒法:利用反應前后參加反應物質的各元素原子跟反應后生成物的各元素原子守恒,求出有機物的分子式。
例40.94g某有機物在純氧中充分燃燒,可生成2.64gCO2,0.54gH2O,消耗2.24g O2。又知此有機物的相對分子質量為氫氣的47倍,該有機物的分子式為_____。
解析:因為有機物的摩爾質量為47×2g·mol-1=94g·mol-1,所以0.94g該有機物的物質的量為0.01 mol。
又因2.64g CO2的物質的量為=0.06 mol,0.54gH2O的物質的量為=0.03 mol,2.24gO2的物質的量為=0.07 mol。
則1 mol該有機物燃燒消耗7 mol O2,生成6 mol CO2,3 mol H2O。
故該有機物中含C為6 mol,H為3 mol×2=6 mol,O為6 mol×2+3 mol×1-7 mol×2=1 mol。
因此該有機物的分子式為C6H6O。
區間法:根據有機物反應的某個量的上、下限值以及有關通式,列出不等式進行求解,從而確定分子式。
例5常溫下,在密閉容器中混有2 mL氣態烷烴和10 mL O2點火爆炸,除去其中的CO2和H2O,又在剩余物中加入5 mL O2,再進行一次爆炸,除得到CO2外,還剩余O2,試確定該烴的分子式:____。
解析:設烷烴的分子式為CnH2n+2,則2mL CnH2n+2完全燃燒時耗O2為(3n+1) mL。則有10<3n+1<10+5,即3 因為n為正整數,故n=4,即分子式為C4H10。 討論法:當反應物的相對用量不確定或條件不足時,應根據有機物分子中的碳原子、氫原子要符合化合價組成原則,或某種特定性質要求,加上C、H原子數要為正整數,然后進行討論來確定有機物的分子式。 例625 ℃某氣態烴與O2混合,在密閉容器中點燃爆炸后又恢復至25 ℃,此時容器內壓強為原來的一半,再經NaOH溶液處理,容器內壓強幾乎為0。該烴的分子式可能為( )。 A.C2H4B.C2H6 C.C3H6D.C3H8 解析:設該烴的分子式為CxHy,則CxHyH2O。 由題意可知,烴和O2的物質的量之和應為CO2的物質的量的2倍,即1+(x+)=2x,得x=1+。 討論:當y=4時,x=2;當y=6時,x=2.5不合題意;當y=8時,x=3。 故正確答案為A、D。 【對應練習】 1.某烴類化合物A的相對分子質量為84,含有碳碳雙鍵,分子中只含有一種類型的氫。A的結構簡式為_____。 2.已知化合物A中各元素的質量分數分別為C 37.5%,H 4.2%,O 58.3%。0.01 mol A在空氣中充分燃燒需要消耗氧氣1.01 L(標準狀況),則A的分子式是____。 3.某含苯環的化合物A,其相對分子質量為104,碳的質量分數為92.3%。A的分子式為_____。 4.烴基烯基醚(含一個氧原子)A的相對分子質量為176,分子中的碳氫原子之比為3∶4,A的分子式為____。 5.A為一元羧酸,8.8gA與足量NaHCO3的溶液反應生成2.24 L CO2(標準狀況下),A的分子式為_____。 6.A是芳香化合物,相對分子質量為180,其碳的質量分數為60.0%,氫的質量分數為4.4%,其余為氧,則A的分子式是____。 7.芳香烴A的相對原子質量在100~110之間,1 mol A充分燃燒可生成72g水,A的化學名稱是_____。 8.一元醇A中氧的質量分數為21.6%,則A的分子式為_____。 答案與提示: 1.(CH3)2C═C (CH3)2提示:因為A的相對分子質量為84,84÷12=7,余數為0,得到分子式C7,一個C可以換12個H,又因為A中含有碳碳雙鍵,故A為含6個碳的烯烴C6H12。又因為A只有一種類型的氫,A應為(CH3)2C═C (CH3)2。 2.C6H8O7提示:由化合物A中各元素的質量分數可確定其實驗式,C∶H∶O=≈6∶8∶7,故A的實驗式為C6H8O7。0.01 mol A在空氣中充分燃燒消耗氧氣1.01 L(標準狀況),即0.045 mol;若其分子式為(C6H8O7)n,由燃燒通式知,解得n=1,故分子式為C6H8O7。 3.C8H8提示:A中的碳原子數為≈8,除碳外余數為8,只能是氫,分子式為C8H8。 4.C12H16O 提示:由信息知A中含有一個氧原子,所以C、H的總的相對原子質量=176-16=160,=13余4,最多含有13個碳原子,即C13H4,一個碳原子換12個H原子,即C12H16,符合C、H原子數目之比為3∶4,所以A的分子式為C12H16O。 5.C4H8O2提示:因為是一元羧酸,故與碳酸氫鈉按1∶1反應生成CO2,可判斷8.8g A的物質的量就是0.1 mol,故A的相對分子質量88,由CxHy—COOH可知CxHy的摩爾質量為88-45=43,=3余7,得C3H7—COOH,A是C4H8O2。 6.C9H8O4提示:A的相對分子質量為180,碳的質量分數為60.0%,氫的質量分數為4.4%,A中的碳原子數為9,氫原子數為≈8,氧原子數為≈4,A的分子式為C9H8O4。 7.苯乙烯 提示:1 mol A~72g H2O~4 mol H2O,A中含有8個H,因此可以設A為CxH8,則M(CxH8)∈(100,110),M(Cx)∈(92,102),x∈(7.7,8.5),這個區間只有8是整數。因此A是C8H8,名稱是苯乙烯。 8.C4H10O 提示:設分子式為CxHyO,相對分子質量為M,則有=21.6%,M(CxHyO)=74,M(CxHy)=74-16=58。=4余10,所以該醇為C4H10O。

