復方阿莫西林乳房注入劑無菌檢查方法的優化
韓寧寧,彭文繡,王 軒,趙 暉,楊秀玉,戴 青,趙富華
(中國獸醫藥品監察所,北京 100081)
阿莫西林乳房注入劑是由阿莫西林、舒巴坦、潑尼松龍與礦物油制成的供乳房灌注用滅菌混懸油溶液,用于奶牛泌乳期乳房炎的治療。β-內酰胺酶抑制劑舒巴坦與β-內酰胺類抗生素阿莫西林聯用,可起到增效和擴大抗菌譜作用[1-2],糖皮質激素藥物潑尼松龍可增加機體對炎癥的耐受性以及降低炎癥的血管反應與細胞反應。無菌檢查是控制乳房注入劑安全性的重要項目。復方阿莫西林乳房注入劑的質量標準收載于《獸藥質量標準匯編》(2013年版)[3]中,無菌檢查采用直接接種法。經國家獸藥基礎數據庫[4]查詢,目前有4家獸藥生產企業獲得了該品種的批準文號,相應產品執行該標準。2019年,農業農村部公告第150號[5]批準了該品種的變更注冊,并發布了修訂后的質量標準,但無菌檢查方法并未發生變更。部分企業在執行該無菌檢查標準的過程中反映,供試品接種后呈混懸狀態,無法準確判斷是否有菌生長,且操作繁瑣,易受外源性微生物污染,對人員操作和環境潔凈程度要求較高。而薄膜過濾法作為各國藥典收載的無菌檢查的首選方法[6-7],可克服上述問題。因此,擬將復方阿莫西林乳房注入劑無菌檢查方法進行優化,優先考慮采用薄膜過濾法。
1 材料與方法
1.1 材料
1.1.1 供試品 共收集到來自2家獸藥生產企業的4批樣品,見表1。

表1 樣品信息Tab1 Information of samples
1.1.2 試驗菌種 金黃色葡萄球菌[CMCC (B) 26003]、大腸埃希菌[CMCC (B) 44102]、銅綠假單胞菌[CMCC (B) 10104]、枯草芽孢桿菌[CMCC (B)63501]、生孢梭菌[CMCC (B) 64941]、白色念珠菌[CMCC (F) 98001]和黑曲霉[CMCC (F)98003] 均購自中國食品藥品檢定研究院。
1.1.3 培養基 硫乙醇酸鹽液體培養基、胰酪大豆胨液體培養基、胰酪大豆胨瓊脂培養基、沙氏葡萄糖液體培養基、沙氏葡萄糖瓊脂培養基均購自北京中海生物科技有限公司。
1.1.4 儀器及耗材 無菌隔離器(HTY-1650G3)和一次性無菌濾器(EVS3、EVS2)均購自浙江泰林生物技術股份有限公司。青霉素酶(30萬單位/mL)購自中國食品藥品檢定研究院。
1.2 方法
1.2.1 薄膜過濾無菌檢查方法的建立
1.2.1.1 萃取溶劑種類的篩選 萃取的油相溶劑采用無抑菌干擾作用且破乳效果良好的肉豆蔻酸異丙酯。將10 g供試品(來源/批號:齊魯/1709007)置200 mL肉豆蔻酸異丙酯中,混勻,得均勻混懸液。采用三種水相溶劑0.1%蛋白胨溶液、pH 7.0氯化鈉-蛋白胨緩沖液和pH 6.0磷酸鹽緩沖液分別對破乳后的混懸液進行萃取,并對水油分離效果進行比較,以選擇適宜的水相溶劑。
1.2.1.2 萃取溶劑體積的選擇 將收集到的兩個生產企業的樣品分別采用不同體積的油相溶劑(600 mL和200 mL)和水相溶劑(300 mL和100 mL)進行萃取,并對水油分離效果進行比較,以選擇適宜的萃取溶劑體積。
1.2.1.3 萃取回收率的考察 為保證樣品中油相包被的菌均分配至水相中,同時為驗證水相溶劑對菌的生長無抑制作用,對萃取回收率進行了考察。取滅菌后的輔料10 g,置分液漏斗中,加入小于100 cfu/mL的金黃色葡萄球菌菌液2 mL,加600 mL肉豆蔻酸異丙酯,混勻,加入300 mL pH 6.0磷酸鹽緩沖液,振搖后靜置,取水層置二聯濾器上過濾。過濾后取下濾膜置胰酪大豆胨瓊脂平板上培養,32.5 ℃培養24 h后計數。
1.2.1.4 沖洗液體積的選擇 取10 g供試品置600 mL肉豆蔻酸異丙酯中,混勻,加入300 mL pH 6.0磷酸鹽緩沖液,振搖后靜置,取水層置二聯濾器上過濾后,分別用300 mL/膜、600 mL/膜、900 mL/膜pH 7.0氯化鈉-蛋白胨緩沖液進行沖洗后,每個濾筒加入約100 mL硫乙醇酸鹽液體培養基,再加入小于100 cfu的金黃色葡萄球菌,32.5 ℃培養并與陽性對照菌的生長情況進行比較,以選擇適宜的沖洗體積。
1.2.1.5 青霉素酶用量的選擇 取10 g供試品置600 mL肉豆蔻酸異丙酯中,混勻,加入300 mL pH 6.0磷酸鹽緩沖液,振搖后靜置,取水層置二聯濾器上過濾后,用300 mL/膜pH 7.0氯化鈉-蛋白胨緩沖液進行沖洗,每個濾筒加入約100 mL硫乙醇酸鹽液體培養基,重復制備5個濾筒,分別加入300萬單位/膜、30萬單位/膜、3萬單位/膜、3千單位/膜、300單位/膜的青霉素酶,再加入小于100 cfu的金黃色葡萄球菌,32.5 ℃培養并與陽性對照菌的生長情況進行比較,以選擇適宜的青霉素酶用量。
1.2.2 擬建立的薄膜過濾無菌檢查法 取混勻后的本品10 g,置滅菌的分液漏斗中,加無菌肉豆蔻酸異丙酯600 mL,充分振搖,再加pH 6.0磷酸鹽緩沖液300 mL,振搖,靜置,取水層用薄膜過濾法處理,用pH 7.0無菌氯化鈉-蛋白胨緩沖液為沖洗液沖洗濾膜,每次沖洗100 mL/膜,共沖洗3次。每膜加入不少于3萬單位青霉素酶。依法檢查(附錄1101),應符合規定。
1.2.3 方法學驗證 按照《中國獸藥典》一部附錄1101[8]的要求,對上述方法進行驗證。
1.2.3.1 菌液的制備 分別取金黃色葡萄球菌、銅綠假單胞菌、枯草芽胞桿菌、大腸埃希菌的新鮮培養物1白金耳,接種于10 mL胰酪大豆胨液體培養基中,經30~35 ℃培養18~24 h,取1 mL分別加入9 mL pH 7.0無菌氯化鈉-蛋白胨緩沖液,作為10-1管,逐管10倍稀釋至小于100 cfu/mL,活菌計數備用。
取生孢梭菌接種于硫乙醇酸鹽流體培養基中,取白色念珠菌接種于沙氏葡萄糖液體培養基中,取黑曲霉接種于沙氏葡萄糖瓊脂斜面培養基上,同法操作。
1.2.3.2 活菌計數 分別取上述細菌菌液1 mL加入培養皿,每種菌液做2個平皿,注入胰酪大豆胨瓊脂培養基約18 mL,置30~35 ℃培養24~48 h。取生孢梭菌菌液置于硫乙醇酸鹽流體培養基中,取真菌菌液注入沙氏葡萄糖瓊脂培養基中,同法操作。
1.2.3.3 培養基的靈敏度檢查 取每管裝量為12 mL的硫乙醇酸鹽流體培養基7支,分別接種小于100 cfu的金黃色葡萄球菌、銅綠假單孢菌、生孢梭菌各2支,另1支不接種作為空白對照,培養3 d。另取每管裝量為9 mL的胰酪大豆胨液體培養基7支,分別接種小于100 cfu的枯草芽孢桿菌、白色念珠菌、黑曲霉各2支,另1支不接種作為空白對照,培養5 d。以空白對照管應無菌生長,加菌的培養基管生長良好來判定該培養基的靈敏度檢查符合規定。
1.2.3.4 薄膜過濾無菌檢查法適用性試驗 ①供試品陽性菌試驗組:取供試品10支,擠出內容物,混勻,取混合樣品10 g,置滅菌的分液漏斗中,照1.2.2項操作,在最后一次沖洗液中分別加入小于100 cfu/mL的菌液1 mL,過濾后,每個濾筒內灌注培養基和3萬單位青霉素酶,其中金黃色葡萄球菌、大腸埃希菌、生孢梭菌在硫乙醇酸鹽流體培養基中,30~35 ℃條件下培養5 d,枯草芽孢桿菌、白色念珠菌、黑曲霉在胰酪大豆胨液體培養基中,20~25 ℃條件下培養5 d,各2組。
②陽性菌對照組:除不加供試品外,其余同法操作。
③供試品組:除不加陽性菌外,其余同法操作。
④陰性對照組:除不加供試品和陽性菌外,其余同法操作。
1.2.4 供試品的無菌檢查 因上市抽驗樣品的最少檢驗數量不包括陽性對照用量,因此在進行供試品無菌檢查實際操作時應增加二分之一的最少檢驗數量作陽性對照用,即取供試品15支,擠出內容物,混勻。取混合樣品10 g,置滅菌的分液漏斗中,加滅菌肉豆蔻酸異丙酯600 mL充分振搖,再加pH 6.0磷酸鹽緩沖液300 mL,振搖,靜置,取水層。再取混合樣品5 g,置滅菌的分液漏斗中,加無菌肉豆蔻酸異丙酯300 mL充分振搖,再加pH 6.0磷酸鹽緩沖液150 mL,振搖,靜置,取水層。將兩次萃取的水層合并,照1.2.2項操作。
2 結果與分析
2.1 薄膜過濾無菌檢查方法的建立
2.1.1 萃取溶劑種類的篩選 pH 6.0磷酸鹽緩沖液相對常規的無菌檢查用溶劑0.1%蛋白胨溶液和pH 7.0氯化鈉-蛋白胨緩沖液而言,明顯減輕了乳化現象,實現了完全分離,提高了萃取效率(表2)。

表2 萃取溶劑種類的選擇Tab 2 Selection of extraction solvent
2.1.2 萃取溶劑體積的選擇 齊魯與澳龍兩家企業的產品黏度差異較大,齊魯的樣品較稀,澳龍的樣品較粘稠。因此,在考察了齊魯的樣品的萃取效果后,將供試品換為澳龍的樣品。采用上述萃取溶劑進行萃取,結果發現又出現了嚴重乳化現象。因此將萃取溶劑量進行了增大。采用600 mL肉豆蔻酸異丙酯與300 mL pH 6.0磷酸鹽緩沖液,對上述2家企業的各10 g供試品進行萃取,均可完全分層(表3)。

表3 萃取溶劑體積的選擇Tab 3 Selection of extraction solvent volume
2.1.3 萃取回收率的考察 萃取后每膜菌落數/每1 mL菌落數=(77+65)/(63+68)=108%,在50%~200%的范圍內。說明萃取后樣品中的菌均分配至水相,且pH 6.0磷酸鹽緩沖液對菌的生長無抑制作用。
2.1.4 沖洗液體積的選擇 結果見表4,該結果表明即便沖洗900 mL/膜仍不能消除阿莫西林對菌生長的抑制作用,需要加青霉素酶使阿莫西林降解以消除影響。
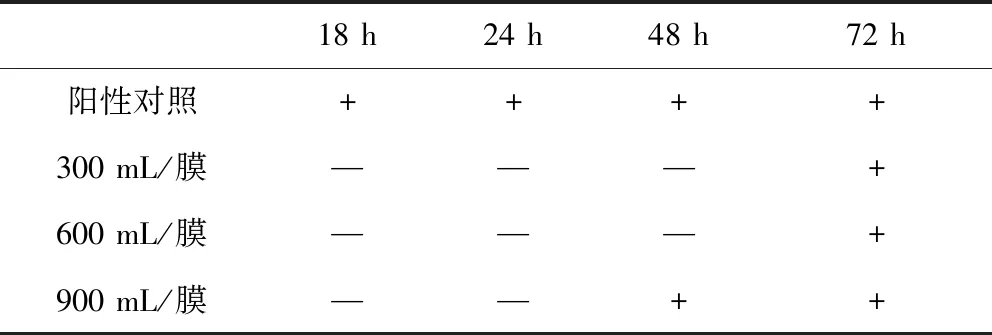
表4 沖洗液體積的選擇Tab 4 Selection of flushing fluid volume
2.1.5 青霉素酶用量的選擇 結果見表5,該結果表明,3000單位/膜是可消除阿莫西林抑菌作用的臨界青霉素酶濃度。但考慮到不同品牌和種類的濾膜對阿莫西林的截留量存在差異,亦考慮到不同試驗人員操作手法有所差異,擬采用青霉素酶的用量為3萬單位/膜。

表5 青霉素酶用量的選擇Tab 5 Selection of penicillin enzyme dosage
2.2 方法學驗證
2.2.1 活菌計數 結果見表6,該結果表明,在各自對應稀釋級別下,各檢定菌株濃度均在50~100 cfu/mL范圍,符合無菌檢查陽性菌濃度要求。

表6 活菌計數結果Tab 6 Results of living bacteria counts
2.2.2 培養基的靈敏度檢查 各細菌檢定菌株均在24 h內生長,各霉菌檢定菌株均在48 h內生長,符合無菌檢查用菌要求。
2.2.3 無菌檢查方法適用性試驗 薄膜過濾后,含供試品的陽性菌試驗組試驗菌均生長良好,供試品對菌生長沒有影響。
2.3 供試品的無菌檢查 4批供試品進行無菌檢查后,陽性對照菌在24 h內生長良好,陰性對照14 d內均澄清,無菌生長,4批供試品14 d內均澄清,無菌生長,無菌檢查結果均符合規定。
3 討論與小結
3.1 薄膜過濾法與直接接種法的優劣性分析[9]在樣品有抑菌作用干擾時,直接接種法由于難以排除樣品干擾,僅可采用減少取樣量的方法進行稀釋,因此,樣品取樣量不可過大,無菌檢查結果對整批樣品的代表性降低;另外,對于油性基質的樣品而言,與培養基混合后會形成混懸液,難以與陽性對照進行區分,結果判斷困難,需進一步采用轉種的方式進行次代培養,方可準確判斷結果,但操作步驟增多又增大了污染的可能性;再者,直接接種法的所有操作均在開放性容器中進行,對人員操作和環境潔凈度的要求較為嚴格。
薄膜過濾法由于可采用沖洗液將樣品沖洗去除,取樣量較直接接種法可有所增大,結果代表性增強;對于油性基質的樣品,可選擇采用聚山梨酯80等水油互溶性表面活性劑溶解后過濾,但如果采用上述手段仍無法使樣品順利過膜,可考慮破乳萃取水相的方式,但需注意選擇適宜的萃取溶劑以避免乳化;另外,薄膜過濾法可采用全封閉式濾器,避免了外源性微生物的污染,操作更為簡便;再者,薄膜過濾法的培養基避免了油相的干擾,結果易于觀察。
對于本方法而言,萃取乳化嚴重的特殊情況導致即便采用薄膜過濾法亦無法較直接接種法[10]進一步增大取樣量,但方法操作更為便捷,方法可靠性增強,結果判斷準確性提高。
3.2 萃取用溶劑的選擇分析 乳房注入劑用于奶牛乳房炎的治療時,需向患病乳區灌注藥物,藥物在乳區局部留置,以充分發揮藥效,基于藥效設計的乳房注入劑多為油性基質的混懸液或乳膏狀半固體[11]。但對于上述基質的樣品而言,無菌的薄膜過濾法如將樣品直接過膜往往會因為堵膜而無法進行。對現有乳房注入劑質量標準中無菌檢查項方法進行了梳理,發現采用薄膜過濾法的方法大部分將樣品進行了萃取,再取水相過膜。萃取用的油相溶劑多采用肉豆蔻酸異丙酯,萃取的水相溶劑多采用附錄1101推薦的常用溶劑0.1%蛋白胨溶液或pH 7.0氯化鈉-蛋白胨緩沖液。但本制劑采用上述常規溶劑萃取乳化現象嚴重,無法實現兩相分離。分析認為乳化現象嚴重的原因是主藥阿莫西林三水合物在pH中性的緩沖液中溶解性差,而酸性緩沖液中阿莫西林溶解度提高,可使乳化現象減輕。但酸性過強的緩沖液亦會對菌的生長產生影響,因此,嘗試采用弱酸性的pH 6.0磷酸鹽緩沖液作為萃取的水相溶劑,在解決乳化問題的同時亦避免了溶劑本身對菌的損傷。
本試驗采用薄膜過濾法對復方阿莫西林乳房注入劑進行無菌檢查。通過萃取溶劑的選擇,解決了萃取乳化嚴重、萃取效率低的問題;通過增大萃取溶劑體積,實現了對不同生產企業制劑的通用性;通過萃取后過濾水相,解決了供試品直接過濾容易堵膜甚至因系統壓力過高而崩裂濾器管路的問題;通過青霉素酶加入量的考察,選擇適宜的酶加入量,在去除了供試品干擾作用的前提下,實現了試劑的節約。

