花生四烯酸對大鼠缺血性腦損傷的作用及機制
李曉華 萬芪

[摘要] 目的
探討花生四烯酸(AA)是否通過人沉默調節蛋白6(SIRT6)-人第10號染色體缺失的磷酸酶及張力蛋白同源的基因(PTEN)通路對大鼠缺血性腦損傷發揮保護作用。
方法 構建大鼠大腦中動脈栓塞(MCAO)在體模型和皮質神經元氧糖剝奪(OGD)離體模型。采用蛋白免疫印跡法和免疫熒光染色法檢測皮質神經元內PTEN和SIRT6蛋白的表達水平;使用2,3,5-氯化三苯基四氮唑(TTC)染色觀察大鼠腦梗死體積;采用Cell Counting Kit-8(CCK-8)法檢測皮質神經元存活情況。
結果 MCAO損傷后,補充AA可以減小大鼠腦梗死體積(F=367.80,P<0.05)。OGD損傷后,補充AA可上調皮質神經元SIRT6表達和抑制PTEN表達(F=11.67、14.85,P<0.05),減輕皮質神經元損傷(F=175.40,P<0.05)。給予OSS_128167(SIRT6抑制劑)干預阻斷了AA誘導的PTEN表達下調(F=15.63,P<0.05)和神經元存活率增加(F=175.20,P<0.05)。
結論 AA通過調控SIRT6-PTEN信號通路發揮神經保護作用,改善大鼠缺血性腦損傷。
[關鍵詞] 花生四烯酸;缺氧缺血,腦;PTEN磷酸水解酶;抗衰老酶;神經保護
[中圖分類號] R972.6;R338.2
[文獻標志碼] A
[文章編號] 2096-5532(2023)06-0808-06
doi:10.11712/jms.2096-5532.2023.59.174
[網絡出版] https://link.cnki.net/urlid/37.1517.r.20231218.1556.003;2023-12-19 14:58:10
EFFECT OF ARACHIDONIC ACID ON ISCHEMIA-REPERFUSION INJURY IN RATS AND ITS MECHANISM
LI Xiaohua, WAN Qi
(Institute of Neurodegeneration and Neurorehabilitation, Qingdao University, Qingdao 266071, China)
; [ABSTRACT]ObjectiveTo investigate whether arachidonic acid (AA) exerts a protective effect against ischemic brain injury in rats via the human silencing regulatory protein 6 (SIRT6)-human phosphatase and tensin homolog deleted on chromosome 10 (PTEN) pathway.
MethodsWe constructed an in vivo model of middle cerebral artery embolism (MCAO) in rats and an ex vivo model of cortical neuronal oxygen glucose deprivation (OGD). The expression levels of PTEN and SIRT6 proteins in cortical neurons were measured using Western blot and immunofluorescence staining. Brain infarct volume was observed in rats using 2,3,5-triphenyltetrazolium chloride staining. The survival of cortical neurons was examined using the Cell Counting Kit-8.
Results
AA supplementation after MCAO reduced cerebral infarct volume (F=367.80,P<0.05). AA supplementation after OGD injury alleviated cortical neurons injury (F=175.40,P<0.05) by upregulating SIRT6 expression and downregulating PTEN expression (F=11.67,14.85,P<0.05). Administration of OSS_128167 (SIRT6 inhibitor) blocked AA-induced downregulation of PTEN (F=15.63,P<0.05) and increased neuronal survival (F=175.20,P<0.05).
ConclusionAA exerts neuroprotective effects through regulating the SIRT6-PTEN signaling pathway to ameliorate ischemic brain injury in rats.
[KEY WORDS]arachidonic acid; hypoxia-ischemia, brain; PTEN phosphohydrolase; sirtuins; neuroprotection
腦缺血/再灌注損傷是由動脈栓塞引起的大腦局部區域血流的突然中斷,使腦中氧氣和葡萄糖缺乏,進而導致神經元死亡和相應的神經功能喪失[1]。花生四烯酸(AA)在大腦中表達極為豐富,是海馬體的主要成分之一,在維持腦的功能中起著重要作用[2-3]。AA通過抑制炎癥反應和氧化應激來減輕腦缺血/再灌注損傷[4],但其神經保護作用機制還不明確。人第10號染色體缺失的磷酸酶及張力蛋白同源的基因(PTEN)是一種雙特異性磷酸酶[5],在缺血性腦損傷中下調PTEN可通過保留γ-氨基丁酸A型受體的功能來減輕神經元損傷[6]。人沉默調節蛋白6(SIRT6)是Sirtuins家族的一員,它可以減少DNA損傷,抑制代謝穩態中基因組的不穩定性[7],改善氧糖剝奪(OGD)誘導的神經元損傷[8]。研究表明,AA可通過環氧化酶-2(COX-2)或5-脂氧合酶(5-LOX)代謝途徑氧化和失活PTEN,
從而促進胰腺癌細胞的生長[9]。SIRT6可以通過上調PTEN信號通路抑制結腸癌進展[10]。本研究旨在
探討AA是否可以通過調控SIRT6-PTEN信號通
路在缺血性腦損傷中發揮神經保護作用。現將結果報告如下。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 體質量250~300 g的成年雄性Sprague-Dawley(SD)大鼠和孕期第18天的SD孕鼠購自濟南朋悅實驗動物繁育有限公司,動物合格證號SCXK(魯)2014007。
1.1.2 主要試劑 PTEN Rabbit mAb、β-actin Antibody購自Cell Signaling Technology公司;Rabbit Anti-SIRT6 antibody購買于Bioss公司;Microtubule-associated protein 2(MAP2)、Poly-D-lysine(PDL)購自Sigma公司;原代神經元培養試劑購自Gibico公司;Cell Counting Kit-8(CCK-8)試劑盒購自TargetMol公司;熒光二抗購自Solarbio公司;山羊抗兔IgG-HR購自武漢科瑞公司。
1.2 實驗分組
為探討AA對大腦中動脈栓塞(MCAO)大鼠缺血性腦損傷的作用,將30只雄性SD大鼠隨機分為假手術(Sham)組、MCAO組和MCAO+AA組,每組10只大鼠,30 mg/kg AA在MCAO再灌注時進行靜脈注射。為了探討AA對OGD損傷神經元的保護作用,實驗分為Sham組、氧糖剝奪/再復氧(OGD/R)組、OGD/R+1 μmol/L AA組、OGD/R+30 μmol/L AA組、OGD/R+50 μmol/L AA組。為探討OGD/R損傷后,AA對PTEN和SIRT6蛋白表達的影響,實驗分為Sham組、OGD/R組、OGD/R+AA組。為探討OGD/R損傷后,SIRT6對AA誘導的PTEN表達的影響,實驗分為Sham組、OGD/R組、OGD/R+AA組、OGD/R+AA+OSS_128167組。30 μmol/L的AA以及80 μmol/L的OSS_128167在神經元再復氧時加入。
1.3 實驗方法
1.3.1 大鼠MCAO模型制備 采用Longa線栓法制備大鼠MCAO模型[11],大鼠頸前切口,鈍性分離各動脈,使用線栓造成大腦中動脈血流供應障礙,缺血90 min。Sham組大鼠采用相同的手術方法,但未阻斷大腦中動脈。
1.3.2 2,3,5-氯化三苯基四氮唑(TTC)染色 根據文獻方法[12],大鼠MCAO 24 h后灌注取腦,切片,置于20 g/L TTC溶液中染色。腦片固定后,采集圖像,定量測定各組腦梗死體積。
1.3.3 原代皮質神經元培養 從雌性SD大鼠孕期第18天的胚胎大腦中獲取皮質神經元。根據文獻方法[11],將胚胎快速斬首,去除腦膜,收獲胚胎大腦皮質,進行消化、離心、吹散、過濾,將得到的神經元接種在提前1 d用PDL包被的培養皿中。培養12 d后進行實驗。
1.3.4 OGD模型制備 根據文獻方法[13],神經元首先被轉移到無葡萄糖的胞外溶液中,在厭氧工作站中培養90 min。隨后復氧,并更換正常培養液繼續培養。
1.3.5 蛋白免疫印跡法檢測皮質神經元內PTEN和SIRT6蛋白表達水平 根據文獻方法[14],使用100 g/L十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分析神經元樣本。用一抗(SIRT6 1∶1 000,PTEN 1∶1 000,β-actin 1∶4 000)和相應二抗(1∶20 000)孵育膜,ECL顯影成像。應用Image J軟件進行定量分析。
1.3.6 免疫熒光染色法檢測皮質神經元內PTEN和SIRT6蛋白表達水平 根據文獻方法[15],腦片和神經元爬片用40 g/L多聚甲醛溶液固定,體積分數0.005 Triton X-100滲透,5 g/L牛血清清蛋白封閉1 h。4 ℃下與一抗(PTEN 1∶500,SIRT6 1∶500,MAP2 1∶500)一起孵育過夜,室溫下與熒光二抗共孵育1 h。使用共聚焦顯微鏡進行觀察。
1.3.7 CCK-8比色法檢測皮質神經元的存活情況
密度均勻的神經元培養12 d后進行OGD處理,加入CCK-8溶液與神經元共孵育3 h。在450 nm波長下用96孔板讀取器測量吸光度值。
1.4 統計學分析
使用GraphPad Prism軟件進行統計學分析。所有實驗均進行了3次或3次以上,所得數據以±s表示。多組比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。P<0.05表示差異有統計學意義。
2 結? 果
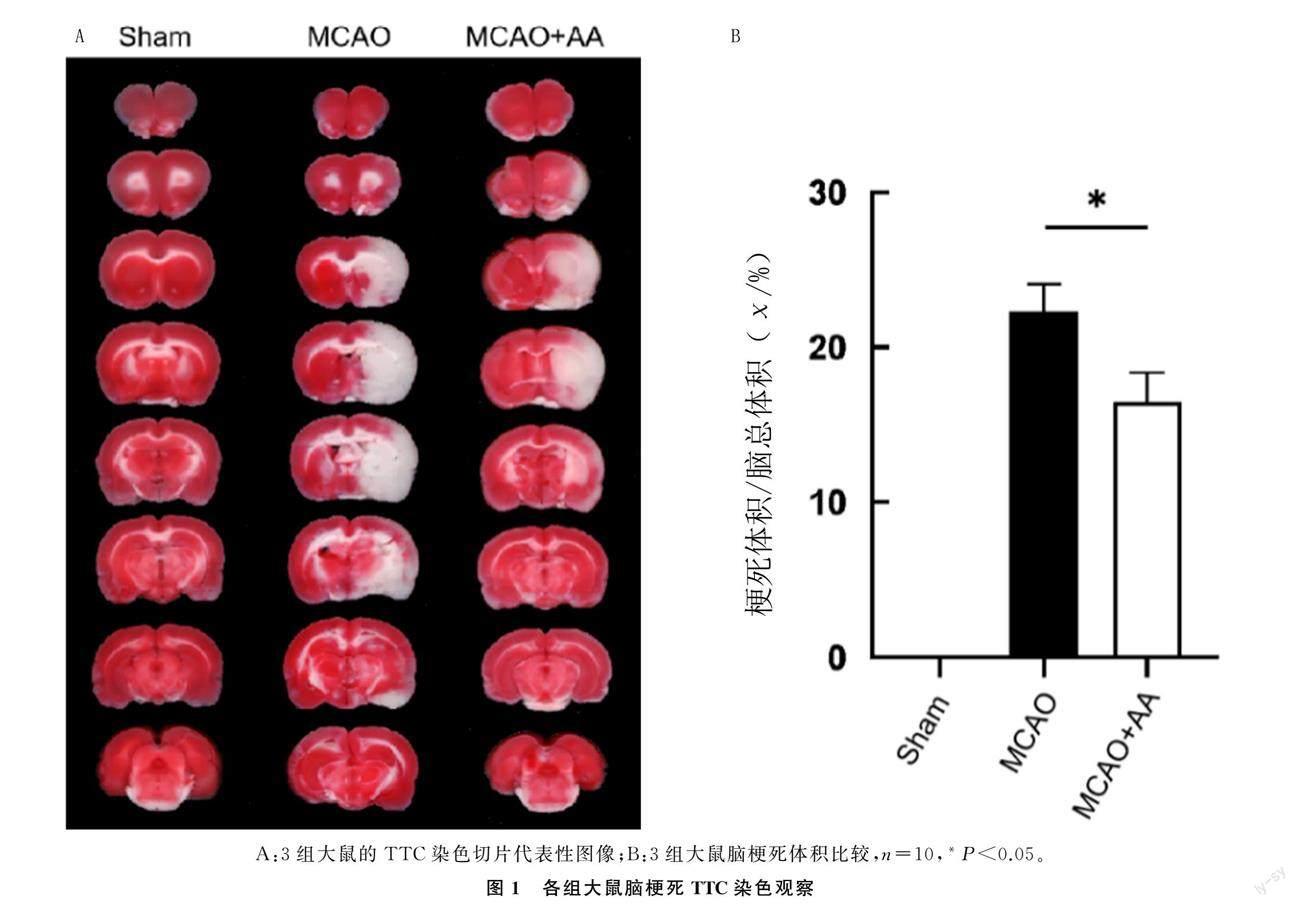
2.1 AA對缺血損傷后大鼠腦梗死體積的影響
TTC染色結果顯示,3組大鼠腦梗死體積差異具有統計學意義(F=367.80,P<0.05);兩兩比較結果顯示,MCAO+AA組的腦梗死體積顯著小于MCAO組(P<0.05)。表明使用AA治療可減小大鼠MCAO后再灌注24 h的腦梗死體積,對大鼠腦缺血再灌注具有神經保護作用。見圖1。
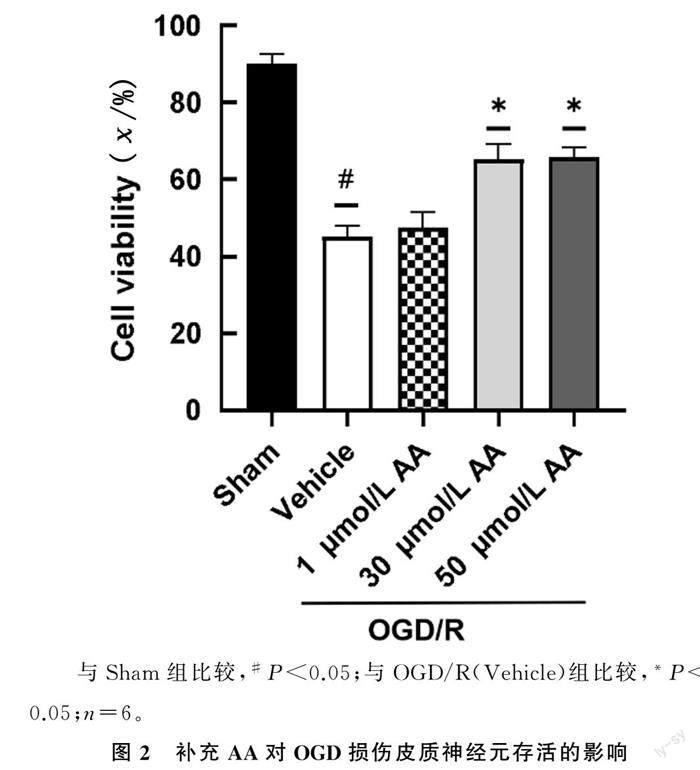
2.2 AA對OGD損傷神經元存活的影響
CCK-8法檢測結果顯示,3組神經元存活率差
異有統計學意義(F=175.40,P<0.05);與OGD/R
(Vehicle)組相比較,OGD/R+30 μmol/L AA組和OGD/R+50 μmol/L AA組神經元的存活率顯著升高(P<0.05)。表明補充AA的神經元對OGD誘導的細胞死亡具有更強的抵抗力,AA明顯促進了OGD損傷神經元的存活。見圖2。
2.3 AA對缺血皮質神經元中SIRT6和PTEN表達的影響
蛋白免疫印跡法檢測結果顯示,3組皮質神經元中PTEN及SIRT6蛋白表達差異有統計學意義(F=11.67、14.85,P<0.05)。與Sham組相比較,OGD/R組皮質神經元中PTEN蛋白表達水平升高,SIRT6蛋白表達水平降低(P<0.05);與OGD/R組相比,OGD/R+AA組PTEN蛋白的表達降低,SIRT6蛋白表達水平升高(P<0.05)。免疫熒光染色結果進一步證實,AA處理降低了OGD/R后皮質神經元中PTEN蛋白的表達水平,升高了SIRT6蛋白表達水平。見圖3、4。
2.4 AA和SIRT6對缺血神經元PTEN表達和存活的影響
各組神經元PTEN蛋白表達差異有統計學意義(F=15.63,P<0.05);與OGD/R+AA組相比,OGD/R+AA+OSS_128167組PTEN蛋白表達水平顯著升高(P<0.05)。各組神經元存活率差異具
有統計學意義(F=175.20,P<0.05);與OGD/R+AA組相比,OGD/R+AA+OSS_128167組神經元存活率顯著降低(P<0.05)。上述結果表明,OSS_128167處理阻斷了AA誘導的OGD損傷神經元PTEN的下調和存活率的增加,即AA誘導的OGD損傷后PTEN表達的下調是通過上調SIRT6介導的。見圖5。
3 討? 論
缺血性腦損傷是一種高致死率、致殘率的神經系統疾病,通常由大腦中動脈阻塞引起,并造成神經元死亡和神經功能紊亂[16]。目前,對缺血性腦損傷的研究雖然取得了很大進展,但人們對該病治療機制的探索從未停止。本文研究結果表明,AA通過PTEN-SIRT6信號通路發揮神經保護作用,減輕缺血性腦損傷。
最近的研究發現,脂質代謝在缺血性腦損傷中的作用至關重要,脂質代謝紊亂也被認為是導致神經細胞損傷和死亡的關鍵因素[17]。AA是一種ω-6多不飽和脂肪酸,在中樞神經系統中發揮著重要作用[3,18]。但AA在中樞神經系統中的研究僅局限在免疫、炎癥等方面[19-20],對脂質代謝調節機制探究甚少。有文獻報道,AA及其代謝產物在肝癌等疾病中已被確認能夠影響脂代謝過程,改善肝臟脂質沉積[21]。本文研究結果顯示,AA的添加減小了大鼠MCAO再灌注所致的腦梗死的體積,促進了OGD損傷神經元的存活。
PTEN是一種具有雙特異性磷酸酶活性的腫瘤抑制基因[5]。PTEN的脂質磷酸酶活性在腫瘤抑制中扮演著非常重要的角色,PTEN可以通過激活RNA聚合酶Ⅲ轉錄MAF1同源物的阻遏物來抑制細胞內脂質的積累,減少肥胖和腫瘤等疾病的發生發展[22-23]。值得注意的是,AA可通過COX-2或5-LOX代謝途徑氧化和失活PTEN,從而促進胰腺癌細胞生長[9]。有研究表明,PTEN過表達增加了海馬神經元對興奮性毒性的敏感性[24],而下調PTEN表達或下調PTEN磷酸化可保護腦組織免受缺血損傷[25]。因此,本研究進一步探討了PTEN是否參與AA對OGD/R處理的皮質神經元的影響。結果顯示,PTEN在OGD/R后表達升高,而其表達升高可被AA逆轉。推測AA可能在缺血/再灌注過程中抑制脂質積累,從而導致PTEN表達降低,失去活性,進而抑制下游信號介導的神經元細胞死亡。
作為一種重要的煙酰胺腺嘌呤二核苷酸依賴性酶,SIRT6自從被發現以來一直受到廣泛關注[26]。SIRT6是一種在大腦中廣泛表達的核沉默信息調節因子,可調節與大腦功能相關的神經發生和突觸、認知、髓鞘形成[27]。此外,SIRT6對于維持脂質代謝穩態至關重要[28]。有研究結果表明,SIRT6通過激活核呼吸因子2(Nrf2),降低OGD損傷后神經元的氧化應激[29]。Nrf2可以參與調控脂肪細胞的脂質代謝[30],提示SIRT6對OGD損傷后神經元的脂質代謝可能具有調控作用。因此,本研究探討了SIRT6是否參與了AA下調OGD/R處理的皮質神經元PTEN表達的過程。研究結果顯示,AA的補充可抑制OGD/R處理后SIRT6表達水平的下降,而OSS_128167處理阻斷了AA誘導的OGD損傷后PTEN表達的下調。表明AA可能在缺血/再灌注過程中通過上調SIRT6表達進而下調PTEN表達來促進神經元細胞的存活。
綜上所述,AA在缺血性腦損傷中的神經保護作用可能是通過調控SIRT6-PTEN信號通路實現的,可能涉及神經元細胞內的脂質代謝。因此,AA調控SIRT6-PTEN信號通路的詳細分子機制仍需進一步研究。本研究證明了AA通過上調SIRT6的表達進而下調PTEN的表達,從而保護神經元免受OGD誘導的損傷。補充AA干預可能是缺血/再灌注腦損傷的潛在治療靶點。
[參考文獻]
[1]LAPCHAK P A, ZHANG J H. The high cost of stroke and stroke cytoprotection research[J]. Translational Stroke Research, 2017,8(4):307-317.
[2]KAKUTANI S, EGAWA K, SAITO K, et al. Arachidonic acid intake and asthma risk in children and adults: a systematic review of observational studies[J]. Journal of Nutritional Science, 2014,3:e12.
[3]MCGAHON B, CLEMENTS M P, LYNCH M A. The ability of aged rats to sustain long-term potentiation is restored when the age-related decrease in membrane arachidonic acid concentration is reversed[J]. Neuroscience, 1997,81(1):9-16.
[4]QU Y, ZHANG H L, ZHANG X P, et al. Arachidonic acid attenuates brain damage in a rat model of ischemia/reperfusion by inhibiting inflammatory response and oxidative stress[J]. Human & Experimental Toxicology, 2018,37(2):135-141.
[5]LI J, YEN C, LIAW D, et al. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer[J]. Science, 1997,275(5308):1943-1947.
[6]LIU B S, LI L J, ZHANG Q G, et al. Preservation of GABAA receptor function by PTEN inhibition protects against neuronal death in ischemic stroke[J]. Stroke, 2010,41(5):1018-1026.
[7]MOSTOSLAVSKY R, CHUA K F, LOMBARD D B, et al. Genomic instability and aging-like phenotype in the absence of mammalian SIRT6[J]. Cell, 2006,124(2):315-329.
[8]CHENG J, FAN Y Q, JIANG H X, et al. Transcranial direct-current stimulation protects against cerebral ischemia-reperfusion injury through regulating Cezanne-dependent signaling[J].
Experimental Neurology, 2021,345:113818.
[9]COVEY T M, EDES K, FITZPATRICK F A. Akt activation by arachidonic acid metabolism occurs via oxidation and inactivation of PTEN tumor suppressor[J]. Oncogene, 2007,26(39):5784-5792.
[10]TIAN J H, YUAN L L. Sirtuin 6 inhibits colon cancer progression by modulating PTEN/AKT signaling[J]. Biomedicine & Pharmacotherapy = Biomedecine & Pharmacotherapie, 2018,106:109-116.
[11]XU X Y, CUI Y, LI C Q, et al. SETD3 downregulation me-
diates PTEN upregulation-induced ischemic neuronal death through suppression of actin polymerization and mitochondrial function[J]. Molecular Neurobiology, 2021,58(10):4906-4920.
[12]KONG X Y, HU W J, CUI Y, et al. Transcranial direct-current stimulation regulates MCT1-PPA-PTEN-LONP1 signaling to confer neuroprotection after rat cerebral ischemia-reperfusion injury[J]. Molecular Neurobiology, 2022,59(12):7423-7438.
[13]CHEN J, ZHUANG Y, ZHANG Z F, et al. Glycine confers neuroprotection through microRNA-301a/PTEN signaling[J]. Molecular Brain, 2016,9(1):59.
[14]CHEN S F, PAN M X, TANG J C, et al. Arginine is neuroprotective through suppressing HIF-1α/LDHA-mediated inflammatory response after cerebral ischemia/reperfusion injury[J]. Molecular Brain, 2020,13(1):63.
[15]ZHAO D, QIN X P, CHEN S F, et al. PTEN inhibition protects against experimental intracerebral hemorrhage-induced brain injury through PTEN/E2F1/β-catenin pathway[J]. Frontiers in Molecular Neuroscience, 2019,12:281.
[16]STRONG K, MATHERS C, BONITA R. Preventing stroke: saving lives around the world[J]. The Lancet Neurology, 2007,6(2):182-187.
[17]MUKHERJEE S, SURESH S N. Neuron-astrocyte liaison to maintain lipid metabolism of brain[J]. Trends in Endocrinology and Metabolism: TEM, 2019,30(9):573-575.
[18]DAVIS-BRUNO K, TASSINARI M S. Essential fatty acid supplementation of DHA and ARA and effects on neurodeve-
lopment across animal species: a review of the literature[J]. Birth Defects Research Part B, Developmental and Reproductive Toxicology, 2011,92(3):240-250.
[19]INNES J K, CALDER P C. Omega-6 fatty acids and inflammation[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2018,132:41-48.
[20]SONNWEBER T, PIZZINI A, NAIRZ M, et al. Arachidonic acid metabolites in cardiovascular and metabolic diseases[J]. International Journal of Molecular Sciences, 2018,19(11):3285.
[21]李沙,蘇文,張曉燕,等. 花生四烯酸代謝與肝臟糖脂代謝穩態調控[J]. 生理學報, 2021,73(4):657-664.
[22]LIU A, ZHU Y Y, CHEN W P, et al. PTEN dual lipid- and protein-phosphatase function in tumor progression[J]. Can-
cers, 2022,14(15):3666.
[23]JOHNSON D L, STILES B L. Maf1, A new PTEN target linking RNA and lipid metabolism[J]. Trends in Endocrinology & Metabolism, 2016,27(10):742-750.
[24]GARY D S, MATTSON M P. PTEN regulates Akt kinase activity in hippocampal neurons and increases their sensitivity to glutamate and apoptosis[J]. NeuroMolecular Medicine, 2002,2(3):261-269.
[25]NING K, PEI L, LIAO M X, et al. Dual neuroprotective signaling mediated by downregulating two distinct phosphatase activities of PTEN[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2004,24(16):4052-4060.
[26]TASSELLI L, ZHENG W, CHUA K F. SIRT6: novel me-
chanisms and links to aging and disease[J]. Trends in Endocrinology & Metabolism, 2017,28(3):168-185.
[27]LI X K, LIU L, LI T, et al. SIRT6 in senescence and aging-related cardiovascular diseases[J]. Frontiers in Cell and Deve-
lopmental Biology, 2021,9:641315.
[28]BAE E J, PARK B H. Multiple roles of sirtuin 6 in adipose tissue inflammation[J]. Diabetes & Metabolism Journal, 2023,47(2):164-172.
[29]KIM S H, LU H F, ALANO C C. Neuronal Sirt3 protects against excitotoxic injury in mouse cortical neuron culture[J]. PLoS One, 2011,6(3):e14731.
[30]QIU S, LIANG Z R, WU Q N, et al. Hepatic lipid accumulation induced by a high-fat diet is regulated by Nrf2 through multiple pathways[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2022,36(5):e22280.
(本文編輯 馬偉平)

