非洲豬瘟病毒MGF110-5L-6L蛋白誘導宿主細胞翻譯阻滯和應激顆粒形成的作用機制
樊帥,鐘函,楊中元,何文瑞,萬博,魏戰勇,韓世充,張改平
非洲豬瘟病毒MGF110-5L-6L蛋白誘導宿主細胞翻譯阻滯和應激顆粒形成的作用機制
樊帥,鐘函,楊中元,何文瑞,萬博,魏戰勇,韓世充,張改平
河南農業大學動物醫學院/動物免疫學國家國際聯合研究中心,鄭州 450046
【】非洲豬瘟(African swine fever,ASF)是由非洲豬瘟病毒(African swine fever virus,ASFV)感染引發的一種豬烈性傳染病,是全球公認的養豬業“頭號殺手”,至今尚無安全有效的疫苗和藥物。病毒作為專性細胞內寄生物,必須通過“劫持”宿主翻譯系統為病毒蛋白合成服務。其中翻譯起始因子eIF2α作為翻譯調控的核心節點,控制細胞應激反應和翻譯重編程走向,對病毒毒力、嗜性、致病性及免疫逃逸等具有重要影響,eIF2α磷酸化調控無疑是病毒與宿主細胞競爭翻譯資源的重要陣地之一。然而,關于ASFV編碼蛋白與eIF2α磷酸化作用關系的認知極度匱乏。【】探究非洲豬瘟病毒MGF110-5L-6L蛋白對宿主細胞翻譯阻滯和促進應激顆粒形成的作用機制,為深入揭示非洲豬瘟病毒的致病機制研究提供科學依據。【】在前期利用熒光素酶報告基因載體和綠色熒光報告載體,篩選發現外源表達MGF110-5L-6L極顯著上調eIF2α磷酸化水平的基礎上。選擇豬肺泡巨噬細胞3D4/21和豬腎細胞PK-15作為研究用細胞系,利用質粒轉染和特異性化學藥物處理等方法,結合免疫印跡和激光共聚焦顯微鏡等檢測技術,驗證了MGF110-5L-6L蛋白與eIF2α磷酸化及其下游翻譯效應之間的功能關系。隨后,通過生物信息學網站預測、亞細胞定位和功能分析等,研究了MGF110-5L-6L蛋白與誘導細胞應激之間的相關性。【】證實外源表達ASFV多基因家族蛋白MGF110-5L-6L能夠顯著增強細胞內eIF2α磷酸化水平及激活轉錄因子ATF4表達量,誘導綜合應激反應的發生;還可誘導細胞發生內質網應激和未折疊蛋白反應,并通過活化PERK和PKR激酶來誘發eIF2α的磷酸化,進而導致細胞蛋白翻譯阻滯和應激顆粒形成。進一步證實,MGF110-5L-6L蛋白含有兩個高度保守的半胱氨酸基序,且主要定位于內質網,少量分布于高爾基體、線粒體和溶酶體,還可誘導高爾基體和過氧化物酶體的亞細胞定位及形態出現顯著改變,提示其可能通過影響內質網腔中氧化還原穩態、蛋白分泌途徑或相關膜性細胞器發生等創造應激條件。【】報道了ASFV早期蛋白MGF110-5L-6L的結構、亞細胞定位及其潛在功能特征,揭示了MGF110-5L-6L蛋白與eIF2α磷酸化和宿主細胞蛋白翻譯系統之間的功能關系,為深入認識ASFV的病原生物學與致病機制提供了新的科學參考。
非洲豬瘟病毒;MGF110-5L-6L蛋白;eIF2α磷酸化;翻譯阻滯;應激顆粒
0 引言
【研究意義】非洲豬瘟(African swine fever,ASF)是由非洲豬瘟病毒(African swine fever virus,ASFV)引起的一種豬烈性傳染病,是全球公認的養豬業“頭號殺手”,強毒株引發的超急性和急性感染致死率高達100%[1]。1921年ASF疫情首次報道于肯尼亞,隨后疫情傳播至撒哈拉以南的非洲地區、歐洲、南美洲、亞洲、大洋洲等多個國家,據世界動物衛生組織最新通報數據顯示,截至2022年4月14日,正在暴發ASF疫情的國家/地區有73個(https://www.oie.int/en/ disease/african-swine-fever/),且全球ASF疫情的蔓延和流行態勢仍非常嚴峻。我國作為全球生豬養殖和豬肉消費第一大國,屬于ASF疫情重災區。自2018年8月暴發首例ASF疫情以來,截至目前,全國已累計通報198起疫情,席卷了除臺灣以外的所有省份(http://www.moa.gov.cn/gk/yjgl_1/yqfb/),給我國生豬產業構成巨大威脅,且造成了重大的社會、經濟以及政治影響。目前,仍無安全有效的ASF疫苗和藥物上市,僅依靠嚴格檢疫和撲殺等綜合生物安全措施進行防控。世界動物衛生組織將ASF列為法定報告動物疫病,我國也將其列為一類動物疫病。ASFV屬于非洲豬瘟相關病毒科(Asfarviridae)非洲豬瘟病毒屬(Asfivirus)的唯一成員,屬于核質大DNA病毒超家族[2-3]。ASFV病毒粒子結構巨大且復雜,由外向內分別是囊膜、衣殼、內膜、核心殼和基因組[4]。ASFV基因組龐大,為全長約170—194 kb的單分子線性雙鏈DNA,擁有超過150個開放閱讀框(open reading frame,ORF),約編碼68種結構蛋白和100多種非結構蛋白,參與病毒入侵、基因組復制、DNA修復、轉錄、翻譯調控、病毒組裝及免疫逃逸等[2-5]。此外,ASFV基因組兩端具有串聯重復序列和多基因家族(multigene families, MGFs)構成的可變區,這是導致ASFV基因和表型特征多樣性的主要原因[6]。鑒于ASFV復雜的生物學特性,且對其毒力相關基因、復制致病及免疫逃逸/耐受機制等知之甚少,嚴重制約了安全有效疫苗和藥物的研發進度。【前人研究進展】病毒作為一類專性細胞內寄生物,缺乏完整的生命系統,雖攜帶負責其基因組轉錄、復制所需的酶,但必須借助細胞的蛋白翻譯、修飾加工系統來完成病毒蛋白合成。然而,這一利用過程勢必存在高度精準、有效且復雜的“劫持”機制,一方面使得病毒mRNA能夠優先享用或獨享有限的蛋白翻譯資源;另一方面嚴密調控細胞的一系列應激反應和天然免疫反應,保障病毒能夠征服細胞且成功復制[7-9]。大量證據表明,病毒對宿主細胞翻譯系統的調控對病毒毒力、細胞嗜性、致病性及免疫逃逸等均有重要影響,且病毒翻譯調控策略研究在疫苗種毒改造、抗病毒藥物開發和溶瘤制劑創制等方面顯示出極大應用價值[8-9]。眾所周知,細胞中eIF2α磷酸化水平與綜合應激反應(integrated stress response,ISR)、細胞翻譯阻滯、應激顆粒(stress granules,SGs)、內質網應激、細胞周期停滯、自噬、凋亡和天然免疫等反應密切相關,參與調控細胞翻譯系統的重編程及胞內環境穩態維持[10-13]。因此,eIF2α磷酸化調控可謂是病毒與宿主細胞搶占翻譯資源的重要陣地,許多病毒可通過抑制eIF2α發生磷酸化或階段性利用eIF2α磷酸化創造的應激環境來促進自身翻譯復制,這與病毒毒力和嗜性密切相關[9, 14]。ASFV作為“老牌的新興病毒”,早期研究表明其mRNA與真核細胞大多數mRNAs結構相似,具有5′ 帽子和3′ poly(A)尾結構,利用帽子依賴性翻譯起始機制介導病毒蛋白翻譯[15]。進一步研究證實,ASFV感染細胞后能夠誘導宿主蛋白翻譯系統阻滯,抑制宿主細胞的蛋白合成,轉而為病毒蛋白翻譯服務。其中ASFV對細胞蛋白翻譯系統的“劫持”策略包括:增強eIF4F復合體組裝及活化;抑制eIF2α發生磷酸化;募集翻譯相關因子eIFs、核糖體和線粒體重分布于“病毒工廠”以壟斷蛋白翻譯資源;調節RNA代謝,包括降解宿主mRNA(D250R脫帽酶)、阻止宿主mRNA出核和限制宿主基因轉錄等[16-19]。然而,關于ASFV編碼蛋白與宿主蛋白翻譯系統的調控機制仍存在巨大空白,尤其是與eIF2α磷酸化調控的功能關系研究幾乎未見報道。【本研究切入點】近年來,挖掘ASFV毒力/免疫逃逸基因及其作用機制,并據此指導構建新型基因缺失疫苗、亞單位疫苗和活載體疫苗已成為本領域的研究熱點及重大需求。聚焦這一科學問題,筆者所在團隊以ASFV編碼蛋白與eIF2α磷酸化的作用關系為研究切入點。基于激活轉錄因子4(Activating transcription factor 4,ATF4)的選擇性翻譯受到eIF2α磷酸化的嚴格調控這一原理,利用攜帶ATF4 mRNA翻譯調控元件的熒光素酶報告質粒,系統篩選了全套179個ASFV編碼蛋白對細胞內eIF2α磷酸化水平的影響。前期結果顯示MGF110家族成員上調eIF2α磷酸化水平的功能最為顯著。此外,已有研究證實在ASFV感染早期,表達水平最高的病毒基因亦多屬于MGF110家族成員,推測其對病毒復制極為重要[20-22]。然而,目前對其功能認知卻極度匱乏。【擬解決的關鍵問題】基于此,本研究靶向挖掘了ASFV MGF110-5L-6L蛋白與eIF2α磷酸化的作用關系,并從病毒蛋白結構、亞細胞定位及潛在功能特征等角度,探討其與宿主細胞蛋白翻譯系統之間的調控關系,為深入認識ASFV的病原生物學特征與致病機制提供新的科學依據。
1 材料與方法
所有試驗于2020年10月至2022年5月在河南農業大學動物醫學院/動物免疫學國家國際聯合研究中心進行。
1.1 細胞及細胞培養
人胚腎細胞(Human embryonic kidney 293T,HEK293T,ATCC#CRL-11268)、豬腎傳代細胞(porcine kidney 15,PK-15,ATCC#CCL-33)和豬肺泡巨噬細胞(3D4/21,ATCC#CRL-2843)均來源于美國ATCC細胞庫,PK-15細胞和3D4/21細胞由河南農業大學國家動物免疫學國際聯合研究中心保存,HEK293T細胞由武漢大學舒紅兵院士團隊惠贈。細胞均培養于含有10%胎牛血清(FBS)(Invitrogen,美國)、100 U·mL-1青霉素和100 μg·mL-1鏈霉素的DMEM(Invitrogen)培養基中,并置于5% CO2、37℃條件下培養。
1.2 抗體和化學藥物
兔抗FLAG、eIF2α、Phospho-eIF2多克隆抗體購自美國proteintech公司;兔抗ATF4、G3BP1、BIP、PERK、Phospho-PKR、PKR、GCN2多克隆抗體,以及鼠抗FLAG、β-actin單克隆抗體均購自武漢ABclonal公司;鼠抗puromycin單克隆抗體(clone 4G11)購自美國Millipore公司;兔抗Phospho - PERK(Thr980)單克隆抗體購自美國CST公司;兔抗Phospho-GCN2(Thr667)多克隆抗體購自美國Abcam公司;Alexa Fluor 488(AF488)、Alexa Fluor 594(AF594)和HRP標記二抗均購自美國Invitrogen公司。
毒胡蘿卜素(Thapsigargin,TG)、PERK抑制劑GSK2606414和ISR抑制劑ISRIB購自美國MedChemexpress(MCE)公司;嘌呤霉素(Puromycin)、亞砷酸鈉(Sodium arsenite,Ars)、PKR抑制劑C16和二甲基亞砜(Dimethyl sulfoxide,DMSO)購自美國Sigma - Aldrich公司。
1.3 質粒與質粒構建
根據GenBank公布的ASFV China/2018/AnhuiXCGQ毒株(Accession No. MK128995.1)全基因組序列,由蘇州GENEWIZ公司合成ASFV MGF110-5L-6L基因的ORF,并克隆至pCMV-C-Flag骨架載體(Beyotime,中國),獲得含有MGF110-5L-6L基因的重組表達質粒;報告基因質粒ATF4-RLuc和ATF4-EGFP交由蘇州GENEWIZ公司合成構建,即將包含人源ATF4 mRNA的leader序列及其后面編碼區的9個堿基片段(GenBank Accession No. NM_182810.3:1-291)分別克隆到pRL-TK(Promega,美國)和pEGFP-N1(Clontech,美國)骨架載體[23]。
內質網定位質粒pDsRed2-ER、線粒體定位質粒pDsRed2-Mito、高爾基體定位質粒pDsRed-Monomer- Golgi、溶酶體定位質粒pDsRed2-LAMP1和過氧化物酶體定位質粒pDsRed2-Peroxi均購自北京莊盟國際生物基因科技有限公司。
1.4 熒光素酶報告基因檢測
待HEK293T細胞單層密度達到70%—80%,利用Lipofectamine 3000(Invitrogen)將ATF4-RLuc報告基因質粒與MGF110-5L-6L表達質粒或FLAG空載體共轉染細胞,孵育24 h后,按照說明書操作規程,利用熒光素酶報告基因檢測系統(Promega,美國)裂解細胞并檢測海腎熒光素酶RLuc的信號強度。
1.5 Western blot分析
煮沸變性的蛋白樣品經SDS PAGE電泳后轉印至PVDF膜,5% 脫脂乳室溫封閉1 h后,4℃孵育一抗(1﹕1 000稀釋)過夜,室溫孵育HRP標記二抗(1﹕5 000稀釋)1 h,加ECL顯色液,并置于BioSpectrum 500全自動化學發光成像分析系統(GE Healthcare,美國)觀察蛋白條帶。
1.6 激光共聚焦(LSCM)檢測
1.6.1 亞細胞器定位分析 待PK-15細胞單層密度
達到40%—50%,利用Lipofectamine 3000(Invitrogen)將亞細胞器定位質粒與MGF110-5L-6L表達質粒或FLAG空載體共轉染細胞,孵育24 h后,4%多聚甲醛室溫固定10 min,0.1% Triton X-100室溫透膜處理10 min,5% BSA室溫封閉30 min;室溫孵育FLAG單抗(1﹕100稀釋)1 h,室溫避光孵育AF488標記二抗(1﹕1 000稀釋)1 h,DAPI(Beyotime)核染5 min,隨后利用封片劑(Beyotime)固定于載玻片,并置于Zeiss LSM800激光掃描共聚焦顯微鏡(Carl Zeiss,美國)下觀察。
1.6.2 SGs形成分析 待PK-15細胞單層培養至40%—50%,利用Lipofectamine 3000(Invitrogen)轉染MGF110-5L-6L表達質粒或FLAG空載體,孵育24 h后,或利用含有0.5 mmol·L-1亞砷酸鈉Ars孵育處理細胞45 min,或不作刺激處理。隨后同上執行間接免疫熒光分析,檢測用抗體包括鼠抗FLAG(1﹕100稀釋)、兔抗G3BP1(1﹕500稀釋),以及AF594抗鼠二抗(1﹕500稀釋)和AF488抗兔二抗(1﹕500稀釋)。
1.7 細胞蛋白翻譯效率檢測
利用Lipofectamine 3000(Invitrogen)將不同劑量的MGF110-5L-6L表達質粒或FLAG空載體轉染PK-15細胞,孵育24 h后,或直接利用5 μg·mL-1嘌呤霉素處理細胞30 min;或利用0.5 mmol·L-1亞砷酸鈉Ars預處理空載體轉染細胞45 min后再進行嘌呤霉素處理,隨后固定或收集細胞,后續如上開展LSCM檢測或Western blot分析。
1.8 蛋白分析軟件
本文中所用的蛋白質序列分析軟件見表1。
1.9 統計分析
使用Image J軟件完成熒光細胞計數、熒光共定位分析及蛋白條帶灰度值分析,所有統計結果均表示生物統計學意義重復(≥3次)的平均值±標準差。數據統計軟件采用IBM SPSS Statistics 22(IBM Corporation,美國),*(<0.05)表示統計學差異顯著,**(<0.01)表示統計學差異極顯著,n.s.(not significant)表示無顯著差異。
2 結果
2.1 外源表達MGF110-5L-6L蛋白誘導eIF2α磷酸化水平顯著上調
ATF4作為細胞內脅迫反應響應的“明星級”轉錄因子,是綜合應激反應ISR的關鍵響應器,因其mRNA 5'-leader中含有兩個短抑制上游開放閱讀框(uORF)特殊元件(圖1-A),使其在elF2α磷酸化后發生選擇性地翻譯上調,且翻譯水平受到eIF2α磷酸化水平的嚴密調控[10, 23]。基于此,筆者前期利用ATF4-RLuc報告質粒,系統篩選了全套ASFV編碼蛋白對eIF2α磷酸化水平的影響(未發表數據)。熒光素酶報告檢測結果顯示,與DMSO組相比,內質網應激誘導劑TG組的RLuc活性增幅達781%,證實ATF4-RLuc報告質粒的功能有效性;與空載對照組相比,ASFV MGF110-5L-6L表達組的RLuc熒光活性增幅達418%(圖1-A)。同時,通過對10個隨機視野中ATF4-EGFP熒光報告細胞與所有細胞(DAPI)進行計數和統計分析,發現TG刺激組中熒光細胞比值顯著多于DMSO組,約為后者的5.2倍;MGF110-5L-6L表達組的熒光細胞比值約是空載體對照組的2.1倍(圖1-B)。利用Western blot進一步證實,在PK-15細胞中過表達MGF110-5L-6L蛋白能夠顯著上調細胞內eIF2α的磷酸化水平及ATF4的表達量,且呈劑量依賴性(圖1-C);隨后,選擇ASFV野毒和細胞適應毒均可感染的肺泡巨噬細胞3D4/21進行再次驗證[32],結果顯示與PK-15細胞中的結論一致(圖1-D)。以上結果表明,外源表達MGF110-5L-6L蛋白特異性誘導宿主細胞的eIF2α磷酸化水平升高,且具備觸發細胞綜合應激反應的能力。

表1 蛋白質序列分析軟件
2.2 外源表達MGF110-5L-6L蛋白誘導宿主細胞蛋白翻譯阻滯
eIF2起始復合體整合了各種應激相關信號來調控宿主細胞翻譯系統。在正常情況下,eIF2結合GTP和甲硫酰基-起始轉運RNA(Met-tRNAi)形成三元復合體(ternary complex,TC),積極參與43S預起始復合體對AUG的識別、60S亞基招募及翻譯起始過程。然而,在應激條件下, eIF2α磷酸化致使eIF2-GDP轉換為elF2-GTP過程受阻,限制了TC的可利用性,進而導致翻譯起始受阻,細胞整體翻譯效率大大降低[10-11](圖2-A)。
鑒于MGF110-5L-6L蛋白顯著上調eIF2α磷酸化水平,推測其對細胞蛋白翻譯效率具有重要影響。基于嘌呤霉素能夠摻入新生肽鏈標記新生蛋白的原理[33],分別利用共聚焦免疫熒光和Western blot試驗雙重驗證MGF110-5L-6L表達對新生蛋白合成效率的影響。激光共聚焦顯微鏡觀察發現,與空載轉染組細胞相比,利用eIF2α磷酸化和翻譯阻滯的強力誘導劑亞砷酸鈉Ars處理細胞,可導致細胞內紅色熒光幾乎缺失,表明新生蛋白合成量顯著減少;同理,MGF110-5L-6L表達細胞中的新生蛋白合成亦顯著降低(圖2-B)。Western blot結果與免疫熒光結果一致,即與對照組相比,Ars處理組細胞中的新生蛋白條帶幾乎消失,MGF110-5L-6L表達組細胞中的新生蛋白合成量顯著降低,且呈劑量依賴性(圖2-C)。為了進一步評估eIF2α磷酸化與MGF110-5L-6L蛋白誘導的細胞翻譯阻滯之間的功能關系,利用小分子抑制劑ISRIB進行驗證,ISRIB作為eIF2B的靶向激活劑,可特異性恢復eIF2α磷酸化介導的翻譯阻滯現象。如圖2-D所示,ISRIB處理可顯著逆轉Ars刺激和MGF110-5L-6L蛋白表達誘導的宿主細胞蛋白翻譯阻滯現象。這些結果表明,外源表達MGF110-5L-6L蛋白能夠顯著抑制宿主細胞蛋白翻譯,且該過程依賴eIF2α發生磷酸化。

A:ATF4-RLuc報告質粒示意圖(上)。將FLAG空載體或MGF110-5L-6L表達質粒與ATF4-RLuc共轉染HEK 293T細胞,孵育24 h。在陽性對照組中,細胞經ATF4-RLuc轉染18 h后,孵育DMSO或TG (1 μmol·L-1) 6 h,最后進行RLuc活性檢測(下);B:將FLAG空載體或MGF110-5L-6L表達質粒與ATF4-EGFP共轉染PK-15細胞,孵育24 h;或細胞轉染ATF4-EGFP 18 h后,孵育DMSO或TG 6 h,并進行免疫熒光分析;C和D:將不同劑量的MGF110-5L-6L重組質粒或空載體轉染PK-15細胞和3D4/21細胞,孵育24 h后,收集細胞裂解物,進行Western blot檢測和灰度值分析。圖中所示結果源自三次獨立重復試驗. **:P<0.01,n.s.:差異不顯著

A:eIF2α磷酸化調控宿主細胞翻譯活性的模式圖;B:將FLAG空載體或MGF110-5L-6L重組質粒轉染PK-15細胞,孵育24 h后,利用嘌呤霉素(5 μg·mL-1)處理細胞30 min。隨后細胞經固定和透膜處理后,分別孵育嘌呤霉素(紅色)和FLAG(綠色)的抗體及相應二抗,細胞核用DAPI染色(藍色),最后用激光共聚焦顯微鏡觀察。Ars是蛋白翻譯阻滯的誘導劑,利用0.5 mmol·L-1Ars預處理空載體轉染細胞45 min后進行嘌呤霉素處理;C:將不同劑量的MGF110-5L-6L表達質粒或空載體轉染PK-15細胞,孵育24 h后,加入5 μg·mL-1嘌呤霉素處理細胞30 min,隨后收集細胞,并進行Western blot檢測和灰度值分析。D:在經Ars處理和MGF110-5L-6L表達質粒轉染的3D4/21細胞中加入0.5 μmol·L-1的ISRIB,收集細胞樣品前,利用嘌呤霉素處理細胞以檢測新生蛋白合成量。該結果源自三次獨立重復試驗. **:P<0.01
2.3 外源表達MGF110-5L-6L蛋白誘導宿主細胞產生應激顆粒(SGs)
宿主細胞暴露于應激情況下,觸發eIF2α的磷酸化,導致大多數mRNA翻譯受到抑制,而特定的脅迫響應mRNA翻譯則增強,這種翻譯重編程允許細胞優先將資源用于細胞內穩態恢復。在此期間,翻譯起始阻滯以及隨后多核糖體的分解導致細胞質內無核糖體結合的mRNA的濃度驟升,催生形成大量的無膜細胞器應激顆粒(SGs)。SGs作為一種高度濃縮的核糖核蛋白顆粒(mRNP),能夠拘儲與翻譯相關的mRNA、eIFs、40S亞基和RNA結合蛋白在內的各種分子,加劇蛋白翻譯系統的關閉[10, 34](圖3-A)。為探究MGF110-5L-6L蛋白對細胞中SGs形成的影響,筆者選擇SG核心網絡組分G3BP1作為標記蛋白進行驗證。共聚焦免疫熒光檢測發現,正常細胞中G3BP1綠色熒光均勻分布于整個細胞質,而MGF110-5L-6L蛋白表達細胞中G3BP1熒光特異地呈現點狀聚集,即SGs形成。熒光細胞計數結果顯示,與空載對照組相比,MGF110-5L-6L表達組的SGs陽性細胞占比上升至23%;作為陽性對照,Ars處理組的SGs陽性細胞占比高達90%,然而,ASFV DP71L蛋白作為已報道的促eIF2α去磷酸化蛋白[35-36],抑制Ars誘導的SGs形成,DP71L表達組的SGs陽性細胞比例降至56%(圖3-B、C)。此外,利用抑制劑ISRIB處理細胞后,發現MGF110-5L-6L蛋白表達細胞中無G3BP1熒光點狀聚集,且統計結果顯示SGs陽性細胞比例降至3.4%。這些結果表明外源表達MGF110-5L-6L蛋白能夠特異地誘導SGs的形成,且該過程依賴eIF2α的磷酸化。
2.4 ASFV MGF110-5L-6L蛋白的序列分析及結構功能域預測
外源表達MGF110-5L-6L蛋白可誘導宿主細胞穩態失調,觸發eIF2α發生磷酸化,啟動ISR、細胞翻譯阻滯和SGs形成等應激反應。為了進一步挖掘MGF110-5L-6L蛋白破壞細胞穩態的機理,我們首先對其氨基酸序列的理化特性、結構和功能域等進行預測分析。眾所周知,MGF110基因家族位于病毒基因組的左末端,因存在廣泛的密碼子重復、丟失或重排事件,使其具有高度的遺傳多樣性特征[37]。鑒于此,分別選取來自不同年份和不同地區(亞洲、歐洲和非洲)的11株高致病性毒株,并對其MGF110-5L-6L氨基酸序列進行比對分析,發現MGF110-5L-6L蛋白總體上在不同毒株間存在較高的保守性,且均擁有兩個保守的半胱氨酸結構域 [C-(X)5-C-(X)2-C-(X)2-C-(X)4-C],且部分羧基端存在內質網滯留信號KDEL基序(圖4-A),暗示MGF110- 5L-6L蛋白可能定位于內質網腔,并通過形成二硫鍵增強腔內的氧化環境。然而,MGF110-5L-6L蛋白在不同毒株中以兩種形式存在,其中在亞洲和歐洲為代表的毒株中多以5L-6L融合蛋白形式表達,而在非洲毒株中則以5L和6L兩個獨立蛋白形式表達,且前者與后者相比,存在3個缺失片段,分別是在5L羧基端缺失23/24個氨基酸,和在6L氨基端分別缺失6個和5個氨基酸(圖4-A)。此外,以China/2018/AnhuiXCGQ毒株的MGF110-5L-6L蛋白為例,利用InterProScan和SignalP 5.0預測發現,MGF110-5L-6L蛋白存在潛在的信號肽序列,且位于其氨基端前18個殘基(圖4-B);利用InterProScan和TMHMM預測發現MGF110-5L-6L蛋白無潛在跨膜區,且ProtScale分析發現其具有極高的親水性;使用NetNGlyc-1.0預測發現MGF110-5L-6L蛋白在第149位Asn處存在潛在的糖基化位點;使用NetSurfP 2.0和I-TASSER對蛋白二級、三級結構進行預測發現,MGF110-5L-6L蛋白呈復合的α螺旋和β折疊拓撲結構(圖4-A、C)。
2.5 ASFV MGF110-5L-6L蛋白的亞細胞定位
MGF110-5L-6L蛋白存在潛在信號肽及內質網滯留信號,可能引導其參與內質網-高爾基體途徑,即分泌途徑,并被分選至特定的細胞部位發揮功能[38]。眾所周知,宿主細胞內膜性細胞器之間的頻繁物質交換和功能聯系,構成了細胞執行復雜生物學過程的功能網絡,其中膜性細胞器包括內質網、高爾基體、線粒體、溶酶體以及過氧化物酶體等。ASFV在感染靶細胞進程中,不可避免地會破壞細胞正常生理狀態,引發各種膜性細胞器發生強烈的應激反應[38-40]。為了探究MGF110-5L-6L蛋白在ASFV感染進程中的定位及其潛在功能,分別將MGF110-5L-6L表達質粒與各膜性細胞器定位質粒共轉PK-15細胞,以分析其亞細胞定位。通過共聚焦免疫熒光檢測及熒光共定位分析發現,MGF110-5L-6L蛋白與內質網定位蛋白的熒光共定位系數為0.92,說明兩者幾乎完全共定位;與高爾基體定位蛋白、線粒體定位蛋白和溶酶體定位蛋白的熒光共定位系數分別為0.52、0.49和0.55,表明MGF110-5L-6L蛋白與這些蛋白僅部分共定位;而與過氧化物酶體定位蛋白的熒光共定位系數為-0.08,表明其不存在共定位關系。同時,發現MGF110-5L-6L表達誘導細胞內高爾基體和過氧化物酶體的熒光定位及形態發生顯著變化。其中,正常細胞中的反式高爾基體網絡類似“彎弓”狀聚集于細胞核周圍,而其在MGF110-5L-6L表達細胞中的分布則顯得較為松散且不規則;過氧化物酶體定位蛋白由胞質中規則的點狀聚集體形態,轉為彌散狀分布于整個細胞(圖5)。以上結果表明,MGF110-5L-6L蛋白主要定位于內質網,且少量蛋白可能通過分泌途徑被轉運至高爾基體、線粒體和溶酶體等部位,同時誘導細胞部分膜性細胞器出現形態發生或結構上的變化。
2.6 外源表達MGF110-5L-6L蛋白顯著上調eIF2α磷酸化水平的機制
MGF110-5L-6L蛋白是如何打破細胞穩態,細胞又是以何種途徑感知應激狀態的呢?眾所周知,eIF2α磷酸化由四種激酶介導,即PERK(內質網應激)、PKR(dsRNA)、GCN2(氨基酸饑餓)和HRI(血紅素不足),4種激酶分別感知不同的應激信號并作出應激性反應(圖6-A)。為了探究MGF110-5L-6L蛋白上調eIF2α磷酸化水平的機制,分別在3D4/21和PK細胞中轉染MGF110-5L-6L重組質粒,并檢測其對不同激酶的蛋白表達量和活化水平的影響。鑒于病毒感染調控HRI活性的報道極為罕見,在此僅檢測了PERK、PKR和GCN2等3個激酶的活化情況。Western blot結果顯示,與DMSO處理組相比,內質網應激誘導劑TG處理能夠誘導BIP蛋白表達量顯著升高,且激酶PERK磷酸化水平顯著升高,而對激酶PKR和GCN2活化水平的影響不顯著。過表達MGF110-5L-6L不僅誘導BIP表達量顯著增加,激酶PERK和PKR磷酸化水平亦顯著增強,且均呈劑量依賴性,但不影響激酶GCN2的活化水平(圖6-B—E)。此外,分別利用PERK抑制劑GSK2606414和PKR抑制劑C16處理細胞,可顯著抑制MGF110-5L-6L表達誘導的PERK和PKR活化以及eIF2α磷酸化水平上調(圖6-F、G)。綜合分析MGF110-5L-6L蛋白的結構、亞細胞定位及功能影響等結果,表明外源表達MGF110-5L-6L蛋白能夠通過誘發內質網應激和未折疊蛋白反應,啟動PERK和PKR激酶的活化,以觸發eIF2α發生磷酸化,進而導致宿主細胞翻譯阻滯和SGs的形成。
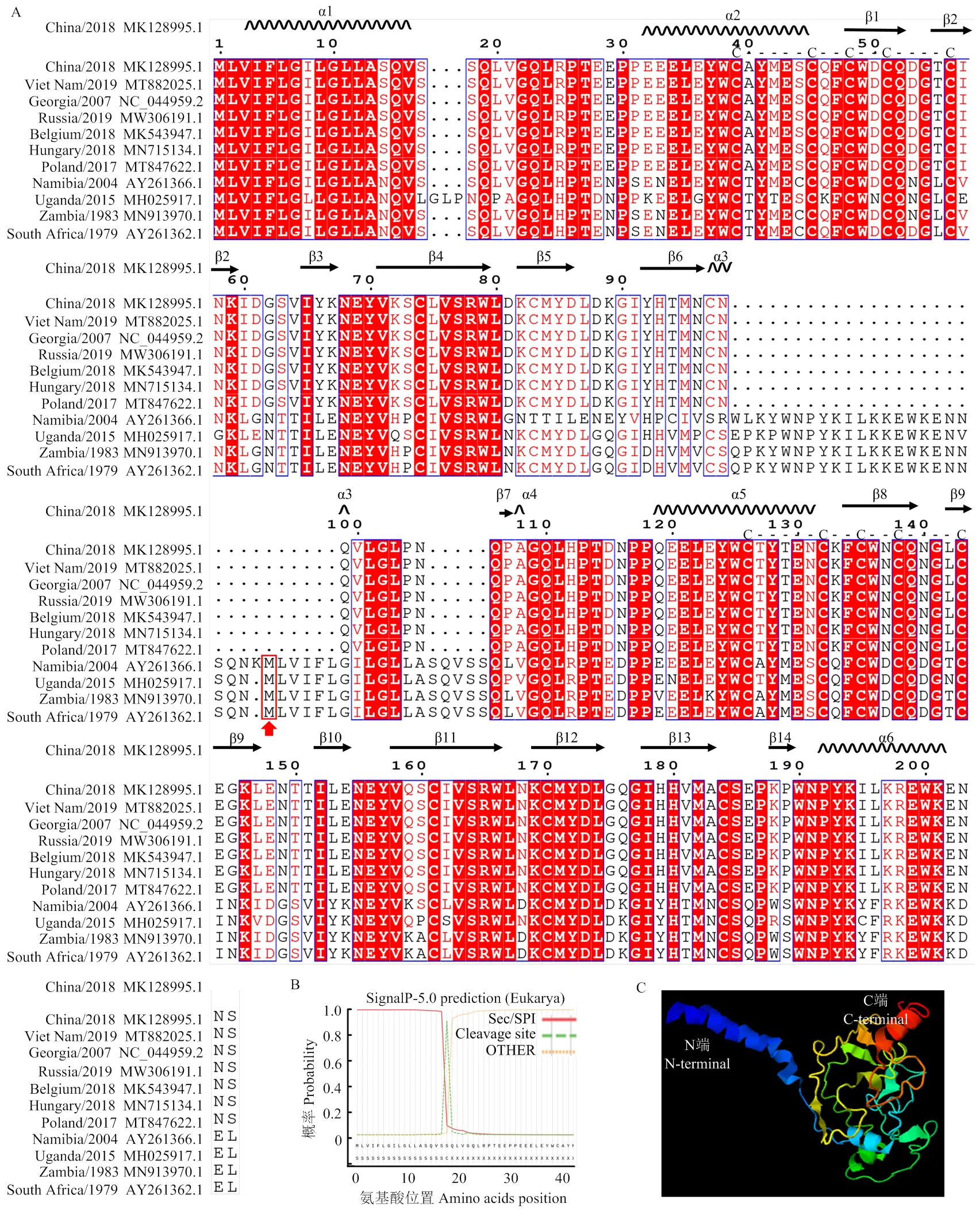
A:不同ASFV毒株MGF110-5L-6L氨基酸序列比對分析,突出顯示了預測的二級結構及保守的半胱氨酸結構域,紅色箭頭指示為非洲代表毒株MGF110-6L蛋白的首個氨基酸位置;B:信號肽預測;C:蛋白三級結構預測

分別將各亞細胞器定位質粒(內質網pDsRed2-ER,高爾基體pDsRed2-Golgi,線粒體pDsRed2-Mito,溶酶體pDsRed2-LAMP和過氧化物酶體pDsRed2-Peroxi)與FLAG空載體或MGF110-5L-6L表達質粒共轉染PK-15細胞,孵育24 h后,細胞經固定和透膜處理,并孵育FLAG(綠色)抗體及相應二抗,細胞核用DAPI染色(藍色),定位質粒直接表達紅色熒光蛋白,最后利用激光共聚焦顯微鏡觀察,并進行熒光共定位分析,包括計算共定位系數R和制作Plot Profile圖
3 討論
3.1 ASFV病毒蛋白翻譯策略的研究進展
蛋白翻譯是病毒復制過程中最重要且最復雜的過程之一,因自身缺乏翻譯系統,病毒必須通過“劫持”細胞的蛋白翻譯系統來完成這項工程,該過程不可避免地會干擾細胞的正常生理進程,導致細胞蛋白翻譯重編程以及應激反應的發生,以抵抗病毒感染。然而,病毒經過長期進化而來的生存策略,不僅能夠保障病毒平穩度過各種應激反應以及抑制天然免疫,還使其能夠利用細胞自身的胞內環境穩態維持機制為自身復制創造場地和原始材料[8-9, 41]。
ASFV因基因組龐大、結構復雜,遺傳多樣性等特征,致使病毒的基因組轉錄、蛋白翻譯和免疫逃逸機制等異常復雜。已有研究表明,ASFV經內吞和巨胞飲途徑入侵細胞后,經內體遷移途徑和膜融合機制將病毒核心釋放至細胞核周圍,激活病毒基因表達和DNA復制[42]。ASFV基因表達具有精準的時空特性,感染初期利用病毒自身攜帶的酶和蛋白因子來完成早期基因的轉錄,隨后借助宿主翻譯系統合成病毒早期蛋白,一方面為病毒DNA復制以及中后期基因轉錄提供所需的酶和轉錄因子等,另一方面參與調控宿主細胞的應激反應及介導免疫逃逸等。隨著ASFV感染進程發展,細胞核周微管組織中心處形成病毒復制的大本營“病毒工廠”,為病毒的蛋白翻譯、基因組復制和組裝等創造有利條件[3, 16]。然而,目前對ASFV功能蛋白介導上述生存策略的認知極度匱乏,尤其是關于病毒蛋白介導的對宿主細胞翻譯系統的調控策略。
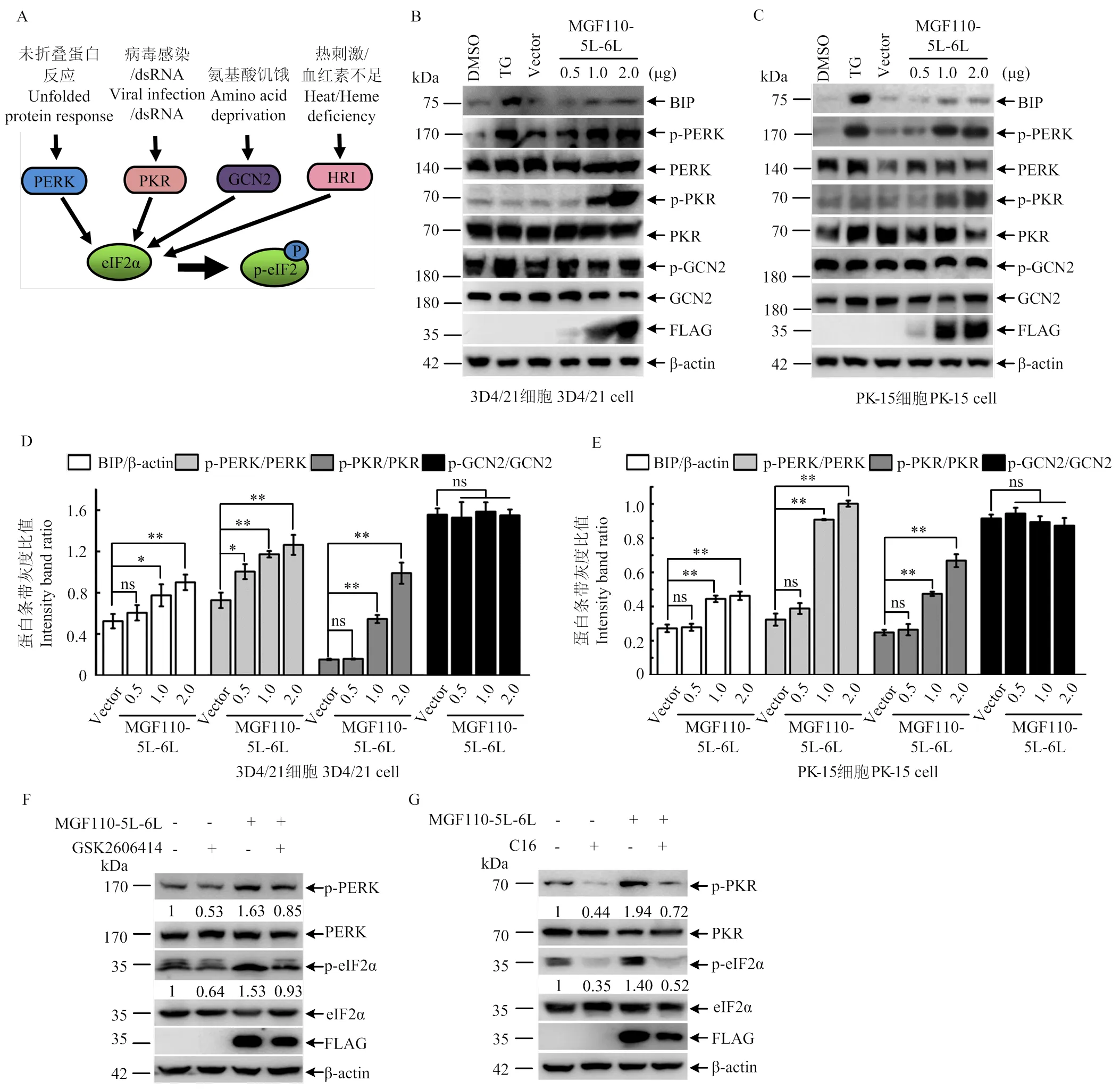
A:PERK,PKR,GCN2,HRI 四種激酶誘導eIF2α磷酸化的模式圖;B-E:將不同劑量的MGF110-5L-6L表達質粒或空載體轉染3D4/21和PK-15細胞,孵育24 h后,收集細胞裂解物,進行Western blot檢測和灰度值分析. 作為陽性對照,利用內質網應激誘導劑TG(1 μmol·L-1)孵育處理細胞6 h。F和G:分別將FLAG空載體或MGF110-5L-6L重組表達質粒轉染3D4/21細胞,伴隨10 μmol·L-1 GSK2606414或1 μmol·L-1 C16處理細胞,孵育24 h后,收集細胞進行Western blot檢測;該結果源自三次獨立重復試驗. **, P<0.01
3.2 外源表達MGF110-5L-6L蛋白對eIF2α磷酸化及其下游翻譯效應調控的影響
eIF2α在翻譯起始調控中具有重要功能,且eIF2α磷酸化與翻譯阻滯、SG形成、細胞周期停滯、內質網應激等反應密切相關[10-13]。另外,值得關注的是,有報道稱ASFV細胞適應性毒株(Ba71V株)在Vero細胞中成功增殖過程中,能夠持續阻止eIF2α發生磷酸化[16];而野毒株(ASFV E70株)在感染小鼠單核/巨噬細胞RAW 264.7后能夠翻譯出病毒早期蛋白,但無法成功增殖,且伴隨著eIF2α磷酸化水平的顯著升高[19]。基于此,不難推測eIF2α信號通路極有可能是ASFV和宿主細胞決戰的重要陣地之一。聚焦這一科學問題,本團隊前期以病毒蛋白與eIF2α信號通路之間的作用關系為切入點,系統篩選了全套ASFV編碼蛋白對eIF2α磷酸化水平的影響。其中,MGF110-5L-6L作為病毒早期蛋白[43],上調eIF2α磷酸化的水平極為顯著。且在ASFV感染整個過程中,MGF110-5L-6L屬于表達水平最高的病毒基因之一,推測其在病毒復制過程中具有重要功能。然而,關于其蛋白結構及功能仍未見報道。
在本研究中,我們利用肺泡巨噬細胞3D4/21(ASFV感染細胞系)和豬腎傳代細胞PK-15,證實外源表達MGF110-5L-6L蛋白可誘導細胞發生內質網應激且激活未折疊蛋白反應,通過PERK和PKR激酶的活化觸發eIF2α的磷酸化,進而誘發ISR、細胞蛋白翻譯阻滯和SGs形成等。從理論上來看,應激狀態導致細胞翻譯重編程和SGs形成對病毒復制是不利的。然而,有研究表明,ASFV早期蛋白pE66L作為一種內質網跨膜蛋白,通過活化PKR/eIF2α通路顯著抑制宿主蛋白翻譯[44];ASFV晚期蛋白DP71L通過募集磷酸酶PP1誘導eIF2α去磷酸化,解除翻譯阻滯以增強病毒蛋白的合成[35-36]。此外,與母本毒株相比,DP71L或pE66L單基因缺失毒株的增殖能力均未受影響,且DP71L基因缺失毒株與母本毒株誘導的eIF2α磷酸化水平無顯著差異[35, 44]。進一步結合本團隊的篩選結果,發現能夠顯著上調eIF2α磷酸化水平的多為病毒早期基因,而顯著下調eIF2α磷酸化水平的多為病毒晚期基因,推測ASFV對宿主細胞eIF2α磷酸化的調控是全方位且多層次的,病毒可能通過在空間和時間上精準控制不同基因的轉錄和翻譯,進行綜合性調控以滿足自身不同階段的增殖需求。其中病毒早期蛋白主要上調eIF2α磷酸化水平,誘發細胞各種應激反應及蛋白翻譯系統關閉,抑制抗病毒免疫;隨著病毒感染進程的不斷發展,中后期蛋白在病毒工廠局部特異地解除eIF2α的磷酸化,以全面促進病毒蛋白的合成。
3.3 外源表達MGF110-5L-6L蛋白與誘發細胞應激反應的相關性分析
最新研究表明,ASFV感染早期可顯著誘導未折疊蛋白反應中PERK通路相關基因的表達上調[22]。為了探析早期蛋白MGF110-5L-6L在該過程中的潛在功能,本研究亦對其結構及亞細胞定位進行了剖析。發現MGF110-5L-6L蛋白存在與其他MGF110家族蛋白相似的序列特征[39],即氨基端存在潛在的信號肽,具有高度保守的半胱氨酸基序,且羧基端包含內質網滯留信號序列等。證實MGF110-5L-6L蛋白主要定位于內質網,少量定位于高爾基體、線粒體和溶酶體,且誘導高爾基體和過氧化物酶體定位和形態發生出現顯著變化,暗示該蛋白在重塑內質網/高爾基體、內質網-高爾基體膜泡運輸、以及過氧化物酶體發生等過程存在獨特功能。推測MGF110-5L-6L蛋白可能通過影響內質網腔中氧化還原穩態、蛋白分泌途徑或相關膜性細胞器組分來破壞細胞的正常生理功能穩態,進而誘發內質網應激等系列應激反應。然而,ASFV經過長期進化而來的生存策略,可能不僅避免了細胞應激對其復制造成太大影響,反而使其能夠利用細胞產生的應激損傷,進而為病毒蛋白的膜向運輸、病毒工廠組裝和免疫逃逸等過程服務[16-19]。這也與ASFV感染破壞細胞分泌途徑中高爾基體反式網絡,以及阻撓膜蛋白MHC-I分子呈遞至巨噬細胞表面的報道一致[45- 46]。
3.4 MGF110-5L-6L與病毒遺傳多樣性和表型之間的相關性分析
在不同的高致病性ASFV毒株中,MGF110-5L-6L基因以兩種形式表達,分別表達5L-6L融合蛋白或5L、6L兩個獨立蛋白,且前者較后者缺失多個氨基酸片段;此外,與大多數天然強毒株和母本毒株相比,發現細胞適應性毒株ASFV-P121基因組中的MGF110-5L-6L基因完全缺失,天然致弱毒株OUR T88/3的6L基因完全缺失,且5L基因缺失近43%[47-48],而細胞適應性毒株ASFV-G/VP110和BA71V則保留MGF110-5L-6L基因[49],暗示MGF110-5L-6L屬于ASFV的非必需基因,與病毒的遺傳多樣性和新表型特征發生有關。已有證據表明,同家族成員MGF110-9L與MGF110-5L-6L類似,均在細胞適應傳代過程中丟失[47-49],且MGF110-9L與病毒增殖能力與毒力顯著相關[50];而MGF110-1L作為所有ASFV毒株的保守基因,單基因缺失后不影響毒株的復制能力與毒力[43]。此外,大量證據表明,同屬非必需基因的MGF360和MGF505/530家族成員在決定細胞嗜性,調控病毒毒力、復制、免疫逃逸,以及參與病毒-宿主互作等方面具有重要影響,且被廣泛用于基因缺失活疫苗的開發研究[1-3]。
基于本研究證實外源表達MGF110-5L-6L蛋白在調控eIF2α發生磷酸化、細胞翻譯重編程和應激反應中的功能特性,結合壓力進化過程中MGF110-5L-6L基因表現出的遺傳多樣性與病毒表型之間的作用關系,推測MGF110-5L-6L在決定病毒宿主細胞范圍、復制和毒力方面亦具有巨大潛力。然而,遺憾的是,本單位不具備開展ASFV感染實驗的資質。本團隊未來將著力與具備活毒操作資質的單位合作,進一步證實MGF110-5L-6L基因與ASFV毒力、嗜性及致病性等方面的功能關系,加深對ASFV病原生物學與致病機制的認識,為疫苗研發提供科學參考。
4 結論
研究發現MGF110-5L-6L蛋白含有兩個高度保守的半胱氨酸基序,且主要定位于內質網,少量分布于高爾基體、線粒體和溶酶體。外源表達MGF110-5L-6L蛋白還可誘導高爾基體和過氧化物酶體的亞細胞定位及形態發生顯著改變,提示其可能通過影響內質網腔中氧化還原穩態、蛋白分泌途徑或相關膜性細胞器發生等,破壞細胞正常生理功能穩態。證實了外源表達MGF110-5L-6L蛋白可誘導宿主細胞發生內質網應激和未折疊蛋白反應,并通過活化PERK和PKR激酶觸發eIF2α的磷酸化,進而誘發綜合應激反應、導致細胞蛋白翻譯阻滯以及應激顆粒形成,為深入探索非洲豬瘟病毒的病原生物學與致病機制提供了新的科學參考。
[1] GALLARDO M C, REOYO A T, FERNáNDEZ-PINERO J, IGLESIAS I, MU?OZ M J, ARIAS M L. African swine fever: a global view of the current challenge. Porcine Health Management, 2015, 1: 21. doi:10.1186/s40813-015-0013-y.
[2] ALONSO C, BORCA M, DIXON L, REVILLA Y, RODRIGUEZ F, ESCRIBANO J M, CONSORTIUM I R. ICTV virus taxonomy profile: Asfarviridae. The Journal of General Virology, 2018, 99(5): 613-614. doi:10.1099/jgv.0.001049.
[3] WANG Y, KANG W F, YANG W P, ZHANG J, LI D, ZHENG H X. Structure of African swine fever virus and associated molecular mechanisms underlying infection and immunosuppression: a review. Frontiers in Immunology, 2021, 12: 715582. doi:10.3389/fimmu.2021.715582.
[4] WANG N, ZHAO D M, WANG J L, ZHANG Y L, WANG M, GAO Y, LI F, WANG J F, BU Z G, RAO Z H, WANG X X. Architecture of African swine fever virus and implications for viral assembly. Science, 2019, 366(6465): 640-644. doi:10.1126/science.aaz1439.
[5] ALEJO A, MATAMOROS T, GUERRA M, ANDRéS G. A proteomic atlas of the African swine fever virus particle. Journal of Virology, 2018, 92(23): e01293-e01218. doi:10.1128/JVI.01293-18.
[6] MALOGOLOVKIN A, KOLBASOV D. Genetic and antigenic diversity of African swine fever virus. Virus Research, 2019, 271: 197673. doi:10.1016/j.virusres.2019.197673.
[7] WALSH D, MOHR I. Viral subversion of the host protein synthesis machinery. Nature Reviews Microbiology, 2011, 9(12): 860-875. doi:10.1038/nrmicro2655.
[8] JAN E, MOHR I, WALSH D. A cap-to-tail guide to mRNA translation strategies in virus-infected cells. Annual Review of Virology, 2016, 3(1): 283-307. doi:10.1146/annurev-virology-100114-055014.
[9] STERN-GINOSSAR N, THOMPSON S R, MATHEWS M B, MOHR I. Translational control in virus-infected cells. Cold Spring Harbor Perspectives in Biology, 2019, 11(3): a033001. doi:10.1101/cshperspect.a033001.
[10] WEK R C. Role of eIF2α kinases in translational control and adaptation to cellular stress. Cold Spring Harbor Perspectives in Biology, 2018, 10(7): a032870. doi:10.1101/cshperspect.a032870.
[11] DONNELLY N, GORMAN A M, GUPTA S, SAMALI A. The eIF2α kinases: Their structures and functions. Cellular and Molecular Life Sciences: CMLS, 2013, 70(19): 3493-3511. doi:10.1007/s00018-012-1252-6.
[12] COSTA-MATTIOLI M, WALTER P. The integrated stress response: from mechanism to disease. Science, 2020, 368(6489): eaat5314. doi:10.1126/science.aat5314.
[13] PAKOS-ZEBRUCKA K, KORYGA I, MNICH K, LJUJIC M, SAMALI A, GORMAN A M. The integrated stress response. EMBO Reports, 2016, 17(10): 1374-1395. doi:10.15252/embr.201642195.
[14] LIU Y, WANG M, CHENG A, YANG Q, WU Y, JIA R, LIU M, ZHU D, CHEN S, ZHANG S. The role of host eIF2α in viral infection. Virology Journal, 2020, 17(1): 112.doi:10.1186/s12985-020-01362-6.
[15] SALAS M L, KUZNAR J, VI?UELA E. Polyadenylation, methylation, and capping of the RNA synthesizedby African swine fever virus. Virology, 1981, 113(2): 484-491. doi:10.1016/0042-6822(81)90176-8.
[16] CASTELLó A, QUINTAS A, SáNCHEZ E G, SABINA P, NOGAL M, CARRASCO L, REVILLA Y. Regulation of host translational machinery by African swine fever virus. PLoS Pathogens, 2009, 5(8): e1000562. doi:10.1371/journal.ppat.1000562.
[17] QUINTAS A, PéREZ-Nú?EZ D, SáNCHEZ E G, NOGAL M L, HENTZE M W, CASTELLó A, REVILLA Y. Characterization of the African swine fever virus decapping enzyme during infection. Journal of Virology, 2017, 91(24): e00990-e00917. doi:10.1128/JVI.00990-17.
[18] BALLESTER M, RODRíGUEZ-CARI?O C, PéREZ M, GALLARDO C, RODRíGUEZ J M, SALAS M L, RODRIGUEZ F. Disruption of nuclear organization during the initial phase of African swine fever virus infection. Journal of Virology, 2011, 85(16): 8263-8269. doi:10.1128/JVI.00704-11.
[19] SáNCHEZ E G, QUINTAS A, NOGAL M, CASTELLó A, REVILLA Y. African swine fever virus controls the host transcription and cellular machinery of protein synthesis. Virus Research, 2013, 173(1): 58-75. doi:10.1016/j.virusres.2012.10.025.
[20] CACKETT G, MATELSKA D, SYKORA M, PORTUGAL R, MALECKI M, B?HLER J, DIXON L, WERNER F. The African swine fever virus transcriptome. Journal of Virology, 2020, 94(9): e00119-e00120. doi:10.1128/JVI.00119-20.
[21] CACKETT G, PORTUGAL R, MATELSKA D, DIXON L, WERNER F. African swine fever virus and host response: transcriptome profiling of the2007/1 strain and porcine macrophages. Journal of Virology, 2022, 96(5): e0193921. doi:10.1128/jvi.01939-21.
[22] ZHENG Y X, LI S, LI S H, YU S X, WANG Q H, ZHANG K H, QU L, SUN Y, BI Y H, TANG F C, QIU H J, GAO G F. Transcriptome profiling in swine macrophages infected with African swine fever virus at single-cell resolution. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(19): e2201288119. doi:10.1073/pnas.2201288119.
[23] VATTEM K M, WEK R C. Reinitiation involving upstream ORFs regulates ATF4mRNA translation in mammalian cells. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(31): 11269-11274. doi:10.1073/pnas.0400541101.
[24] LARKIN M A, BLACKSHIELDS G, BROWN N P, CHENNA R, MCGETTIGAN P A, MCWILLIAM H, VALENTIN F, WALLACE I M, WILM A, LOPEZ R, THOMPSON J D, GIBSON T J, HIGGINS D G. Clustal W and clustal X version 2.0. Bioinformatics, 2007, 23(21): 2947-2948. doi:10.1093/bioinformatics/btm404.
[25] ROBERT X, GOUET P. Deciphering key features in protein structures with the new ENDscript server. Nucleic Acids Research, 2014, 42(W1): W320-W324. doi:10.1093/nar/gku316.
[26] MITCHELL A L, ATTWOOD T K, BABBITT P C, BLUM M, BORK P, BRIDGE A, BROWN S D, CHANG H Y, EL-GEBALI S, FRASER M I, et al. InterPro in 2019: improving coverage, classification and access to protein sequence annotations. Nucleic Acids Research, 2018, 47(D1): D351-D360. doi:10.1093/nar/gky1100.
[27] ALMAGRO ARMENTEROS J J, TSIRIGOS K D, S?NDERBY C K, PETERSEN T N, WINTHER O, BRUNAK S, VON HEIJNE G, NIELSEN H. SignalP 5.0 improves signal peptide predictions using deep neural networks. Nature Biotechnology, 2019, 37(4): 420-423. doi:10.1038/s41587-019-0036-z.
[28] KROGH A, LARSSON B, VON HEIJNE G, SONNHAMMER E L L. Predicting transmembrane protein topology with a hidden Markov model: Application to complete genomes. Journal of Molecular Biology, 2001, 305(3): 567-580. doi:10.1006/jmbi.2000.4315.
[29] GUPTA R, BRUNAK S. Prediction of glycosylation across the human proteome and the correlation to protein function. Pacific Symposium on Biocomputing, 2002: 310-322.
[30] KLAUSEN M S, JESPERSEN M C, NIELSEN H, JENSEN K K, JURTZ V I, S?NDERBY C K, SOMMER M O A, WINTHER O, NIELSEN M, PETERSEN B, MARCATILI P. NetSurfP-2.0: Improved prediction of protein structural features by integrated deep learning. bioRxiv, 2018, doi:10.1101/311209. doi:10.1101/311209.
[31] ZHENG W, ZHANG C X, LI Y, PEARCE R, BELL E W, ZHANG Y. Folding non-homologous proteins by coupling deep-learning contact maps with I-TASSER assembly simulations. Cell Reports Methods, 2021, 1(3): 100014. doi:10.1016/j.crmeth.2021.100014.
[32] WEINGARTL H M, SABARA M, PASICK J, VAN MOORLEHEM E, BABIUK L. Continuous porcine cell lines developed from alveolar macrophages: Partial characterization and virus susceptibility. Journal of Virological Methods, 2002, 104(2): 203-216. doi:10.1016/S0166-0934(02)00085-X.
[33] SCHMIDT E K, CLAVARINO G, CEPPI M, PIERRE P. SUnSET, a nonradioactive method to monitor protein synthesis. Nature Methods, 2009, 6(4): 275-277. doi:10.1038/nmeth.1314.
[34] IVANOV P, KEDERSHA N, ANDERSON P. Stress granules and processing bodies in translational control. Cold Spring Harbor Perspectives in Biology, 2019, 11(5): a032813. doi:10.1101/cshperspect.a032813.
[35] ZHANG F Q, MOON A, CHILDS K, GOODBOURN S, DIXON L K. The African swine fever virus DP71L protein recruits the protein phosphatase 1 catalytic subunit to dephosphorylate eIF2alpha and inhibits CHOP induction but is dispensable for these activities during virus infection. Journal of Virology, 2010, 84(20): 10681-10689. doi:10.1128/JVI.01027-10.
[36] ROJAS M, VASCONCELOS G, DEVER T E. An eIF2α-binding motif in protein phosphatase 1 subunit GADD34 and its viral orthologs is required to promote dephosphorylation of eIF2α. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(27): E3466-E3475. doi:10.1073/pnas.1501557112.
[37] ZHU Z Z, CHEN H T, LIU L, CAO Y, JIANG T J, ZOU Y Q, PENG Y S. Classification and characterization of multigene family proteins of African swine fever viruses. Briefings in Bioinformatics, 2020, 22(4): bbaa380. doi:10.1093/bib/bbaa380.
[38] GOMEZ-NAVARRO N, MILLER E. Protein sorting at the ER-Golgi interface. The Journal of Cell Biology, 2016, 215(6): 769-778. doi:10.1083/jcb.201610031.
[39] NETHERTON C, ROUILLER I, WILEMAN T. The subcellular distribution of multigene family 110 proteins of African swine fever virus is determined by differences in C-terminal KDEL endoplasmic reticulum retention motifs. Journal of Virology, 2004, 78(7): 3710-3721. doi:10.1128/jvi.78.7.3710-3721.2004.
[40] 丁鏟. 病毒感染引起的細胞器應激損傷和選擇性自噬. 中國家禽, 2019, 41(10): 1-9. doi:10.16372/j.issn.1004-6364.2019.10.001.
DING C. Virus infection causes cell organelle stress and selective autophagy. China Poultry, 2019, 41(10): 1-9. doi:10.16372/j.issn.1004-6364.2019.10.001. (in Chinese)
[41] MCCORMICK C, KHAPERSKYY D A. Translation inhibition and stress granules in the antiviral immune response. Nature Reviews Immunology, 2017, 17(10): 647-660. doi:10.1038/nri.2017.63.
[42] ANDRéS G. African swine fever virus gets undressed: New insights on the entry pathway. Journal of Virology, 2017, 91(4): e01906-e01916. doi:10.1128/JVI.01906-16.
[43] RAMIREZ-MEDINA E, VUONO E, PRUITT S, RAI A, SILVA E, ESPINOZA N, ZHU J, VELAZQUEZ-SALINAS L, BORCA M V, GLADUE D P. Development andevaluation of a MGF110-1L deletion mutant in African swine fever strain. Viruses, 2021, 13(2): 286. doi:10.3390/v13020286.
[44] SHEN Z, CHEN C, YANG Y L, XIE Z H, AO Q Y, LV L, ZHANG S F, CHEN H C, HU R L, CHEN H J, PENG G Q. A novel function of African Swine Fever Virus pE66L in inhibition of host translation by the PKR/eIF2α pathway. Journal of Virology, 2020, 95(5): e01872-e01820. doi:10.1128/JVI.01872-20.
[45] MCCROSSAN M, WINDSOR M, PONNAMBALAM S, ARMSTRONG J, WILEMAN T. The trans Golgi network is lost from cells infected with African swine fever virus. Journal of Virology, 2001, 75(23): 11755-11765. doi:10.1128/JVI.75.23.11755-11765.2001.
[46] NETHERTON C L, MCCROSSAN M C, DENYER M, PONNAMBALAM S, ARMSTRONG J, TAKAMATSU H H, WILEMAN T E. African swine fever virus causes microtubule-dependent dispersal of the trans-Golgi network and slows delivery of membrane protein to the plasma membrane. Journal of Virology, 2006, 80(22): 11385-11392. doi:10.1128/JVI.00439-06.
[47] CHAPMAN D A G, TCHEREPANOV V, UPTON C, DIXON L K. Comparison of the genome sequences of non-pathogenic and pathogenic African swine fever virus isolates. The Journal of General Virology, 2008, 89(Pt 2): 397-408. doi:10.1099/vir.0.83343-0.
[48] WANG T, WANG L, HAN Y, PAN L, YANG J, SUN M W, ZHOU P P, SUN Y, BI Y H, QIU H J. Adaptation of African swine fever virus to HEK293T cells. Transboundary and Emerging Diseases, 2021, 68(5): 2853-2866. doi:10.1111/tbed.14242.
[49] KRUG P W, HOLINKA L G, O'DONNELL V, REESE B, SANFORD B, FERNANDEZ-SAINZ I, GLADUE D P, ARZT J, RODRIGUEZ L, RISATTI G R, BORCA M V. The progressive adaptation of a Georgian isolate of African swine fever virus to vero cells leads to a gradual attenuation of virulence in swine corresponding to major modifications of the viral genome. Journal of Virology, 2015, 89(4): 2324-2332. doi:10.1128/JVI.03250-14.
[50] LI D, LIU Y G, QI X L, WEN Y, LI P, MA Z, LIU Y J, ZHENG H X, LIU Z J. African swine fever virus MGF-110-9L-deficient mutant has attenuated virulence in pigs. Virologica Sinica, 2021, 36(2): 187-195. doi:10.1007/s12250-021-00350-6.
African Swine Fever Virus Mgf110-5l-6lInduces Host Cell Translation Arrest and Stress Granule Formation by Activating the Perk/Pkr-eif2α Pathway
FAN Shuai, ZHONG Han, YANG ZhongYuan, HE WenRui, WAN Bo, WEI ZhanYong, HAN ShiChong, ZHANG GaiPing
College of Veterinary Medicine, Henan Agricultural University/International Joint Research Center of National Animal Immunology, Zhengzhou 450046
【】African swine fever (ASF) is an acute, highly contagious, and deadly infectious disease of pigs caused by ASF virus (ASFV), which is currently considered the biggest killer in global swine industry. To date, there is no effective vaccines or antiviral drugs for the prevention or treatment of ASF. As obligate intracellular parasites, the viruses are fully reliant on the host translation machinery to produce the polypeptides that are essential for viral replication. A central mechanism regulating translation initiation involves phosphorylation of the α subunit of eukaryotic initiation factor 2 (eIF2α), which directs host translational control and adaptation to cellular stress. The regulation of eIF2α phosphorylation has been regarded as a critical step for viral infection, with important effects on virulence, tissue tropism, pathogenicity, and immunoevasion. However, the molecular mechanisms by which most of the ASFV-encoded proteins affecting eIF2α phosphorylation have not been well studied. 【】The aim of this study was to explore the mechanism of ASFV MGF110-5L-6L protein on the host cell translation block and promote the formation of stress particles, so as to provide a scientific basis for further revealing the pathogenic mechanism of African swine fever virus.【】 The preliminary screening by luciferase reporter assays identified that ectopic expression of ASFV MGF110-5L-6L, a previously uncharacterized member of the multigene family 110, significantly increased eIF2α phosphorylation levels. To confirm and clarify the potential role of MGF110-5L-6L expression in mediating eIF2α phosphorylation and downstream of translation control, two continuous porcine cell lines, including 3D4/21 (porcine alveolar macrophage) and PK-15 (porcine kidney), were used for the plasmid transfection and/or drug treatment and subjected to immunoblotting or confocal immunofluorescence analysis. To investigate how the ectopic expression of MGF110-5L-6L triggers cellular stress, the structure, subcellular localization and function of the MGF110-5L-6L protein were further characterized by a combination of bioinformatic prediction, immunofluorescence and immunoblotting analysis.【】 Here, it was confirmed that ectopic expression of MGF110-5L-6L remarkably promoted eIF2α phosphorylation and the expression of ATF4, indicating that it functions in the integrated stress response. The subsequent analyses revealed that MGF110-5L-6L expression could trigger the ER stress and activate the unfolded protein response, and the phosphorylation of eIF2α was mediated via PERK and PKR, resulting in the suppression of host translation and stress granule formation. It was further observed that MGF110-5L-6L protein had two highly conserved central cysteine-rich domains and was mainly retained in the endoplasmic reticulum (ER), and also caused a significant reorganization of the subcellular distribution and morphological characteristics of the Golgi and peroxisome, suggesting that it might interfere with ER redox homeostasis, secretory pathway, and other membrane-bound organelles to trigger cellular stress.【】 Together, these results demonstrated a previously uncharacterized role of ASFV MGF110-5L-6L and further defined several molecular interfaces by which ASFV MGF110-5L-6L hijacks the host cell translation, which expanded the view of ASFV in determining the fate of host-pathogen interactions.
African swine fever virus; MGF110-5L-6L protein; eIF2α phosphorylation; translation arrest; stress granules
2022-02-28;
2022-06-30
國家自然科學基金(31941001, 32102655)、河南省重點研發與推廣專項(212102110369)
樊帥,Tel:15138698236;E-mail:fshuai9859@163.com。通信作者韓世充,E-mail:hanshichong081@126.com。通信作者張改平,E-mail:zhanggaip@126.com
(責任編輯 林鑒非)

