電離輻射對(duì)幼鼠小腦和前額葉皮質(zhì)發(fā)育的影響
王洋洋 劉元朵 劉蓮

摘 要:為探討X 射線對(duì)幼鼠小腦和前額葉皮質(zhì)發(fā)育的影響,照射組小鼠于出生后( postanal day,PD) 3 天進(jìn)行2 Gy (2 Gy/ min) 劑量的全身X 射線照射,分別于照射后7、21 和90 天( PD 3+7、PD 3+21、PD 3+90) 采集腦樣本進(jìn)行不同的實(shí)驗(yàn)研究。蘇木素-伊紅( Hematoxylin-eosin, HE) 染色檢測(cè)腦組織病理形態(tài)變化,免疫組織化學(xué)檢測(cè)IBa1 和GFAP 蛋白表達(dá),Western Blotting 檢測(cè)IL-1β 和TNF-α 蛋白表達(dá)。結(jié)果表明,照射組小腦及前額葉皮質(zhì)炎性細(xì)胞浸潤(rùn),外顆粒層厚度變窄,浦肯野細(xì)胞向內(nèi)顆粒層遷移,小腦部分細(xì)胞丟失。與對(duì)照組比較,照射后21天小腦IBa1 陽(yáng)性細(xì)胞數(shù)增加( p<0. 05) ,照射后7 天 GFAP 陽(yáng)性細(xì)胞數(shù)減少( p<0. 05) 。前額葉皮質(zhì)中IBa1 陽(yáng)性細(xì)胞在照射后數(shù)量持續(xù)增加( p<0. 05,p<0. 01) ,GFAP 陽(yáng)性細(xì)胞數(shù)量持續(xù)減少( p<0. 01) 。照射后90 天,小鼠小腦和前額葉皮質(zhì)中IL-1β 蛋白表達(dá)均增加( p<0. 05) ,而TNF-α 表達(dá)無(wú)改變。結(jié)果證實(shí)幼年小鼠2 Gy X 射線照射可引起小鼠小腦顆粒細(xì)胞層、分子層、浦肯野細(xì)胞層產(chǎn)生連續(xù)性病理改變,前額葉皮質(zhì)出現(xiàn)炎性細(xì)胞聚集,前額葉皮質(zhì)和小腦小膠質(zhì)細(xì)胞數(shù)量增加,星形膠質(zhì)細(xì)胞數(shù)量減少,炎癥因子主要是IL-1β。
關(guān)鍵詞:電離輻射;小腦;前額葉皮質(zhì);膠質(zhì)細(xì)胞;神經(jīng)炎癥
中圖分類號(hào):R818 文獻(xiàn)標(biāo)識(shí)碼:A
近年來(lái)隨著電離輻射在工業(yè)及醫(yī)療領(lǐng)域的廣泛應(yīng)用,輻射暴露的風(fēng)險(xiǎn)在增大。電離輻射對(duì)機(jī)體的影響是全身性的[1-3] ,以造血系統(tǒng)[4] 、神經(jīng)系統(tǒng)[5-7] 的改變最為明顯。
輻射對(duì)神經(jīng)系統(tǒng)產(chǎn)生影響的兩個(gè)組成部分為輻射發(fā)生的時(shí)間及輻射劑量,中樞神經(jīng)系統(tǒng)經(jīng)過(guò)輻射損傷后會(huì)導(dǎo)致大腦環(huán)境持續(xù)改變(包括腦血管、神經(jīng)膠質(zhì)細(xì)胞群的結(jié)構(gòu)和功能改變以及認(rèn)知障礙),其中炎癥起著至關(guān)重要的作用[8] 。輻射后引起的神經(jīng)炎癥與腦損傷和認(rèn)知障礙有關(guān)[9-10] ,研究表明,電離輻射誘導(dǎo)神經(jīng)炎癥的認(rèn)知能力下降涉及多種神經(jīng)細(xì)胞類型的損傷,其中小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞在神經(jīng)炎癥的發(fā)生和發(fā)展中發(fā)揮著關(guān)鍵作用,它們通過(guò)活化啟動(dòng)、響應(yīng)炎癥級(jí)聯(lián)反應(yīng)[11-12] ,促進(jìn)進(jìn)行性神經(jīng)損傷。
未發(fā)育成熟的大腦比成熟的大腦輻射敏感性更高,幼年期照射可顯著減少神經(jīng)發(fā)生、腦血管內(nèi)皮細(xì)胞發(fā)生以及產(chǎn)生認(rèn)知障礙[13-14] 。已經(jīng)有研究表明,幼年時(shí)期輻射引發(fā)成年動(dòng)物認(rèn)知損傷[14-15] ,而這些研究多集中于海馬區(qū)域[15-17] ,目前關(guān)于電離輻射對(duì)幼年期小腦和前額葉皮質(zhì)發(fā)育及膠質(zhì)細(xì)胞的影響的報(bào)道較少。在本研究中,我們使用幼年期小鼠建立電離輻射損傷模型,探究X 射線對(duì)幼年期小鼠前額葉皮質(zhì)及小腦膠質(zhì)細(xì)胞及炎癥因子的影響。
1 材料與方法
1. 1 儀器及試劑
醫(yī)用電子直線加速器( Precise TreatmentSystem; Elekta, Crawley, United Kingdom ),CM1950 冷凍切片機(jī)(Leica,德 國(guó)),DM4B 顯微鏡(Leica, 德國(guó)), GelDoc XR 凝膠成像系統(tǒng)( BIO-RAD,美國(guó)), 全波長(zhǎng)酶標(biāo)儀( Thermo, 美國(guó)),BBY24 M 全自動(dòng)組織破碎儀(NESTADVANCE,美國(guó)),ML - 204 電子分析天平( Mettler Toledo, 美國(guó)),渦旋混合器(金壇市醫(yī)療儀器廠,中國(guó)),電熱恒溫干燥箱(上海新苗醫(yī)療器械制造有限公司,中國(guó)),β-actin 抗體(博奧森,中國(guó)),兔源 GFAP 單克隆抗體(Abcam,英國(guó)),兔源 IBa1 單克隆抗體(Abcam,英國(guó)),鼠源 IL - 1β 單克隆抗體( 美國(guó)CST 公司),兔源 TNF-α 單克隆抗體(英國(guó) Abcam公司),羊抗鼠抗體(Invitrogen,美國(guó)),羊抗兔抗體(Jackson, 美國(guó)), ABC 試劑盒、DAB 試劑盒(Vector,美國(guó)),RIPA 裂解液、PMSF(大連美侖生物技術(shù)有限公司,中國(guó)),BCA 蛋白濃度測(cè)定試劑盒(碧云天生物技術(shù)有限公司,中國(guó)),磷酸酶抑制劑(普利萊基因技術(shù)有限公司,中國(guó))。
1. 2 方法
1. 2. 1 實(shí)驗(yàn)動(dòng)物及分組
SPF 級(jí)8 周C57BL/ 6J 小鼠(北京市實(shí)驗(yàn)動(dòng)物研究中心, 動(dòng)物合格證號(hào): SCXK ( 京) 2016 -0006),雌鼠25 只,雄鼠5 只,適應(yīng)性喂養(yǎng) 1 周后,隨機(jī)按雌雄比 2 ∶ 1 合籠,幼鼠出生后第一天記為產(chǎn)后1 天(postanal day; PD 1),將動(dòng)物隨機(jī)分為對(duì)照組和照射組(每組小鼠來(lái)自 4 ~ 5 只不同的孕鼠)。實(shí)驗(yàn)經(jīng)過(guò)長(zhǎng)江大學(xué)倫理委員會(huì)審核,均遵守實(shí)驗(yàn)動(dòng)物飼養(yǎng)和使用原則。
1. 2. 2 照射條件
使用電子直線加速器( Precise TreatmentSystem; Elekta, Crawley, United Kingdom) 對(duì)產(chǎn)后3 天(postanal day 3,PD 3)的小鼠進(jìn)行2 Gy(照射時(shí)間:1 min,劑量率:2 Gy/ min)全身X 射線照射,距離100 cm。
1. 2. 3 病理組織學(xué)
分別于照射后7、21、90 天,腹腔注射戊巴比妥麻醉后4%中性甲醛灌注,收集小鼠標(biāo)本。將腦組織從正中線分開,每只小鼠的右側(cè)半腦在4%的多聚甲醛中4 ℃ 固定過(guò)夜,乙醇二甲苯梯度脫水,再進(jìn)行石蠟包埋,以5 μm 切片,將切片進(jìn)行常規(guī)HE 染色,觀察照射后腦組織病理學(xué)改變。
1. 2. 4 免疫組織化學(xué)染色
將小鼠大腦呈矢狀面切開,左側(cè)半腦浸泡于4%中性甲醛中固定過(guò)夜,24 h 后轉(zhuǎn)入30%蔗糖溶液。待組織沉底后,以40 μm 進(jìn)行冰凍切片,將切好的組織切片用畫筆移入12 孔板,分別加入30%的雙氧水,室溫 30 min,PBST 洗滌,血清封閉室溫震蕩孵育2 h,加入 GFAP 抗體( 1 ∶1 000)、 IBa1 抗體(1 ∶ 1 000),4 ℃ 搖床過(guò)夜,PBST 洗滌,二抗室溫孵育1 h,PBST 洗滌,加入AB 液孵育 30 min,DAB 顯色,蘇木素復(fù)染,脫水,透明,封片。
1. 2. 5 Western Blot 實(shí)驗(yàn)檢測(cè)小腦和前額葉皮質(zhì)中IL-1β、TNF-α 含量
處死小鼠后迅速剝離小腦和前額葉皮質(zhì),取小腦和前額葉皮質(zhì)準(zhǔn)確稱重并加入 RIPA 蛋白裂解液在組織破碎儀中破碎,破碎完成后在冰上靜置裂解 30 min,14 000 rpm 離心10 min 取蛋白上清。蛋白定量變性后進(jìn)行常規(guī)電泳,轉(zhuǎn)膜,封閉后分別加入 IL-1β (1 ∶ 500) 、TNF-α(1 ∶ 1 000)和β-actin(1 ∶ 10 000)抗體,4 ℃ 過(guò)夜,TBST 洗滌,加入相應(yīng)的辣根過(guò)氧化物酶標(biāo)記二抗, 室溫40 min,TBST 洗滌,化學(xué)發(fā)光顯色。
1. 3 圖像分析和統(tǒng)計(jì)學(xué)方法
免疫組化圖片使用Image-pro plus 6. 0 軟件,小鼠小腦結(jié)構(gòu)和大腦皮層結(jié)構(gòu)的連續(xù)切片用于定量分析。免疫組化實(shí)驗(yàn)中每個(gè)標(biāo)本檢測(cè) 6 ~ 9 張切片,檢測(cè)區(qū)域包括小腦I~ III 葉(外顆粒細(xì)胞層、浦肯野細(xì)胞層、內(nèi)顆粒細(xì)胞層)、大腦皮層前額葉皮質(zhì)區(qū),高倍視野下進(jìn)行陽(yáng)性細(xì)胞計(jì)數(shù),計(jì)算平均陽(yáng)性細(xì)胞數(shù)。WB 蛋白條帶使用 Image J 軟件進(jìn)行灰度分析。
所有數(shù)據(jù)使用Prism 6 軟件統(tǒng)計(jì)分析,計(jì)量資料以均值± 單次測(cè)量標(biāo)準(zhǔn)差表示, 組間采用Students T 檢驗(yàn)、ANOVA 檢驗(yàn)進(jìn)行分析,p <0. 05為差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2. 1 X 射線照射對(duì)小鼠小腦組織形態(tài)的影響
2. 1. 1 X 射線照射對(duì)小鼠小腦顆粒層細(xì)胞的影響
圖1 為X 射線照射后使用 HE 染色小鼠小腦顆粒層細(xì)胞病理形態(tài)學(xué)的變化。由圖1 可見,光鏡下觀察到對(duì)照組小腦顆粒層細(xì)胞飽滿,形態(tài)完整,排列層次有序。與對(duì)照組相比,照射組小鼠小腦在PD 3 + 7 可見外顆粒層( external granularlayer, EGL)細(xì)胞厚度變窄(圖1A、B),幼鼠發(fā)育過(guò)程中EGL 細(xì)胞于21 天后消失。在PD 3+21 和PD3+90 小腦內(nèi)顆粒層(internal granular layer,IGL)與對(duì)照組相比,照射組小鼠IGL 細(xì)胞數(shù)量減少、排列松散混亂(圖1C、D)。
2. 1. 2 X 射線照射對(duì)小鼠小腦浦肯野細(xì)胞的影響
圖2 為X 射線照后小鼠小腦浦肯野細(xì)胞的病理學(xué)圖片。如圖2 所示,光鏡下觀察到對(duì)照組小腦浦肯野細(xì)胞飽滿,形態(tài)完整,核大而圓、透明、核仁明顯清晰,邊緣規(guī)整,各個(gè)時(shí)間點(diǎn)上生長(zhǎng)發(fā)育過(guò)程連續(xù)。與對(duì)照組相比,照射組小鼠小腦在PD3+7、PD 3+21、PD 3+90 細(xì)胞界限不清、排列紊亂,在PD 3+21、PD 3+90 可見浦肯野細(xì)胞向IGL 遷移(見黑色箭頭)、細(xì)胞丟失(見方框);且部分細(xì)胞收縮呈三角形或不規(guī)則形, 空泡化加劇, 胞質(zhì)深染。
2. 2 X 射線照射對(duì)小鼠前額葉皮質(zhì)形態(tài)的影響
使用HE 染色評(píng)估小鼠前額葉皮質(zhì)(prefrontalcortex, PFC) 細(xì)胞病理形態(tài)學(xué),結(jié)果如圖3 所示。
由圖3 可見,光鏡下觀察到對(duì)照組PFC 細(xì)胞飽滿、形態(tài)完整,排列層次有序,各個(gè)時(shí)間點(diǎn)上生長(zhǎng)發(fā)育過(guò)程連續(xù)。與對(duì)照組相比,照射組細(xì)胞排列稀疏,深嗜堿性皺縮,邊緣鋸齒狀,形態(tài)不規(guī)則,核固縮或溶解,可見病理性改變炎性細(xì)胞浸潤(rùn)( 見白色箭頭)。
2. 3 X 射線照射對(duì)小鼠腦組織膠質(zhì)細(xì)胞的影響
2. 3. 1 X 射線照射對(duì)小鼠小膠質(zhì)細(xì)胞的影響
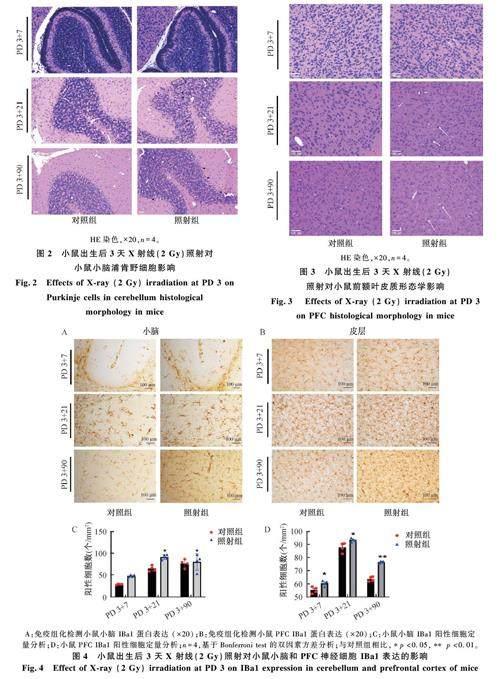
圖4 為小鼠出生后 3 天X 射線(2 Gy)照射對(duì)小鼠小腦小膠質(zhì)細(xì)胞表達(dá)的影響。如圖4A 所示,與對(duì)照組相比,照射組小鼠小腦小膠質(zhì)標(biāo)志性蛋白IBa1 細(xì)胞數(shù)量在PD 3+21 增加(p <0. 05),在PD 3+90 恢復(fù)正常。如圖4B 所示,與對(duì)照組相比,照射組小鼠PFC 小膠質(zhì)細(xì)胞數(shù)量在照射后各時(shí)間點(diǎn)均增加(p<0. 05, p<0. 01)。結(jié)果說(shuō)明幼鼠出生后X 射線照射早期誘導(dǎo)增加小腦小膠質(zhì)細(xì)胞數(shù)量,而PFC 小膠質(zhì)細(xì)胞在照射后持續(xù)增加至成年。
2. 3. 2 X 射線照射對(duì)小鼠星形膠質(zhì)細(xì)胞的影響
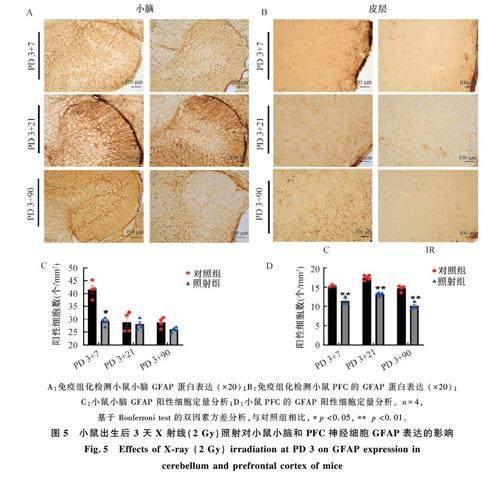
圖5 為小鼠出生后 3 天X 射線(2 Gy)照射對(duì)小鼠小腦星形膠質(zhì)細(xì)胞表達(dá)的影響。如圖5A 所示,與對(duì)照組相比,PD 3+7 照射組小鼠小腦星形膠質(zhì)細(xì)胞標(biāo)志蛋白 GFAP 數(shù)量減少(p<0. 05),PD3+21 和PD 3+90 數(shù)量沒變化。如圖5B 所示,與對(duì)照組相比,照射組小鼠PFC 的 GFAP 蛋白在照射后各時(shí)間點(diǎn)均降低(p<0. 01)。結(jié)果說(shuō)明幼鼠出生后照射早期降低小鼠小腦星形膠質(zhì)細(xì)胞數(shù)量,PFC 區(qū)星形膠質(zhì)細(xì)胞數(shù)量持續(xù)降低至成年。
2. 4 X 射線照射對(duì)成年小鼠炎癥相關(guān)蛋白表達(dá)的影響
圖6 為 2 Gy X 射線對(duì)成年小鼠炎癥相關(guān)蛋白表達(dá)的影響。如圖6 所示,通過(guò)檢測(cè)成年小鼠小腦和PFC 的IL-1β、TNF-α 蛋白表達(dá),發(fā)現(xiàn)在小腦及PFC 中IL-1β 表達(dá)增加(p <0. 05),而TNF-α無(wú)明顯改變。
3 討論
小腦和前額葉皮質(zhì)的發(fā)育是一個(gè)長(zhǎng)期的過(guò)程。小腦發(fā)育在產(chǎn)前和產(chǎn)后早期,EGL 中干/ 祖細(xì)胞在PD 15 時(shí)達(dá)到峰值,在PD 24 消失,EGL 是幼年期小鼠神經(jīng)發(fā)育的主要區(qū)域[18] ;PFC 的發(fā)育從產(chǎn)前持續(xù)至成年,幼年期是PFC 認(rèn)知功能發(fā)展最重要的時(shí)期[19] 。因此,在發(fā)育期的小腦和皮層經(jīng)歷了較長(zhǎng)時(shí)間的生長(zhǎng),特別容易受到不良因素的損傷。在幼鼠出生后3 天予以2 Gy X 射線全身照射后,其小腦顆粒層細(xì)胞數(shù)量降低至成年。浦肯野細(xì)胞是GABA 能神經(jīng)和細(xì)胞,是小腦和皮層的主要神經(jīng)元,具有延伸到分子層的精細(xì)樹突狀結(jié)構(gòu)[18] 。本研究結(jié)果發(fā)現(xiàn),幼年小鼠受照后浦肯野細(xì)胞向IGL 遷移,且部分細(xì)胞丟失,浦肯野細(xì)胞分支收縮呈深紫色的圓形或類圓形,這種改變持續(xù)至成年;在前額葉皮質(zhì)中觀察到細(xì)胞收縮呈深紫色的圓形或類圓形。以上結(jié)果均提示在幼年期小鼠受到照射后,小鼠小腦和皮層出現(xiàn)炎癥反應(yīng),在其發(fā)育過(guò)程中的病理學(xué)損傷是一個(gè)不可逆的反應(yīng)。
小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞在輻射所致的腦損傷中起重要作用,其數(shù)量增加是輻射誘導(dǎo)神經(jīng)炎癥變化的特征[20-21] 。不同于成年小鼠,幼年小鼠大腦在受到損傷后 6 h 內(nèi)小膠質(zhì)細(xì)胞數(shù)量增加,而在 1 周后小膠質(zhì)細(xì)胞數(shù)量下降至低于正常水平,其原因是輻射導(dǎo)致的小膠質(zhì)細(xì)胞直接性死亡[22-23] 。也有研究發(fā)現(xiàn),IBa1 陽(yáng)性細(xì)胞在早期增多,48 h 后出現(xiàn)下降,而21 天增多達(dá)到高峰,隨后出現(xiàn)下降[24] 。在本研究中。IBa1 蛋白在前額葉皮質(zhì)中持續(xù)增加,在小腦中僅在照射后21 天增加,提示輻射激活小鼠小腦和前額葉皮質(zhì)小膠質(zhì)細(xì)胞,前額葉皮質(zhì)小膠質(zhì)細(xì)胞反應(yīng)更為明顯。有證據(jù)表明輻射早期24 ~ 48 h 星形膠質(zhì)細(xì)胞GFAP會(huì)快速增高,在1 周左右出現(xiàn)下降,4 周左右恢復(fù)至正常水平[24] 。本研究中,在照射后7 天小鼠小腦中的GFAP 陽(yáng)性細(xì)胞降低,在PD 3+21 時(shí)數(shù)量恢復(fù)正常,與上述結(jié)果一致。在大劑量照射早期皮層GFAP 的陽(yáng)性表達(dá)增高[25-26] ,在電磁輻射早期PFC 中GFAP 陽(yáng)性細(xì)胞表達(dá)增加而后會(huì)逐漸降低[26-27] ,本實(shí)驗(yàn)中小鼠前額葉皮質(zhì)的GFAP 陽(yáng)性細(xì)胞照射后持續(xù)降低至成年。小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞的激活在退行性疾病中存在交互作用[12] ,而在本研究中IBa1 表達(dá)持續(xù)增加與GFAP的持續(xù)性降低,推測(cè)可能是因?yàn)檩椛鋵?dǎo)致的炎癥激活小膠質(zhì)細(xì)胞,一方面炎癥持續(xù)刺激損傷星型膠質(zhì)細(xì)胞誘發(fā)其數(shù)量減少,一方面可能是因?yàn)檠装Y刺激引起星型膠質(zhì)細(xì)胞保護(hù)性減少以緩解神經(jīng)炎癥損傷。其具體機(jī)制還有待我們進(jìn)一步研究。
輻射產(chǎn)生的神經(jīng)炎癥會(huì)導(dǎo)致膠質(zhì)細(xì)胞的活化并誘導(dǎo)炎癥介質(zhì)的分泌, 如IL - 1β、TNF - α 和IFN-γ 等[28-30] 。為了進(jìn)一步驗(yàn)證神經(jīng)炎癥的存在,我們檢測(cè)了成年小鼠小腦和前額葉皮質(zhì)中IL-1β 和TNF-α 蛋白表達(dá),結(jié)果表明照射后小腦和前額葉皮質(zhì)中IL-1β 蛋白表達(dá)在成年后仍高于對(duì)照組,TNF-α 蛋白表達(dá)無(wú)明顯改變。研究提示,輻射誘導(dǎo)的神經(jīng)炎癥因子以IL-1β 為主。
綜上,得出以下結(jié)論,幼年小鼠X 射線照射可引起小鼠小腦顆粒細(xì)胞層、分子層、浦肯野細(xì)胞層產(chǎn)生連續(xù)性病理改變,前額葉皮質(zhì)出現(xiàn)炎性細(xì)胞聚集;增加前額葉皮質(zhì)和小腦小膠質(zhì)細(xì)胞數(shù)量,減少其星形膠質(zhì)細(xì)胞數(shù)量,炎癥因子主要是IL-1β。
后期研究需要我們通過(guò)多標(biāo)志蛋白觀察膠質(zhì)細(xì)胞的激活及極化改變,以便深層次了解兩種膠質(zhì)細(xì)胞在輻射所致前額葉皮質(zhì)中的相互作用,為更全面了解輻射所致腦損傷機(jī)制。
參考文獻(xiàn):
[ 1 ] HAVRNKOV R. Biological effects of ionizing radiation [J]. Cas Lek Cesk, 2020, 159(7-8): 258-260.
[ 2 ] Pasqual E, Bosch De Basea M, LPez-Vicente M, et al. Neurodevelopmental effects of low dose ionizing radiation exposure: A systematic review of the epidemiological evidence [J]. Environ Int, 2020, 136: 105371.
[ 3 ] Tapio S, Little M P, Kaiser J C, et al. Ionizing radiation-induced circulatory and metabolic diseases [J]. Environ Int,2021, 146: 106235.
[ 4 ] Lumniczky K, Impens N, Armengol G, et al. Low dose ionizing radiation effects on the immune system [J]. Environ Int,2021, 149: 106212.
[ 5 ] Limbad C, Oron T R, Alimirah F, et al. Astrocyte senescence promotes glutamate toxicity in cortical neurons [J]. PloS ONE, 2020, 15(1): e0227887.
[ 6 ] DENG Z, HUANG H, WU X, et al. Distinct expression of various angiogenesis factors in mice brain after whole-brain irradiation by X-ray [J]. Neurochem Res, 2017, 42(2): 625-633.
[ 7 ] Gorbunov N V, Kiang J G. Brain damage and patterns of neurovascular disorder after ionizing irradiation. complications in radiotherapy and radiation combined injury [J]. Radiat Res, 2021, 196(1):1-16.
[ 8 ] Ramanan S, Kooshki M, Zhao W, et al. PPARalpha ligands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-kappaB and AP-1 pathways [J]. Free Radic Biol Med, 2008, 45(12): 1695-1704.
[ 9 ] DING Z, ZHANG H, LV X F, et al. Radiation-induced brain structural and functional abnormalities in presymptomatic phase and outcome prediction [J]. Hum Brain Mapp, 2018, 39(1): 407-427.
[10] Hladik D, Tapio S. Effects of ionizing radiation on the mammalian brain [J]. Mutat Res Rev Mutat Res, 2016, 770(PtB): 219-230.
[11] WANG Q Q, YIN G, HUANG J R, et al. Ionizing radiation-induced brain cell aging and the potential underlying molecular mechanisms [J]. Cells, 2021, 10(12):3570.
[12] Kwon H S, Koh S H. Neuroinflammation in neurodegenerative disorders: the roles of microglia and astrocytes [J]. Transl Neurodegener, 2020, 9(1): 42.
[13] Tang F R, Loke W K, Khoo B C. Postnatal irradiation-induced hippocampal neuropathology, cognitive impairment and aging [J]. Brain Dev, 2017, 39(4): 277-293.
[14] Eriksson P, Buratovic S, Fredriksson A, et al. Neonatal exposure to whole body ionizing radiation induces adult neurobehavioural defects: Critical period, dose—Response effects and strain and sex comparison [J]. Behav Brain Res,2016, 304: 11-19.
[15] Buratovic S, Stenerlow B, Fredriksson A, et al. Neonatal exposure to a moderate dose of ionizing radiation causes behavioural defects and altered levels of tau protein in mice [J]. Neurotoxicology, 2014, 45: 48-55.
[16] Gupta M, Mishra S K, Kumar B S, et al. Early detection of whole body radiation induced microstructural and neuroinflammatory changes in hippocampus: A diffusion tensor imaging and gene expression study [J]. J Neurosci Res,2017, 95(4): 1067-1078.
[17] WANG G, REN X, YAN H, et al. Neuroprotective effects of umbilical cord-derived mesenchymal stem cells on radiationinduced brain injury in mice [J]. Ann Clin Lab Sci, 2020, 50(1): 57-64.
[18] Marzban H, Del Bigio M R, Alizadeh J, et al. Cellular commitment in the developing cerebellum [ J]. Front Cell Neurosci, 2014, 8: 450.
[19] Le Merre P, Ahrlund-richter S, Carlen M. The mouse prefrontal cortex: Unity in diversity [J]. Neuron, 2021, 109(12):1925-1944.
[20] Chiang C S, Mcbride W H, Withers H R. Radiation-induced astrocytic and microglial responses in mouse brain [ J].Radiother Oncol, 1993, 29(1): 60-68.
[21] Betlazar C, Middleton R J, Banati R B, et al. The impact of high and low dose ionising radiation on the central nervous system [J]. Redox Biol, 2016, 9: 144-156.
[22] Kalm M, Lannering B, Bj?rk-Eriksson T, et al. Irradiation-induced loss of microglia in the young brain [ J]. J Neuroimmunol, 2009, 206(1-2): 70-75.
[23] Ladeby R, Wirenfeldt M, Garcia-Ovejero D, et al. Microglial cell population dynamics in the injured adult central nervous system [J]. Brain Res Rev, 2005, 48(2): 196-206.
[24] Markarian M, Krattli R P, Baddour J D, et al. Glia-selective deletion of complement c1q prevents radiation-induced cognitive deficits and neuroinflammation [J]. Cancer Res, 2021, 81(7): 1732-1744.
[25] ZHOU D, HUANG X, XIE Y, et al. Astrocytes-derived VEGF exacerbates the microvascular damage of late delayed RBI[J]. Neuroscience, 2019, 408: 14-21.
[26] Carballo-quintS M, Martínez-silva I, Cadarso-surez C, et al. A study of neurotoxic biomarkers, c-fos and GFAP after acute exposure to GSM radiation at 900 MHz in the picrotoxin model of rat brains [J]. Neurotoxicology, 2011, 32(4):478-494.
[27] Brillaud E, Piotrowski A, De Seze R. Effect of an acute 900 MHz GSM exposure on glia in the rat brain: A timedependent study [J]. Toxicology, 2007, 238(1): 23-33.
[28] Loane D J, Kumar A. Microglia in the TBI brain: The good, the bad, and the dysregulated [J]. Exp Neurol, 2016, 275(Pt 3): 316-327.
[29] Turnquist C, Harris B T, Harris C C. Radiation-induced brain injury: current concepts and therapeutic strategies targeting neuroinflammation [J]. Neurooncol Adv, 2020, 2(1): vdaa057.
[30] Boyd A, Byrne S, Middleton R J, et al. Control of neuroinflammation through radiation-induced microglial changes [J].Cells, 2021, 10(9):2381.

