PKG 抑制劑KT-5823 對宮頸癌HeLa 細胞活力、凋亡、自噬的影響
楊瀾,周春雷,王藝霖,董賀楠,楊磊,穆紅
(1.天津醫科大學一中心臨床學院,天津 300192;2.天津市第一中心醫院檢驗科,天津 300192)
宮頸癌是女性生殖系統最常見的惡性腫瘤之一,每年全球約有50 萬新發病例,26 萬死亡病例[1]。宮頸癌新發病例主要集中于發展中國家,我國發病率較高,每年發病率為16.6/100 000[2],且有向年輕化發展的趨勢[3]。目前宮頸癌的治療策略包括手術切除、常規化療、放療,但療效有限,多數患者仍會出現復發和轉移,隨后死亡[4],亟需尋找新的治療方案。
環鳥苷酸依賴性蛋白激酶(cGMP-dependent protein kinase,PKG)是在哺乳動物中普遍存在的一種絲氨酸/蘇氨酸蛋白激酶,可被cGMP 激活,進而影響細胞的生物學功能[5]。有研究證實,PKG 的活化在減少腫瘤細胞自發凋亡[6]、增強腫瘤細胞干性和轉移[7]、增加腫瘤惡性程度[8]等方面發揮重要作用。同時PKG 可作為多種腫瘤潛在的治療靶點,如卵巢癌[9]、胰腺癌[10]、前列腺癌[11]等,但抑制PKG 對宮頸癌的作用還未有報道。KT-5823 是PKG 的特異性抑制劑,本研究擬探討KT-5823 對宮頸癌HeLa 細胞活力、凋亡和自噬的影響,并研究其可能的作用機制。
1 材料與方法
1.1 材料 人宮頸癌細胞株HeLa 購自于中國科學院典型培養物保藏委員會細胞庫。PKG 抑制劑KT-5823,純度≥85%,購自Sigma,貨號:K1388。
1.2 儀器與試劑
1.2.1 儀器 EnSpire Mutilabel Reader 酶標儀(美國PerkinElmer 公 司);Alpha Innotech FluroChem FC2 凝膠成像分析系統(美國Alpha Innotech 公司);LightCycle96 熒光定量PCR 儀(瑞士Roche 公司);BD Accuri C6 P1us 流式細胞儀(美國BD Sciences公司);倒置顯微鏡(日本Olympus IX71 公司);離心機(德國Eppendorf 公司);正置熒光顯微鏡(日本Nikon 公司);CO2細胞培養箱(美國Thermo 公司);電泳儀(美國Bio-Rad 公司)。
1.2.2 試劑 MEM-Alpha 培養基(以色列Biological Industries 公司);胎牛血清(北京鈕因泰克生物技術有限公司);PBS、青霉素/鏈霉素復合液(北京索萊寶生物技術有限公司);胰蛋白酶-EDTA 消化液(0.25%)酚紅(美國Invitrogen 公司);GFP-LC3B質粒(湖南科愛醫療器械有限公司);SBI-0206965(美國默克公司);細胞凋亡檢測試劑盒(天津三箭生物技術股份有限公司);膜再生液(北京索萊寶生物技術有限公司);LipofectamineTM3000 (美國Thermo Fisher 公司);RNA 逆轉錄試劑盒、SYBR Green、熒光定量PCR 試劑盒(日本Takara 生物技術有限公司);細胞增殖及細胞毒性檢測試劑盒、曝光液(Boster 生物工程有限公司);甘氨酸、Tris、SDS 粉末、氯化鈉、脫脂牛奶、抗體稀釋液(北京索萊寶生物技術有限公司)、兔抗人PKG1、哺乳動物雷帕霉素靶蛋白(mTOR)、磷酸化哺乳動物雷帕霉素靶蛋白(p-mTOR)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、微管相關蛋白1 輕鏈3(LC3)Ⅱ/Ⅰ抗體(美國CST 公司);Beclin1、B 細胞淋巴瘤2 家族蛋白(Bcl-2)、Bcl-2 相關X 蛋白(Bax)、天冬氨酸特異性半胱氨酸蛋白酶3(Caspase 3)、GAPDH、HRP 標記羊抗兔抗體(美國Proteintech 公司)。
1.3 方法 1.3.1 細胞培養 HeLa 細胞使用MEM-Alpha 培養基(含有10%胎牛血清、1%青鏈霉素雙抗)培養,置于37℃、5%CO2的培養箱中培養,當細胞密度達到80%~90%進行傳代種板。
1.3.2 試劑溶解與實驗分組 KT-5823 用DMSO溶解成儲存液,將儲存液分裝到若干EP 管中,-20℃保存,避免反復凍融。將HeLa 細胞分為DMSO 組(對照組)、KT-5823 組(實驗組),干預24 h 后收集細胞用于后續實驗。
1.3.3 CCK-8 檢測細胞存活率 取對數生長期的HeLa 細胞制備單細胞懸液,以每孔3 000 個細胞接種于96 孔培養板中,每組設3 個復孔,過夜培養。更換新培養基,將不同濃度的KT-5823 分別加入對應孔中,刺激24 h。每孔加入10 μL CCK8 溶液,孵育2 h。酶標儀檢測450 nm 波長處吸光度值。根據下列公式計算細胞存活率:
細胞存活率=[(實驗孔-空白孔)/(對照孔-空白孔)]×100%
1.3.4 流式細胞術檢測細胞凋亡 將HeLa 細胞(每孔1×105個)接種到24 孔板,每組設3 個復孔,貼壁后待細胞密度達到70%~80% 加入藥物處理24 h,收集細胞,采用Annexin V-FITC/PI 雙染法檢測細胞凋亡率。
1.3.5 GFP-LC3B 熒光斑點實驗 將HeLa 細胞(每孔0.8×105個)接種到24 孔板。待細胞密度達到60%~70%,使用LipofectamineTM3000 轉染GFP-LC3B質粒6 h 后,更換新鮮完全培養基培養24 h 后再加入藥物刺激24 h,用4%多聚甲醛固定細胞20 min,PBS清洗3次。熒光顯微鏡觀察GFP-LC3斑點的形成。
1.3.6 實時熒光定量PCR(RT-qPCR) 收集干預之后的細胞,使用Trizol 提取細胞總RNA,測定RNA 濃度,按照試劑盒說明書將RNA 逆轉錄為cDNA。用TB Green 進行RT-qPCR 檢測PKG1、LC3Ⅱ、Beclin1、β-actin mRNA 的表達水平,2-ΔΔCt計算mRNA 的相對表達。熒光定量熱循環條件為:預變性:95℃,2 min;3 步擴增:95℃,10 s;58℃,10 s;72℃,10 s,循環45 次。引物序列如表1 所示。

表1 引物序列Tab 1 Primer sequences
1.3.7 蛋白免疫印跡試驗檢測各蛋白表達水平收集KT-5823 干預之后的HeLa 細胞,加入含磷酸酶抑制劑的裂解液裂解細胞提取蛋白,用BCA 法進行蛋白定量。蛋白樣品(30 μg/孔)加入不同濃度SDS- PAGE 凝膠中進行電泳,分開蛋白條帶。轉膜后脫脂牛奶封閉2 h(5%),孵育兔抗人PKG1、LC3Ⅱ/Ⅰ、Beclin1、Akt、p-Akt、mTOR、p-mTOR、Bcl-2、Bax、Caspase-3、GAPHD(1∶1 000)抗體過夜(4℃),洗滌后孵育二抗(1∶1 000)1 h,加入ECL 顯影液后在蛋白凝膠成像儀中顯影觀察,Image J 分析蛋白條帶灰度值,實驗獨立重復3 次。
1.3.8 利用自噬抑制劑SBI 觀察誘導的自噬的作用 將HeLa 細胞(以1×105/孔的密度)接種到24 孔板,細胞分為3 組:DMSO 組(對照組)、KT-5823 組(實驗組)、實驗組+自噬抑制劑組,每組設3 個復孔。預實驗自噬抑制劑選取的劑量分別為10、30、50、70 μmol/L SBI 和100 μmol/L,過夜培養。待細胞密度達到70%~80%,分別在對應孔加入自噬抑制劑SBI-0206965 刺激2 h,然后加入3 μmol/L 的KT-5823 刺激24 h,收集細胞,用流式細胞術檢測細胞凋亡。
1.4 統計學處理 應用GarphPad Prism9.0、SPSS 16.0 軟件進行統計分析,符合正態分布的計量資料以x±s 表示,兩組間比較采用獨立樣本t 檢驗,多組間比較采用單因素方差分析,P<0.05 表示差異有統計學意義。
2 結果
2.1 KT-5823 對HeLa 細胞增殖能力的影響 CCK8結果顯示,與對照組相比(圖1A),3~100 μmol/L不同濃度的KT-5823 均可明顯抑制HeLa 細胞的增殖(3 μmol/L:t=10.23,P=0.000 5;5 μmol/L:t=10.65,P=0.000 4;10 μmol/L:t=14.28,P=0.000 1;30 μmol/L:t=13.22,P=0.000 2;50 μmol/L:t=14.83,P=0.000 1;70 μmol/L:t=12.10,P=0.000 3;100 μmol/L:t=13.56,P=0.000 2),且3 μmol /L KT-5823 接近半數抑制濃度。顯微鏡圖片顯示(圖1B),KT-5823 刺激HeLa細胞24 h 后,細胞形態從規則梭形變成圓形并出現細胞碎片,這種形態變化隨濃度的增加而逐漸加劇。免疫印跡實驗結果顯示,與對照組相比(圖1C),隨KT-5823 的濃度增加,PKG1 蛋白表達水平逐漸降低(1 μmol/L:t=10.01,P=0.000 6;3 μmol/L:t=13.83,P=0.000 2;5 μmol/L:t=11.86,P=0.000 3;10 μmol/L:t=14.17,P=0.000 1)。綜合考慮,最終選取了濃度梯度中的有效劑量3 μmol/L 用于后續研究。
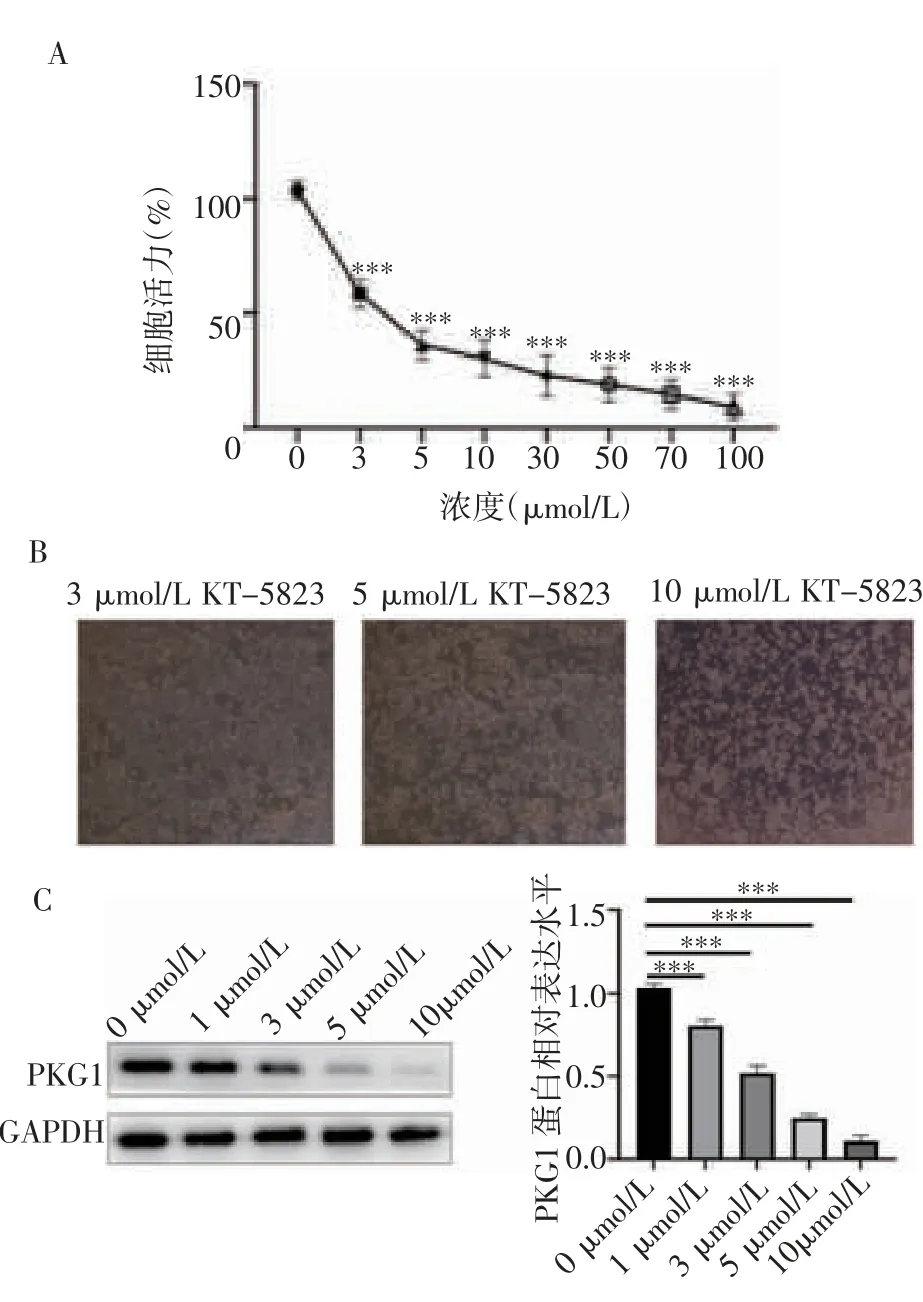
圖1 KT-5823 可有效抑制HeLa 細胞的增殖能力Fig 1 KT-5823 can effectively inhibit the proliferation of HeLa cells
2.2 KT-5823 對PKG1 的抑制作用 RT-qPCR 結果顯示,與對照組相比(圖2A),實驗組PKG1 mRNA 表達水平顯著降低(t=13.56,P=0.000 2);免疫印跡實驗與RT-qPCR 結果一致,與對照組相比(圖2B),實驗組PKG1 蛋白表達水平顯著降低(t=5.461,P=0.005 5),KT-5823 可明顯抑制PKG1 的表達。

圖2 KT-5823 對PKG1 表達的影響Fig 2 Effect of KT-5823 on the expression of PKG1
2.3 KT-5823 對HeLa 細胞凋亡的影響 流式細胞術結果顯示,與對照組相比(圖3A),KT-5823 可促進HeLa 細胞凋亡(t=10.78,P=0.004)。免疫印跡試驗結果顯示,與對照組相比(圖3B),KT-5823 可上調HeLa 細胞凋亡相關蛋白Caspase 3 的表達(t=9.341,P=0.000 7),降低Bcl2/Bax 的比值(t=13.79,P=0.000 2)。
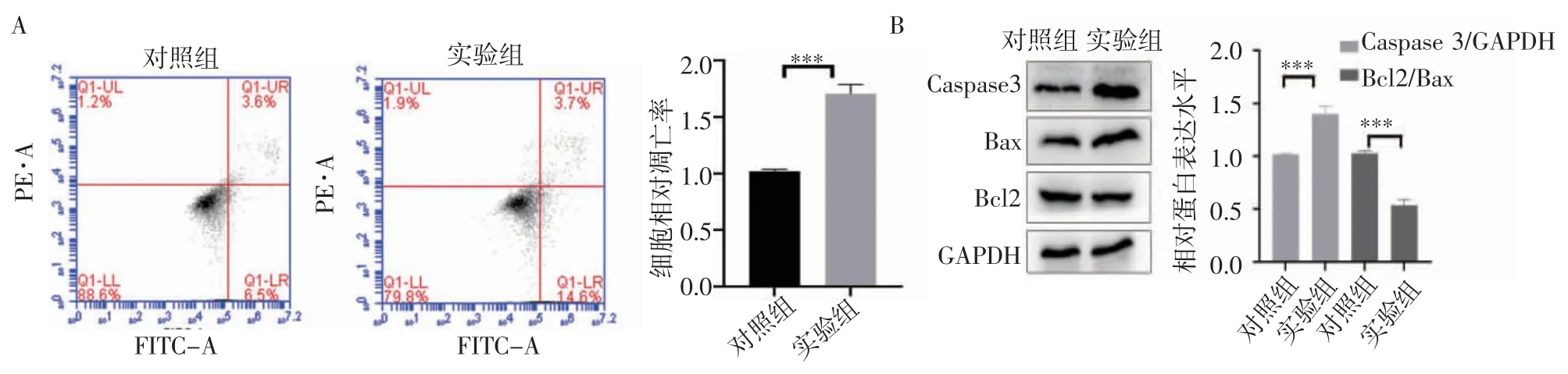
圖3 KT-5823 對HeLa 細胞凋亡的影響Fig 3 Effects of KT-5823 on apoptosis in HeLa cells
2.4 KT-5823 對HeLa 細胞自噬的影響 轉染GFP-LC3 質粒后,與對照組相比(圖4A),KT-5823可促進GFP-LC3B 斑點的形成(t=10.12,P=0.000 5),表明KT-5823 可促進Hela 細胞自噬體的形成。免疫印跡實驗結果顯示,與對照組相比(圖4B),KT-5823 可上調LC3Ⅱ/Ⅰ、Beclin1 蛋白的表達(t=6.924,P=0.002 3;t=11.84,P=0.000 3),降低自噬相關通路蛋白p-Akt/Akt、p-mTOR/mTOR 的比值(t=5.194,P=0.006 5;t=12.78,P=0.000 2)。與蛋白結果一致,RT-qPCR 結果顯示,與對照組相比(圖4C),KT-5823可上調HeLa 細胞自噬相關基因LC3Ⅱ、Beclin1 mRNA 的表達(t=8.359,P=0.001 1;t=5.782,P=0.004 4)。
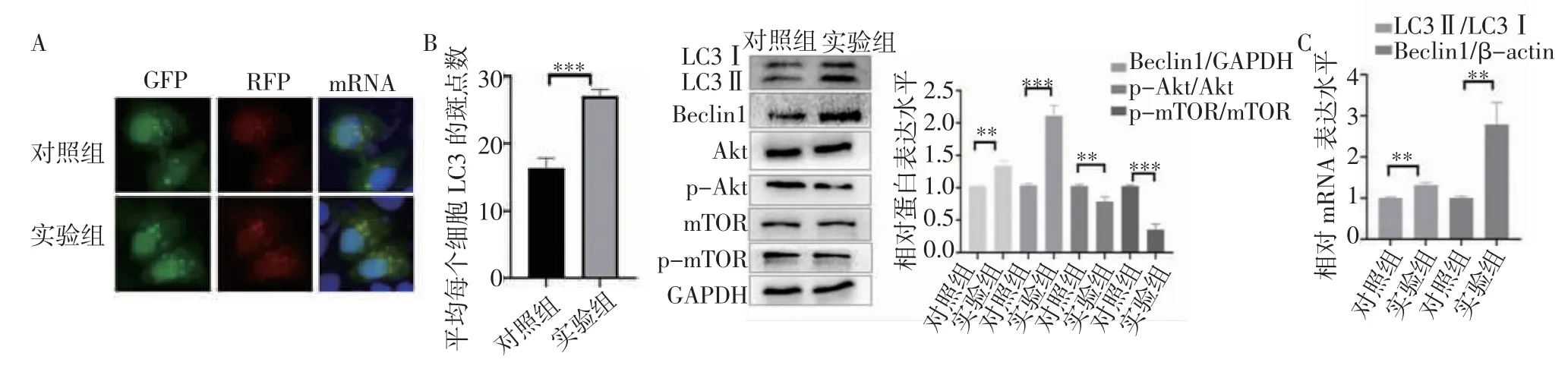
圖4 KT-5823 對HeLa 細胞自噬的影響Fig 4 Effects of KT-5823 on autophagy in HeLa cells
2.5 自噬抑制劑SBI對KT-5823誘導細胞凋亡的影響 流式細胞術實驗結果顯示(圖5),與實驗組相比,當自噬抑制劑劑量超過10 μmol/L 后,隨自噬抑制劑劑量的增加,細胞凋亡也逐步增加(實驗組+30 μmol/L SBI:t=7.616,P=0.001 6;實驗組+50 μmol/L SBI:t=15.43,P=0.000 1;實驗組+70 μmol/L SBI:t=11.01,P=0.000 4;實驗組+100 μmol/L SBI:t=15.39,P=0.000 1)。
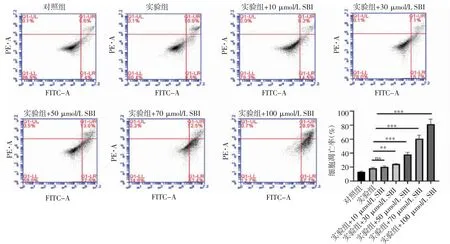
圖5 流式細胞術檢測KT-5823 聯合SBI-0206965 對細胞凋亡的影響Fig 5 Effects of KT-5823 combined with SBI-0206965 on apoptosis detected by flow cytometry assay
3 討論
KT-5823 是一種可穿透細胞膜的PKG 特異性抑制劑,可用于細胞研究。因PKG 存在組織器官差異,研究多集中于心臟[12]、血管[13]、成纖維細胞[14]等方面。近年來,PKG 與腫瘤的研究逐漸豐富,研究表明PKG 對腫瘤有促進作用[6-8],因此筆者對抑制PKG是否可用于宮頸癌治療進行了探索。本研究首先應用CCK-8 檢測了不同濃度的KT-5823 對HeLa 細胞增殖能力的影響,結果發現,KT-5823 在3 μmol/L以上濃度均可顯著抑制HeLa 細胞的增殖能力,且隨KT-5823 刺激濃度的增加,細胞活力逐漸降低。與CCK-8 實驗結果相吻合,分別用3、5、10 μmol/L KT-5823 刺激細胞后,細胞形態出現明顯加劇的毒性變化,表現為變圓變亮的細胞比例逐漸增加。這與不同劑量KT-5823 對PKG1 活性的抑制程度有關。以上實驗結果證明了KT-5823 具有抑制HeLa細胞生長的作用。
細胞凋亡是一種多基因參與調控的細胞程序性死亡形式[15]。Caspase 3 在細胞凋亡過程中位于級聯反應下游,執行凋亡過程。Bax 和Bcl-2 同屬于Bcl-2 家族蛋白,Bcl-2 是一種抑制凋亡的基因,主要通過阻止線粒體釋放凋亡因子來發揮抗凋亡作用,而Bax 是一種促凋亡基因。正常情況下,Bax 和Bcl-2 以適當的比例存在,但受到外界凋亡信號刺激后,二者的含量或比例會發生變化。當Bcl-2 表達增多時,會促使Bax/Bax 復合體解離,進而與Bcl-2結合形成更加牢固的Bcl-2/Bax 異源二聚體,抑制凋亡的發生;當Bax 表達增多時,Bax/Bax 同二聚體會明顯增多,進而激活Caspase 家族蛋白[16]。前期的流式細胞術實驗結果顯示,KT-5823 能夠促進宮頸癌細胞凋亡。為進一步研究KT-5823 對宮頸癌細胞凋亡的影響,并對凋亡相關蛋白Caspase 3、Bcl-2、Bax 蛋白進行了檢測,結果顯示,KT-5823 可提高促凋亡相關基因Caspase 3、Bax 的表達,下調抗凋亡基因Bcl-2 的表達,降低Bcl-2/Bax 比值。以上實驗結果表明KT-5823 可通過調節Caspase 3、Bcl-2 和Bax 蛋白的表達進而誘導HeLa 細胞發生凋亡,這與前人關于抑制cGMP/PKG 通路可抑制宮頸癌細胞生長的實驗結果相吻合[17]。
自噬是一種降解和消除錯誤折疊蛋白質和受損細胞器的分解代謝過程[18]。自噬在腫瘤細胞中具有雙重作用,一方面腫瘤細胞可利用自噬對受損細胞器和陳舊蛋白質進行機械化降解,維持細胞穩態,且在面對應激反應時腫瘤細胞可通過激活自噬免除細胞死亡[19];另一方面當自噬超過閾值時,可能會引發自噬性細胞死亡或激活其他細胞死亡方式,最終導致細胞死亡[20]。筆者首先通過轉染GFP-LC3質粒探究了抑制PKG1 對宮頸癌細胞自噬的影響,發現與對照組相比,KT-5823 能夠增加宮頸癌細胞自噬泡的形成。然后通過RT-qPCR 和免疫印跡試驗檢測自噬基因LC3Ⅱ、Beclin1 的表達水平發現,與對照組相比,實驗組LC3Ⅱ/Ⅰ、Beclin1 表達水平增加。PI3K/Akt/mTOR 信號通路是經典的自噬通路,mTOR 是調節自噬的明星因子[21]。此信號通路也是細胞內關鍵的信號轉導通路,可促進細胞生長并抑制細胞凋亡[22]。基于此,筆者研究了KT-5823 刺激后Akt-mTOR 信號通路的變化,發現p-Akt/Akt、pmTOR/mTOR 比值降低。以上研究結果表明宮頸癌細胞在KT-5823 刺激后,可通過抑制Akt-mTOR 信號通路誘導細胞自噬水平增加。為了探究自噬在宮頸癌細胞PKG1 抑制中的作用,筆者應用了自噬特異性抑制劑SBI-0206965,發現自噬抑制劑與PKG1抑制劑KT-5823 共處理宮頸癌細胞后,與單獨使用KT-5823 處理組相比,細胞凋亡率增加,且隨自噬抑制劑劑量的增加細胞凋亡程度加劇。結果表明,KT-5823 干預后細胞上調的自噬水平并未達到自噬過度激活的閾值,而是發揮降低KT-5823 刺激造成不利影響的保護作用。這也表明KT-5823 通過聯合靶向抑制自噬可提高抗宮頸癌治療的效果。
綜上所述,本文證實PKG 特異性抑制劑KT-5823可抑制宮頸癌細胞的增殖能力,通過調控Caspase 3/Bax/Bcl2 促進細胞凋亡的發生。同時,KT-5823 抑制PKG 后,宮頸癌細胞可通過調控Akt/mTOR 信號通路發生保護性細胞自噬,而抑制這種自噬可進一步加劇宮頸癌細胞死亡。在未來筆者準備進一步研究PKG 基因敲除對宮頸癌細胞的作用,同時可加入動物實驗進一步支持驗證。總之,本研究為靶向PKG治療宮頸癌提供了實驗和理論依據,為臨床治療提供了新的靶點。

