褪黑素的生理功能及應用研究進展
李佳佳 門海濤 高麗美
摘要:褪黑素(N-乙酰基-5甲氧基色胺)屬于一類常見的吲哚雜環類小分子物質,是生物體內重要的內源性激素信號分子,在動、植物細胞生長發育和各種生理生化代謝過程中起著積極的調控作用。褪黑素最初在動物體中被發現,具有調節晝夜節律、清除自由基、改善機體睡眠質量、提高免疫力等多種生理功能。隨后人們在植物各類組織或器官中也檢測到了植物褪黑素。近年來,隨著對植物褪黑素研究認識的不斷深入,褪黑素在植物體內的具體合成途徑及生理作用也越來越清晰,特別是褪黑素在參與緩解植物生物脅迫或非生物脅迫方面的作用及調控機制受到了廣泛關注。本文從理化性質、生物合成途徑、生理作用以及調控有機體生物脅迫和非生物脅迫響應等多個方面系統闡述了褪黑素的分子結構特點、生物學功能及其在生活生產領域中的應用現狀,并展望了未來關于褪黑素信號分子感知環境信號及其作用機制是一個非常有趣的研究領域。本文將為深入探究褪黑素與有機體細胞互作的分子機制,促進褪黑素在工農業生產和人類生活中的推廣應用提供理論參考。
關鍵詞:褪黑素;自由基清除劑;抗氧化代謝;生物脅迫;非生物脅迫
中圖分類號:Q42;S184 文獻標志碼:A
文章編號:1002-1302(2023)08-0017-09
基金項目:山西省青年科技基金(編號:201801D221260)。
作者簡介:李佳佳(1997—),女,山西忻州人,碩士研究生,主要從事植物細胞生物學研究。E-mail:1845999496@qq.com。
通信作者:高麗美,博士,碩士生導師,主要從事植物細胞生物學研究。E-mail:limeigao1122@126.com。
褪黑素(melatonin,MT)屬于一類吲哚雜環類激素小分子,廣泛分布于從藻類到高等哺乳動物等眾多生物體內[1-2]。1917年天然褪黑素分子最早被發現于動物松果體中,故又被稱為松果體素或松果腺素,關于褪黑素早期的研究也主要集中在動物體內[3-4]。人們發現褪黑素分子可以改善動物睡眠、調節機體時差、增強機體免疫力、延緩組織衰老以及具有抗腫瘤功效等一系列功能[5-6]。1995年人們又首次在維管植物組織中分離鑒定出了植物褪黑素,隨后的研究很快發現褪黑素幾乎存在于所有的植物體中,而且在根、莖、葉等多種植物器官中普遍分布[7-12]。在不同植物組織或器官中,天然褪黑素濃度從0.1 pg/鮮質量(g)至30.0 μg/鮮質量(g)不等[13]。作為植物重要的內源性激素分子之一,褪黑素具有類似生長素的功能,在調控種子萌發、細胞增殖、植物生長發育以及延緩葉片衰老等方面均發揮著積極作用。同時,作為一種重要的自由基清除劑,褪黑素還具有抵抗氧化應激反應的作用,因此在緩解植物生物脅迫或非生物脅迫引起的氧化脅迫損傷中也具有重要地位[14-17]。
1 褪黑素的理化性質
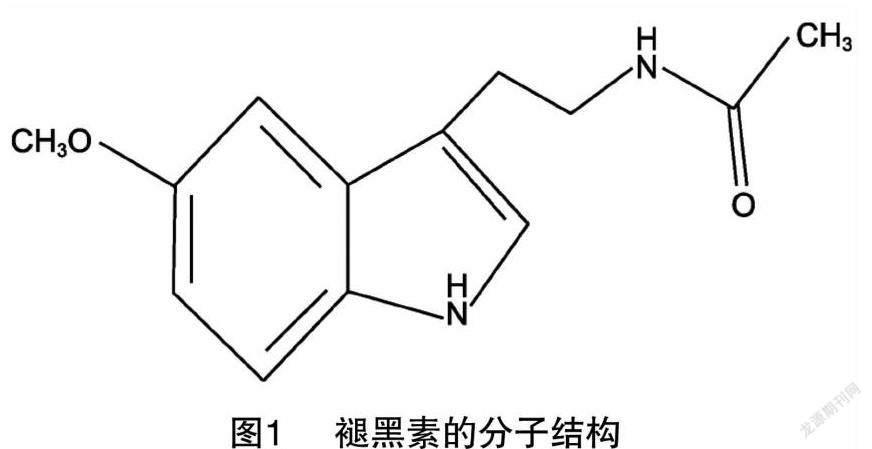
褪黑素,別稱抑黑素、褪黑激素、松果腺素,外觀呈白色或類白色結晶粉末,化學名稱為N-乙酰基-5甲氧基色胺(N-acetyl-5-methoxytryptamine),分子量232.278 3,熔點116~118 ℃,分子式C13H16N2O2,分子結構如圖1所示。褪黑素具有良好的熱穩定性,但是見光易分解,易溶于熱水和乙醇,幾乎不溶于水,最大紫外吸收波長為278 nm。褪黑素分子結構中的乙酰基和5-甲氧基官能團決定了該激素既具有親脂性和親水性特點,同時也表現出與受體結合的高度特異性。
2 褪黑素的生物合成
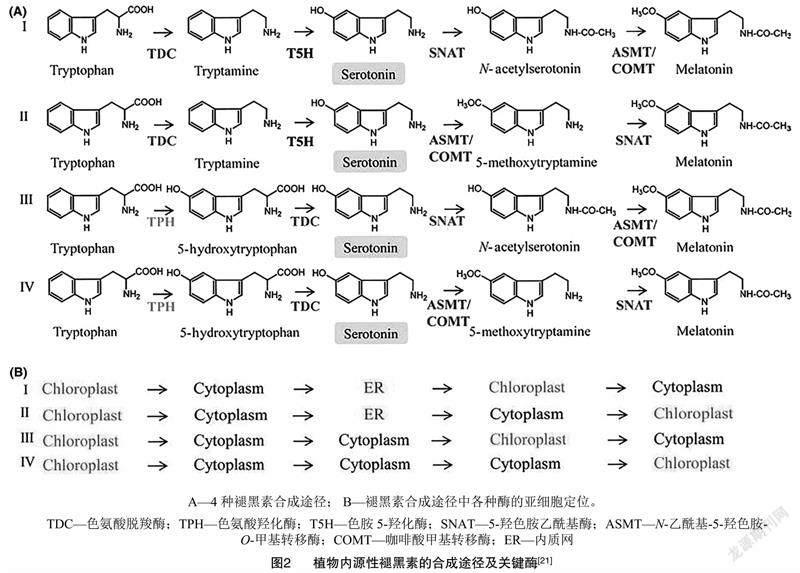
天然褪黑素在生物細胞中的含量很低,通常以皮克(1 pg=1×10-12 g)級水平存在。在高等動物體中,褪黑素由松果體中的松果體細胞合成,在人體內也是由位于大腦深處的松果體分泌產生[18]。動物細胞的5-羥色胺(血清素)在N-乙酰轉移酶催化作用下可與乙酰輔酶A反應轉化為N-乙酰-5-羥色胺,然后N-乙酰-5-羥色胺再在乙酰血清素O-甲基轉移酶催化作用下,被S-腺苷甲硫氨酸(SAM)甲基化,形成了褪黑素[19]。高等植物褪黑素的合成主要有4條連續的酶促反應途徑,均是以色氨酸為起始原料[20],在不同關鍵酶的催化作用下合成一系列中間體(圖2),最終產生褪黑素信號分子。其中,途徑Ⅰ和途徑Ⅱ是植物內源褪黑素合成的主要路徑,通過酶促動力學反應試驗證實,當植株處于正常生長環境中時通過途徑Ⅰ合成褪黑素分子;而當植物處于脅迫環境中時,則會通過途徑Ⅱ合成大量的褪黑素物質。4條途徑中共同的中間產物是5-羥色胺,因此5-羥色胺是植物內源褪黑素合成的重要底物[21],其濃度大小也是決定褪黑素合成速率的關鍵因素[22]。當植物組織中將色氨酸轉換為5-羥色胺的速率大于將5-羥色胺轉化為褪黑素的速率時,植物內會合成少量的褪黑素;反之,植物內褪黑素合成量會大大提高。此外,各種褪黑素合成途徑的中間體會產生并積累于不同的亞細胞區室,如細胞質(cytoplasm)、內質網(ER)和葉綠體(chloroplast)等中(圖2),這些中間體的濃度也在一定程度上調控著合成途徑中酶促反應的發生。褪黑素合成途徑中的一些關鍵酶也是其合成速率的限速酶,如5-羥色胺乙酰基酶(SNAT)、咖啡酸甲基轉移酶(COMT)和N-乙酰基-5-羥色胺-O-甲基轉移酶(ASMT)等。同時,環境脅迫對植物產生的特異效應物也可能會影響褪黑素的生物合成過程[21,23-25]。
生物有機體內源褪黑素的合成具有三大生理特點:首先褪黑素的合成具有明顯的晝夜節律性,這就造成08:00機體內褪黑素濃度降至最低,直到20:00左右又開始合成,此后濃度逐漸上升,23:00左右迅速升高,至次日02:00—03:00達到峰值,然后又開始逐漸下降,直到次日08:00分泌終止[26]。所以,褪黑素是一種內源性生物睡眠調節器,而不是睡眠促進器。其次,褪黑素的合成還會受到環境中光照條件的控制,通常白天光照較強抑制了內源褪黑素的合成,夜晚無光照時褪黑素合成會增多,但不管白天或晚上只要機體頻繁接受光照就會影響體內褪黑素的分泌量[27]。這應該也是導致機體內褪黑素合成具有節律性特征的根本原因。總之,褪黑素分泌與視網膜、眼部晶狀體、胃腸道及腦部松果體細胞均有密切關系[28-30]。最后,褪黑素的合成還與生物體的年齡有關。年幼個體褪黑素的分泌通常是充足的,而隨著年齡的不斷增長,褪黑素分泌量會減少,并呈現平均每10年以10%~15%的趨勢降低。因此,老年人尤其是老年睡眠障礙患者體內褪黑素合成下降會愈加明顯,最終導致了睡眠節律和多個系統功能紊亂[31]。
3 褪黑素的生物學作用
盡管天然褪黑素在生物有機體內分泌水平極低,但其生理調控功能卻是極高效的。褪黑素的生理功能非常廣泛,涉及到生物有機體生長、發育、生殖、免疫等多個方面,在不同動、植物體內的作用也不盡相同。
3.1 動物褪黑素的作用
動物褪黑素是一種內源性生物時鐘調節劑,在動物細胞內的分泌具有嚴格的晝夜節律性特點。通常情況下,天然褪黑素分子在黑暗條件下才會生成,在光亮時即使是很微弱的燈光都會明顯抑制褪黑素的分泌。因此,褪黑素可調節動物睡眠,提高睡眠質量,具有安神、安眠的作用[32]。褪黑素也是一種高效的自由基清除劑,可以明顯抑制生物分子的過氧化反應,保護細胞結構,防止遺傳物質DNA氧化損傷,降低過氧化物濃度,具有延緩機體組織衰老的生物保護效應。研究發現,褪黑素對由于外源性因素造成的過氧化反應,以及誘發產生自由基而引起的細胞損傷具有一定的拮抗作用。褪黑素還可以有效激活動物細胞的免疫應激反應,提高機體免疫力[33],甚至表現出抗腫瘤和抗炎癥、防治心血管疾病、控制血壓以及預防老年癡呆等抗御疾病的醫療功效[32]。此外,褪黑素又和人的視力有著密切關系,實驗證實適當補充褪黑素有利于預防白內障、青光眼及黃斑退化等眼部疾病發生[34]。
3.2 植物褪黑素的作用
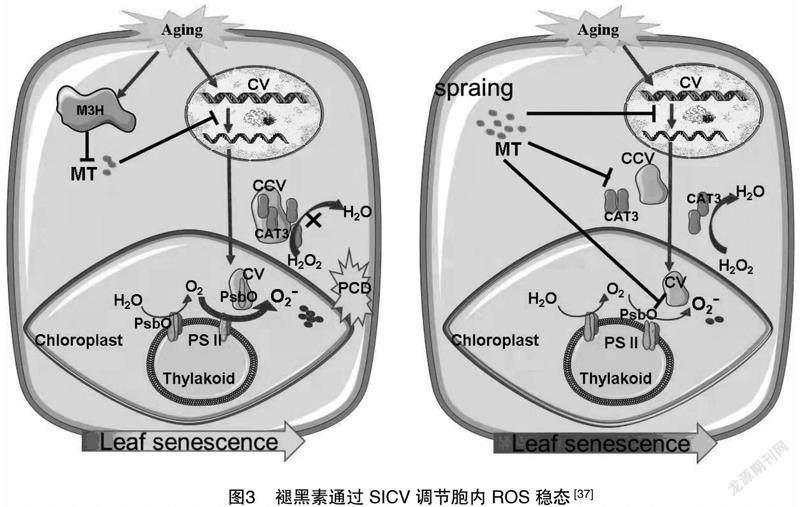
植物褪黑素幾乎合成于所有的植物組織器官中,在植物生長發育中起著一定的作用[35]。褪黑素也是植物體內一類高效的自由基清除劑,參與調控著植物體內的氧化/抗氧化代謝平衡。植物褪黑素可以及時清除植物體內過量的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等自由基成分,保護組織免受其氧化毒害作用,防止細胞結構與DNA分子氧化損傷,延緩葉片衰老進程。作為公認的內源性自由基清除劑之一,褪黑素不僅可以直接與多種自由基、活性氧和活性氮相互作用解除其對細胞的毒害作用,而且還可以通過激發自由基清除的抗氧化酶系統間接清除ROS或RNS[36]。褪黑素能直接與具有高毒性的羥基自由基物質反應,有效地降低羥基自由基的積累;也可以與過氧化氫(H2O2)、單線態氧分子(1O2)、過氧亞硝基陰離子(ONOO—)、氧化氮(NO)和次氯酸(HClO)等物質反應,進而中和其對植物細胞的氧化傷害。褪黑素的2種主要代謝產物 N1-乙酰基-N2-甲酰基-5-甲氧基犬尿氨酸(AFMK)和N1-乙酰基-5-甲氧基犬尿氨酸(AMK)等都具有很強的減緩自由基損傷的能力,從而進一步增強了褪黑素的抗氧化能力,該現象被稱為褪黑素與自由基相互作用的級聯反應。最近研究指出,植物褪黑素會顯著抑制葉綠體囊泡化蛋白SICV的表達,SICV既可以囊泡化光系統Ⅱ(PSⅡ)復合體的一個亞基(PsbO),加速ROS的產生;又能囊泡化胞質中的過氧化氫酶3(CAT3),減弱ROS的清除,造成ROS積累,誘導細胞程序性死亡。因此,植物褪黑素可以通過調節SICV-SIPsbO/SICAT3(葉綠體囊泡化蛋白SICV與番茄PsbO或CAT3相互作用)模塊,影響細胞內ROS代謝穩態,延緩植物葉片衰老(圖3)[37]。
大量研究指出,褪黑素還能顯著解除由非生物或生物脅迫誘導的植物氧化脅迫,抵御不利環境因素導致的脅迫損傷,甚至提高植物的抗逆性。ROS和RNS是調節植物免疫應答的重要信號分子。研究發現不利環境脅迫下ROS和RNS會在胞內積累,進而促進機體內源褪黑素合成,但有趣的是在脅迫初期,褪黑素分子又可以反過來進一步誘導ROS和RNS積累,而在脅迫后期,褪黑素則可通過激活抗氧化酶和抗氧化物負調控胞內ROS的積累。因此,環境脅迫觸發的褪黑素-ROS-RNS調控環路對于維持植物抗逆性與發育之間的平衡至關重要[38]。
4 褪黑素與環境脅迫
各種植物生長于自然環境中,不可避免地會受到來自環境中的各種脅迫因子的影響,包括非生物脅迫(abiotic stress),如紫外線B(UV-B)輻射、干旱、高溫、重金屬、鹽脅迫等,以及生物脅迫(biotic stress),如病原微生物浸染、病蟲害侵襲等。
4.1 褪黑素與非生物脅迫
非生物脅迫是對植物生長發育影響最為廣泛的一類脅迫因子。當前全球氣候環境的異常多變導致植物面臨多重不利環境因素的影響。極端環境會使植物的生長發育發生改變,引起表型發育異常,品質產量下降,甚至降低植株存活率或產生變異株系。非生物脅迫因子種類眾多,與植物生長最為密切,影響最大的包括光質、溫度、水分、射線、重金屬以及化學污染物等[39]。
在長期的適應演化過程中,植物體內演化形成了一系列積極應對環境因子尤其是不利脅迫因子的免疫防御策略。綠色植物葉片表面形成的蠟質層就是一種典型的防御性保護結構,蠟質層可有效阻止某些病原菌的侵襲[40]。植物體內的次生代謝產物也是重要的自我保護物質,這些物質通常具有一定的抑菌活性,可以及時阻斷病原菌的傳播,如木質素、胼胝質等;有些代謝物可吸收來自環境中的有害射線輻射,降低輻射損傷,如類黃酮、多酚化合物等;還有一些代謝產物可以通過特定的信號途徑刺激植物細胞釋放出特定化學物質進行自我保護,如水楊酸信號途徑、茉莉酸信號途徑等。植物受到脅迫時,還可以激活體內某些免疫系統,如病原菌相關的分子反應模式(PTI反應)或R基因主導的識別反應模式(ETI反應),激發植物感知病原菌并引發免疫反應。此外,大部分植物都可以通過激活抗氧化代謝反應,提高抗氧化性能來抵御不利環境脅迫的影響[41]。隨著科技的不斷發展和進步,人們也相繼發現很多參與改善植物抗逆性的生物小分子,如激素分子、生長因子等。褪黑素作為普遍公認的重要的植物體內源信號調節分子,近年來它也被報道參與調控了植物的多種抗逆代謝過程。
4.1.1 溫度脅迫
由于近年來劇烈的氣候變化,溫度波動已成為全球影響植物生長、產量和分布的關鍵限制因素之一。尤其重要的是,植物體內最重要的生理化學過程光合作用對溫度表現很敏感,導致植物生長非常容易受到極端氣候變化的影響[42]。長期暴露在極端溫度下的植物葉片光合作用能力會降低,光合色素合成量會減少[43-45]。極端溫度也會迅速耗盡葉片中的水分,降低膜的硬度進而影響光合作用進程[46]。
高等植物核酮糖-1,5-二磷酸羧化酶(Rubisco)等多種光合酶活性易受高溫影響,而且1,5-二磷酸核酮糖(RuBP)的合成速率和Rubisco的羧化位點也都會受到溫度變化而改變[47]。高溫脅迫會改變葉綠體類囊體膜的完整性,并破壞PSⅠ和PSⅡ,PSⅠ和PSⅡ是公認的ROS釋放的主要位點,類囊體反應中心葉綠素的過度還原會導致過量ROS的產生[48-50]。在高溫脅迫下,植物體內的葉綠體結構被破壞,CO2的溶解度會降低,葉綠素合成受到抑制,還降低了Rubisco對于CO2的親和力與光合系統組分的熱穩定性,從而導致植物光合速率發生變化。極端高溫環境一方面會使植物體細胞膜的膜脂組成發生改變,即內質網、線粒體、高爾基體等的內膜結構發生改變,導致細胞膜的選擇性吸收功能受損,電解質滲漏和電導率增大。另一方面高溫脅迫也會使細胞中的丙二醛(MDA)過量堆積,進而造成質膜氧化受損[51]。前期研究結果顯示,黃瓜幼苗在高溫脅迫過程中過氧化氫和丙二醛含量升高,說明高溫脅迫會使植株體內活性氧大量積累,導致膜脂過氧化發生,膜的結構和功能受到損傷,外源施加褪黑素能有效抑制高溫脅迫過程中黃瓜幼苗葉片過氧化氫的積累,減輕ROS對細胞膜造成的傷害[52]。此外,Jahan等的研究表明,100 μmol/L 外源褪黑素處理通過降低ROS的產生,提高抗氧化酶活性,調節抗壞血酸-谷胱甘肽(ASA-GSH)代謝循環,上調抗氧化酶相關基因的表達,提高了番茄幼苗的耐熱性,并且褪黑素也可以通過上調多胺(polyamines,PAs)生物合成基因表達來提高內源PAs和 NO含量,從而有利于解除過量積累ROS的細胞毒性[44]。Jahan等的研究還表明,褪黑素處理可以提高植物葉片的葉綠素含量,并使高溫誘導的葉片退化受到抑制[53]。
低溫脅迫不僅會使植物的形態改變,如葉片失水、葉面積減小、植物發生萎蔫等;也會影響植物的生殖生長,如發育期延遲、開花數量減少、落花落果等[54]。低溫脅迫還會使植物光合氣體交換受到限制,并且造成光合速率、呼吸代謝能力和葉綠素熒光參數下降,植物中活性氧大量增加,最終導致植物的結構和功能受到破壞[55]。婁慧等的研究采用20 μmol/L的褪黑素處理棉花種子,結果表明棉花種子萌發后胚根生長發育狀況最好,接近正常萌發水平,檢測到棉花的抗氧化酶活性較好,并且施加褪黑素后抑制了膜脂過氧化現象的產生,降低了丙二醛和過氧化氫的含量,最終降低了低溫條件下對棉花種子所帶來的傷害,提高了棉花種子萌發期的耐低溫特性[56]。此外,Li等前期的研究表明,局部應用褪黑素可以通過長距離信號途徑誘導植物器官的耐冷性[57]。另外,Li等的研究表明,外源褪黑素的使用一方面可以激活茶樹組織中超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)和過氧化物酶(peroxidase,POD)等抗氧化酶的活性;另一方面也可通過誘導谷胱甘肽合成酶(glutathione synthetase,GS)、谷胱甘肽還原酶(glutathione reductase,GR)和抗壞血酸過氧化物酶(ascorbate peroxidase,APX)編碼基因的轉錄表達,從而提高還原型谷胱甘肽酶(glutathione,GSH)、氧化型谷胱甘肽酶(glutathione oxidized,GSSG)的催化活性,從而抑制ROS的過量積累,減輕生物膜系統損傷,從而緩解低溫脅迫對茶樹生長發育的傷害[58]。
4.1.2 干旱脅迫
水分是植物正常生存和代謝的基礎。在干旱脅迫下,植物的正常生長會發生變化,其中包括植物的形態、組織結構等會發生不同程度的變化,在生理、生態方面會產生影響,導致植物光合作用受抑、呼吸作用紊亂、代謝異常,生長受到抑制,甚至死亡[59-62]。施加外源褪黑素能夠調控植物氣孔的關閉,從而減少水分散失,緩解干旱脅迫對植物生長所產生的影響[63]。褪黑素主要可以通過調節絲裂原活化蛋白激酶 (MAPK) 信號通路和抗壞血酸-谷胱甘肽循環途徑,激活抗氧化酶活性,保護光合系統和調節激素代謝來增強植物的耐旱性[64]。Zou等研究發現,外源噴施100 mmol/L 褪黑素可提高氨基酸和氮代謝化合物的合成,進而提高大豆植株的耐旱性[65]。鄒京南等用聚乙二醇(PEG-6000)對春大豆進行處理,同時對植株葉片噴施100 μmol/L的褪黑素,試驗結果顯示褪黑素提高了春大豆的光合色素、干物質和脯氨酸等的含量,并提高了植物光合速率和抗氧化酶活性,緩解了干旱環境對春大豆的抑制效應[66]。古咸彬等的試驗也表明,在干旱條件下褪黑素能提高桃苗的根系活力、相對葉綠素含量和相對含水量,從而對根系和葉片起到了保護作用。此外,褪黑素通過提高SOD、POD和CAT的活性,抑制了H2O2、MDA的生成,以此來緩解干旱脅迫對桃樹幼苗造成的氧化損傷[67]。佟莉蓉等的試驗表明,施加適宜濃度的外源褪黑素可顯著提高達烏里胡枝子的鮮質量、葉片鮮質量干質量比,以及葉片相對含水量,進而提高植物的抗旱性[68]。
干旱條件下,施加外源褪黑素可以降低脯氨酸、MDA、H2O2的濃度以及提高葉片糖代謝活力和抗氧化活性來抑制棉鈴脫落,從而提高棉花的耐旱性,保證生產性能[69]。此外,100 μmol/L褪黑素處理可通過抑制細胞膜損傷和降低H2O2濃度,調節超氧化物歧化酶、過氧化氫酶、谷胱甘肽過氧化物酶和抗壞血酸過氧化物酶的活性及相關基因的表達,從而減小大豆植株的氧化損傷,使植物保持較高的葉綠素含量,進而顯著促進了大豆植株的生長發育[70]。
4.1.3 鹽脅迫
鹽脅迫對植物生長的危害主要體現在抑制種子萌發、影響植株生長發育和降低植株結實率等多個方面。此外,鹽脅迫還會導致植物體內產生大量活性氧自由基,過量活性氧積累更進一步加劇了鹽脅迫給植物帶來的傷害[71]。孫浩月等的試驗表明,施加褪黑素顯著提高了葉片抗氧化酶活性,增加了葉片可溶性糖和可溶性蛋白含量,降低了MDA含量和相對電導率,從而促進了蕓豆幼苗生物量積累。因此證明褪黑素可以有效緩解NaCl脅迫對蕓豆幼苗的抑制效應,提高蕓豆幼苗的耐鹽性[72]。還有一些研究表明,褪黑素主要是通過清除由鹽脅迫形成的活性氧來使細胞膜保持完整,最終促進黃瓜種子萌發[73]。2015年,Liang等的研究報道顯示,添加10~20 μmol/L褪黑素可延緩水稻葉片的衰老和細胞死亡,并通過直接或間接地對抗細胞內過氧化氫的積累來增強水稻的耐鹽性[74]。Wei等的試驗通過在鹽脅迫下對植物葉面噴施 200 μmol/L 褪黑素,也證明了褪黑素可顯著提高抗氧化酶的活性,清除過量ROS分子,減輕細胞膜脂分子和細胞其他結構的過氧化損傷,并且施用褪黑素還可以促進植物對氮、鉀、硅的吸收和運輸,減少鈉的吸收和運輸,改善植物體內離子的動態平衡和滲透調節,增加地上部分和根系統的生物量。因此,施用褪黑素處理顯著提高了水稻幼苗的耐鹽性[75]。Yan等利用轉錄組測序和病毒誘導的基因沉默(VIGS)方法鑒定褪黑素誘導番茄耐鹽堿脅迫的關鍵下游轉錄因子DREB1α和IAA3,表明褪黑素可通過激活DREB1α和IAA3轉錄因子的表達進一步調控鹽脅迫下幼苗體內的離子平衡、氣孔關閉、水分平衡、酸堿平衡和氧化還原平衡,從而提高番茄耐鹽堿能力[76]。中國農業科學院棉花研究所研究發現,褪黑素合成基因COMT被抑制后,棉花植株對鹽脅迫表現更敏感,外源使用褪黑素處理可減輕COMT沉默植株的鹽脅迫敏感性[77];同時,外源褪黑素作用于正常植株,可通過激活活性氧清除系統和Ca2+信號傳遞途徑提高棉花的耐鹽性[77]。外源施用或提高內源褪黑素的合成,均可通過誘導乙烯合成途徑的關鍵基因(如MYB108A和ACS1)轉錄,促進葡萄乙烯的生物合成和植株的耐鹽性[78]。
4.1.4 重金屬脅迫
在工業化和城鎮化的發展過程中,工業生產、交通運輸、污水排放、堆肥、農藥和化肥的施用都可以引起重金屬污染,導致土壤重金屬污染問題日益嚴重[79]。重金屬在土壤中難以降解,積累在土壤中,部分重金屬會與植物蛋白結合,使其失去活性,最終對植物的生理生化和生長發育造成影響[80]。此外,重金屬通過引發自由基介導的連鎖反應,導致脂質、蛋白質和核酸被氧化,從而對主要的生物大分子造成氧化損傷[81]。研究表明,在鎘脅迫下,施加外源褪黑素會對紫花苜蓿的抗氧化酶活性產生影響[82]。Hodzic等通過比較檸檬香油根和葉的抗氧化防御系統和ROS積累水平,研究褪黑素對重金屬脅迫下檸檬香油根和葉的保護作用,結果表明外源褪黑素可以通過激活植物體內的抗氧化防御系統,減輕Cd和Zn對植物的傷害,提高植物的耐受性[83]。Xu等使用miRNA和轉錄組聯合分析發現,蘿卜在受到Cd脅迫后,使用褪黑素處理蘿卜幼苗可誘導RsMT1基因的上調表達,從而增強蘿卜對Cd的耐受性[84]。此外,外源褪黑素還可以提高光化學效率進而提高硒脅迫下油菜生物量的積累[85]。Nawaz等的研究表明,褪黑素預處理后不僅可以減少釩從根部到莖的轉運,降低葉和莖的釩含量,還可以通過調節褪黑素的生物合成及超氧化物歧化酶、過氧化物酶和抗壞血酸的基因表達,增強西瓜幼苗超氧化物歧化酶和過氧化氫酶的活性,降低了過氧化氫和丙二醛的含量從而提高西瓜幼苗在釩脅迫下的葉綠素相對含量、光合作用能力和生長量[86]。
4.1.5 射線輻射
近年來,隨著工業的發展和人類活動的增加,大氣中臭氧的含量逐漸減少。臭氧減少導致到達地面的UV-B輻射增加,進而會對地面的植物產生影響,UV-B輻射增強可以使植物發生矮化、葉面積減少、葉面積指數降低、發育遲緩、光合作用和蒸騰作用下降,還會影響各種酶的活性、使作物的產量降低、品質發生變化甚至影響整個植物生態系統[87]。有試驗結果表明,UV-B輻射增強會降低馬鈴薯植株的高度,外源褪黑素處理可以在一定程度內提高株高,且使1,5-二磷酸核酮糖羧化酶和磷酸烯醇式丙酮酸羧化酶(PEPC)的活性提高,光合能力增強[88]。馬征在研究擬南芥褪黑素在UV-B 脅迫中的作用時發現,UV-B輻射處理可使褪黑素合成酶基因5-羥色胺乙酰轉移酶、咖啡酸甲基轉移酶和N-乙酰基-5-羥色胺-O-甲基轉移酶的表達量升高,以此來抵抗UV-B脅迫給擬南芥幼苗造成的傷害[3]。2021年Yao等的研究也報道擬南芥褪黑素調節了UV-B信號轉導途徑相關基因的轉錄,激活了擬南芥植株的抗氧化代謝,增強了其UV-B脅迫抗性[4]。
綜上所述,褪黑素是植物體內重要的內源激素分子之一,在植物響應各類非生物脅迫中起著積極的作用,同時也在一定程度上可以增強植物對非生物脅迫因子的抗逆性。盡管關于褪黑素與植物非生物脅迫的互作關系研究已經較多,但對褪黑素參與調控非生物脅迫的分子機制卻知之甚少,因此該領域今后的研究重點還應該在此方面有所突破。
4.2 褪黑素與生物脅迫
褪黑素對植物應對生物脅迫的影響主要表現為在減緩植物和采后果實的細菌、真菌和病毒病害等方面發揮著重要作用。2022年海南大學施海濤團隊系統闡述了褪黑素在該領域的相關研究進展[38]。該報道指出:(1)病原體侵染可觸發褪黑素-ROS-RNS調控環路,從而維持植物抗病和發育之間的平衡。(2)褪黑素還可能與其他植物激素互作調節植物的抗病性。例如,人們發現褪黑素在病原體浸染時會作用于水楊酸(SA)上游并正調控其積累,激活依賴于MAPK信號級聯反應介導植物免疫應答;褪黑素也可影響生長素與茉莉酸(JA)信號通路提高植物對病原菌的抗性。(3)褪黑素處理也會直接抑制病原體(如多種細菌、真菌等)的活性,以及下調與病原體毒性相關基因的表達,從而減輕其對植物的致病性。然而,目前褪黑素對病原體防御的研究仍處于早期階段,其介導植物免疫反應中的具體機制仍有待將來深入闡明。
5 結語與展望
關于植物褪黑素的研究有很多,主要集中在生物合成途徑、生理功能及非生物脅迫應答等方面。雖然褪黑素在植物各器官、組織中廣泛分布,但有關褪黑素在植物體內的運輸途徑及作用機制還有待進一步研究。此外,褪黑素被認為可以作為激素信號分子在逆境脅迫應答中發揮重要作用,然而對于植物如何感受褪黑素及如何進行信號調控仍不清楚,這也將是今后對植物褪黑素生物學功能進行深入研究的一個重要方向。
參考文獻:
[1]汪俊峰,余敏芬,李東賓,等. 褪黑素對模擬干旱脅迫下北美紅櫟幼樹光合性能及抗氧化酶系統的影響[J]. 生態科學,2021,40(2):167-174.
[2]Hardeland R. Melatonin in plants-diversity of levels and multiplicity of functions[J]. Frontiers in Plant Science,2016,7:198.
[3]馬 征. 擬南芥褪黑素響應UV-B脅迫的功能和其合成酶表達研究[D]. 西安:西北大學,2019.
[4]Yao J W,Ma Z,Ma Y Q,et al. Role of melatonin in UV-B signaling pathway and UV-B stress resistance in Arabidopsis thaliana[J]. Plant,Cell & Environment,2021,44(1):114-129.
[5]Arnao M B,Hernández-Ruiz J. Melatonin:a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science,2019,24(1):38-48.
[6]Bose S K,Howlader P. Melatonin plays multifunctional role in horticultural crops against environmental stresses:a review[J]. Environmental and Experimental Botany,2020,176:104063.
[7]KolárˇJ,Machácˇková I,Eder J,et al. Melatonin:occurrence and daily rhythm in Chenopodium rubrum[J]. Phytochemistry,1997,44(8):1407-1413.
[8]Murch S J,Simmons C B,Saxena P K. Melatonin in feverfew and other medicinal plants[J]. The Lancet,1997,350(9091):1598-1599.
[9]Manchester L C,Tan D X,Reiter R J,et al. High levels of melatonin in the seeds of edible plants:possible function in germ tissue protection[J]. Life Sciences,2000,67(25):3023-3029.
[10]Burkhardt S,Tan D X,Manchester L C,et al. Detection and quantification of the antioxidant melatonin in Montmorency and Balaton tart cherries (Prunus cerasus)[J]. Journal of Agricultural and Food Chemistry,2001,49(10):4898-4902.
[11]Tan D X,Manchester L C,Reiter R J,et al. Significance of melatonin in antioxidative defense system:reactions and products[J]. Biological Signals and Receptors,2000,9(3/4):137-159.
[12]Murch S J,Krishnaraj S,Saxena P K. Tryptophan is a precursor for melatonin and serotonin biosynthesis in in vitro regenerated St.Johns wort (Hypericum perforatum L.cv. Anthos) plants[J]. Plant Cell Reports,2000,19(7):698-704.
[13]劉德帥,姚 磊,徐偉榮,等. 褪黑素參與植物抗逆功能研究進展[J]. 植物學報,2022,57(1):111-126.
[14]Hattori A,Migitaka H,Iigo M,et al. Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International,1995,35(3):627-634.
[15]Moustafa-Farag M,Almoneafy A,Mahmoud A,et al. Melatonin and its protective role against biotic stress impacts on plants[J]. Biomolecules,2019,10(1):54.
[16]Dubbels R,Reiter R J,Klenke E,et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research,1995,18(1):28-31.
[17]Sharif R,Xie C,Zhang H,et al. Melatonin and its effects on plant systems[J]. Molecules,2018,23(9):2352.
[18]Tan D X. Melatonin and brain[J]. Current Neuropharmacology,2010,8(3):161.
[19]Tan D X,Hardeland R,Back K,et al. On the significance of an alternate pathway of melatonin synthesis via 5-methoxytryptamine:comparisons across species[J]. Journal of Pineal Research,2016,61(1):27-40.
[20]Murch S J,Alan A R,Cao J,et al. Melatonin and serotonin in flowers and fruits of Datura metel L.[J]. Journal of Pineal Research,2009,47(3):277-283.
[21]Back K,Tan D X,Reiter R J. Melatonin biosynthesis in plants:multiple pathways catalyze tryptophan to melatonin in the cytoplasm or chloroplasts[J]. Journal of Pineal Research,2016,61(4):426-437.
[22]王睿劼. 植物褪黑素合成關鍵酶的生物信息學分析暨轉mgfp-5基因煙草的愈傷誘導[D]. 西安:西北大學,2017.
[23]Tan D X,Hardeland R,Manchester L C,et al. The changing biological roles of melatonin during evolution:from an antioxidant to signals of darkness,sexual selection and fitness[J]. Biological Reviews,2010,85(3):607-623.
[24]王 萌. 外源褪黑素對NaCl脅迫下北美豆梨和杜梨生理特性的影響[D]. 保定:河北農業大學,2021.
[25]Tan D X,Manchester L C,di Mascio P,et al. Novel rhythms of N1-acetyl-N2-formyl-5-methoxykynuramine and its precursor melatonin in water hyacinth:importance for phytoremediation[J]. The FASEB Journal,2007,21(8):1724-1729.
[26]Tilden A R,Rasmussen P,Awantang R M,et al. Melatonin cycle in the fiddler crab Uca pugilator and influence of melatonin on limb regeneration[J]. Journal of Pineal Research,1997,23(3):142-147.
[27]馮佳倩,王天明,楊靜文. 海洋動物中褪黑素信號系統的研究進展[J]. 海洋科學,2021,45(11):144-155.
[28]Sheng W L,Weng S J,Li F,et al. Immunohistological localization of Mel1a melatonin receptor in pigeon retina[J]. Nature and Science of Sleep,2021,13:113-121.
[29]Kinker G S,Ostrowski L H,Ribeiro P A C,et al. MT1 and MT2 melatonin receptors play opposite roles in brain cancer progression[J]. Journal of Molecular Medicine,2021,99(2):289-301.
[30]Yasmin F,Sutradhar S,Das P,et al. Gut melatonin:a potent candidate in the diversified journey of melatonin research[J]. General and Comparative Endocrinology,2021,303:113693.
[31]劉揚華,劉詩翔. 睡眠障礙的診斷及治療概述[J]. 神經損傷與功能重建,2012,7(2):143-146.
[32]劉建忠,朱艷君,周麗芳. 褪黑素生理及藥理作用研究進展[J]. 武漢科技大學學報(自然科學版),2004,27(2):198-201.
[33]Calvo J R,González-Yanes C,Maldonado M D. The role of melatonin in the cells of the innate immunity:a review[J]. Journal of Pineal Research,2013,55(2):103-120.
[34]謝愛萍,彭立核,李靈梅,等. 人體中內源性褪黑素作用及檢測技術現狀[J]. 中國衛生檢驗雜志,2019,29(22):2814-2816.
[35]Arnao M B,Hernández-Ruiz J. Functions of melatonin in plants:a review[J]. Journal of Pineal Research,2015,59(2):133-150.
[36]Tan D X,Manchester L C,Terron M P,et al. One molecule,many derivatives:a never-ending interaction of melatonin with reactive oxygen and nitrogen species? [J]. Journal of Pineal Research,2007,42(1):28-42.
[37]Yu J C,Lu J Z,Cui X Y,et al. Melatonin mediates reactive oxygen species homeostasis via SlCV to regulate leaf senescence in tomato plants[J]. Journal of Pineal Research,2022,73(2):e12810.
[38]Zeng H Q,Bai Y J,Wei Y X,et al. Phytomelatonin as a central molecule in plant disease resistance[J]. Journal of Experimental Botany,2022,73(17):5874-5885.
[39]Zhu J K. Abiotic stress signaling and responses in plants[J]. Cell,2016,167(2):313-324.
[40]Zhu L,Guo J S,Zhu J,et al. Enhanced expression of EsWAX1 improves drought tolerance with increased accumulation of cuticular wax and ascorbic acid in transgenic Arabidopsis[J]. Plant Physiology and Biochemistry,2014,75:24-35.
[41]賈學靜,董立花,丁春邦,等. 干旱脅迫對金心吊蘭葉片活性氧及其清除系統的影響[J]. 草業學報,2013,22(5):248-255.
[42]Tan W,Meng Q W,Brestic M,et al. Photosynthesis is improved by exogenous calcium in heat-stressed tobacco plants[J]. Journal of Plant Physiology,2011,168(17):2063-2071.
[43]Shah Jahan M,Wang Y,Shu S,et al. Exogenous salicylic acid increases the heat tolerance in tomato (Solanum lycopersicum L.) by enhancing photosynthesis efficiency and improving antioxidant defense system through scavenging of reactive oxygen species[J]. Scientia Horticulturae,2019,247:421-429.
[44]Jahan M S,Shu S,Wang Y,et al. Melatonin alleviates heat-induced damage of tomato seedlings by balancing redox homeostasis and modulating polyamine and nitric oxide biosynthesis[J]. BMC Plant Biology,2019,19(1):414.
[45]Shanmugam S,Kjaer K H,Ottosen C O,et al. The alleviating effect of elevated CO2 on heat stress susceptibility of two wheat (Triticum aestivum L.) cultivars[J]. Journal of Agronomy and Crop Science,2013,199(5):340-350.
[46]Berry J,Bjrkman O. Photosynthetic response and adaptation to temperature in higher plants[J]. Annual Review of Plant Physiology,1980,31:491-543.
[47]Kattge J,Knorr W. Temperature acclimation in a biochemical model of photosynthesis:a reanalysis of data from 36 species[J]. Plant,Cell & Environment,2007,30(9):1176-1190.
[48]Rexroth S,Mullineaux C W,Ellinger D,et al. The plasma membrane of the cyanobacterium Gloeobacter violaceus contains segregated bioenergetic domains[J]. The Plant Cell,2011,23(6):2379-2390.
[49]Müller P,Li X P,Niyogi K K. Non-photochemical quenching. A response to excess light energy[J]. Plant Physiology,2001,125(4):1558-1566.
[50]Takagi D,Takumi S,Hashiguchi M,et al. Superoxide and singlet oxygen produced within the thylakoid membranes both cause photosystem Ⅰ photoinhibition[J]. Plant Physiology,2016,171(3):1626-1634.
[51]解玉玲. 高溫脅迫對植物生理影響的研究進展[J]. 吉林農業,2019(8):107-108.
[52]徐向東,孫 艷,郭曉芹,等. 褪黑素對高溫脅迫下黃瓜幼苗抗壞血酸代謝系統的影響[J]. 應用生態學報,2010,21(10):2580-2586.
[53]Jahan M S,Shu S,Wang Y,et al. Melatonin pretreatment confers heat tolerance and repression of heat-induced senescence in tomato through the modulation of ABA-and GA-mediated pathways[J]. Frontiers in Plant Science,2021,12:650955.
[54]丁紅映,王 明,謝 潔,等. 植物低溫脅迫響應及研究方法進展[J]. 江蘇農業科學,2019,47(14):31-36.
[55]李 賀. 褪黑素對大豆苗期低溫脅迫抗性的調控作用[D]. 大慶:黑龍江八一農墾大學,2021.
[56]婁 慧,趙曾強,朱金成,等. 褪黑素對低溫脅迫下棉花種子萌發特性的影響[J]. 中國農學通報,2021,37(35):13-19.
[57]Li H,Chang J J,Zheng J X,et al. Local melatonin application induces cold tolerance in distant organs of Citrullus lanatus L. via long distance transport[J]. Scientific Reports,2017,7:40858.
[58]Li J H,Arkorful E,Cheng S Y,et al. Alleviation of cold damage by exogenous application of melatonin in vegetatively propagated tea plant [Camellia sinensis (L.) O.Kuntze][J]. Scientia Horticulturae,2018,238:356-362.
[59]羅會英,金 杰,趙瓊玲,等. 辣木干旱脅迫研究進展[J]. 中國熱帶農業,2021(4):21-23,72.
[60]何小三,徐林初,龔 春,等. 干旱脅迫對‘贛無12苗期光合特性的影響[J]. 中南林業科技大學學報,2018,38(12):52-61.
[61]鄧輝茗,龍聰穎,蔡仕珍,等. 不同水分脅迫對綿毛水蘇幼苗形態和生理特性的影響[J]. 西北植物學報,2018,38(6):1099-1108.
[62]鄭鵬麗,黃曉蓉,費永俊,等. 水分脅迫對楨楠幼樹光合生理特性的影響[J]. 中南林業科技大學學報,2019,39(10):64-70.
[63]Campos C N,vila R G,de Souza K R D. Melatonin reduces oxidative stress and promotes drought tolerance in young Coffea arabica L. plants[J]. Agricultural Water Management,2019,211:37-47.
[64]Meng J F,Xu T F,Wang Z Z,et al. The ameliorative effects of exogenous melatonin on grape cuttings under water-deficient stress:antioxidant metabolites,leaf anatomy,and chloroplast morphology[J]. Journal of Pineal Research,2014,57(2):200-212.
[65]Zou J N,Yu H,Yu Q,et al. Physiological and UPLC-MS/MS widely targeted metabolites mechanisms of alleviation of drought stress-induced soybean growth inhibition by melatonin[J]. Industrial Crops and Products,2021,163:113323.
[66]鄒京南,曹 亮,王夢雪,等. 外源褪黑素對干旱脅迫下大豆結莢期光合及生理的影響[J]. 生態學雜志,2019,38(9):2709-2718.
[67]古咸彬,陸玲鴻,宋根華,等. 外源褪黑素預處理對干旱脅迫下桃苗生長的緩解效應[J]. 植物生理學報,2022,58(2):309-318.
[68]佟莉蓉,倪順剛,任星遠,等. 褪黑素對干旱脅迫下達烏里胡枝子幼苗生長及葉片水分生理的影響[J]. 草地學報,2021,29(8):1682-1688.
[69]Khattak W A,He J Q,Abdalmegeed D,et al. Foliar melatonin stimulates cotton boll distribution characteristics by modifying leaf sugar metabolism and antioxidant activities during drought conditions[J]. Physiologia Plantarum,2022,174(1):e13526.
[70]Imran M,Latif Khan A,Shahzad R,et al. Exogenous melatonin induces drought stress tolerance by promoting plant growth and antioxidant defence system of soybean plants[J]. AoB Plants,2021,13(4):plab026.
[71]Choudhary S,Wani K I,Naeem M,et al. Cellular responses,osmotic adjustments,and role of osmolytes in providing salt stress resilience in higher plants:polyamines and nitric oxide crosstalk[J]. Journal of Plant Growth Regulation,2023,42:539-553.
[72]孫浩月,吳洪斌,李 明,等. 褪黑素浸種對鹽脅迫下蕓豆幼苗生長及生理特性的影響[J]. 河南農業科學,2021,50(12):111-120.
[73]Zhang H J,Zhang N,Yang R C,et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems,ABA and GA4 interaction in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research,2014,57(3):269-279.
[74]Liang C Z,Zheng G Y,Li W Z,et al. Melatonin delays leaf senescence and enhances salt stress tolerance in rice[J]. Journal of Pineal Research,2015,59(1):91-101.
[75]Wei L,Zhao H Y,Wang B X,et al. Exogenous melatonin improves the growth of rice seedlings by regulating redox balance and ion homeostasis under salt stress[J]. Journal of Plant Growth Regulation,2022,41(6):2108-2121.
[76]Yan Y Y,Jing X,Tang H M,et al. Using transcriptome to discover a novel melatonin-induced sodic alkaline stress resistant pathway in Solanum lycopersicum L.[J]. Plant and Cell Physiology,2019,60(9):2051-2064.
[77]Zhang Y X,Fan Y P,Rui C,et al. Melatonin improves cotton salt tolerance by regulating ROS scavenging system and Ca2+ signal transduction[J]. Frontiers in Plant Science,2021,12:693690.
[78]Xu L L,Xiang G Q,Sun Q H,et al. Melatonin enhances salt tolerance by promoting MYB108A[WTBZ][STBZ]-mediated ethylene biosynthesis in grapevines[J]. Horticulture Research,2019,6:114.
[79]Li Z Y,Ma Z W,van der Kuijp T J,et al. A review of soil heavy metal pollution from mines in China:pollution and health risk assessment[J]. Science of The Total Environment,2014,468/469:843-853.
[80]Figlioli F,Sorrentino M C,Memoli V,et al. Overall plant responses to Cd and Pb metal stress in maize:growth pattern,ultrastructure,and photosynthetic activity[J]. Environmental Science and Pollution Research,2019,26(2):1781-1790.
[81]Yadav S K. Heavy metals toxicity in plants:an overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants[J]. South African Journal of Botany,2010,76(2):167-179.
[82]Gu Q,Chen Z P,Yu X L,et al. Melatonin confers plant tolerance against cadmium stress via the decrease of cadmium accumulation and reestablishment of microRNA-mediated redox homeostasis[J]. Plant Science,2017,261:28-37.
[83]Hodzic E,Galijasevic S,Balaban M,et al. The protective role of melatonin under heavy metal-induced stress in Melissa officinalis L.[J]. Turkish Journal of Chemistry,2021,45(3):737-748.
[84]Xu L,Zhang F,Tang M J,et al. Melatonin confers cadmium tolerance by modulating critical heavy metal chelators and transporters in radish plants[J]. Journal of Pineal Research,2020,69(1):e12659.
[85]Ulhassan Z,Huang Q,Gill R A,et al. Protective mechanisms of melatonin against selenium toxicity in Brassica napus:insights into physiological traits,thiol biosynthesis and antioxidant machinery[J]. BMC Plant Biology,2019,19(1):507.
[86]Nawaz M A,Jiao Y Y,Chen C,et al. Melatonin pretreatment improves vanadium stress tolerance of watermelon seedlings by reducing vanadium concentration in the leaves and regulating melatonin biosynthesis and antioxidant-related gene expression[J]. Journal of Plant Physiology,2018,220:115-127.
[87]Vanhaelewyn L,van der Straeten D,de Coninck B,et al. Ultraviolet radiation from a plant perspective:the plant-microorganism context[J]. Frontiers in plant science,2020,11:597642.
[88]萬麗嬙,李光達,和秋蘭,等. 外源褪黑素對UV-B輻射下馬鈴薯光合、熒光特性的影響[J]. 華北農學報,2021,36(4):116-123.

