不同耐藥型的結核分枝桿菌hspX基因序列與表達的比較
楊瑜?王楠?李華?吳玲?王琪?謝貝?劉志輝?孟繁榮

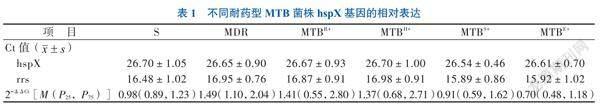
【摘要】目的 比較不同耐藥型的結核分枝桿菌(MTB)熱休克蛋白基因hspX序列與表達,初步探討hspX與MTB的耐藥是否存在相關性。方法 選取4種一線抗結核藥物全部敏感株(S)、同時對異煙肼和利福平耐藥(MDR)和一種耐藥[單耐利福平(MTBR+)、單耐異煙肼(MTBH+)、單耐鏈霉素(MTBS+)和單耐乙胺丁醇(MTBE+)]的菌株各10株,采用改良的十二烷基苯磺酸鈉裂解法和TRIzol法分別提取各組菌株的DNA和RNA,使用特異性引物進行PCR和實時熒光定量PCR確定hspX基因的存在及其表達。對 PCR 產物進行測序以檢查正向和反向的多態性,并用DNAman軟件進行與標準株H37Rv序列比對。以敏感菌株(S)組為對照組進行兩兩對比分析不同耐藥型的MTB菌株hspX表達的差異。結果 PCR成功獲得各組特異性的hspX基因,與H37Rv序列比對具有97%~99%的同一性,無存在明顯差異;以相對定量2-ΔΔCt法計算獲得S、MDR、MTBR+、MTBH+、MTBS+和MTBE+菌株hspX的表達分別為0.98(0.89,1.23)、1.49(1.10,2.04)、1.41(0.55,2.80)、1.37(0.68,2.71)、0.91(0.59,1.62)和0.70(0.48,1.18)。
以敏感菌株(S)組為對照組,不同耐藥型菌株組與其比較,hspX表達差異均無統計學意義(P均> 0.05)。結論 hspX基因在MTB中是保守的。在自然狀態下,hspX基因在MTB的耐藥性方面無明顯相關性。
【關鍵詞】結核分枝桿菌;熱休克蛋白;hspX基因;耐藥性
Comparison of hspX gene sequence and expression in Mycobacterium tuberculosis with different drug resistance types Yang Yu, Wang Nan, Li Hua, Wu Ling, Wang Qi, Xie Bei, Liu Zhihui, Meng Fanrong. Institute of Pulmonary Diseases, Guangzhou Chest Hospital, State Key Laboratory of Respiratory Disease, Guangzhou 510095,China
Corresponding author,Meng Fanrong, E-mail: rendong.mfr@163.com
【Abstract】Objective To preliminarily explore whether there is a correlation between heat shock protein gene hspX and drug resistance of Mycobacterium tuberculosis (MTB) by comparing the sequence and expression of hspX in MTB with different drug resistance types. Methods Ten strains sensitive to all four first-line anti-tuberculosis drugs (S), one drug resistance (rifampicin-resistant MTBR+, isoniazid-resistant MTBH+, streptomycin-resistant MTBS+ and ethambutol-resistant MTBE+) and multidrug resistance (MDR) to isoniazid and rifampicin were selected, respectively. The DNA and RNA of strains in each group were extracted by modified SDS lysis method and TRIzol method, respectively. The existence and expression of hspX gene were determined by PCR and RT-PCR using specific primers. PCR products were sequenced to check the forward and reverse polymorphism, and DNAman software was employed to compare the sequence with the standard strain H37Rv. The difference in the expression of hspX among MTB strains with different drug resistance types was analyzed by pairwise with the sensitive strain group as the control group. Results The specific hspX gene was successfully obtained by PCR. The hspX gene sequence was 97%-99% identical with H37Rv, and there was no significant difference. The mean expression level of hspX through relative quantitation 2-ΔΔCt in S, MDR, MTBR+, MTBH+, MTBS+ and MTBE+ strains was calculated as 0.98(0.89, 1.23), 1.49(1.10, 2.04), 1.41(0.55, 2.80), 1.37(0.68, 2.71), 0.91(0.59, 1.62)
and 0.70(0.48, 1.18), respectively. There was no significant difference in the expression of hspX among different drug-resistant strains groups when the sensitive strain group was regarded as the control group (all P > 0.05). Conclusion The hspX gene is conserved in MTB. In natural state, there is no significant correlation between hspX gene and drug resistance of MTB.
【Key words】Mycobacterium tuberculosis; Heat shock protein; hspX gene; Drug resistance
目前,一般認為結核分枝桿菌(MTB)對一、二線抗結核藥物耐藥主要源自藥物靶基因的改變,但是目前所發現的基因不能全面解釋耐藥性,仍有耐藥株未測得相應靶基因突變,機制未明[1-2]。抗菌素在許多水平上影響細菌的反應,除了突變引起的獲得性耐藥性外,應激反應、細胞壁不通透性、外排泵的活性、分枝桿菌酶對抗生素的修飾和基因表達的調節,這些都是有主導蛋白參與的耐藥可能機制[3-4]。對于應激調控的熱休克蛋白(HSP)可能也影響到MTB的藥物敏感性[5]。HSP是一組結構高度保守的蛋白,它普遍存在于細菌、真核生物,屬于分子伴侶的超家族,是細胞蛋白質量控制機制的組成部分,被認為是抵御危害細胞蛋白質組的第一道防線[6]。目前還沒有明確的研究表明熱休克蛋白是否直接或間接地在授予耐藥性方面發揮了作用。本研究旨在通過比較不同耐藥型MTB的HSP16.3基因hspX序列的表達,初步探討hspX與MTB的耐藥相關性。
材料與方法
一、材 料
1.菌 株
實驗所用的MTB菌株均源于我院的MTB菌株庫。菌株均已通過生化和分子方法鑒定為結核桿菌以及通過臨床藥敏診斷實驗鑒定為“敏感株(S)”“耐多藥(同時對異煙肼和利福平耐藥)株(MDR)”“單耐利福平株(MTBR+)”“單耐異煙肼株(MTBH+)”“單耐鏈霉素株(MTBS+)”和“單耐乙胺丁醇株(MTBE+)”。
2.試劑與儀器
TRIzol(200 mL)、逆轉錄試劑盒(High-Capacity cDNA Reverse Transcription Kits)、熒光定量PCR試劑盒為美國Thermo有限公司產品。Middlebrook 7H9/7H10培養基由美國BD公司生產。細菌超聲分散儀BACspreaderTM 1100(體必康)、微量分光光度計(Thermo)、MP快速樣品制備儀、熒光定量PCR儀ABI Vin7、凝膠成像系統儀(BioRad)、細菌培養箱等。
二、方 法
1.菌株復蘇
-80 ℃冰箱里取出上述各類型的凍存菌各10株,置水浴箱快速解凍,吸取1 mL轉接于約7 mL新鮮配置的7H9液體培養基1周,而后取200 ?L菌液涂布于自制的斜面7H10固體培養基,置于37 ℃培養箱2~3周。后續刮取斜面培養物各接種培養3管用于實驗研究。
2. DNA提取與鑒定
于斜面固體培養基中刮取濕重約20 mg的菌苔,置于1 mL磷酸鹽緩沖液打散重懸,室溫以10 000 r/min離心1 min,棄上清,加入600 ?L含有蝸牛酶的反應液,37 ℃水浴過夜。菌壁裂解充分后,按試劑盒的說明步驟依次加樣進行,包括去除菌蛋白、洗脫雜質、異丙醇沉淀DNA,最后50 ?L TE緩沖液溶解DNA。取1 ?L DNA樣品進行濃度檢測。使用針對hspX全基因片段的引物(上游:5′-TCAAAGGCATCCGTTTCCATCG-3′;下游:5′-GGTGGACCGGATCTGAATGTGC-3′)進行PCR擴增,1.5%的瓊脂糖凝膠電泳進行條帶鑒定。
3. RNA提取與擴增表達
取各組對數生長期的培養菌液10 mL,調整濃度約為1麥氏濁度,室溫以10 000 r/min離心1 min,棄上清,加1 mL TRIzol液體,上下顛倒混勻,全部轉移至裂解介質管中,并置于MP快速樣品制備儀,快速振蕩30 s,冰浴2 min,重復2次。在4℃下以13 000 r/min離心15 min,取上清至RNase-free 1.5 mL EP管,加入200 ?L 氯仿,混勻,室溫靜置5 min。在4℃下以13 000 r/min離心15 min, 將上層液體轉移至另一RNase-free 1.5 mL EP管中,加入600 ?L異丙醇,60 ?L的3 mol/L NaAc (pH 5.3),10 ?L的glogen,-70 ℃條件過夜。在4℃下以13 000 r/min離心15 min, 棄上清,加入1 mL 75% 乙醇重懸,在4 ℃下以13 000 r/min離心5 min,小心去除液滴,自然干燥5 min, 加入40 ?L RNase-free 水溶解。取1 ?L RNA樣品進行濃度檢測。調整濃度,各樣品取10 ?L進行逆轉錄為cDNA,再使用針對hspX的特異性引物(上游:5′-TTATGGTCCGCGATGGTCAG-3′;下游:5′-AATGCCCTTGTCGTAGGTGG-3′)進行熒光定量PCR擴增,以rrs為內參基因,測得各組菌株hspX的Ct值,并進行相對定量2-ΔΔCt法表達分析,以“敏感菌株(S)”hspX基因表達為“1”標準,超過“1”兩倍的為過表達,低于“1” 的1/2為低表達。
4. hspX基因序列測序與比對
以DNA為模板的hspX全基因片段長的PCR產物送至廣州華大科技生物有限公司進行正、反向測序,獲得的所有序列與NCBI基因庫中存在的H37Rv
株的hspX基因(Gene ID:887579)序列進行比較。
三、統計學處理
采用SPSS 17.0統計軟件分析數據。根據各組菌株的hspX基因的Ct值相對表達值(2-ΔΔCt)。正態分布計量數據用表示,兩兩比較采用兩獨立樣本t檢驗或校正t檢驗,多組比較采用單因素方差分析;非正態分布計量數據用中位數(四分位數)即[M(P25,P75)]表示,兩兩比較采用兩獨立樣本秩和檢驗,多組比較采用Kruskal-Wallis H秩和檢驗。P < 0.05為差異有統計學意義。
結果
一、hspX全基因片段的鑒定
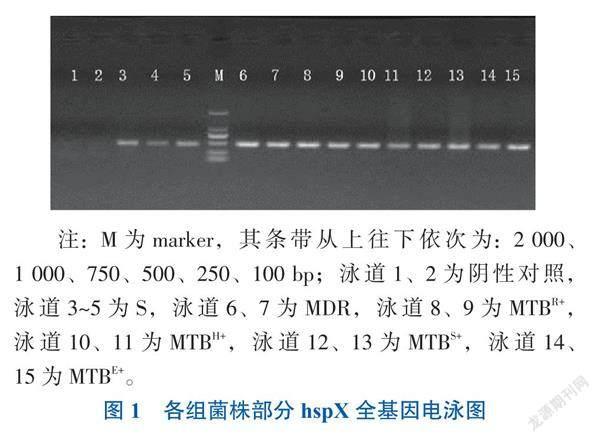
共提取了60株菌的總DNA,hspX基因全長為435 bp,PCR產物瓊脂糖凝膠電泳鑒定:條帶清晰,無雜帶,大小位于500 bp附近。見圖1。
二、各組菌株hspX基因序列與標準株H37Rv序列比對
經華大基因測序獲得各組菌株hspX基因序列,并與標準株H37Rv基因序列比對,各組序列與標準株H37Rv基因序列無差異,具有97%~99%的同一性。見圖2。
三、各組菌株hspX表達差異
經熒光定量PCR檢測各組菌株hspX基因與內參基因rrs的Ct值,測得以敏感菌株(S)組為對照的相對表達值(2-ΔΔCt)。不同耐藥型MTB各組菌株hspX基因的表達差異無統計學意義(F = 1.830,P = 0.122)。見表1
討論
近年來,HSP功能和特性的復雜性和多樣性以及它們對人類疾病的影響受到廣泛關注。在細菌中,HSP不僅能保護細胞免受非生物威脅,充當分子伴侶,還參與細菌多種生物功能,增強細菌自身毒力,是細菌抵御非生物威脅的重要蛋白[7]。HSP在藥物抵抗方面也是研究熱點。白色念珠菌HSP90蛋白協調細胞壁的補償修復機制,響應抗真菌引起的應激,參與了抗真菌耐藥性的快速發展[8-9]。Zhou等[10]通過轉錄組學比較敏感與耐藥的白色念珠菌,發現多個HSP相關基因(HSP12和HSP90)在抗耐藥菌株中表達上調。在MTB中,HSP70是一種 ATP 依賴性分子伴侶蛋白,針對HSP70的變構抑制劑能夠提高氨基糖苷類抗菌藥物的療效并降低對一線結核病藥物利福平的耐藥性[11]。
在MTB被巨噬細胞吞噬后,HSP16.3暴露于應激(低氧)壓力下,由兩個傳感器激酶(如DOSS和DOST)組成的雙組分系統被激活,調節劑DOSR磷酸化,HSP16.3表達上調[12]。與其他HSP一樣,HSP16.3是MTB重要生存毒力蛋白,低氧休眠時其高表達,抑制巨噬細胞功能以至于MTB在細胞內存活,同時細胞壁增厚,是抗結核藥物抵抗的可能通路[13]。Hu等[14]用hspX缺失突變菌株(ΔhspX株)與野生菌株感染正常的BALB/C小鼠3周后,給予利福平、異煙肼和吡嗪酰胺治療14周,通過器官細菌計數,發現感染ΔhspX株的小鼠進行抗菌藥物治療后,體內細菌清除更快,提示hspX基因缺失,可能提高了體內細菌的藥物敏感性。
因此,本研究初步通過比較不同耐藥型的MTB hspX序列與表達,初步探討hspX與MTB的耐藥相關性,實驗結果表明hspX基因序列在所有結核分離株中均較為保守,在各類型臨床分離耐藥MTB中發現無明顯差異,與Seyed Majidi等[15]的研究結果一致。本研究結果還顯示單耐利福平和單耐異煙肼的菌株組hspX表達比敏感組高接近2倍,利福平和異煙肼耐藥可能跟hspX有關,盡管統計學分析表明不同耐藥型菌株與敏感株的hspX的表達量比較無明顯差異,然而該基因在藥物刺激下的表達情況未知,這也是我們后續實驗中重點的內容,我們將進行不同培養時間不同抗結核藥物刺激下MTB hspX的表達情況,同時還探討標準株H37Rv在不同抗結核藥物誘導的作用下為耐藥株的過程中hspX的表達。相似工作也有同行在進行,Nachappa等[16]通過研究暴露于抗結核藥物HSP-DnaK/ClpB分子伴侶網絡中選擇基因的表達,以評估它們在異煙肼和利福平暴露期間MTB臨床分離株的應激反應中的作用,但實驗結果因樣本量不足未能充分驗證。
總之,HSP維持細胞蛋白功能方面至關重要,它們在抗結核藥物引起宿主細胞的應激壓力的影響尚不清楚。關于MTB的HSP對抗結核藥物的適應性反應的研究將有助于我們更好地了解抗結核藥物的作用機制和耐藥性。這些知識可以為治療MTB提供新的靶點,并用于開發新藥或增強劑,以提高現有的抗結核藥物的敏感性。
參 考 文 獻
[1] Nguyen Q H, Contamin L, Nguyen T V A, et al. Insights into the processes that drive the evolution of drug resistance in Mycobacterium tuberculosis. Evol Appl, 2018, 11(9): 1498-1511.
[2] 陳昕昶,陳嘉臻,張文宏.抗結核藥物及其耐藥相關突變位點的研究進展.微生物與感染, 2019, 14(2): 106-112.
[3] Briffotaux J, Liu S, Gicquel B. Genome-wide transcriptional responses of Mycobacterium to antibiotics. Front Microbiol,2019, 10: 249.
[4] Nasiri M J, Haeili M, Ghazi M, et al. New insights in to the intrinsic and acquired drug resistance mechanisms in mycobacteria. Front Microbiol, 2017, 8: 681.
[5] Jee B, Kumar S, Yadav R, et al. Ursolic acid and carvacrol may be potential inhibitors of dormancy protein small heat shock protein16.3 of Mycobacterium tuberculosis. J Biomol Struct Dyn,2018, 36(13): 3434-3443.
[6] Carra S, Alberti S, Benesch J L P, et al. Small heat shock proteins: multifaceted proteins with important implications for life. Cell Stress Chaperones, 2019, 24(2): 295-308.
[7] Weidmann S, Maitre M, Laurent J, et al. Production of the small heat shock protein Lo18 from Oenococcus oeni in Lactococcus lactis improves its stress tolerance. Int J Food Microbiol, 2017, 247: 18-23.
[8] Lamoth F, Juvvadi P R, Steinbach W J. Heat shock protein 90 (Hsp90): a novel antifungal target against Aspergillus fumigatus. Crit Rev Microbiol, 2016, 42(2): 310-321.
[9] Lee Y, Puumala E, Robbins N, et al. Antifungal drug resistance: molecular mechanisms in Candida albicans and beyond. Chem Rev, 2021, 121 (6): 3390-3411.
[10] Zhou W, Li X, Lin Y, et al. A comparative transcriptome between anti-drug sensitive and resistant Candida auris in China. Front Microbiol, 2021, 12: 708009.
[11] Hosfelt J, Richards A, Zheng M, et al. An allosteric inhibitor of bacterial Hsp70 chaperone potentiates antibiotics and mitigates resistance. Cell Chem Biol, 2022, 29(5): 854-869.e9.
[12] Jee B, Singh Y, Yadav R, et al. Small heat shock protein16. 3 of Mycobacterium tuberculosis: after two decades of functional characterization. Cell Physiol Biochem, 2018, 49(1): 368-380.
[13] Yang L, Zhang C, Zhao Y, et al. Effects of Mycobacterium tuberculosis mutant strain hsp16.3 gene on murine RAW 264.7 macrophage autophagy. DNA Cell Biol, 2018, 37(1): 7-14.
[14] Hu Y, Liu A, Menendez M C, et al. HspX knock-out in Mycobacterium tuberculosis leads to shorter antibiotic treatment and lower relapse rate in a mouse model–a potential novel therapeutic target. Tuberculosis, 2015, 95(1): 31-36.
[15] Seyed Majidi A, Bazzazi H, Zamani S, et al. Comparison of hspX gene sequence in the Beijing and non-Beijing Mycobacterium tuberculosis. J Clin Tuberc Other Mycobact Dis,2020, 21: 100187.
[16] Nachappa S A, Neelambike S M, Ramachandra N B. Differential expression of the Mycobacterium tuberculosis heat shock protein genes in response to drug-induced stress. Tuberculosis(Edinb),2022, 134: 102201.
(收稿日期:2022-12-25)
(本文編輯:楊江瑜)

