改良后腹膜優(yōu)先原位腹腔鏡胰十二指腸切除術的短期效果評價
袁琪,張輝,周文策1,
(1.蘭州大學第一臨床醫(yī)學院 普通外科,甘肅 蘭州 730099;2.蘭州大學第二醫(yī)院 普通外科,甘肅 蘭州 730030;3.河西學院附屬張掖人民醫(yī)院 普通外科,甘肅 張掖 734000)
隨著微創(chuàng)器械的改進與外科手術經驗的積累腹腔鏡胰十二指腸切除術(laparoscope pancreaticoduodenectomy,LPD)已逐漸被各大胰腺外科中心所接受,其安全性和可行性也被大家所認可[1]。LPD逐漸由傳統(tǒng)的靜脈入路衍生出如動脈入路優(yōu)先甚至多入路聯(lián)合的微創(chuàng)手術策略[2],但動脈優(yōu)先入路操作較靜脈入路復雜,學習曲線長,不建議學習初期使用[3],對于壺腹部腫瘤及鉤突部較小的腫瘤靜脈入路亦可達到滿意的效果。本文針對蘭州大學第一臨床醫(yī)學院開展的改良后腹膜優(yōu)先原位腹腔鏡胰十二指腸切除術(modified peritoneal priority laparoscopic pancreaticoduodenectomy,MPPLPD)與傳統(tǒng)腹腔鏡胰十二指腸切除術(traditional laparoscopic pancreaticoduodenectomy,TLPD)的療效進行對比,現總結如下。
1 資料和方法
1.1 一般資料
回顧性分析我院普通外科2017年1月至2022年7 月成功施行的15 例MPPLPD患者及62 例TLPD患者臨床資料。納入標準:(1)年齡18~80周歲;(2)術后病理檢查證實為壺腹占位及壺腹周圍占位性病變;(3)未發(fā)現遠處臟器轉移;(4)臨床資料完整。排除標準:(1)術中因心、腦等意外事件終止手術;(2)術中發(fā)現遠處臟器轉移行姑息性切除;(3)術中單純行病灶切除術;(4)麻醉開始評估心肺功能后中轉開腹。本研究通過蘭州大學第一醫(yī)院倫理委員會批準(批號:LDYYLL2023-51)。
1.2 手術方法
MPPLPD:首先探查腹腔,觀察是否有腹腔廣泛轉移。游離結腸肝曲系膜并下降橫結腸。提起橫結腸及其系膜根部,透見十二指腸(圖1A)。沿十二指腸長軸橫行切開結腸系膜,向頭側分離顯露下腔靜脈,分離十二指腸與下腔靜脈間隙(圖1B),向右側完全游離并抬起十二指腸二、三段,打開胰腺下緣,暴露腸系膜上靜脈(superior mesenteric vein,SMV)。提起十二指腸向足側分離胰頭及鉤突周圍組織使其完全游離(圖1C),謹慎分離胰十二指腸下靜脈,離斷胰頭鉤突血管。打開胰腺上緣,清掃腹腔干、肝總動脈旁淋巴結,結扎并離斷胃十二指腸動脈(gastroduodenal artery,GDA)。打開小網膜孔,結扎胃右動脈及胃網膜右動脈后使用直線切割吻合器橫斷胃。距屈式韌帶15 cm橫斷空腸,游離近端空腸與上面會師(圖1D),抽出徹底游離的十二指腸及空腸近段,結扎胰十二指腸下動脈(inferior pancreaticoduodenal artery,IPDA)后離斷胰腺,結扎胰十二指腸下靜脈(inferior pancreaticoduodenal vein,IPDV)。游離膽囊并解剖第一肝門,解剖膽總管及門靜脈(portal vein,PV),將肝動脈及肝十二指腸韌帶淋巴結清掃后使其骨骼化,于膽管匯合處下段約1.5 cm處離斷肝總管,此時胃遠端、十二指腸、膽總管、膽囊、胰頭及部分空腸的上段均被完整地切除。胰腸、膽腸吻合采用結腸后吻合方式。
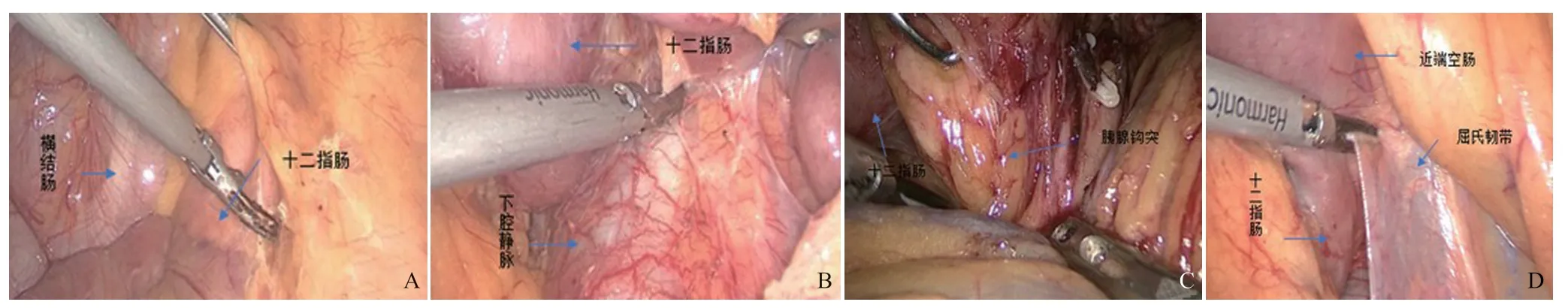
圖1 MPPLPD術中操作圖
TLPD:打開胃結腸韌帶游離胃的遠端,將胃右動脈及胃網膜右動脈結扎后使用直線切割吻合器在胃竇、胃體交界處橫斷胃。向右翻轉遠端胃,顯露肝總動脈、肝固有動脈并清除周圍淋巴結及脂肪組織,探查是否存在變異的右肝動脈,結扎GDA。自十二指腸外側腹膜將十二指腸第二、三段連同胰頭由腹膜后向胰腺頸部游離,顯露SMV、PV起始部,游離胰頭上、下緣至預定切除線,在SMV左側離斷胰腺。肝門部解剖同MPPLPD。打開屈式韌帶,游離近端空腸并距屈式韌帶15 cm處切斷空腸。此時胃遠端、十二指腸、膽總管、膽囊、胰頭及部分空腸的上段均被完整地切除。胰腸、膽腸的吻合采用結腸前吻合方式。
1.3 觀察指標
觀察患者性別、年齡、身體質量指數(BMI)、腹部手術史、術前減黃、腫瘤大小、腫瘤位置、病理分型、手術時間、術中出血量、中轉開腹率、淋巴結清掃總數目、術后住院時間、肛門排氣時間、膽瘺發(fā)生率、腹腔感染發(fā)生率、二次手術率及30 d內病死率。
1.4 統(tǒng)計學分析
使用SPSS 26.0軟件進行統(tǒng)計與分析。計量資料符合正態(tài)分布以()表示,組間比較采用t檢驗,不符合正態(tài)分布計量資料以M(P25,P75)表示,組間比較采用秩和檢驗。計數資料采用χ2檢驗或Fisher精確概率法。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 兩組術前一般資料比較
兩組患者性別、年齡、BMI、腹部手術史、術前減黃、ASA分級等情況比較,組間差異無統(tǒng)計學意義(P>0.05)。見表1。
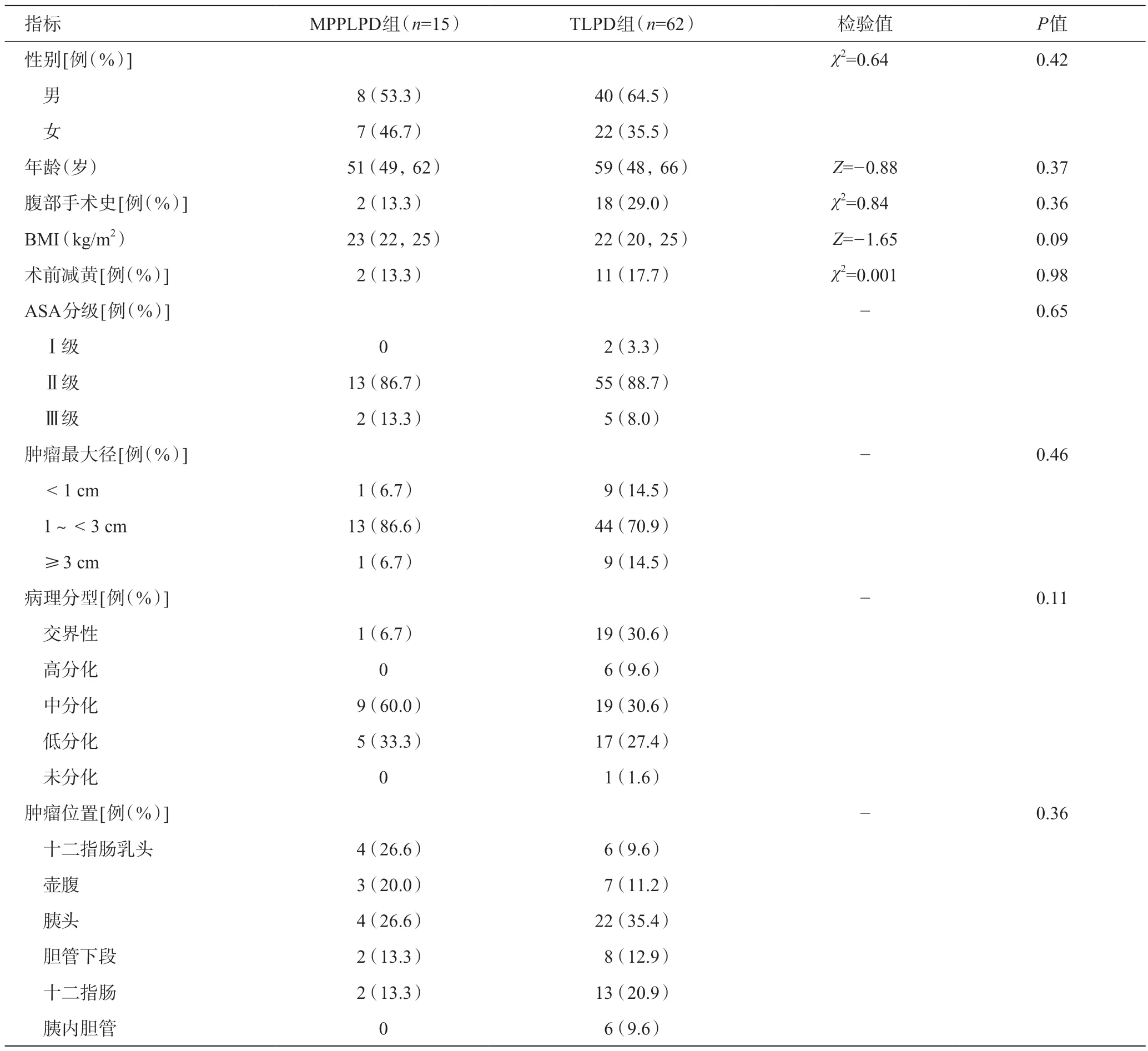
表1 兩組患者術前一般資料比較
2.2 兩組術中資料比較
兩組在手術時間、術中出血量、中轉開腹方面差異無統(tǒng)計學意義(P>0.05)。與TLPD組比較,MPPLPD組淋巴結清掃數量多 [24(8,28)vs12(8,19),P<0.05],尤以胰頭后方淋巴結 [0(0,2)vs0(0,0),P<0.05],后腹膜淋巴結 [3(0,10)vs0(0,4),P<0.05]清掃數量為著。在腸系膜上動脈周圍淋巴結、肝總動脈前淋巴結、門靜脈旁淋巴結、胰周淋巴結清掃數量方面兩組差異無統(tǒng)計學意義(P>0.05)。見表2。
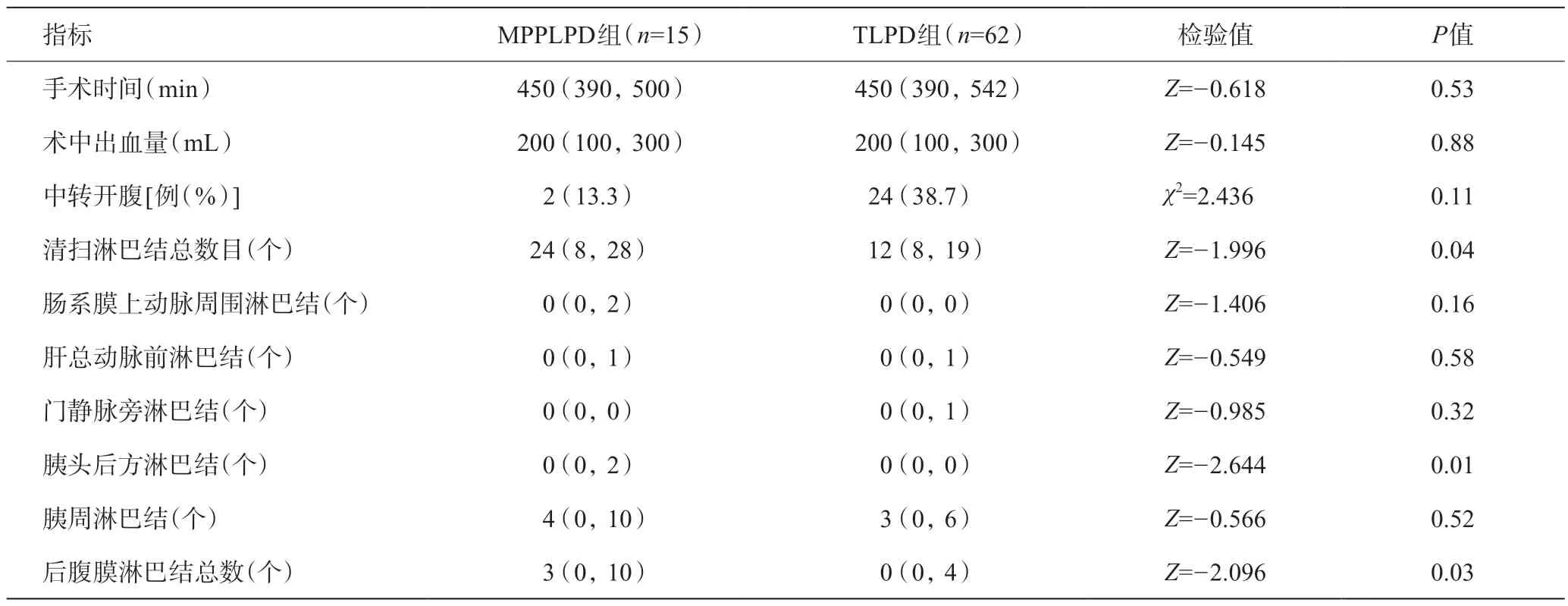
表2 兩組患者術中資料比較
2.3 兩組術后資料比較
兩組患者術后住院時間、肛門排氣時間、膽瘺發(fā)生率、腹腔感染發(fā)生率、二次手術及30 d內病死率差異無統(tǒng)計學意義(P>0.05),MPPLPD組消化道排空障礙3例,A級2例,C級1例,TLPD組21例,其中A級10例,B級7例,C級4例,兩組B/C級消化道排空障礙差異有統(tǒng)計學意義(P<0.05)。MPPLPD組經口進食時間較TLPD組明顯縮短 [4(2,6)dvs7(5,10)d],差異具有統(tǒng)計學意義(P<0.05)。MPPLPD組B/C級胰瘺發(fā)生率低于TLPD組,但差異無統(tǒng)計學意義(P=0.07)。見表3。
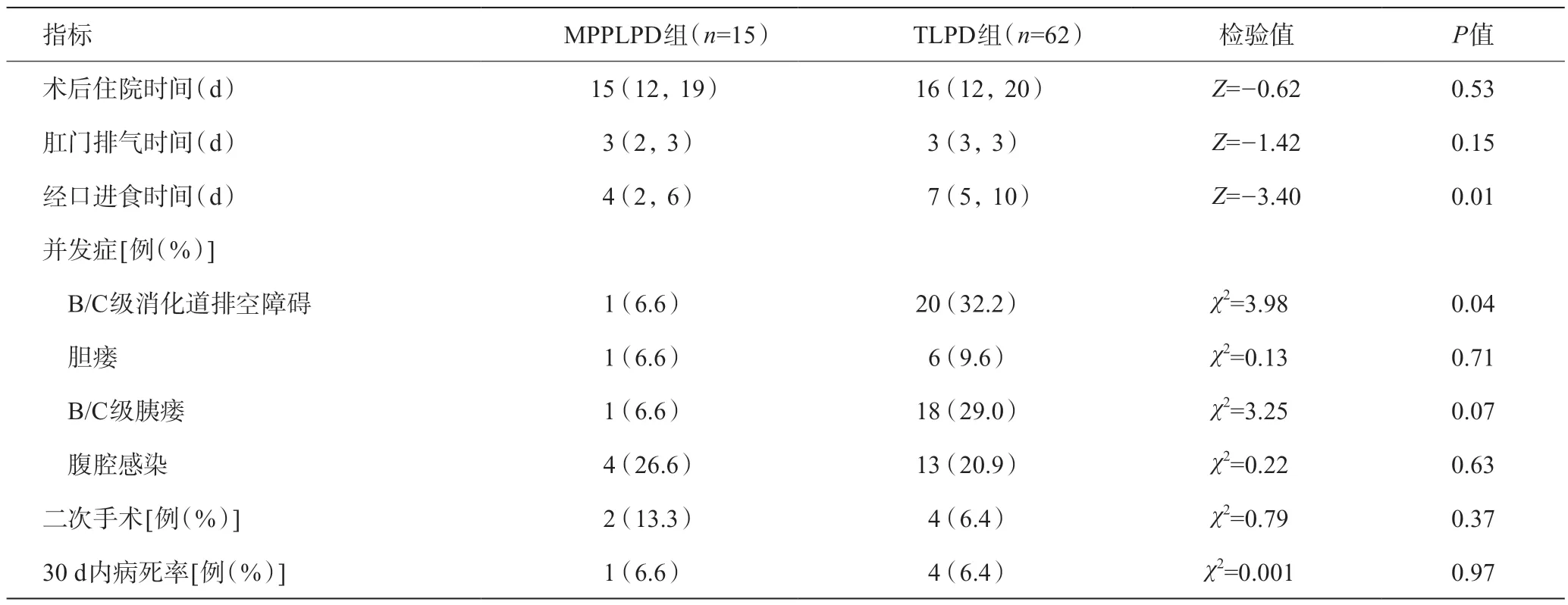
表3 兩組患者術后資料比較
3 討論
對LPD手術入路及手術操作步驟的優(yōu)化目的是增加手術安全性、簡化手術操作及降低圍手術期并發(fā)癥發(fā)生率。本文針對MPPLPD手術優(yōu)勢、后腹膜淋巴結清掃的臨床意義進行了討論與說明。
3.1 MPPLPD的優(yōu)勢
3.1.1 MPPLPD空間顯露優(yōu)勢主要體現在以下幾方面:(1)主刀右側站位更符合十二指腸解剖過程自右向左的解剖過程以及由上向下、由足側向頭側的LPD切除視野;(2)打開的結腸系膜孔可作為空腸遠端與胰腺及膽管行結腸后吻合時的通路,避免在結腸系膜上另行開孔,節(jié)省時間,且經此孔上提的空腸近端位置正是原十二指腸的位置,更加接近生理解剖結構;(3)部分橫結腸系膜在十二指腸表面附著,且Henle靜脈干位于橫結腸系膜根部[4],對結腸肝曲系膜的游離有利于打開Kocher切口后手術操作視野的顯露,如削弱結腸后入路對十二指腸背側顯露空間過于狹小的弊端,其次對胰頭后方動、靜脈血管叢顯露及后腹膜淋巴結清掃有一定益處。本研究胰頭后方淋巴結、門靜脈后方淋巴結及后腹膜淋巴結清掃總數目都優(yōu)于TLPD組。
3.1.2 MPPLPD對消化道排空的影響小:TLPD胰腸、膽腸吻合多采用結腸前吻合方式,MPPLPD采用結腸后吻合方式,盡管在本研究中兩組患者消化道排空障礙總體發(fā)生率差異無統(tǒng)計學意義(P>0.05),但MPPLPD組B/C級消化道排空障礙發(fā)生率低于TLPD組,差異具有統(tǒng)計學意義(P<0.05)。有研究發(fā)現結腸后較結腸前十二指腸空腸吻合術發(fā)生消化道排空障礙風險更高,認為結腸前重建增加了胃的流動性,并為殘胃與胰腺提供了屏障,可以減少胰腺瘺可能帶來的負面影響[5],但在本研究中結腸后吻合發(fā)生消化道排空障礙的風險更低,結腸后吻合是否更利于術后胃腸功能的恢復,仍需更多的臨床數據進行驗證。消化道排空障礙發(fā)生率在15%~40%之間[6-7],是PD術后患者住院時間延長的最主要原因[8]。消化道排空障礙的發(fā)生不但增加了費用,也影響了患者的生存質量[5],積極探索其發(fā)生的原因對改善患者生存質量有一定的幫助。
3.2 后腹膜淋巴結清掃的意義
早期血行播散、周圍神經浸潤及腹膜后淋巴結高轉移率是擴大PD并不能改善胰腺癌患者遠期生存的重要原因[9],根治性PD聯(lián)合后腹膜神經、淋巴及軟組織清掃術可有效清除受腫瘤侵犯的淋巴結和神經組織,從而提高患者長期生存率[10]。后腹膜淋巴結清掃對胰腺癌長期預后的影響研究較少,但對后腹膜器官如腎盂、輸尿管上、中段腫瘤,通過后腹膜淋巴結清掃可降低局部微轉移,提高無復發(fā)生存率[11-12]。胰腺癌淋巴結轉移20%~25%在胰前部,30%~40%位于胰后,60%位于腹膜后間隙、腸系膜動脈根部和腹主動脈側,若不能徹底解剖腹膜后神經、淋巴組織,殘留的淋巴、神經組織易被腫瘤細胞浸潤[13]。Adham等[14]描述了從胰頭后、腸系膜上靜脈/門靜脈延伸到腹腔干和腸系膜上動脈的三角空間,并提出了整塊根治性切除的技術,在實際應用中,三角空間對應胰外神經叢,包括淋巴管和淋巴結[15],并強調該手術是“以血管為導向的胰頭切除術”[16]。胰腺導管腺癌術后局部復發(fā)的區(qū)域對應于“三角區(qū)”[17],在開放性PD中,三角空間內組織和淋巴結清掃術可在不增加術后并發(fā)癥和病死率的情況下,增加淋巴結清掃數量及降低切緣陽性率[18]。因此,在PD術中對后腹膜淋巴結的清掃不容忽視。
3.3 本研究的局限與不足
本研究的局限性如下:(1)MPPLPD組手術醫(yī)師擁有豐富的微創(chuàng)手術經驗及數十例TLPD手術操作經驗,而TLPD組來源于多個胰腺外科診療組,兩組患者數據比較難免出現偏倚;(2)雖然統(tǒng)計了每個區(qū)域解剖的淋巴結數量并進行了類比,但缺乏相關的長期預后數據,如無病生存期和總生存期,無法對兩組患者的長期預后進行比較;(3)本研究樣本量較少且為回顧性分析,因此仍需更多的臨床數據加以驗證。
4 小結
中國胰腺癌診療指南(2021 版)已對PD的淋巴結清掃標準做了較為詳細的描述[19]。對于PD擴大淋巴結清掃術能否給患者帶來更好的生存效益尚無定論[20],有研究認為擴大淋巴結清掃術局部復發(fā)率更高,而術后輔助治療是患者獲得良好預后的關鍵因素,通過術后化療來降低局部復發(fā)率較擴大范圍的淋巴結清掃更為重要[21],也有研究顯示應根據腫瘤的具體位置選擇最佳的淋巴結切除范圍[22]。本研究通過兩種術式短期臨床效果的比較分析了MPPLPD手術操作及對后腹膜淋巴結清掃的優(yōu)勢,對于后腹膜淋巴結清掃能夠給胰腺癌患者帶來遠期生存的益處仍需大量的臨床數據,希望本文能給胰腺外科工作者提供一定的參考價值。

