早產兒支氣管肺發育不良與25(OH)D的關系及治療方式的探討
雷瑞瑞,張新,張劍,張藝森
駐馬店市中心醫院新生兒科,駐馬店 463000
支氣管肺發育不良(bronchopulmonary dysplasia,BPD)是早產兒常發生的并發癥之一,易并發哮喘、呼吸道感染及神經系統發育障礙,可嚴重影響早產兒健康[1]。該病在出生體重≤1500g 的早產兒中具有較高的發病率,探究BPD 的發病機制及危險因素對于該病的預防及早期治療至關重要[2-3]。相關研究發現[4-6],維生素D 缺乏可引起多種肺部疾病,可能的機制是維生素D 缺乏影響了肺表面活性物質的合成及肺泡化進程,進而影響了肺功能。研究顯示[7],血清25 羥維生素D[25-hydroxy-vitamin D,25(OH)D]水平低下的早產兒較易出現呼吸窘迫綜合征。也有研究提示維生素缺乏易引發哮喘[8]。如何合理防治BPD 是臨床關注的熱點問題,隨著臨床機械通氣策略的改進及糖皮質激素的應用,早產兒存活率明顯增加。但采用糖皮質激素治療BPD 尚存在一定爭議,其雖然能夠有效改善肺功能,但也可能會引起神經系統發育不良,在用藥時需要權衡利弊[9]。本研究分析了早產兒BPD 發生與25(OH)D 的關系,探討霧化吸入布地奈德+機械通氣治療的效果以及并發癥,以期為明確BPD 的發病機制及治療方法提供參考依據。
1 資料與方法
1.1 一般資料
回顧性選取某院2020年1月~2021年12月早產兒病房收治的確診為BPD 的早產兒86 例作為BPD 組,選取同期出生且支氣管發育正常的早產兒90 例作為對照組。兩組早產兒的分娩體重、胎齡、性別構成等一般資料比較無統計學差異(P>0.05),具有可比性(表1)。
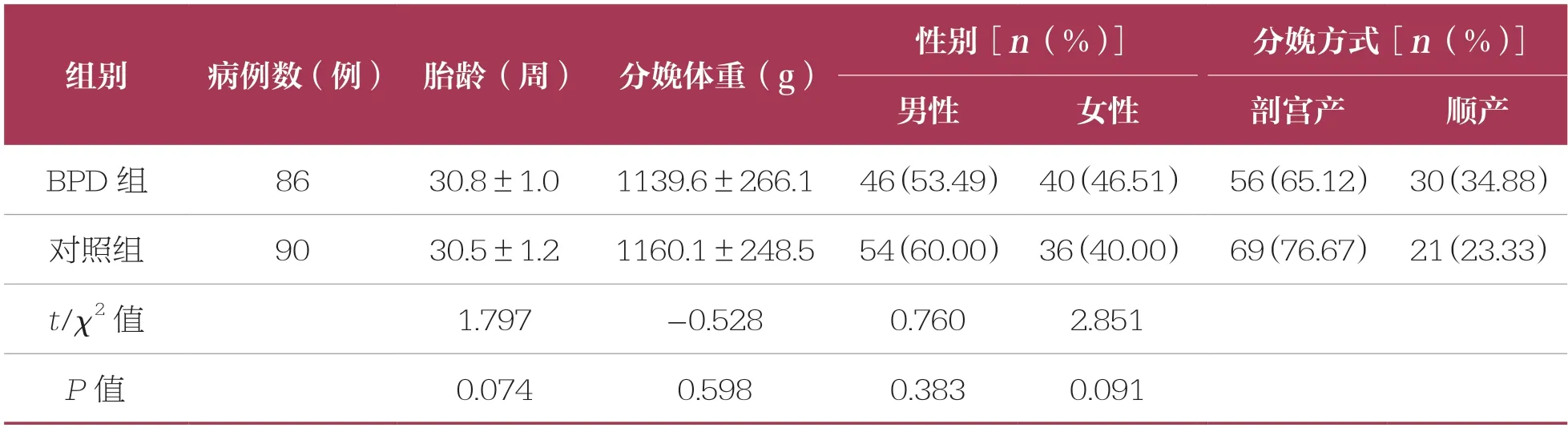
表1 兩組一般資料比較
納入標準:①分娩胎齡<32 周,出生體重≤1500g 者。②依據《實用新生兒學》[10]的診斷標準確診為BPD 者。③對任何氧療依賴度>21%者。④病情程度屬于中重度者。⑤住院時間超過28 天者。⑥均為該院分娩的早產兒。
排除標準:①支氣管、肺部畸形者。②染色體缺陷者。③先天性心臟病者。④具有基礎的肝腎功能疾病、甲狀腺功能疾病者。⑤伴有其他系統的重大疾病者。
1.2 治療方法
根據早產兒治療過程中是否使用布地奈德將BPD 組分為A 組和B 組。兩組早產兒入院后給予機械通氣,采取同步間歇指令通氣模式,參數:吸氣峰壓(peak inspiratory pressure,PIP) 22~18cmH2O、呼吸頻率(respiratory rate,RR) 40~60次/min、呼氣末正壓通氣(positive end expiratory pressure,PEEP) 5~6cmH2O,吸氧濃度(fraction ofinspiration O2,FiO2) 30%~80%。
A 組在上述治療的基礎上取0.5mg 吸入用布地奈德混懸液(Astra Zeneca Pty Ltd,國藥準字H20140475,規格2ml∶1ml)加入生理氯化鈉溶液(石家莊四藥有限公司,國藥準字H20066533,規格500ml∶4.5g)2ml 置于霧化器內,在氧氣驅動下進行霧化吸入治療,每次10min,結束后去除殘留藥液。bid,共治療10 天。B 組不使用其他類型糖皮質激素。兩組早產兒可適當補充維生素D。
1.3 觀察指標
(1)對比兩組早產兒出生時(0 天)、出生后14天、出生后28 天血清25(OH)D 水平:留取早產兒靜脈血2ml,LD4-2A 離心機(北京醫用離心機廠)以2000r/min 離心10min(4℃)后留取血清待測,采用電化學發光免疫分析法測定25(OH)D 水平。試劑盒(英國IDS 艾狄斯公司)。血清25(OH)D<30nmol/L 即認為是維生素D 缺乏;在30~49.9nmol/L范圍認為是維生素D 不足,>50nmol/L 即維生素D充足。
(2)BPD 早產兒的病情程度參考《實用新生兒學》[10]中的診斷標準:①輕度:胎齡<32 周,早產兒糾正胎齡36 周或出院時已經不需要吸氧。②中度:胎齡<32 周,早產兒糾正胎齡達到36 周時,因病情需要繼續吸氧,FiO2<30%。③重度:胎齡<32 周,早產兒糾正胎齡達到36 周,因病情較為嚴重需要繼續吸氧,FiO2≥30%和(或)持續氣道正壓通氣(continuous positive airway pressure ventilation,CPAP)或機械通氣。
(3)對比BPD 早產兒治療前(0 天)、治療14天、治療28 天的PIP、平均氣道壓(mean airway pressure,MAP)、FiO2、動脈血二氧化碳分壓(arterial blood carbon dioxide partial pressure,PaCO2)水平。
(4)記錄并統計兩組早產兒治療期間發生早產兒視網膜病、敗血癥、顱內感染、早產兒壞死性小腸結腸炎、膽汁淤積、腦白質軟化等不良反應發生情況。
1.4 統計學方法
采用SPSS21.0 軟件進行數據統計學分析。計量資料以±s 表示,組間對比假設檢驗采用獨立樣本t檢驗;重復測量的數據組間比較采用重復測量方差分析法,任意時間點之間兩兩比較采用LSD-t檢驗;計數資料以n(%)表示,組間對比分析用χ2檢驗。P<0.05 為具有統計學差異。
2 結果
2.1 兩組早產兒血清25(OH)D 水平比較
BPD 組早產兒在出生時、出生后14 天、出生后28 天血清25(OH)D 水平均低于對照組,具有統計學差異(P<0.05)(表2)。
表2 兩組早產兒血清25(OH)D 水平比較 ±s,nmol/L

表2 兩組早產兒血清25(OH)D 水平比較 ±s,nmol/L
組別病例數(例)出生時出生后14 天出生后28 天對照組9033.20±5.9462.41±8.7884.02±12.48 BPD 組8627.65±4.8155.28±9.5077.81±10.54 t 值-6.794 -5.174 -3.558 P 值 0.000 0.000 0.000
2.2 不同病情程度的B P D 早產兒血清2 5(O H)D 水平比較
86 例BPD 早產兒中有中度BPD 早產兒57 例、重度BPD 早產兒29 例。重度組早產兒在出生時、出生后14 天、出生后28 天的血清25(OH)D 水平低于中度組,具有統計學差異(P<0.05)(表3)。
表3 不同病情程度的BPD 早產兒血清25(OH)D 水平比較 ±s,nmol/L
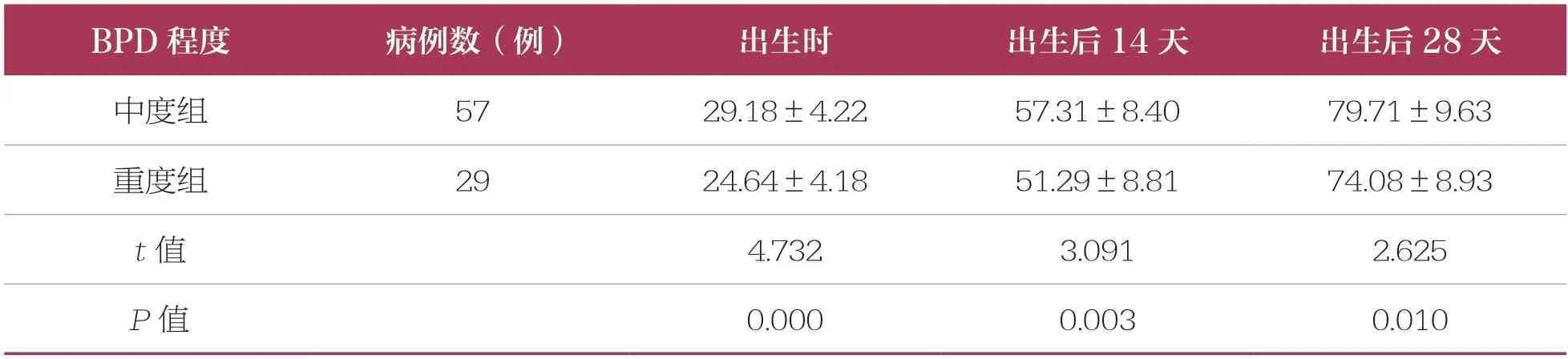
表3 不同病情程度的BPD 早產兒血清25(OH)D 水平比較 ±s,nmol/L
BPD 程度病例數(例)出生時出生后14 天出生后28 天中度組5729.18±4.2257.31±8.4079.71±9.63重度組2924.64±4.1851.29±8.8174.08±8.93 t 值4.7323.0912.625 P 值0.0000.0030.010
2.3 不同治療方式的BPD 早產兒血氣參數變化分析
A 和B 組早產兒在治療前的PIP、MAP、FiO2、PaCO2測定值比較無統計學差異(P>0.05);治療14 天、治療28 天后兩組早產兒PIP、MAP、FiO2、PaCO2測定值降低,且A 組低于B 組(P<0.05)(表4)。
表4 不同治療方式的BPD 早產兒的血氣參數變化分析 ±s

表4 不同治療方式的BPD 早產兒的血氣參數變化分析 ±s
PIP:吸氣峰壓;MAP:平均氣道壓;FiO2:吸氧濃度;PaCo2:動脈血二氧化碳分壓。與本組治療前比較,a:P<0.05
指標組別治療前治療14 天治療28 天PIP(cmH 2O)A 組(n=42)18.32±1.7214.72±1.30a11.52±1.28a B 組(n=44)18.10±1.6715.89±1.54a13.28±1.51a t 值0.602 -3.798 -5.817 P 值0.549 0.000 0.000 MAP(cmH2O)A 組(n=42)10.86±0.859.61±0.90a7.57±0.78a B 組(n=44)11.10±0.9210.66±0.98a8.52±0.81a t 值-1.255 -5.168 -5.536 P 值0.213 0.000 0.000 FiO2(%)A 組(n=42)34.40±1.6027.57±1.29a26.04±1.72a B 組(n=44)33.68±2.1230.52±1.85a28.62±1.97a t 值1.771 -8.540 -6.457 P 值0.080 0.000 0.000 PaCO2(mmHg)A 組(n=42)49.12±3.6739.56±3.37a35.81±2.90a B 組(n=44)50.18±4.3445.10±4.72a42.75±4.14a t 值-1.220 -6.238 -8.964 P 值0.226 0.000 0.000
2.4 不同治療方式BPD 早產兒并發癥發生情況
A 組早產兒在治療過程中有5 例早產兒出現并發癥,B 組有14 例出現并發癥,A 組早產兒的并發癥率(11.90%)低于B 組(31.82%),具有統計學差異(P<0.05)(表5)。

表5 并發癥發生情況對比 例
3 討論
早產兒易并發BPD,BPD 早產兒常表現為肺結構受損、持續性低氧血癥及氧氣依賴等。近年來維生素D 與肺部結構受損的關系逐漸受到關注,有利于調節胎兒肺部發育,減輕肺損傷,其缺乏時會引發哮喘、慢性阻塞性肺疾病等[11]。考慮維生素D與BPD 早產兒發病之間存在某種聯系。本研究旨在通過探究早產兒血清25(OH)D 與BPD 發生的關系,為臨床防治提供參考。
盧田甜等[12]的研究顯示,維生素D 通過調控反應元件對其受體進行調控,進而參與肺部發育。本研究中,BPD 組早產兒出生時、出生后14 天、出生后28 天的血清25(OH)D 水平低于對照組,且重度組低于中度組。提示25(OH)D 可作為預測BPD發生的重要指標,且對評估病情程度具有參考意義。分析25(OH)D 水平降低與增加BPD 發病風險的機制可能有:①無活性的維生素D 在人體中在肝、腎羥化酶的催化下生成具有活性的25(OH)D,后者在受體的作用下與維生素D 反應元件結合,起到調節維生素D 靶基因表達的作用[13]。②25(OH)D可參與肺表面蛋白質和活性磷脂合成過程,還參與肺泡上皮細胞、纖維原細胞的分化,早產兒尤其是體重較輕者的維生素D 較為缺乏[14]。不同病情程度早產兒血清25(OH)D 差異較大的原因可能是其在促進重度病變時發揮生物學作用消耗過多。基于此,本研究提出25(OH)D 缺乏會促進BPD 的發病,以期對早產兒BPD 發病機制探討及疾病管理提供思路。
如何合理防治BPD 是早產兒領域關注的重點問題,而糖皮質激素在治療BPD 的臨床應用中一直存在較大爭議,并且相關標準中肯定了糖皮質激素藥物治療早產兒BPD 的作用,但是對于激素種類、用藥途徑及并發癥防治尚無明確推薦意見,有待進一步研究[15-18]。本研究探討霧化吸入布地奈德+CPAP或機械通氣治療中重度BPD 早產兒的治療效果以及不良反應、隨訪情況,旨在為BPD 治療提供參考。
本研究結果顯示,重度組在出生時、治療14天、治療28 天的PIP、MAP、FiO2、PaCO2測定值高于中度組,具有統計學差異(P<0.05);A 和B組早產兒在治療后,PIP、MAP、FiO2、PaCO2測定值較治療前降低,且A 組低于B 組。提示采取霧化吸入布地奈德+CPAP 或機械通氣治療有利于改善BPD 早產兒血氣參數,促進BPD 早產兒恢復。布地奈德屬于一種糖皮質激素,主要發揮免疫調節作用和抗炎作用,有利于減輕肺水腫,降低早產兒對機械通氣的需求,可視為BPD 的防治用藥[19-20]。布地奈德霧化吸入后作用于氣道黏膜,在呼吸系統局部發揮較強的作用。治療后血氣參數明顯改善,提示A 組方案使得早產兒肺通氣功能得到顯著改善,有利于排出CO2。
早產兒、BPD 早產兒本身就會引起一系列并發癥,在接受治療之前就已經存在復雜并發癥的發生風險。本研究結果顯示,治療后A 組早產兒的并發癥率低于B 組。提示布地奈德可以改善早產兒的肺功能,減少呼吸做功,且不會增加治療后并發癥,具有一定安全性。BPD 的發病原因有很多,本研究的創新點是對早產兒BPD 的25(OH)D 水平變化特點進行分析,并在此基礎上探究合理的治療方案。后續還需要進一步對采取維生素D 治療能否改善BDD 病情等進行探討。
綜上所述,該院BPD 早產兒在出生時及出生后一段時間內的血清25(OH)D 水平均低于未發生BPD 的早產兒,且血清25(OH)D 不足與BPD病情嚴重程度有關;采取霧化吸入布地奈德+CPAP或機械通氣治療治療中重度BPD 早產兒有助于盡早改善呼吸機參數,促進BPD 早產兒正常生長發育。

