基于實驗證據建構認知模型的教學設計
熊娟


摘要:基于證據推理與模型認知的化學教學是課堂教學設計的重要研究內容。本文以人教版選擇性必修1“原電池”的課堂教學為例,從單液原電池的實驗現象和電流變化發現問題,引導學生從單液原電池模型逐步完善到雙液原電池、隔膜電池,深入掌握原電池的本質規律。建立從真實問題出發,獲取實驗證據為依據,構建認知模型思維模式。提高學生發現問題、解決問題的能力,培養學生“證據推理與模型認知”“科學探究與創新意識”的核心素養。
關鍵詞:實驗證據;模型認知;原電池;本質規律
文章編號:1008-0546(2023)10-0028-06
中圖分類號:G632.41
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2023.10.007
“證據推理與模型認知”是高中化學核心素養的重要組成部分。基于證據推理與模型認知的化學教學是課堂教學設計的重要研究內容。在課堂教學中培養學生證據意識,建立觀點、結論和證據之間的邏輯關系[1]是建構認知模型的重要途徑。學生通過完整的邏輯鏈證據建立的“模型認知”,構建更全面、解釋更準確、運用更靈活、衍生更廣泛。實驗證據是在實驗中發現問題或不足,通過分析或改進實驗解決問題的重要證據推理過程。在實驗改進中學生不斷完善認知模型,建立多重模型認知。本文以人教版選擇性必修1“原電池”教學為例,設計基于實驗證據建構認知模型的課堂教學,提高學生發現問題、解決問題的能力,培養學生“證據推理與模型認知”“科學探究與創新意識”的核心素養。
一、教學內容和教學現狀分析
原電池的基本概念和工作原理是人教版必修第二冊第六章第一節“化學反應與能量變化”中的必備核心知識。學生具備單液原電池的模型認知和電極反應的符號表征能力。但對于原電池仍有認識偏差,如以為鋅和稀硫酸必須接觸才能引發原電池反應產生電流等等。人教版選擇性必修1第四章第一節“原電池”直接提出單液原電池電流會逐漸衰減,引入銅一鋅雙液原電池,組織學生展開一系列的“思考與討論”[2],發展學生對原電池工作原理的認識,建立原電池過程的系統分析思路,提高學生對原電池本質的認識。[1]
筆者在教學中發現三個問題:①學生對銅一鋅雙液原電池實驗未做,停留在看視頻實驗階段,對于鹽橋陌生且存疑。②銅一鋅雙液原電池是針對單液原電池的不足中改進而來,銅一鋅雙液原電池是否也有不足,沒有進一步的探究討論。③單液原電池和雙液原電池的模型是直接建構的,重點解釋原電池的工作原理,忽視模型認知的證據推理過程。
二、課堂教學改進
1.利用數字電流傳感器,實時監測原電池中電流的變化。通過可視化的電流變化探析微觀電子定向移動。在監測電流的變化中發現問題,引導學生解決問題,通過實驗證據構建多重原電池認知模型。
2.自主設計隔膜原電池。雙液原電池存在電流小、鹽橋配制不方便和存放時間短等不足,引導學生解決問題,設計隔膜電池,增大接觸面積,增大電流且使用方便。培養學生科學探究和創新意識的核心素養。
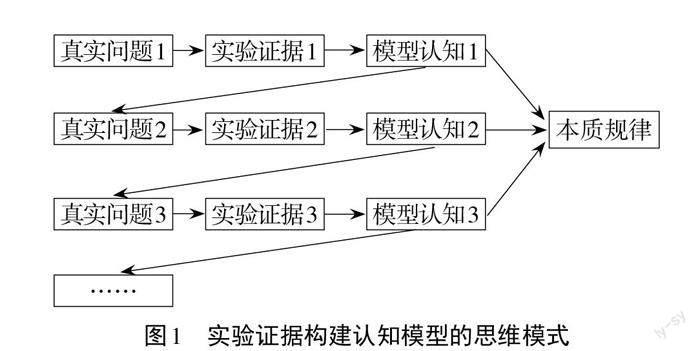
3.建構“實驗證據與模型認知”逐級發展思維模式(圖1)。
三、教學目標
1.通過單液原電池強化電極反應、電極材料、離子導體、電子導體四個基本電池構成要素,構建原電池基礎模型。
2.通過實驗證據發現真實問題,進一步思考解決問題,完善原電池思維模型。培養學生發現問題、解決問題的關鍵能力,提高學生證據推理與模型認知、科學探究與創新意識的核心素養。
3.通過實驗證據逐步構建多重原電池模型,總結原電池本質規律,為后續原電池設計、電源分析、隔膜電化學討論構建思維模型,形成從化學理論到實踐應用過程的科學態度。
四、教學流程
教學流程(表1)。
五、教學實錄
1.創設情境
【教師】我校優秀校友,大家的學長戴宏杰院士是中國科學院外籍院士、美國科學院院士。戴院士團隊開發的一種具有超快充電、不易燃燒爆炸、可折疊、材料成本低等突出優點的鋁離子電池于2015年4月6日在Nature雜志網絡版發表。超快可充電鋁離子電池的基本原理是同學們高一學過的原電池。
【學生】快速瀏覽Nature雜志網絡版新型鋁離子電池(見圖2)。
2.單液原電池
【教師】火力發電廠將化學能通過一系列能量的轉化轉變成電能,多次轉化中會造成能量的損失。怎樣直接將化學能轉變成電能?
【學生】可以設計成原電池。
【教師】請同學們分組利用銅、鋅和硫酸銅溶液設計原電池,接人數字電流傳感器。
根據實驗討論:①單液電池工作原理及電極判斷和反應。
②觀察實驗現象和電流變化。
③根據實驗現象發現組裝的原電池有哪些不足?可以怎樣解決呢?
【學生實驗】分組實驗,組裝銅、鋅和硫酸銅溶液單液原電池(圖3、圖4)。
【學生交流】
工作原理:負極鋅失電子經外電路到正極銅;溶液中銅離子向負極鋅定向移動,鋅離子向正極銅定向移動,構成閉合回路。
電極反應:負極Zn-2e-=Zn2+(氧化反應)正極Cu2++2e-=Cu(還原反應)
實驗現象:銅表面有紅色銅生成,鋅表面有紅色銅覆蓋(圖5);電流不斷衰減(圖6)。
不足之處:鋅與硫酸銅溶液接觸,直接電子得失。電流不穩定,衰減快。化學能部分轉化成熱能,沒有全部轉化成電能,能量損耗大。
解決方案:讓鋅與硫酸銅溶液不接觸。
3.雙液原電池
【過渡】根據同學們發現的問題和想到的解決方案,我們將原電池進行改進(圖7)。大家討論是否可行?
【學生】不可行,沒有形成閉合回路。
【教師】怎樣形成閉合回路呢?介紹鹽橋。鹽橋是將飽和KCI溶液和瓊脂加熱成糊狀,趁熱注入U形管中,冷卻后仍然有自由移動的離子的裝置。請同學們利用鹽橋組裝雙液原電池,接人數字電流傳感器。
根據實驗討論:①雙液電池工作原理及電極判斷和反應。
②鹽橋的作用。
③觀察實驗現象和電流變化。
④根據實驗現象發現雙液原電池有哪些不足?可以怎樣解決呢?
【學生實驗】分組實驗,組裝銅、鋅和硫酸銅溶液雙液原電池(圖8、圖9)。
【學生交流】
工作原理:負極鋅失電子經外電路到正極銅;鹽橋中K+向正極移動,CI-向負極移動。構成閉合回路。
電極反應:負極Zn- 2e-=2n2+(氧化反應)正極Cu2++2e-=Cu(還原反應)
鹽橋作用:①形成閉合回路;②平衡溶液中的電荷;③將Zn與硫酸銅溶液分離。
實驗現象:銅表面有紅色銅生成,鋅慢慢減少,表面沒有銅附著;電流讀數穩定,但很小(圖10)。
不足之處:電流穩定,但是電流非常小。離子移動的距離遠,電阻大。
解決方案:縮短鹽橋、增大鹽橋U形管口徑,增大離子的接觸面積。
4.隔膜原電池
【過渡】同學們通過實驗發現了雙液原電池的不足,并想到了解決辦法。是否有更好地滿足大家改進要求的物品代替鹽橋呢?
【教師】介紹離子交換膜(圖11)。離子交換膜是對離子具有選擇透過性的高分子材料制成的薄膜。常見的有只允許陽離子通過的陽離子交換膜、只允許陰離子通過的陰離子交換膜和只允許H+通過的質子交換膜。將陰離子交換膜固定在電解槽中,可以組成隔膜電池。
【教師演示】組裝銅、鋅、硫酸銅溶液陰離子交換膜電池,接人數字電流傳感器(圖12、圖13、圖14)。
根據實驗討論:①隔膜電池工作原理及電極判斷和反應。
②陰離子交換膜的作用。
③觀察實驗現象和電流變化。
④隔膜電池有哪些不足?可以怎樣解決呢?
【學生交流】
工作原理:負極鋅失電子經外電路到正極銅;正極溶液中S042-向負極方向定向移動。構成閉合回路。
電極反應:負極2n_2e-=2n2+(氧化反應)正極Cu2++2e-=Cu(還原反應)
陰離子交換膜的作用:①形成閉合回路;②允許陰離子自由移動,平衡溶液中的電荷;③阻止CU2+進入負極溶液,將Zn與硫酸銅溶液分離;④增大離子的接觸面積,減小電阻。
實驗現象:銅表面有紅色銅生成,鋅慢慢減少,表面沒有銅附著;電流讀數穩定,電流大(圖15)。
不足之處:電源中的溶液不方便攜帶。
解決方案:向兩極溶液中加入瓊脂等,將溶液固定。
5.課堂小結
【過渡】同學們通過實驗證據發現原電池的不足,并成功改進。現在科研工作者有關電池的研究和開發大都通過改變電解質狀態、利用隔膜等改進,實現更方便、高效、安全的電池。下一節課“化學電源”學習中我們會進一步探究和學習。
【教師】本節課同學們通過實驗證據逐步構建了單液原電池、雙液原電池和隔膜電池的模型認知。請同學總結這三種原電池(表2)。
【學生】小組討論,發表觀點。
【教師】三種電池的本質規律相同,都是將自發進行的氧化還原反應分別在兩極進行,通過電極材料、離子導體、電子導體構成閉合回路。同學們課后可以查閱各種新型電池,按原電池的本質規律分析其工作原理,了解新型電池的應用和發展方向。
六、教學反思
1.真實實驗證據,形成科學精神
《普通高中化學課程標準(2017年版2020年修訂)》中界定的“證據推理和模型認知”核心素養重在培養學生的證據意識,基于證據構建模型,運用模型揭示本質規律。[3]真實的證據對于學生模型構建和理解本質規律有重要作用。實驗證據是基于實驗現象的真實證據,對于學生有體驗性和可視性。教師設計獲得實驗證據過程需注意實驗原理和實驗過程符合學生的認知;實驗現象、實驗數據真實可信。本節課利用朗威8.0數字電流傳感器實時監測電流,充分利用數字化信息技術,使微觀電流變化的實驗證據定量、真實,引導學生提出真實問題,驗證改進效果。本節課多次獲取實驗證據的過程加強了學生的證據意識,使學生逐步形成獲取、收集、整合證據意識的科學精神。
2.完善模型認知,尋找本質規律
基于證據推理構建認知模型,是由現象到本質、由個體到群體的進階過程。根據學生的學情,教師應引導學生分析歸納證據,幫助學生認知、建構、修正、應用相關模型。[4]構建模型認知的過程是一個逐步完善、循序漸進的過程。模型構建和完善過程中跨度不宜太大,涉及的變化要有說明和證據。本節課從學生已有模型認知單液原電池著手,通過實驗證據提出真實問題,通過鹽橋、離子交換膜解決問題,完善模型認知。教學最后比較所有模型,尋找構建原電池的本質規律,修正原電池中還原劑需和氧化劑接觸的認識偏差,為原電池模型的應用——化學電源和討論有關隔膜電化學問題奠定基礎。
3.鼓勵解決問題,培養創新意識
解決問題的能力是學生在未來面對與學科相關的生活實踐或學習探索問題情境時必須具備的能力[5]。通過獲取證據創設真實問題情境,學生需要在思維上主動、理性、科學思考解決問題。這也是學生在發展中打破固有的認知,構建新結論,適應時代要求的重要能力。本節課學生從認知的角度不一定能提出鹽橋、離子交換膜等方法,但是可以從原理的角度提出將還原劑和氧化劑分離,增大離子間接觸面積等設想。教師在深挖教材、精心設計的基礎上,不斷創新實驗,自制隔膜電池,將學生的設想變成現實,提高教學效果、激發學生解決問題的興趣,培養學生的創新意識的化學學科素養。
參考文獻
[1] 王晶,鄭長龍.普通高中教科書:化學選擇性必修1[Ml.北京:人民教育出版社,2019:94.
[2] 中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[S].北京:人民教育出版社,2020.
[3] 余騰,李欣.高中數理化,基于數字化實驗發展“證據推理與模型認知”素養的教學設計[J].2020(9):75-77.
[4] 朱如琴.化學教育(中英文),基于證據推理與模型認知的主題式復習[J].2021(21):41-46.
[5] 教育部考試中心.中國高考評價體系[M].北京:人民教育出版社,201 9.

