嗜果刀孢菌在野杏葉片致病過程中主要酶的種類及活性分析
劉楚麗 魯海龍 陳虹瑾 孫洪濤 馬榮
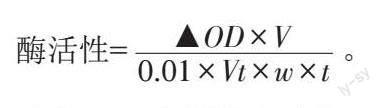
摘要:【目的】明確引起野杏穿孔病的嗜果刀孢菌(Wilsonomyces carpophilus)在致病過程中主要酶的種類及活性。【方法】通過3,5-二硝基水楊酸(DNS)法開展了細(xì)胞壁降解酶的種類及其活性的測(cè)定,并分析了野杏葉片受嗜果刀孢菌侵染后抗氧化酶活性的變化。【結(jié)果】首次發(fā)現(xiàn)嗜果刀孢菌在體外不同誘導(dǎo)物培養(yǎng)條件下均可產(chǎn)生木聚糖酶、多聚半乳糖醛酸酶(PG)、聚甲基半乳糖醛酸酶(PMG)等6 種細(xì)胞壁降解酶,且酶活性呈顯著差異。嗜果刀孢菌侵染野杏葉片后產(chǎn)生的細(xì)胞壁降解酶中PG和PMG酶活性最高,羧甲基纖維素酶活性最低;過氧化物酶(POD)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)3 種抗氧化酶活性隨嗜果刀孢菌侵染時(shí)間的延長(zhǎng)呈先上升后下降趨勢(shì)。【結(jié)論】首次明確果膠酶在嗜果刀孢菌致病過程中起重要作用,野杏葉片受嗜果刀孢菌危害后體內(nèi)抗氧化酶活性升高。
關(guān)鍵詞:野杏;穿孔病;嗜果刀孢菌;細(xì)胞壁降解酶;抗氧化酶
中圖分類號(hào):S662.2 文獻(xiàn)標(biāo)志碼:A 文章編號(hào):1009-9980(2023)04-0747-10
野杏(Prunus armeniaca)是世界上廣泛栽培杏的起源物種,也是我國(guó)新疆特色果樹的重要種質(zhì)資源,具有極高的科研價(jià)值、生態(tài)價(jià)值及應(yīng)用價(jià)值[1]。近年來,穿孔病的發(fā)生已成為威脅野杏健康生長(zhǎng)的重要影響因子,其中以嗜果刀孢菌(Wilsonomycescarpophilus)引起的穿孔病最為嚴(yán)重。該病原菌具有潛伏侵染的特性,主要危害核果類植物的葉片和果實(shí),也可危害嫩枝、休眠芽及花萼,嚴(yán)重影響植株生長(zhǎng)和果品質(zhì)量[2-4]。目前,國(guó)內(nèi)外關(guān)于嗜果刀孢菌的研究多集中在病原菌的種類和防治方面,少數(shù)學(xué)者研究了該菌的流行病學(xué)、真菌寄主范圍、遺傳多樣性及次生代謝產(chǎn)物等[3-11]。關(guān)于嗜果刀孢菌引起的穿孔病致病機(jī)制的研究很少,尚未有嗜果刀孢菌致病過程中產(chǎn)生的酶的種類及活性的相關(guān)研究。
病原菌與寄主的相互作用是一個(gè)十分復(fù)雜的過程,病原菌產(chǎn)生對(duì)寄主正常生理活動(dòng)有影響的代謝產(chǎn)物。酶、毒素和生長(zhǎng)調(diào)節(jié)物質(zhì)是國(guó)內(nèi)外科研工作者研究最多的病原物主要的三大致病因子[12]。研究發(fā)現(xiàn)植物在受到病原物侵染后,膜系統(tǒng)受到傷害,細(xì)胞膜透性增強(qiáng),過氧化物酶(POD)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)等抗氧化酶會(huì)參與植物的防御,這些指標(biāo)被作為植物抗病性鑒定的重要生理指標(biāo)[13]。此外,宿主細(xì)胞壁是阻止病原真菌侵入的一道屏障。病原真菌入侵時(shí)通過分泌多種細(xì)胞壁降解酶,降解組成宿主細(xì)胞壁的各種多糖物質(zhì),從而破壞細(xì)胞壁和胞間層,或?qū)е录?xì)胞分離,組織潰散[14]。Adaskaveg[15]證實(shí)了扁桃穿孔病病原菌(W.carpophilus)在侵入寄主的過程中先破壞細(xì)胞壁,在一定程度上加速了病原菌侵入。Chiu 等[16]的研究表明,果膠酶在褐腐菌(Monilinia fructicola)致病過程中發(fā)揮了重要的作用。王鵬程等[17]也證實(shí)了細(xì)胞壁降解酶在棗黑斑病菌(Alternaria sp.)侵入棗果過程中的作用。然而不同的病原菌所分泌的細(xì)胞壁降解酶種類是不同的,并且不同的降解酶在致病過程中發(fā)揮的作用也不同。目前關(guān)于嗜果刀孢菌(W. carpophilus)在危害野杏穿孔病的過程中產(chǎn)生的細(xì)胞壁降解酶的種類及其活性變化等研究未見報(bào)道,以及嗜果刀孢菌侵染過程中寄主體內(nèi)抗氧化酶的生理指標(biāo)是如何變化的尚不清楚。
筆者在本研究中通過嗜果刀孢菌活體外誘導(dǎo)培養(yǎng)和接種野杏葉片后,采用3,5- 二硝基水楊酸(DNS)法和考馬斯亮藍(lán)(Bradford)法測(cè)定嗜果刀孢菌在野杏葉片內(nèi)外產(chǎn)生的細(xì)胞壁降解酶活性,分析比較其變化趨勢(shì)。研究結(jié)果為深入了解其致病機(jī)制提供理論依據(jù)及對(duì)開展穿孔病的預(yù)防和控制等工作具有重要意義。
1 材料和方法
1.1 材料
供試菌株:嗜果刀孢菌菌株XJAU-Y046-7m2 源自天山野果林野杏葉片,種類鑒定由前期研究完成[18]。供試寄主:栽植于新疆農(nóng)業(yè)大學(xué)試驗(yàn)地的2~3 a(年)的野杏。
1.2 方法
1.2.1 嗜果刀孢菌體外細(xì)胞壁降解酶的提取 以Czaper 液體培養(yǎng)基(KNO3 2.0 g,KCl 0.5 g,F(xiàn)eSO40.01 g,K2HPO4 1.0 g,MgSO4 ·7 H2O 0.5 g)為基礎(chǔ)培養(yǎng)基,分別添加10 g 不同誘導(dǎo)物至錐形瓶中,主要有蔗糖、果膠、微晶纖維素、羧甲基纖維素(CMC)、濾紙粉、脫脂棉屑、野杏葉片,最后用蒸餾水定容至1 L。通過磷酸將培養(yǎng)基的pH 調(diào)至5.0,于121 ℃高溫滅菌20 min。
將PDA平板上純化培養(yǎng)10 d 的嗜果刀孢菌,用直徑0.5 cm 打孔器選取菌落生長(zhǎng)一致的菌餅,選取5 個(gè)菌餅置于盛有100 mL上述培養(yǎng)基的250 mL的三角瓶?jī)?nèi),25 ℃下振蕩培養(yǎng)7 d 后過濾去除菌絲,4 ℃ 10 000 r·min-1 離心30 min,棄去沉淀,留上清液(粗酶液)備用[17,19]。
1.2.2 嗜果刀孢菌產(chǎn)生的細(xì)胞壁降解酶的活性測(cè)定 參考Douaiher 等[20]和Siah 等[21]的研究方法測(cè)定羧甲基纖維素酶(Cx)、β-葡萄糖苷酶、木聚糖酶、聚甲基半乳糖醛酸酶(PMG)、多聚半乳糖醛酸酶(PG)的活性。利用DNS比色法,在分光光度計(jì)540 nm處測(cè)定反應(yīng)混合物吸光值,根據(jù)酶反應(yīng)所釋放的還原糖含量計(jì)算上述酶活性。酶活性單位為50 ℃下每分鐘每毫升酶液(每毫克蛋白)催化底物產(chǎn)生1 μmol還原糖所需酶量,根據(jù)D-半乳糖醛酸標(biāo)準(zhǔn)曲線計(jì)算生成的還原糖。
果膠甲基反式消除酶(PMTE)的活性測(cè)定:在232 nm處測(cè)定反應(yīng)混合物吸光值,30 ℃下每分鐘每毫升酶液催化底物釋放1 μmol 不飽和醛酸為一個(gè)酶活單位(U·mL-1)。酶蛋白濃度測(cè)定按照Bradford的方法,用考馬斯亮藍(lán)G-250 顯色,在595 nm 比色測(cè)定,用牛血清做標(biāo)準(zhǔn)曲線。
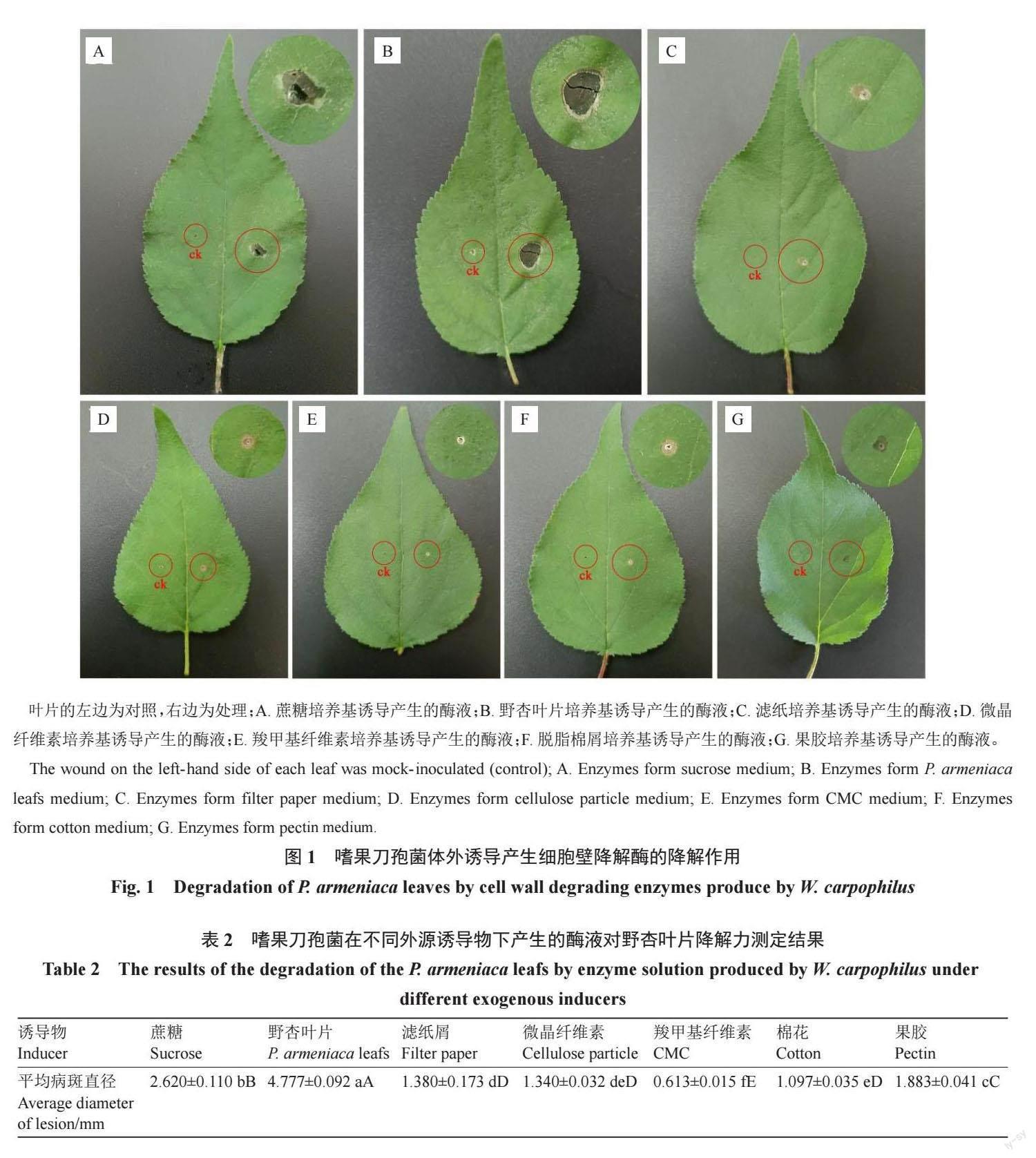
1.2.3 嗜果刀孢菌產(chǎn)生細(xì)胞壁降解酶對(duì)野杏葉片的降解作用 采用離體針刺法,將1.2.2 中得到的經(jīng)7 種誘導(dǎo)物誘導(dǎo)的酶液各2 mL,分別滴加在無菌的棉球上,使棉球完全潤(rùn)濕。取野杏葉片,用滅菌后的3 號(hào)昆蟲針在葉片的左右兩側(cè)對(duì)稱針刺大小一致的傷口,右邊接種以酶液潤(rùn)濕的棉花,左邊以煮沸滅活的酶液為對(duì)照處理,每個(gè)處理3 次重復(fù)。25 ℃左右光照條件下培養(yǎng),7 d 后觀察葉片變化情況。
1.2.4 嗜果刀孢菌在野杏葉片內(nèi)產(chǎn)生細(xì)胞壁降解酶的提取 將PDA 平板上純化培養(yǎng)10 d 的嗜果刀孢菌,用直徑0.5 cm打孔器選取菌落生長(zhǎng)一致的菌餅,接種至健康的野杏葉片上,以接種空白培養(yǎng)基作為對(duì)照,于接種后2、4、6、8、10、12、14、16 d 分別取樣。稱取葉片1 g,放入研缽中,冰浴研磨,加入5 mL1 mol ·L- 1 NaCl 提取液(20 mmol ·L- 1 Tris-HCl 緩沖液,pH 值7.4),4 ℃、5000 r · min-1下離心15 min,取上清液(粗酶液)備用,4 ℃保存。
1.2.5 野杏葉片中抗氧化酶的提取及活性測(cè)定 葉片的接種方法同1.2.4,于接種后1、3、5、10、15 d分別取樣。稱取1 g 野杏葉片,剪碎放入研缽中,加適量磷酸緩沖液,冰浴研磨成勻漿,4 ℃,12 000 r ·min-1,冷凍離心30 min,取上清液為提取粗酶液。POD活性測(cè)定采用愈創(chuàng)木酚法[22]、SOD活性測(cè)定采用四唑氮藍(lán)還原法[23]、CAT活性測(cè)定參照高俊鳳[24]的方法,酶活性根據(jù)公式計(jì)算,每個(gè)處理3 次重復(fù)。酶活性= ▲OD ×V0.01×Vt ×w ×t。
式中:0.01為酶活性單位;V是提取酶液的體積;Vt 為測(cè)定時(shí)酶液用量;w表示用于提取酶的葉片質(zhì)量;t 為▲OD 變化所用時(shí)間;酶活性單位為U/ (鮮質(zhì)量·時(shí)間)。
1.3 數(shù)據(jù)處理
將測(cè)定的全部數(shù)據(jù)采用Excel 2010 進(jìn)行處理和分析,計(jì)算3 次重復(fù)的平均值,利用IBM SPSS Statistics22.0 統(tǒng)計(jì)分析軟件進(jìn)行方差分析,采用Duncan檢驗(yàn)法進(jìn)行多重比較及差異顯著性分析,使用Origin2018 64Bit軟件進(jìn)行圖表制作。
2 結(jié)果與分析
2.1 嗜果刀孢菌在不同外源誘導(dǎo)物下產(chǎn)生細(xì)胞壁降解酶的種類
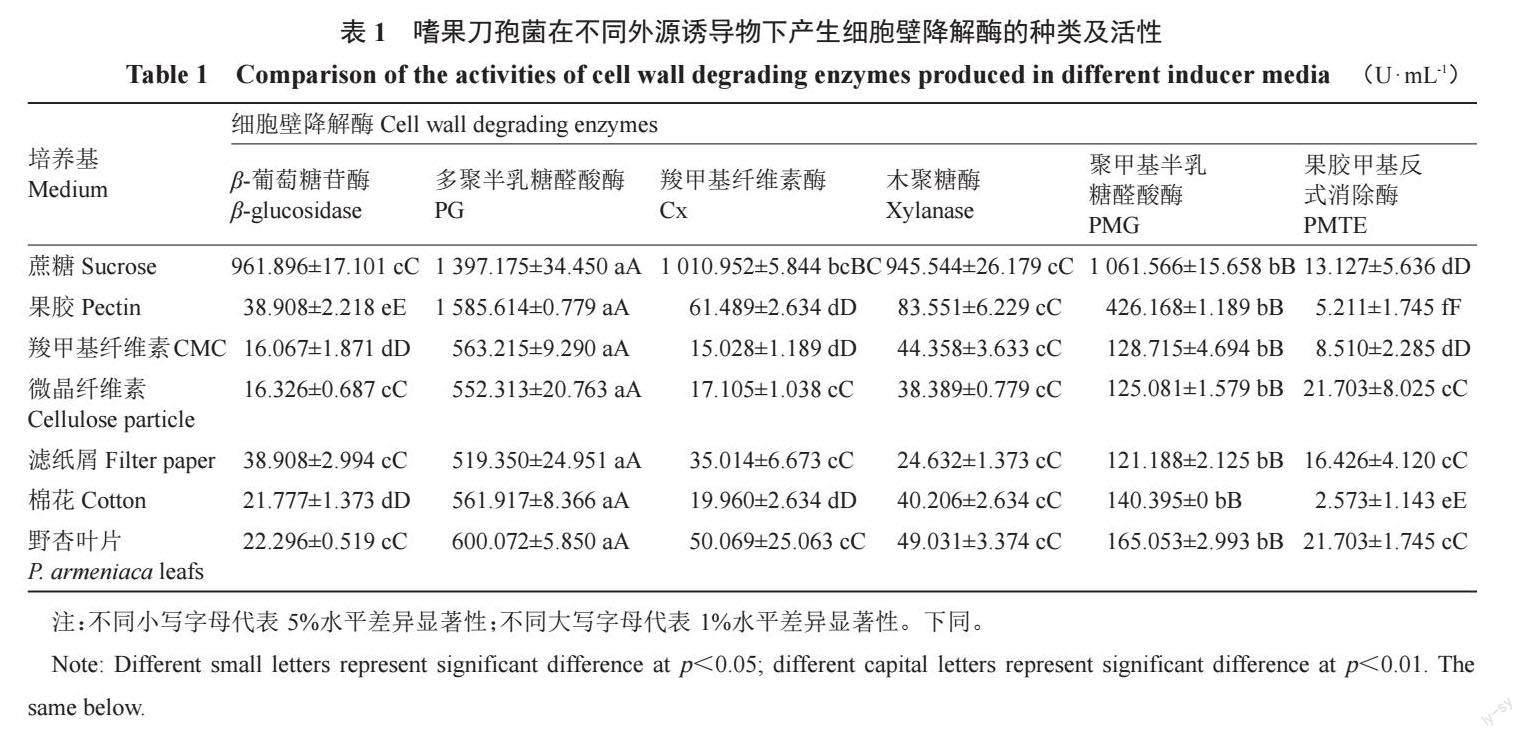
嗜果刀孢菌在7 種不同外源誘導(dǎo)物培養(yǎng)基上均能產(chǎn)生羧甲基纖維素酶(Cx)、β-葡萄糖苷酶、木聚糖酶、聚甲基半乳糖醛酸酶(PMG)、多聚半乳糖醛酸酶(PG)、果膠甲基反式消除酶(PMTE),且酶活性呈現(xiàn)顯著性差異(表1)。6 種酶中PG 酶活性最高,其次為PMG、木聚糖酶、Cx、β-葡萄糖苷酶,而PMTE酶活性最低,其中PG、PMG、PMTE 屬于果膠酶,木聚糖酶、Cx、β-葡萄糖苷酶為纖維素酶。嗜果刀孢菌在分別以蔗糖、果膠、羧甲基纖維、微晶纖維素、濾紙粉、脫脂棉屑、野杏葉片為誘導(dǎo)物的培養(yǎng)基中,產(chǎn)生的PG酶活性依次為:(1397.175±34.450)、(1 585.614 ± 0.779)、(563.215 ± 9.290(552.313±20.763)、(519.350 ± 24.951)、(561.917 ± 8.366)、(600.072±5.850)U·mL-1;產(chǎn)生的PMG酶活性依次為(1 061.566±15.658)、(426.168±1.189)(128.715±4.69(125.081±1.579)、(121.188±2.125)、(140.395±0)、(165.053±2.993)U·mL-1;產(chǎn)生的PMTE酶活性依次為(13.127±5.636)、(5.211±1.745)、(8.510±2.285)、(21.703 ± 8.025)、(16.426 ± 4.120)、(2.573 ± 1.143)、(21.703±1.745)U·mL-1。PG、PMG、分別在果膠、蔗糖誘導(dǎo)培養(yǎng)基中酶活性最高,果膠、蔗糖為PG、PMG的最佳誘導(dǎo)物。
2.2 嗜果刀孢菌體外誘導(dǎo)產(chǎn)生細(xì)胞壁降解酶的降解作用
將添加不同誘導(dǎo)物蔗糖、果膠、微晶纖維素、羧甲基纖維素(CMC)、濾紙粉、脫脂棉屑、野杏葉片誘導(dǎo)產(chǎn)生的細(xì)胞壁降解酶液分別接種于野杏葉片后呈現(xiàn)不同程度的降解,對(duì)照葉片無癥狀。不同誘導(dǎo)物誘導(dǎo)產(chǎn)生的酶液接種至葉片2 d 后接種點(diǎn)出現(xiàn)黃褐色斑點(diǎn),7 d 后出現(xiàn)黑褐色病斑(圖1)。由病斑直徑顯著性分析可知(表2),以野杏葉片誘導(dǎo)產(chǎn)生的酶液降解野杏葉片的能力最強(qiáng),發(fā)病病斑最大,其次是以蔗糖、果膠誘導(dǎo)產(chǎn)生的酶液,而以微晶纖維素、羧甲基纖維素(CMC)、濾紙粉、脫脂棉誘導(dǎo)產(chǎn)生的酶液作用于葉片后呈現(xiàn)的病斑較小,降解能力弱。
2.3 嗜果刀孢菌侵染野杏葉片后細(xì)胞壁降解酶的活性變化
2.3.1 纖維素酶活性變化 野杏葉片接種嗜果刀孢菌2 d 后出現(xiàn)黃褐色小圓斑,隨后病斑不斷擴(kuò)展。野杏葉片接種病菌后Cx 酶活性在2~4 d 呈急劇上升、4~8 d 波動(dòng)上升、8~16 d 急劇下降的趨勢(shì),酶活性在接種后的第4 天和第8 天出現(xiàn)峰值(49.031、51.626 U·mL-1),依次為對(duì)照組的1.313 倍和2.096 倍,酶活性在接種第14 天時(shí)急劇下降至40.465 U·mL-1。對(duì)照組Cx 酶活性呈現(xiàn)先上升再逐漸下降最后緩慢上升,且處理組Cx酶活性始終高于對(duì)照組酶活性(圖2-A)。
受嗜果刀孢菌侵染后野杏葉片內(nèi)的β-葡萄糖苷酶活性在2~4 d 呈急劇升高、4~12 d 波動(dòng)下降、12~16 d 緩慢上升的趨勢(shì),接種第4 天酶活性達(dá)55.519 U·mL-1為最高峰,為對(duì)照組的1.862 倍,隨后在接種第12 天酶活性急劇下降至33.717 U·mL-1。對(duì)照組β-葡萄糖苷酶活性隨接種時(shí)間的增加呈緩慢波動(dòng)上升的趨勢(shì)(圖2-B)。
木聚糖酶活性變化為2~8 d 呈急劇升高、8~12 d后急劇下降、14~16 d波動(dòng)下降的趨勢(shì),接種第8天達(dá)到高峰,酶活性為116.516 U·mL-1,為對(duì)照組的2.014倍,在接種第12天時(shí)酶活性急劇下降至88.743 U·mL-1,12 d 后變化較平緩。對(duì)照組木聚糖酶活性呈先上升隨后緩慢下降的趨勢(shì),且變化趨勢(shì)沒有處理組明顯(圖2-C)。
2.3.2 果膠酶活性變化 PG 酶活性在接種2~6 d短時(shí)間內(nèi)急劇上升,隨后在6~8 d 急劇下降,8~16 d 變化逐漸穩(wěn)定,接種6 d 時(shí)達(dá)到高峰,酶活性為1 784.435 U·mL-1,為對(duì)照組的2.309 倍,隨后在接種第8 天時(shí)酶活性急劇下降至632.776 U·mL-1,隨后酶活性變化逐漸穩(wěn)定。對(duì)照組PG 酶活性在接種后變化趨勢(shì)平緩,PG 酶活性明顯低于處理組(圖3-A)。
PMG酶活性在接種病菌后2~6 d 急劇上升,6~8 d 急劇下降,8~16 d 逐漸平穩(wěn),接種第6 天時(shí)達(dá)到高峰,酶活性為530.511 U·mL-1,為對(duì)照組的1.981 倍,在接種第8 天時(shí)酶活性急劇下降至216.186 U·mL-1,隨后酶活性變化穩(wěn)定。對(duì)照組PMG酶活性在接種后有緩慢上升的趨勢(shì),但其變化明顯小于處理組(圖3-B)。
PMTE酶活性在接種病菌后2~8 d 急劇升高,8~16 d急劇下降。接種第8天時(shí)酶活性達(dá)130.549 U·mL-1為最高峰,為對(duì)照組的3.003 倍,隨后酶活性急劇下降,16 d 下降至19.724 U·mL-1 。對(duì)照組PMTE酶活性在接種后呈緩慢上升的趨勢(shì),隨后逐漸下降,其PMTE酶活性明顯低于處理組(圖3-C)。
2.4 嗜果刀孢菌侵染野杏后葉片內(nèi)抗氧化酶的活性變化
野杏葉片受嗜果刀孢菌侵染后,POD活性隨著侵染時(shí)間的增加呈上升趨勢(shì),在接種第5天時(shí)達(dá)到高峰,酶活性為323.889 U · mg- 1 · min- 1,為對(duì)照組的5.949 倍。對(duì)照組的POD活性隨著時(shí)間的增加呈下降趨勢(shì)(圖4-A)。CAT活性動(dòng)態(tài)變化呈1~5 d急劇上升、5~15 d 波動(dòng)下降的趨勢(shì),接種第5 天后CAT活性達(dá)到高峰,為81.111 U·mg-1 ·min-1,為對(duì)照組的1.497倍,接種15 d后酶活性為72.778 U·mg-1·min-1。對(duì)照組的CAT 活性隨著時(shí)間的增加呈緩慢上升趨勢(shì),但其酶活性變化明顯小于處理組(圖4-B)。SOD活性動(dòng)態(tài)變化為1~3 d 呈緩慢下降、5~10 d 急劇上升、10~15 d 緩慢下降的趨勢(shì),接種第10 天時(shí)酶活性達(dá)最高峰,為228.675 U·mg-1 ·min-1,為對(duì)照組的1.85 倍。對(duì)照組的SOD活性隨病菌危害時(shí)間的增加呈下降趨勢(shì)(圖4-C)。
3 討論
國(guó)內(nèi)外學(xué)者研究發(fā)現(xiàn)細(xì)胞壁降解酶是病原菌致病過程中產(chǎn)生的關(guān)鍵酶。目前尚無嗜果刀孢菌致病過程中產(chǎn)生的酶的種類和活性的研究,筆者在本研究中初步明確嗜果刀孢菌產(chǎn)生的纖維素酶和果膠酶是引起穿孔病發(fā)生的重要致病因子。李寶聚等[19] 發(fā)現(xiàn)黃瓜黑星病菌(Cladosporium cucumerinum)在不同底物改良的Czaper 液體培養(yǎng)基中和罹病黃瓜組織中均能產(chǎn)生羧甲基纖維素酶(Cx)及果膠甲基半乳糖醛酸酶(PMG)。陳曉林等[25]的研究得出蘋果樹腐爛病菌(Valsa ceratosperma)在培養(yǎng)基誘導(dǎo)和病組織侵染中均能產(chǎn)生β-葡萄糖苷酶、Cx、PG、PMG 和木聚糖酶,并且木聚糖酶活性高于其他種類。李沅澤等[26]測(cè)得蘋果輪紋病菌(Botryosphaeria doyhide)在不同誘導(dǎo)培養(yǎng)基上均可產(chǎn)生PG、PMG、內(nèi)切-4-1,4-葡聚糖酶、木葡聚糖酶、β-葡萄糖苷酶、木聚糖酶和濾紙酶(FPA),但是在發(fā)病蘋果枝條中未檢測(cè)到上述細(xì)胞壁降解酶。張大智等[27]測(cè)得杧果細(xì)菌性角斑病菌(Xanthomonascampestris pv. mangiferaeindicae)在羧甲基纖維素鈉和柑橘果膠誘導(dǎo)培養(yǎng)基和感病杧果葉片中均可分泌Cx、β-glucosidase、PG、PMG、PMTE和PGTE 等細(xì)胞壁降解酶,且Cx 和PMG 的活性高于PMTE 和PGTE。金勤等[28]研究得出膠孢炭疽菌(Colletotrichum gloeosorioide)在體外產(chǎn)生的PMG 活性遠(yuǎn)高于Cx 和漆酶。研究測(cè)得嗜果刀孢菌在寄主體內(nèi)外均可產(chǎn)生Cx、木聚糖酶、PG、PMG、β-葡萄糖苷酶和PMTE 等6 種細(xì)胞壁降解酶,在寄主體內(nèi)外酶活性最高的均為果膠酶中的PMG 和PG,纖維素酶活性最低,表明果膠酶在嗜果刀孢菌致病過程中起到了較為關(guān)鍵的作用。前人的研究表明不同種類的病菌分泌的細(xì)胞壁降解酶是不同的,在致病過程中起關(guān)鍵作用的降解酶也不同。通過將嗜果刀孢菌接種到野杏葉片上發(fā)現(xiàn),在接種第4 天時(shí)PG 和PMG 的活性達(dá)到高峰,顯著高于其他5 種細(xì)胞壁降解酶活性,木聚糖酶和PMTE 的活性在接種后8 d 達(dá)到高峰。表明果膠酶中的PMG 和PG 在嗜果刀孢菌致病過程中分泌最早且果膠酶比纖維素酶對(duì)野杏葉片致病作用明顯。筆者研究發(fā)現(xiàn)野杏葉片接種病菌后細(xì)胞壁降解酶均表現(xiàn)出起伏變化,是否為野杏葉片的免疫對(duì)抗作用有待進(jìn)一步研究。
在植物與病原物長(zhǎng)期協(xié)同進(jìn)化過程中,植物形成了一系列復(fù)雜的防御酶體系抵御病原物的入侵[29]。植物體內(nèi)的POD、CAT、SOD等是防御酶系統(tǒng)中的關(guān)鍵保護(hù)酶,可清除植物細(xì)胞內(nèi)產(chǎn)生的O2- .和H2O2 等活性氧物質(zhì),以此抵御病原菌入侵的危害[30]。金勤等[28]的研究得出油茶受到炭疽病菌的侵染后,植株體內(nèi)的POD、PPO 等防御酶的活性顯著升高。韓彥卿等[31]的研究證實(shí)白發(fā)病菌(Sclerosporagraminicola)侵染抗病品種后CAT、POD、SOD酶活性升高,且遠(yuǎn)遠(yuǎn)高于感病品種,相反在感病品種中這幾種酶活性顯著下降,表明POD等防御酶在抵御病原菌和保護(hù)植物細(xì)胞免受傷害過程中發(fā)揮重要抗病作用。筆者研究發(fā)現(xiàn)野杏葉片接種嗜果刀孢菌后,POD、CAT、SOD 活性均有所升高,野杏葉片的POD等抗氧化酶活性升高,表明野杏葉片在受到嗜果刀孢菌侵染后,會(huì)通過調(diào)節(jié)自身的抗氧化酶系統(tǒng)減輕植物體內(nèi)活性氧產(chǎn)生的危害。
嗜果刀孢菌可危害杏(P. armeniaca)、扁桃(Amygdalus communis)、稠李(Padus avium)、西洋梨(Pyrus communis)、蘋果(Malus domestica)和冬青櫟(Quercus ilex)等多種寄主植物[32],其在不同寄主上產(chǎn)生的酶類及活性變化是否存在差異,以及嗜果刀孢菌在致病過程中是否會(huì)產(chǎn)生其他種細(xì)胞壁降解酶如漆酶和PGTE 等,還需進(jìn)一步研究。植物病原菌侵入寄主是一個(gè)復(fù)雜的過程,除了能向外分泌細(xì)胞壁降解酶外,往往還可以產(chǎn)生毒素和激素等致病因子。由于病原菌致病過程中的機(jī)制是非常復(fù)雜的,關(guān)鍵致病因子與不同致病因子間如何協(xié)調(diào)作用等,有待深入研究。
4 結(jié)論
筆者在本研究中首次發(fā)現(xiàn)嗜果刀孢菌在野杏葉片內(nèi)外均可產(chǎn)生多聚半乳糖醛酸酶、羧甲基纖維素酶、β-葡萄糖苷酶、木聚糖酶、聚甲基半乳糖醛酸酶和果膠甲基反式消除酶等6 種細(xì)胞壁降解酶,在野杏葉片內(nèi)外酶活性最高的均為果膠酶中的PMG和PG,纖維素酶活性最低。嗜果刀孢菌細(xì)胞壁降解酶在野杏葉片致病過程中的動(dòng)態(tài)變化表明果膠酶中的PMG和PG在嗜果刀孢菌致病過程中分泌最早,且果膠酶比纖維素酶對(duì)野杏葉片致病作用明顯。野杏葉片受嗜果刀孢菌危害后,POD、CAT、SOD等抗氧化酶活性升高。
參考文獻(xiàn)References:
[1] 劉黎明. 新疆野杏生殖生態(tài)學(xué)初步研究[D]. 烏魯木齊:新疆農(nóng)業(yè)大學(xué),2010.
LIU Liming. Primary research on reproductive ecology of Armeniacavulgaris Lam.[D]. Urumqi:Xinjiang Agricultural University,2010.
[2] 何蘇琴,白濱,文朝慧,荊卓瓊. 甘肅省桃果實(shí)褐斑病病原鑒定[J]. 植物保護(hù),2016,42(5):53-57.
HE Suqin,BAI Bin,WEN Chaohui,JING Zhuoqiong. Identificationof the pathogen of the brown spot of peach fruit in Gansu,China[J]. Plant Protection,2016,42(5):53-57.
[3] BUBICI G,DAMICO M,CIRULLI M. Field reactions of plumcultivars to the shot hole disease in southern Italy[J]. Crop Protection,2010,29(12):1396-1400.
[4] NARMANI A,TEPONNO R B,ARZANLOU M,BABAIAHARIA,STADLER M,New secondary metabolites producedby the phytopathogenic fungus Wilsonomyces carpophilus[J].Phytochemistry Letters,2018,26:212-217.
[5] SCHERM H,SAVELLEAT,BOOZER R T,F(xiàn)OSHEEWG. Seasonaldynamics of conidial production potential of Fusicladiumcarpophilum on twig lesions in southeastern peach orchards[J].Plant Disease,2008,92(1):47-50.
[6] AHMADPOUR A,GHOSTA Y,JAVAN-NIKKHAH M,F(xiàn)ATAHIR,GHAZANGARI K. Isolation and pathogenicity tests ofIranian cultures of the shot hole pathogen of Prunus species,Wilsonomycescarpophilus[J]. Australasian Plant Disease Notes,2009,4(1):133-134.
[7] LALANCETTR N,MCFARLAND K A,BURNETT A L. Modelingsporulation of Fusicladium carpophilum on nectarine twiglesions:Relative humidity and temperature effects[J]. Phytopathology,2012,102(4):421-428.
[8] AHMADPOUR A,GDOSTA Y,JAVAN-NIKKHAH M,GHAZANGARIK,F(xiàn)ATAHI R. Study on morphology,pathogenicityand genetic diversity of Wilsonomyces carpophilus isolates,thecausal agent of shot hole of stone fruit trees based on RAPDPCRin Iran[J] Archives Of Phytopathology And Plant Protection,2012,45(17):2076-2086.
[9] TOVAR-PEDRAZA J M,AYALA-ESCOBAR V,SEGURA-LEONO L. Thyrostroma carpophilum causing apricot shot-hole inMexico[J]. Australasian Plant Disease Notes,2013,8(1):31-33.
[10] THOMIDIS T,EXADAKTYLOU E. Effect of a plastic rainshield on fruit cracking and cherry diseases in Greek orchards[J].Crop Protection,2013,52:125-129.
[11] NABI A,SHAH M U D,PADDER B A,DAR M S,AHMAD M.Morphocultural,pathological and molecular variability in Thyrostromacarpophilum causing shot hole of stone fruits in India[J].European Journal of Plant Pathology,2017,151(3):613-627.
[12] 劉勝毅,許澤永,何禮遠(yuǎn). 植物與病原菌互作和抗病性的分子機(jī)制[J]. 中國(guó)農(nóng)業(yè)科學(xué),1999,32(S1):94-102.
LIU Shengyi,XU Zeyong,HE Liyuan. Plantparasite interactionsand molecular mechanism of resistance[J]. Scientia AgriculturaSinica,1999,32(S1):94-102.
[13] KUMARESAN V,GNANAM A J,PASUPULETI M,ARASUM V,AL-DHABI N A,HARIKRISHNAN R,ACROCKIARAJJ. Comparative analysis of Cs Cu/ZnSOD defense role by molecularcharacterization:Gene expression- enzyme activity- proteinlevel[J]. Gene,2015,564(1):53-62.
[14] MAKELAMR,DONOFRIO N,VRIES R P. Plant biomass degradationby fungi[J]. Fungal Genetics and Biology,2014,72:2-9 .
[15] ADASKAVEG J E. Conidial morphology,host colonization anddevelopment of shot hole of almond caused by Wilsonomycescarpophilus[J]. Canadian Journal of Botany,1995,73(3):432-444.
[16] CHIU C M,YOU B J,CHOU C M,YU P L,YU F Y,PAN S M,BOSTOCK R M,CHUNG K R,LEE M H. Redox status-mediatedregulation of gene expression and virulence in the brown rotpathogen Monilinia fructicola[J]. Plant Pathology,2013,62(4):809-819.
[17] 王鵬程,郝海婷,王蘭,凌新慧. 棗黑斑病菌細(xì)胞壁降解酶活性測(cè)定及致病性分析[J]. 果樹學(xué)報(bào),2019,36(7):903-910.
WANG Pengcheng,HAO Haitin,WANG Lan,LING Xinhui.Analysis of cell wall degrading enzymes from jujube black spotpathogen and its pathogenicity[J]. Journal of Fruit Science,2019,36(7):903-910.
[18] YE S H,JIA H Y,CAI G F,TIAN C M,MA R. Morphology,DNA phylogeny,and pathogenicity of Wilsonomyces carpophilusisolate causing shot- hole disease of Prunus divaricata andPrunus armeniaca in Wild- Fruit Forest of Western TianshanMountains,China[J]. Forests,2020,11(3):319.
[19] 李寶聚,周長(zhǎng)力,趙奎華,李鳳云,陳紅漫. 黃瓜黑星病菌致病機(jī)理的研究. Ⅱ. 細(xì)胞壁降解酶及其在致病中的作用[J]. 植物病理學(xué)報(bào),2000,30(1):13-18.
LI Baoju,ZHOU Changli,ZHAO Kuihua,LI Fengyun,CHENHongman. Pathogenic mechanism of scab of cucumber causedby Cladosporium cucumerinum. Ⅱ.The cell wall- degrading enzymesand ITS Pathogenic action[J]. Acta Phytopathologica Sinica,2000,30(1):13-18.
[20] DOUAIHER M N ,NOWAK E ,DURAND R ,HALAMAP ,REIGNAULT P. Correlative analysis of Mycosphaerellagraminicola pathogenicity and cell wall-degrading enzymes producedin vitro:The importance of xylanases and polygalacturonases[J]. Plant Pathology,2007,56(1):79-86.
[21] SIAH A,DEWEER C,DUYME F,SANSSENE J,DURANDR,HALAMA P,REIGNAULT P. Correlation of in planta endobeta-1,4- xylanase activity with the necrotrophic phase of thehemibiotrophic fungus Mycosphaerella graminicola[J]. Plant Pathology,2010,59(4):661-670.
[22] BEAUCHAMP C,F(xiàn)RIDOVICH I. Superoxide dismutase:improvedassays and an assay applicable to acrylamide gels[J]. AnalyticalBiochemistry,1971,44(1):276-287.
23] El-MOSHATY F I B,PIKE S M,NOVACKY A J,SEHGAL OP. Lipid peroxidation and superoxide production in cowpea (Vignaunguiculata) leaves infected with tobacco ringspot virus orsouthern bean mosaic virus[J]. Physiological and MolecularPlant Pathology,1993,43(2):109-119.
[24] 高俊鳳. 植物生理學(xué)實(shí)驗(yàn)技術(shù)[M]. 西安:世界圖書出版公司,2000:214-215.
GAO Junfeng. Experimental techniques of plant physiology[M].Xian:World Publishing Corporation,2000:214-215.
[25] 陳曉林,牛程旺,李保華,李桂舫,王彩霞. 蘋果樹腐爛病菌產(chǎn)生細(xì)胞壁降解酶的種類及其活性分析[J]. 華北農(nóng)學(xué)報(bào),2012,27(2):207-212.
CHEN Xiaolin,NIU Chengwang,LI Baohua,LI Guifang,WANG Caixia. The kinds and activities of cell wall- degradingenzymes produced by Valsa ceratosperma[J]. Acta AgriculturaeBoreali-Sinica,2012,27(2):207-212.
[26] 李沅澤,李保華,王彩霞. 蘋果輪紋病菌產(chǎn)生細(xì)胞壁降解酶種類及其活性分析[J]. 青島農(nóng)業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),2021,38(2):85-90.
LI Yuanze,LI Baohua,WANG Caixia. The varieties and activitiesof cell wall-degrading enzymes produced by Botryosphaeriadothidea form apple fruit[J]. Journal of Qingdao AgriculturalUniversity (Natural Science Edition),2021,38(2):85-90.
[27] 張大智,詹儒林,柳鳳,李國(guó)平,趙艷龍,常金梅. 杧果細(xì)菌性角斑病菌細(xì)胞壁降解酶的致病作用[J]. 果樹學(xué)報(bào),2016,33(5):585-593.
ZHANG Dazhi,ZHAN Rulin,LIU Feng,LI Guoping,ZHAOYanlong,CHANG Jinmei. Pathogenic effect of cell wall degradingenzymes produced by pathogencausing mango bacterial leafspot[J]. Journal of Fruit Science,2016,33(5):585-593.
[28] 金勤,周國(guó)英,劉君昂,何苑皞. 細(xì)胞壁降解酶在油茶炭疽病菌致病過程中的作用研究[J]. 植物保護(hù),2017,43(3):97-102.
JIN Qin,ZHOU Guoying,LIU Junang,HE Yuanhao. The role ofcell- degrading enzymes in the pathogenic process of Camelliaoleifera diease caused by Colletotrichum gloeosporioides[J].Plant Protection,2017,43(3):97-102.
[29] 王晨芳,黃麗麗,張宏昌,韓青梅,朱琳,馮浩,康振生. 小麥-條銹菌互作過程中活性氧及保護(hù)酶系的變化研究[J]. 植物病理學(xué)報(bào),2009,39(1):52-60.
WANG Chenfang,HUANG Lili,ZHANG Hongchang,HANQingmei,ZHU Lin,F(xiàn)ENG Hao,KANG Zhensheng. Changes ofreactive oxygen species and protective enzymes in the interactionof wheat and Puccinia striiformis f. sp. tritici[J]. Acta PhytopathologicaSinica,2009,39(1):52-60.
[30] 孫嘉曼,傅俊范,嚴(yán)雪瑞,周如軍. 相關(guān)防御酶對(duì)人參銹腐病誘導(dǎo)抗性的響應(yīng)[J]. 植物病理學(xué)報(bào),2012,42(4):396-403.
SUN Jiaman,F(xiàn)U Junfan,YAN Xuerui,ZHOU Rujun. Responseof the defense enzymes to induced resistance of ginsengrusty root rot[J]. Acta Phytopathologica Sinica,2012,42(4):396-403.
[31] 韓彥卿,王鶴,王慧娜,程富英,田娜娜,閆鑫,韓淵懷. 谷子抵御白發(fā)病菌侵染的生理生化及基因表達(dá)分析[J]. 植物病理學(xué)報(bào),2020,50(6):657-665.
HAN Yanqing,WANG He,WANG Huina,CHENG Fuying,TIAN Nana,YAN Xin,HAN Yuanhuai. Physiological,biochenicaland gene expression analysis of foxtail millet aganist infectionof Sclerospora graminicola[J]. Acta Phytopathologica Sinica,2020,50(6):657-665.
[32] 葉雙華. 伊犁野果林中Juglanconis 和Wilsonomyces 屬引起的病害病原菌種類研究[D]. 烏魯木齊:新疆農(nóng)業(yè)大學(xué),2020.
YE Shuanghua. Identification of Juglanconis and Wilsonomycespathogens species in Ili Wild-Fruit Forest[D]. Urumqi:XinjiangAgricultural University,2020.

