不同基原吳茱萸藥材中質量標志物預測分析:基于網絡藥理學和指紋圖譜
邢菊玲,羅宇琴,吳文平,楊曉東,劉曉琳,李國衛,鄧成程,羅文匯1,*
(1.廣東一方制藥有限公司,廣東 佛山 528244;2.廣東省中藥配方顆粒企業重點實驗室,廣東 佛山 528244;3.湖南一方天江藥業有限公司,湖南 常德 415000)
吳茱萸為蕓香科植物吳茱萸Euodiarutaecarpa(Juss.)Benth.、石虎Euodiarutaecarpa(Juss.)Benth.var.officinalis(Dode)Huang 或疏毛吳茱萸Euodiarutaecarpa(Juss.)Benth.var.bodinieri(Dode)Huang的干燥近成熟果實,又名食茱萸、吳萸、茶辣、漆辣子等,始載于《神農本草經》,列為中品,其味辛、苦,熱,有小毒,歸肝、脾、胃、腎經,具有溫脾止瀉、散寒止痛、降逆止嘔等功效,常用于厥陰頭痛、寒疝腹痛、寒濕腳氣、經行腹痛、脘腹脹痛、嘔吐吞酸、五更泄瀉等[1]。原植物以栽培為主,全國各地都有大面積的栽種,主產于江西、廣西、安徽、重慶等地區[2],但因各地采收季節差異、異地引種及基原多樣等原因,導致各地吳茱萸藥材的質量差異非常大[3],因此,建立一套完善的吳茱萸藥材質量控制及評價體系,對于確保優質及穩定的藥材資源十分重要。
2016年劉昌孝院士首次提出中藥質量標志物(Quality markers,Q-Marker)概念,提出基于溯源與傳遞性、特有性、可測性、有效性以及處方配伍這5項核心原則,進行中藥安全性及有效性的標示性物質的質量研究[4-5]。另外,網絡藥理學(Network pharmacology)作為新興學科,是以系統生物學和藥理學為理論基礎,應用生物分子網絡分析方法揭示了“藥物-基因-靶點-疾病”之間復雜的網絡關系[6]。目前,已廣泛將其運用于單味中藥及復方中藥的研究[7-8]。本研究整合化學、數理統計及生物信息學等多種方法,進行吳茱萸網絡藥理學及指紋圖譜的潛在Q-Marker預測,旨在建立吳茱萸藥材的質量控制方法,為吳茱萸的質量控制及后續開發提供科學依據。
1 儀器與試藥
1.1 儀器
Waters高效液相色譜儀(Waters H-Class,沃特世公司);YMC Triart C18色譜柱(100mm×2.1mm,1.9μm);萬分之一分析天平(ME204E,梅特勒-托利多公司);百萬分之一分析天平(XP26,梅特勒-托利多公司);數控超聲波清洗器(KQ500D,昆山市超聲儀器有限公司);恒溫水浴鍋(上海一恒科技有限公司,型號:HWS28型);超純水系統(默克股份有限公司,Milli-Q Direct)。
1.2 試藥
新綠原酸(批號:wkq18030107,含量98%,四川維克奇生物科技有限公司);綠原酸(批號:110753-202018,含量96.1%);金絲桃苷(批號:111521-201809,含量94.9%);橙皮苷(批號:110721-202019,含量95.3%);去氫吳茱萸堿(批號:112075-202101,含量99.6%)、吳茱萸堿(批號:110802-201710,含量99.6%)、吳茱萸次堿(批號:110801-201608,含量99.7%),均購自中國食品藥品檢定研究院;乙醇(天津市富宇精細化工有限公司,分析純);甲醇(天津市富宇精細化工有限公司,分析純);磷酸(天津市富宇精細化工有限公司,色譜純);乙腈(默克股份有限公司,色譜純);水為超純水(實驗室自制)。研究所用藥材,經廣東一方制藥有限公司主任中藥師魏梅進行鑒定。鑒定結果,見表1。
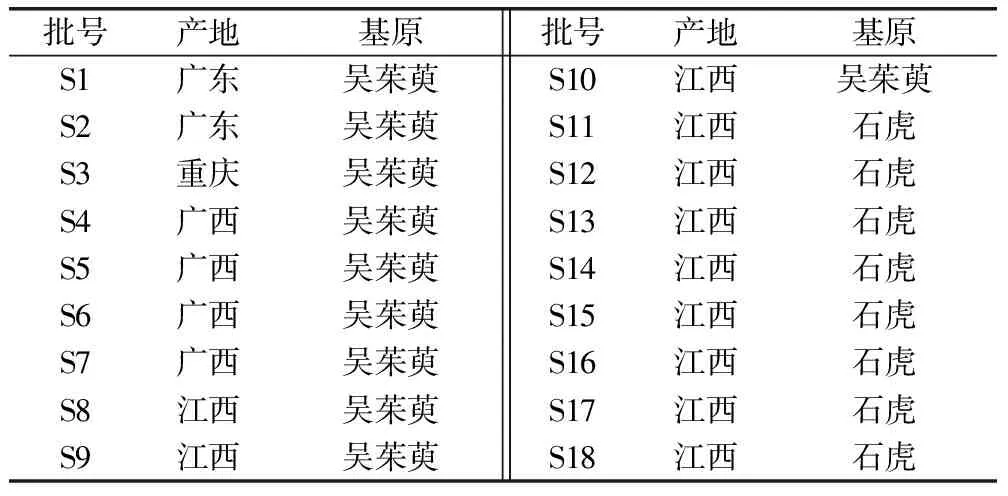
表1 吳茱萸藥材來源
2 方法與結果
2.1 網絡藥理學對吳茱萸藥材的Q-Marker預測分析
2.1.1 吳茱萸活性成分的篩選 通過中藥系統藥理學分析平臺(TCMSP(http://tcmspw.com/tcmsp.php)和中醫藥整合藥理學研究平臺(http://www.tcmip.cn/TCMIP/index.php/Home/),以“吳茱萸”為關鍵詞進行檢索,其中TCMSP數據庫獲得口服生物利用度(OB≥30%)及類藥性(DL≥0.18)的化學成分共30個,相關靶點共201個;TCMIP數據庫獲得16個有效成分,相關靶點共133個;再通過靶點標準化數據庫UniProt(https://www.uniprot.org/)上傳上述得到藥物成分靶點(target name),蛋白種屬設置為“Homo sapiens(Human)”,刪除重復靶點后共得到活性成分相關靶點,共209個。
2.1.2 蛋白質相互作用(PPI)的構建及其核心網絡篩選 將上述靶點導入在線網站STRING 11.5(https://string-db.org),選用Multiple proteins 工具,種屬設置為“Homo sapiens(Human)”,獲取蛋白相互作用關系,根據最高級篩選條件“highest confidence(≥0.9)”,得到聯系最緊密的PPI網絡,并保存TSV格式文件。將文件中的node1,node2,combined score整理導入Cytoscape 3.6.1軟件進行網絡拓撲結構分析,得到蛋白質相互作用圖(圖1),該網絡含有119節點和736條邊,網絡中靶點大小和顏色可反映節點degree值和節點之間的combined score,并應用插件Network Analyzer分析網絡節點度Degree,其中,degree值排名前3的基因分別是ESR1(degree=23)、RELA(degree=22)、PIK3R1(degree=20)、RXRA(degree=20)。
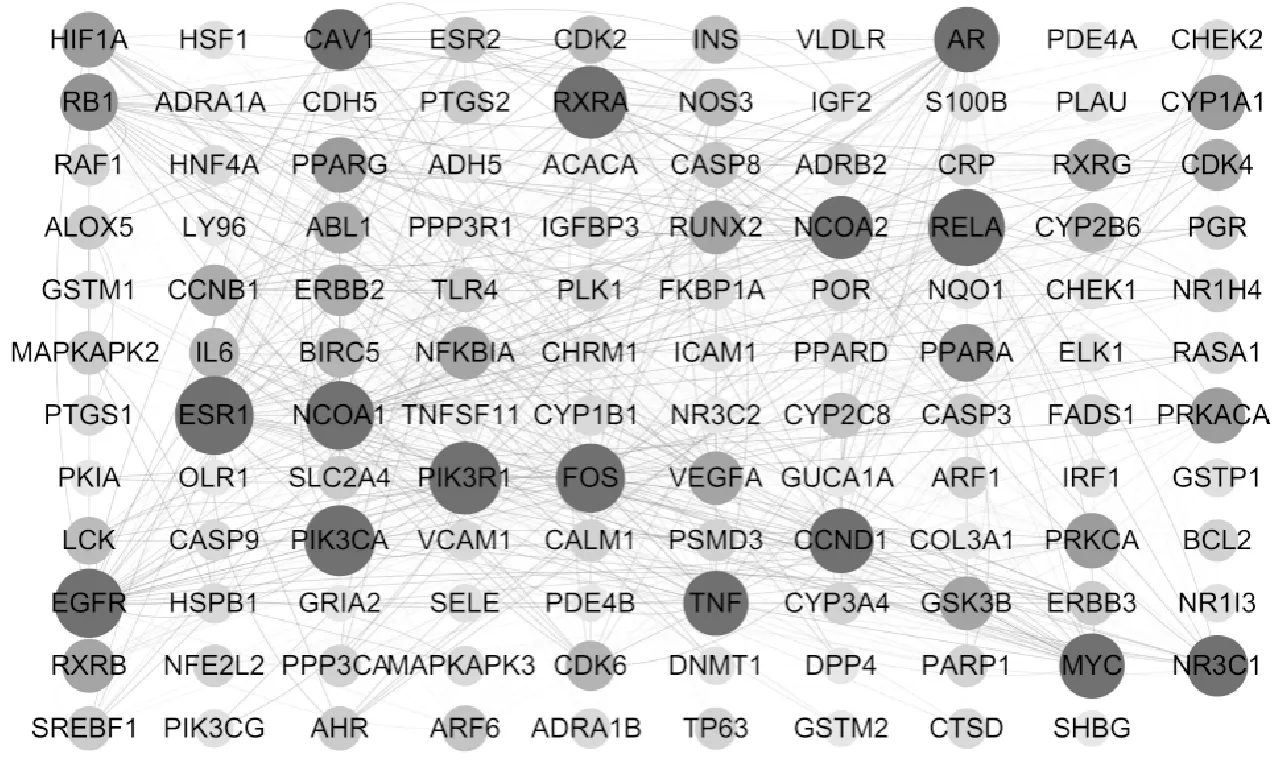
圖1 蛋白-蛋白相互作用(PPI)網絡
2.1.3 GO生物過程和KEGG通路富集分析 通過DAVID數據庫,上傳上述得到的209個靶蛋白基因并進行GO生物過程及KEGG信號通路的富集分析。以P<0.05為篩選條件,共得到了119個GO條目,主要涉及神經遞質受體、類固醇激素受體、核受體活性及配體門控離子通道活性、門控氯離子通道活性等分子功能。另外,KEGG結果分析,共富集157條信號通路(P<0.05),主要涉及脂質和動脈粥樣硬化、流體剪切應力和動脈粥樣硬化、鈣信號通路、小細胞肺癌、甲狀腺激素信號通路、血管內皮生長因子信號通路、AGE-RAGE信號通路和cAMP等信號通路,并根據P值從小到大排序,選擇P值在Top20條的KEGG信號通路進行可視化處理。見圖2。
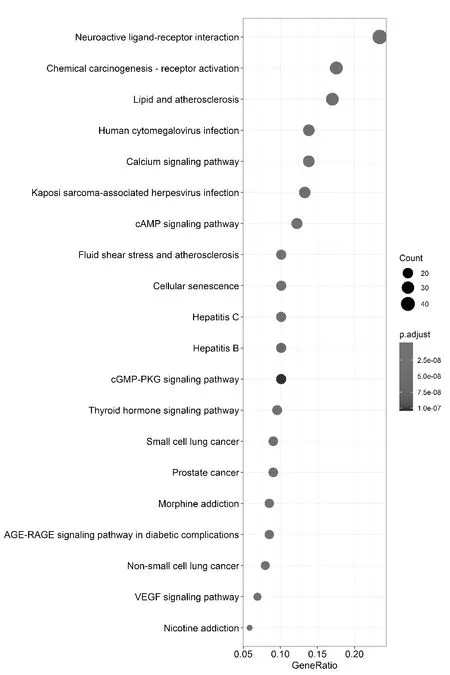
圖2 KEGG通路富集分析氣泡圖
2.1.4 “活性成分-靶點-通路網絡”的構建 將上述Top20條的KEGG信號通路及對應靶點及成分導入軟件Cytoscape 3.6.1得到吳茱萸活性成分-靶點-通路網絡圖(圖3),該網絡包含173個節點、609條邊,其中紫色菱形代表活性成分(30)、黃色橢圓代表靶點(123)、紅色六邊形代表信號通路(20),可見一種活性成分對應多個靶點,一個靶點也對應多種成分、多條通路,從而更加直觀地體現了中藥多成分、多靶點、多通路的特點,其中,網絡節點度Degree值較高的成分有槲皮素(degree=49)、Goshuyic Aci(degree=22)、異鼠李素(degree=12)、β-谷甾醇(degree=12)、花色苷(degree=10)、Synephrine(degree=8)、吳茱萸酰胺甲(degree=8)、吳茱萸堿(degree=6)、Rutalinidine(degree=5)、1-甲基-2-壬基-4-喹諾酮(degree=5)、小檗堿(degree=4)、吳茱萸次堿(degree=4)、1-甲基-2-十五烷基-4-喹諾酮(degree=4)、吳茱萸卡品堿(degree=4)、穆茱萸酰胺(degree=4),Degree值較高的靶點有AR(degree=19)、PIK3R1(degree=15)、PIK3CA(degree=15)、RELA(degree=14)、RAF1(degree=14)、CHRM1(degree=13)、CHRM3(degree=12)、CASP9(degree=12)、PRKCA(degree=12),表明吳茱萸能通過以上核心活性成分及核心靶點作用于AGE-RAGE信號通路、cAMP等信號通路來發揮作用。

圖3 活性成分-靶點-通路網絡
2.2 吳茱萸指紋圖譜定性分析
2.2.1 色譜條件 色譜柱為YMC Triart C18(100mm×2.1mm,1.9μm);流動相為乙腈(A)-0.1%磷酸溶液(B),梯度洗脫:0~9min,92% B;9~18min,92%~70% B;18~28min,70%~20% B;28~33min,20%~0% B;體積流量為0.3mL/min;柱溫為30℃;進樣量為1μL;檢測波長為254nm,理論板數按吳茱萸堿峰計算應不低于5 000。
2.2.2 對照品溶液制備 取新綠原酸對照品、綠原酸對照品、金絲桃苷對照品、橙皮苷對照品、去氫吳茱萸堿對照品、吳茱萸堿對照品、吳茱萸次堿對照品適量,精密稱定,加70%甲醇溶液制成每1mL各含5μg的混合溶液,即得。
2.2.3 供試品溶液制備 取吳茱萸藥材(過四號篩)約0.3g,精密稱定,置具塞錐形瓶中,精密加入70%甲醇50mL,稱定重量,超聲處理(功率300W,頻率40kHz)40min,放冷,再稱定重量,用70%甲醇補足減失的重量,搖勻,濾過,取續濾液,即得。
2.2.4 方法學考察 (1)精密度考察:取同一供試品溶液,按照“2.3.1”項下色譜條件,重復進樣6次,記錄色譜圖,以與吳茱萸堿參照物相應的峰為S峰,計算各特征峰與S峰相對保留時間和相對峰面積。結果顯示各特征峰的相對保留時間與相對峰面積RSD值<3%,表明儀器精密度良好。
(2)重復性考察:取同一批吳茱萸藥材粉末(過四號篩)適量,共6份,按照“2.3.4”項下方法制備供試品溶液,按照“2.3.1”項下色譜條件,進樣分析,記錄色譜圖,以吳茱萸堿峰為S峰,計算各特征峰與S峰相對保留時間和相對峰面積。結果顯示各特征峰的相對保留時間及相對峰面積的RSD值<3%,表明該方法的重復性良好。
(3)穩定性考察:取同一供試品溶液,按照“2.3.1”項下色譜條件,分別在0、2、4、6、8、12h進樣分析,記錄色譜圖,以吳茱萸堿峰為S峰,計算各特征峰與S峰相對保留時間和相對峰面積。結果顯示各特征峰的相對保留時間及相對峰面積的RSD值<3%,表明供試溶液在12h內穩定性良好。
2.2.5 樣品測定 取18批吳茱萸樣品,按照“2.3.3”項下方法制備供試品溶液,按照“2.3.1”項下色譜條件進樣分析,得到18批吳茱萸UPLC指紋圖譜。將所得數據導入《中藥色譜指紋圖譜相似度評價系統》(2012 年版),建立指紋圖譜并生成指紋圖譜共有模式(圖4)。指紋圖譜中共標定出18個共有峰,通過與對照品比對,分別指認出新綠原酸(峰4)、綠原酸(峰6)、金絲桃苷(峰9)、橙皮苷(峰11)、去氫吳茱萸堿(峰12)、吳茱萸堿(峰14)、吳茱萸次堿(峰15)等7個共有峰,其中,吳茱萸堿(峰14)出峰位置適宜,色譜峰較穩定、響應值高,故確定為參照峰S。
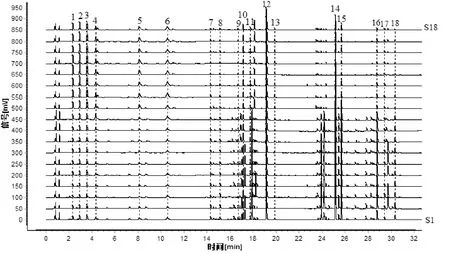
圖4A 吳茱萸UPLC指紋圖譜疊加
2.2.6 數據分析 (1)相似度分析:對18批樣品的指紋圖譜峰面積(表2),通過《中藥色譜指紋圖譜相似度評價系統》(2012B)軟件進行匹配,以平均數法進行共有峰標識,分別得到不同來源樣品相似度。計算結果,見表3。

表3 18批吳茱萸樣品指紋圖譜相似度分析結果
從上述相似度分析結果來看,結合基原差異,得到18批樣品與對照模式相似度為:吳茱萸基原相似度為0.993~0.984、石虎基原相似度為0.531~0.816,從整體來看,以吳茱萸基原樣品相似度較高。
(2)聚類分析:對18批吳茱萸藥材指紋圖譜峰面積進行分析,通過SPSS 20.0版軟件進行系統聚類,采用組間連接法,選用平方歐氏距離為樣品間距離計算方法,得到聚類分析結果,見圖5。
從上圖可知,可將吳茱萸藥材分為2類,其中S1~S10為第一類,均為吳茱萸基原藥材;S11~S18為第二類,均為石虎基原藥材,說明不同基原吳茱萸藥材差異顯著,與相似度分析結果一致。
(3)主成分分析:應用SPSS 20.0軟件對不同產地吳茱萸藥材指紋圖譜峰面積進行分析,進行標準化處理后進行主成分分析,得出相關矩陣的特征值及其方差,抽樣適合性檢驗系數KMO值=0.624>0.6,巴特利特球形度P= 0.00<0.05,主成分分析結果見表4、圖6。由表4可知,前2個成分的特征值>1,對總方差的累積貢獻率達88.737%,故選擇上述兩個成分作為第1和第2主成分,且碎石圖中前2個特征值的變化曲線陡峭,表明這2個主成分因子可作為吳茱萸藥材整體質量評價指標。
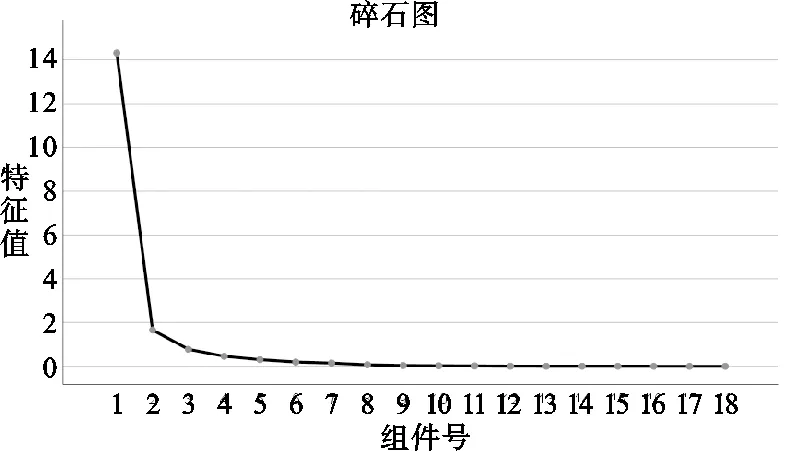
圖6 碎石圖
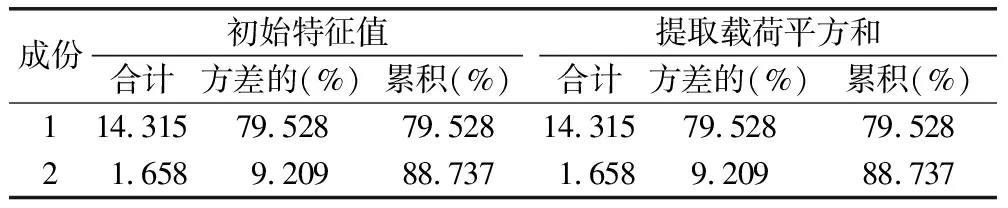
表4 解釋的總方差
成分矩陣見表5,由表5可知,峰主成分峰1~3、9、11、13~16、18在主成分1上載荷絕對值最大,峰12主成分3上的載荷量最大。說明包括峰14(吳茱萸堿)、峰15(吳茱萸次堿)等在內的生物堿類成分及其他有機酸類成分對吳茱萸藥材整體質量影響較大。
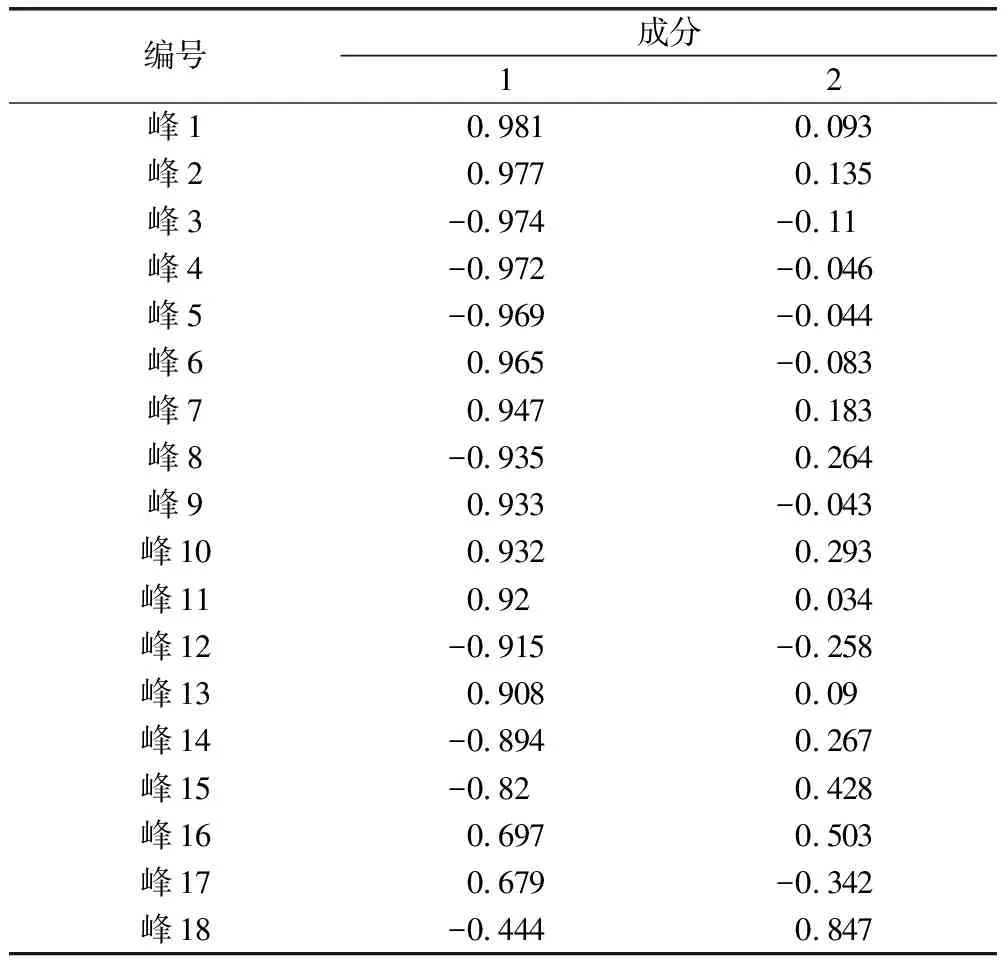
表5 成分矩陣
應用主成分分析方法,根據因子得分系數矩陣及特征向量法,得出綜合評價函數Y綜合得分表達式為:Y=0.079 528×Y1+0.009 209×Y2,其中Y1、Y2為各批次樣品與2個主成分得分。計算所得18批樣品的主成分得分,見表6,從分析結果可知,相較于石虎,吳茱萸基原綜合得分較高,藥材質量總體上較好。
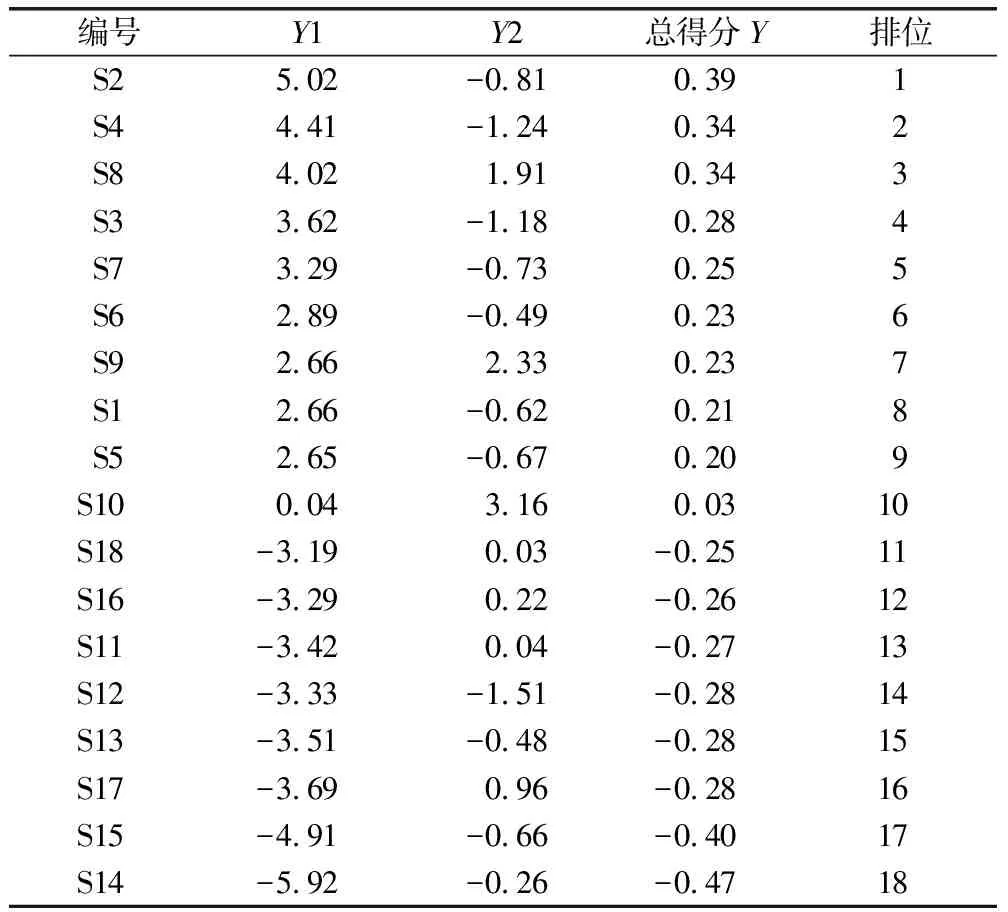
表6 樣品得分
3 討論
吳茱萸為臨床常用中藥,其原植物來源于蕓香科吳茱萸屬植物吳茱萸、石虎或疏毛吳茱萸的干燥未成熟果實。其植物形態特征較為相似,目前藥用的吳茱萸主要以栽培為主,野生較少,從分布情況來看,吳茱萸主要分布于江西、貴州、重慶部分地區,石虎主要分布在江西、湖南等地,疏毛吳茱萸主要分布于貴州、浙江、陜西等省的部分地區[9]。熊紅紅[10]對吳茱萸商品藥材流通情況進行了調查,發現吳茱萸主要商品藥材以原植物來源的吳茱萸的各種栽培品種為主,以石虎來源為輔,疏毛吳茱萸在市場上所占比例很小,且疏毛吳茱萸產地較少,種植面積較小。因此,本研究結合吳茱萸資源分布情況及研究的代表性,綜合收集了來自江西、廣東等產地的多批吳茱萸、石虎樣本,由相似度分析結果可知,吳茱萸基原相似度在0.993~0.984,石虎基原相似度在0.531~0.816,即吳茱萸基原樣品相似度較高,且與石虎基原樣品有顯著區別;由聚類分析結果可知,18批次吳茱萸樣品可分為2類,其中S1~S10吳茱萸基原藥材歸為第一類,S11~S18石虎基原藥材歸為第二類,結果同相似度分析。說明不同產地、不同生長環境對吳茱萸藥材質量有一定的影響。
本研究通過網絡藥理學的方法進行吳茱萸藥材Q-Marker的預測分析,共涉及有效成分30個、相關靶點209個,通過PPI網絡篩選出ESR1、RELA、PIK3R1、RXRA等關鍵靶點;通過GO、KEGG通路富集分析篩選出癌癥通路、AGE-RAGE信號通路和cAMP等關鍵通路;構建的“活性成分-靶點-通路網絡”進一步表明,吳茱萸中槲皮素、異鼠李素、吳茱萸堿、吳茱萸次堿等活性成分能通過激活AR、PIK3R1、PIK3CA等核心靶點作用于癌癥通路、cAMP等信號通路,發揮關鍵性作用。現代研究表明,吳茱萸中的喹唑啉咔生物堿吳茱萸堿能在不影響線粒體功能的前提下激活293T細胞AMPK信號通路,從而發揮作用[11,12]。另外,陽霞[13]研究發現,吳茱萸堿還可作為Notch3表觀遺傳修飾劑,抑制Notch通路激活,有效阻滯細胞周期,抑制細胞增殖,具有預防肺癌發生及降低腫瘤惡性等作用。本研究結果與以上報道相符,反映了本研究數據的可靠性。在活性成分-靶點-通路網絡中degree值排名靠前的核心成分有槲皮素、Goshuyic Acid、異鼠李素、β-谷甾醇、花色苷、Synephrine、吳茱萸果酰胺I、吳茱萸堿、Rutalinidine、1-甲基-2-壬基-4-喹諾酮、小檗堿、吳茱萸次堿、1-甲基-2十五烷基-4(1H)-喹諾酮、吳茱萸卡品堿、穆茱萸酰胺,其中槲皮素、異鼠李素、β-谷甾醇、花色苷以及小檗堿存在于多種中藥材中,具有多種生物活性[14-16],因此不能作為辨別藥材質量的標志性成分;其余的均為吳茱萸生物堿類化合物,根據其結構類型可分為三類、吲哚類生物堿(吳茱萸果酰胺甲、吳茱萸堿、吳茱萸次堿)、喹諾酮類生物堿(1-甲基-2-壬基-4-喹諾酮、1-甲基-2-十五烷基-4-喹諾酮、吳茱萸卡品堿)及其他類生物堿(辛弗林、Rutalinidine、穆茱萸酰胺),其中吳茱萸堿和吳茱萸次堿的含量最高,為吳茱萸的主要活性成分,同時也是《中國藥典》中吳茱萸的含量檢測指標性成分,具有強心、調節心律、抗動脈粥樣硬化、降血脂、降血糖、抗炎、抗腫瘤、抗多種癌癥(肺癌、肝癌、胃癌、結直腸癌、宮頸癌)等多重藥理功效[17-27]。因此,基于化學成分的有效性,可將吳茱萸堿和吳茱萸次堿作為吳茱萸的Q-Marker。
本研究通過收集18批吳茱萸基源和石虎基原藥材,通過UPLC法建立指紋圖譜,共確立了18個共有峰,并指認了7個色譜峰(新綠原酸、綠原酸、金絲桃苷、橙皮苷、去氫吳茱萸堿、吳茱萸堿、吳茱萸次堿)。該方法具有良好的精密度、穩定性和重復性,能有效定性鑒別吳茱萸、石虎基原藥材;同時,數理統計結果表明,吲哚類生物堿類成分吳茱萸堿、吳茱萸次堿類對吳茱萸藥材整體質量影響較大,說明吳茱萸Q-Marker的選取符合化學特性。
由于中藥化學成分復雜,具有多成分、多靶點、多通路的特點,建立質量標準并進行質量控制研究是保障臨床療效和促進中醫藥發展的關鍵性問題,本研究基于Q-Marker“五原則”,通過吳茱萸網絡藥理學、指紋圖譜及數理統計等多種方法,從化學和生物信息學等角度預測吳茱萸藥材潛在的Q-Marker,為后期吳茱萸質量評價標準的提升及作用機制的深入研究提供了參考依據。

