饑餓脅迫對粘蟲幼蟲糖原、海藻糖含量和蛻皮激素滴度變化的影響
李文平,張亞玲,楊順義,王貞霖,金秋彤
(甘肅農(nóng)業(yè)大學(xué) 植物保護學(xué)院,甘肅省農(nóng)作物病蟲害生物防治工程實驗室,蘭州 730070)
粘蟲Mythimnaseparata(Walker)為鱗翅目Lepidoptera夜蛾科Noctuidae昆蟲,是著名的遷飛性、暴食性、多食性害蟲。主要危害玉米、小麥、水稻等禾谷類糧食作物[1]。據(jù)史料記載,中國曾有多項粘蟲暴發(fā)成災(zāi)的記錄,且在多個省份均有發(fā)生,造成了嚴重的經(jīng)濟損失,甘肅等西北地區(qū)的發(fā)生為害以2代粘蟲為主[2-3]。
粘蟲暴發(fā)時,幼蟲擴散和成蟲遷飛的規(guī)模龐大,極易出現(xiàn)食物短缺的現(xiàn)象[4]。Gaurav等[5]研究了粘蟲食性的能量學(xué)、不同齡期組織生長的能量學(xué)以及同化速率和呼吸速率,發(fā)現(xiàn)幼蟲的代謝率主要取決于食物的消耗。昆蟲以糖原(glycogen)形式將能量儲存在脂肪體中。孟竹等[6]發(fā)現(xiàn)連續(xù)饑餓72 h的家蠶Bombyxmori幼蟲脂肪體中糖原和甘油三酯的含量持續(xù)降低;Lutz等[7]研究發(fā)現(xiàn)非洲果甲蟲Pachnodasinuata在饑餓狀態(tài)下血淋巴中碳水化合物含量降低,脂肪體中糖原和總脂含量減少。昆蟲的海藻糖(trehalose)和糖原之間可以相互轉(zhuǎn)化,在逆境中起著關(guān)鍵作用[8-9]。孟竹等[6]發(fā)現(xiàn)在饑餓家蠶幼蟲48~72 h之間血淋巴中海藻糖濃度升高;Hibshman等[10]發(fā)現(xiàn)秀麗隱桿線蟲Caenorhabdataselegans的FoxO/daft 6能通過轉(zhuǎn)移碳代謝促進海藻糖合成以提高線蟲抗饑餓能力。蛻皮激素(ecdysone,E)能夠參與調(diào)控昆蟲的生長發(fā)育,對環(huán)境脅迫進行響應(yīng)[11]。蛻皮激素主要由幼蟲前胸腺(Prothoracic gland,PG)及成蟲生殖腺合成,前胸腺主要合成前體E,之后釋放到血淋巴變成有活性的20-羥基蛻皮酮(20-hydroxyecdysone,20E)[12-13]。已有研究表明,當黑腹果蠅Drosophilamelanogaster遭遇食物缺乏,饑餓信號會激活蛻皮激素的合成,使20E濃度明顯升高[14];Chen等[15]發(fā)現(xiàn)在饑餓條件下,家蠶幼蟲會通過增加蛻皮激素的生成來提高存活率。蛻皮激素在昆蟲體內(nèi)與海藻糖共同作用,互相影響。Tan等[16]從綠盲蝽Apolyguslucorum中克隆獲得AlEcR-B,并對其表達譜進行了研究,發(fā)現(xiàn)在降低AlEcR-B后,海藻糖分解代謝增加。
為探究饑餓對粘蟲不同齡期幼蟲代謝的影響,本研究對4~6齡幼蟲進行饑餓處理,分別測定正常和饑餓條件下幼蟲體內(nèi)糖原、海藻糖含量和蛻皮激素滴度的變化情況,旨在探討粘蟲幼蟲受到饑餓脅迫時主要能源物質(zhì)的變化規(guī)律,為進一步揭示饑餓肋迫下粘蟲幼蟲體內(nèi)關(guān)鍵因子的調(diào)控機制以及繁殖適應(yīng)性奠定基礎(chǔ)。
1 材料與方法
1.1 材 料
1.1.1 供試昆蟲 粘蟲由甘肅農(nóng)業(yè)大學(xué)植物保護學(xué)院農(nóng)藥實驗室自種的新鮮玉米葉飼養(yǎng)。
1.1.2 供試藥劑及試劑 乙醚、氫氧化鉀、無水乙醇、濃鹽酸、蒽酮、濃硫酸、三氯乙酸,苯基硫脲,均為國產(chǎn)分析純;昆蟲蛻皮激素ELISA檢測試劑盒(上海優(yōu)選生物科技有限公司)。
1.1.3 主要儀器 人工氣候箱、電熱恒溫鼓風(fēng)干燥箱、高壓滅菌鍋、高速冷凍離心機、電熱恒溫水浴鍋、電子天平、分光光度計等。
1.2 試驗方法
1.2.1 飼養(yǎng)條件 1~3齡幼蟲用養(yǎng)蟲缸(d=20 cm,h=30 cm)群體飼養(yǎng),4齡開始用餐盒 (15 cm×10 cm×5 cm)飼養(yǎng),密度為10頭/盒,溫度為(25±1)℃,相對濕度為(70±5)%,光周期為L14∶D10,光照度2 000~3 000 lx,在實驗室人工氣候箱中飼養(yǎng)[17]。
1.2.2 飼養(yǎng)方法 將卵卡放入養(yǎng)蟲缸中,養(yǎng)蟲缸內(nèi)加適量鮮玉米葉,濕棉球保濕,缸口蓋以黑布,保持空氣通透,用皮筋扎緊以防初孵幼蟲逃逸;幼蟲孵化后,采用新鮮幼嫩玉米苗飼喂,每日更換玉米苗并清除糞便(用篩子篩出),保持養(yǎng)蟲缸的良好環(huán)境,防止幼蟲感染疾病。4齡開始轉(zhuǎn)移至餐盒飼養(yǎng)[1]。
1.2.3 饑餓處理 幼蟲4齡剛蛻皮開始,將試驗分為兩組,以正常飼養(yǎng)為對照,另一組進行饑餓處理,饑餓時間過后正常飼養(yǎng)[18]。
5齡和6齡處理方法同4齡。
1.3 糖原及海藻糖含量
1.3.1 不同組織樣品的收集 分別選取生長健康、大小基本一致的粘蟲幼蟲4~6齡幼蟲,用乙醚麻醉至死,在70 ℃干燥箱中烘干,碾磨成粉,待用。每處理取10頭幼蟲,以正常飼養(yǎng)為對照,重復(fù)3次[19]。
1.3.2 試劑 0.2 mg/mL葡萄糖標準溶液:取葡萄糖200 mg,用雙蒸水定容至1 000 mL,待用;0.2% 蒽酮試劑:將0.2 g蒽酮溶于100 mL 95% 硫酸溶液中。
1.3.3 糖原的提取 取0.02 g樣品移入1.5 mL離心管中,加入30% KOH 1 mL,沸水浴30 min,加無水乙醇0.5 mL混勻后離心10 min (4 000 r/min),棄上清液,再在沉淀物中加0.6 mol/L鹽酸1 mL,沸水浴2 h后離心去沉淀,定容至1 mL,待用[19]。
1.3.4 海藻糖的提取 取0.02 g樣品移入1.5 mL離心管中,加入10%三氯乙酸溶液1 mL于 5 000 r/min離心5 min,將上清液轉(zhuǎn)入1.5 mL離心管中,定容至1 mL,待用[19]。
1.3.5 測定方法 糖原和海藻糖測定均采用蒽酮比色法[20],取樣100 L,加蒽酮試劑2.4 mL,搖勻后沸水浴10 min,立刻冰浴2 min,冷卻后于620 nm測定吸光度,標樣為葡萄糖。糖原值為所得數(shù)值乘以0.927[19]。
1.4 蛻皮激素滴度測定
1.4.1 樣品收集 分別選取生長健康、大小基本一致的粘蟲幼蟲4~6齡幼蟲,每24 h取樣1 次,至該齡期結(jié)束。收集血淋巴,于幼蟲腹部節(jié)間膜處扎一小洞,然后輕壓腹部,將流出的血淋巴滴入置于冰浴上的離心管內(nèi),每毫升血淋巴加5 L苯基硫脲,備用。每齡取剛蛻皮成功的幼蟲做試蟲,取樣時間分別為1 d,2 d,3 d。每處理取10頭幼蟲,以正常飼養(yǎng)為對照,重復(fù)3次[21]。
1.4.2 蛻皮激素滴度測定 根據(jù)昆蟲蛻皮激素ELISA檢測試劑盒使用說明書測定不同時期粘蟲20E滴度。
1.5 數(shù)據(jù)處理
試驗數(shù)據(jù)采用Excel 2016和 SPSS 24.0軟件進行統(tǒng)計分析,采用Duncan’s新復(fù)極差法 (P<0.05)進行差異顯著性分析。
2 結(jié)果與分析
2.1 糖原含量測定結(jié)果
由圖1可知:各齡期饑餓第1天時的糖原含量均低于對照組,且4齡饑餓組相比對照組顯著降低,各齡期饑餓第2天和第3天時的糖原含量均顯著低于對照組。從變化規(guī)律來看,對照組 4~6齡糖原含量均呈上升趨勢,各齡期飼喂3 d的糖原含量分別達到43.06 mg/g、43.18 mg/g和37.30 mg/g;饑餓組隨處理天數(shù)的增加,各齡期幼蟲的糖原含量逐漸減少,饑餓第3天時分別為15.11 mg/g、16.13 mg/g和15.50 mg/g。除5齡1 d和6齡1 d的處理組與對照組無顯著差異外,其余饑餓組的糖原含量均顯著低于對照組。
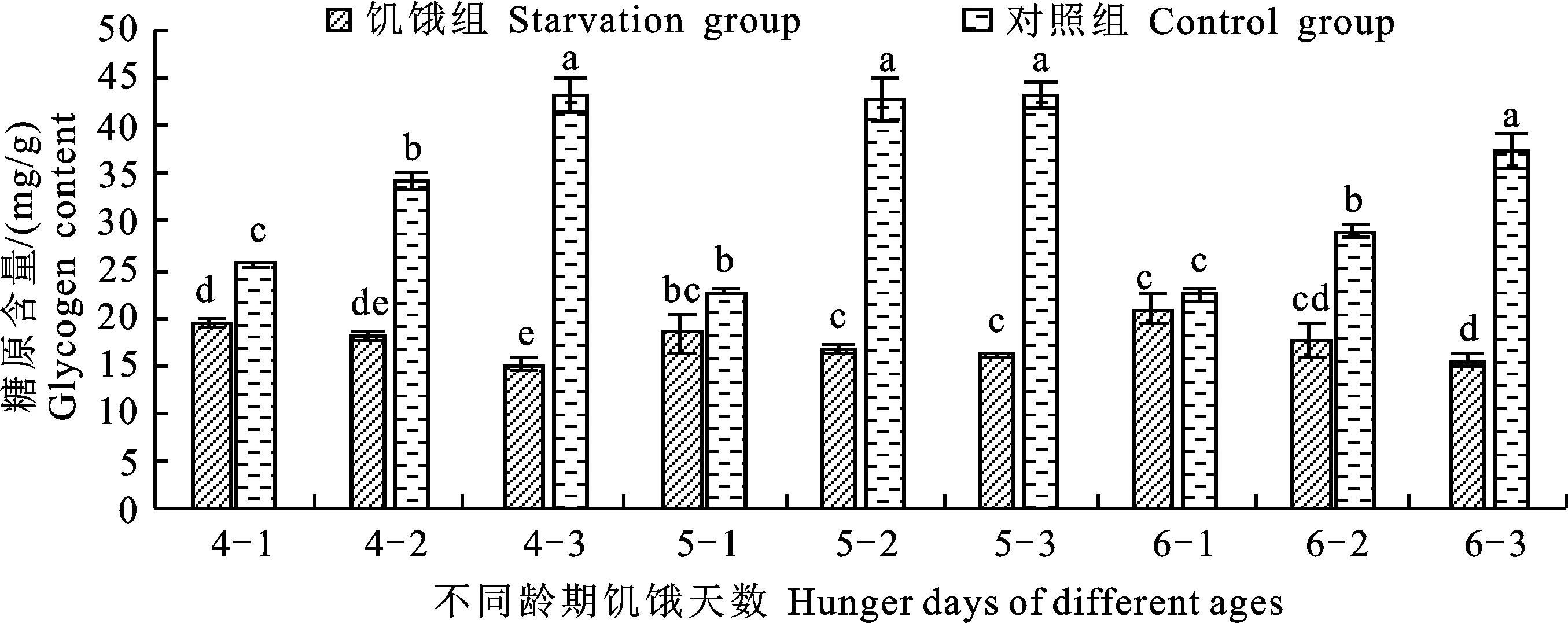
不同小寫字母表示差異顯著(P<0.05);圖中4-1,4-2等分別表示4齡饑餓1 d,4齡饑餓2 d等。下同
2.2 海藻糖含量測定結(jié)果
如圖2所示:各齡期饑餓第1天時的海藻糖含量均低于對照組,且5齡和6齡饑餓組相比對照組顯著降低,各齡期饑餓第2天和第3天時的海藻糖含量均顯著高于對照組。從變化規(guī)律來看,隨饑餓天數(shù)的增加,各對照組的海藻糖含量變化均呈現(xiàn)先下降再升高的趨勢,饑餓組4~6齡的海藻糖含量均逐漸升高,各齡期饑餓3 d的海藻糖含量分別達到35.41 mg/mL、39.56 mg/mL和40.06 mg/mL。
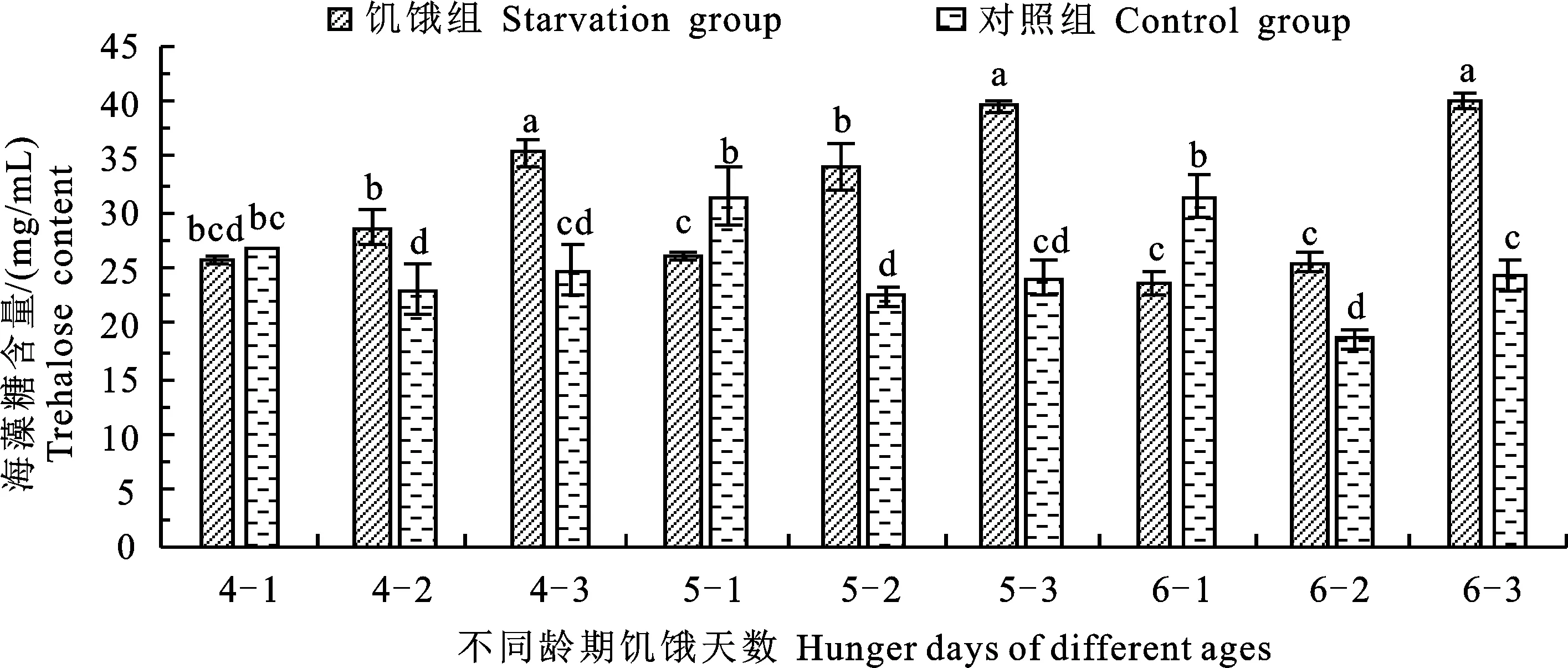
圖2 不同齡期及不同饑餓天數(shù)處理下粘蟲幼蟲的海藻糖含量變化Fig.2 Changes of trehalose content in M.separata larvae under different days of starvation and different instars
2.3 蛻皮激素含量測定結(jié)果
由圖3可知:4齡饑餓組在處理第1天和第3天時的20E滴度均高于對照組,且饑餓第3天時與對照組差異顯著,饑餓第2天時的20E滴度則顯著低于對照組。從變化規(guī)律來看,饑餓組在第1~3天時的20E滴度逐漸升高,對照組的20E滴度則是1~2 d時逐漸升高,在第2天時達到最大值49.71 ng/L,第3 天時顯著降低,對照組有部分幼蟲在4齡第3 天時即蛻皮進入5齡,而饑餓組20E滴度一直處于不斷上升的狀態(tài),在第3 天時20E滴度達到39.92 ng/L,較對照第2天時的49.71 ng/L低9.79 ng/L,饑餓組在處理第3天時未見蛻皮,其生長發(fā)育明顯滯后于對照組。5齡饑餓組饑餓2 d和3 d的20E滴度均顯著低于對照組,從變化規(guī)律來看,5齡對照組的20E滴度隨天數(shù)的增加逐漸升高,饑餓組亦呈升高趨勢,但其第2 天和第3 天的20E滴度均顯著低于對照組,說明5齡幼蟲受饑餓脅迫后也出現(xiàn)生長發(fā)育減緩的現(xiàn)象。6齡饑餓組饑餓1~3 d的20E滴度均顯著高于對照組,從變化規(guī)律來看,6齡對照組的20E滴度隨天數(shù)的增加而逐漸升高,但增長幅度較小,饑餓組20E滴度則均顯著高于對照組,說明6齡幼蟲受到饑餓脅迫后,會通過增加體內(nèi)蛻皮激素含量以便提前進入蛹期,以此來應(yīng)對饑餓的環(huán)境壓力。
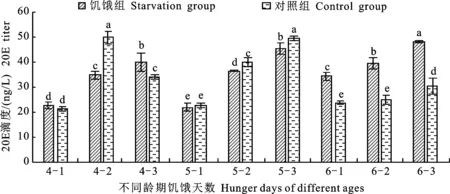
圖3 不同齡期不同饑餓天數(shù)處理下粘蟲幼蟲的20E滴度變化Fig.3 Changes of 20E titers of M.separata larvae under treatment of different days of starvation and different instars
隨處理天數(shù)的增加,4~6齡饑餓組的20E滴度均呈現(xiàn)逐漸升高的趨勢,各齡期饑餓3 d的20E滴度分別達到39.92 ng/L、45.36 ng/L和48.03 ng/L。
3 討論與結(jié)論
試驗結(jié)果表明:4~6齡幼蟲饑餓第1天時的糖原含量均低于對照組,且隨處理時間的延長呈不斷降低的趨勢,說明幼蟲受到饑餓脅迫后,糖原被消耗代謝,用于抵抗外界逆境;隨饑餓時間的延長,4~6齡幼蟲的海藻糖含量逐漸升高,梯度變化明顯,說明在幼蟲受到饑餓后,海藻糖含量會急劇增加,在第一時間參與代謝,供應(yīng)機體需要以應(yīng)對逆境條件。
4齡對照組的20E滴度先升高后降低,且在試驗過程中發(fā)現(xiàn)有部分幼蟲在4齡第3天即蛻皮進入5齡,而饑餓組第3 天時的20E滴度為 39.92 ng/L,較對照組的最大值49.71 ng/L低9.79 ng/L且差異顯著,饑餓組在處理第3天時未見蛻皮,其生長發(fā)育明顯滯后于對照組。5齡饑餓第2天和第3天的20E滴度均顯著低于對照組,說明幼蟲在饑餓脅迫下生長發(fā)育減緩,這與鞠珍等[22]發(fā)現(xiàn)饑餓后的美國白蛾Hyphantria cunea幼蟲生長發(fā)育歷期增長的研究結(jié)果一致。
6齡饑餓組20E滴度均顯著高于對照組,有部分6齡幼蟲在饑餓第3天時會進入預(yù)蛹期,說明20E可減少昆蟲食物的消耗,使得末齡幼蟲提前化蛹,在受到饑餓時起到一定的調(diào)控作用,這與Wang等[23]的研究結(jié)果一致,發(fā)現(xiàn)對家蠶末齡幼蟲注射20E 24 h后,家蠶幼蟲停止取食并進入游走期。
糖原、海藻糖和蛻皮激素在昆蟲的生長發(fā)育、生理代謝等生長活動中都有著不可或缺的作用,當粘蟲幼蟲受到饑餓脅迫時,它們發(fā)揮著重要的平衡和協(xié)調(diào)作用。本試驗通過對粘蟲幼蟲糖原、海藻糖和蛻皮激素的含量以及變化規(guī)律的觀察分析,發(fā)現(xiàn)饑餓對粘蟲幼蟲正常生長代謝活動的影響較大,因此,在粘蟲的綜合防治中可以從饑餓方面通過抑制糖原、海藻糖的代謝及相互轉(zhuǎn)化,或打亂粘蟲生理代謝平衡的手段,開發(fā)昆蟲生長調(diào)節(jié)劑等昆蟲激素類殺蟲劑。

