新疆野生核桃 JfDREB1A基因的克隆與原核表達分析
韓立群 ,張 捷 ,趙 鈺 ,梅 闖,馬 凱
(1.新疆農業大學 園藝學院,烏魯木齊 830052; 2.新疆農業科學院 園藝作物研究所,新疆特色果蔬基因組研究與遺傳改良重點實驗室,農業部新疆地區果樹科學觀測試驗站,烏魯木齊 830091; 3.新疆林業學校,烏魯木齊 830026)
低溫作為一種非生物脅迫已經成為世界最為嚴重的災害之一,影響植物的生長發育,嚴重時會造成植物的死亡[1-2]。揭示植物感知低溫信號的機理對探究植物是如何避免低溫損傷十分必要[3]。目前,CBF(C-repeat binding factor)轉錄因子又稱為DREB1(Dehydration-responsive element binding factor 1),其介導的低溫信號轉導是研究最為透徹的植物低溫響應機制[4-5]。DREB1/CBF轉錄因子編碼一個植物所特有的高度保守DNA結合結構域(AP2結構域)和兩個特征序列(PKK/RPAGRTKFRETRHP和DSAWR)[6-7]。低溫脅迫下,DREB1/CBF的表達受到誘導,結合其下游低溫應答相關基因啟動子區域的順式作用元件,從而調控基因的表達,增強植物的低溫耐受性[1, 8],其功能作用已經在榛子(Corylusheterophylla)[9]、野扁桃(Amygdalusledebouriana)[10]、新疆野蘋果(Malussieversii)[11]、歐李(Cerasushumilis)[12]等多種果樹中得到初步驗證。
核桃(JuglansregiaL.)屬胡桃科核桃屬落葉禾木,是世界四大堅果之一,低溫會嚴重影響其正常生長發育,制約核桃產業的發展和經濟效益的提高[13]。野生植物經極端自然環境選擇,是挖掘植物優異抗性基因的重要材料[2]。新疆野生核桃(JuglansfallaxD.)是中國珍稀野生植物資源,是新疆栽培核桃的直系祖先,在長期進化過程中形成了許多特有變異,具有很大的挖掘利用潛力[14-15]。韓立群等[16]前期研究發現,新疆野生核桃群落中存在具有較強耐寒能力的株系。然而,關于新疆野生核桃低溫響應關鍵基因的挖掘鮮有報道。因此,本研究以經過初步鑒定具有較強耐寒能力的新疆野生核桃‘小矩圓核桃’類型為材料,克隆其低溫響應關鍵基因JfDREB1A,進行生物學與表達水平分析,構建原核表達載體并誘導目的蛋白表達,以期為揭示該蛋白在調控新疆野生核桃響應低溫脅迫中的功能作用奠定基礎。
1 材料與方法
1.1 試驗材料及處理
試驗材料為新疆鞏留縣野核桃溝自然保護區中的‘小矩圓核桃’類型。2020-09-28,在核桃果實成熟時,收集種子,帶回實驗室置于4 ℃冰箱中沙藏3個月,然后冷水浸泡催芽,當種子露白時播種于營養缽(20 cm×20 cm)中,基質為草炭土∶珍珠巖=3∶1(體積比),每個營養缽點播1粒種子,共播種100粒,獲得幼苗90株。當幼苗生長至30 cm高時,選擇生長良好且長勢一致的幼苗5株,采取頂葉下2~5片嫩葉液氮速凍,置于 -80 ℃冰箱中保存,備用;選擇幼苗35株,用于低溫脅迫下基因的表達量測定。
1.2 方 法
1.2.1JfDREB1A基因克隆 使用天根公司的植物總RNA提取試劑盒提取新疆野生核桃葉片中的總RNA,通過High Capacity cDNA反轉錄試劑盒(Thermo Fisher Scientific,上海)推薦反應體系合成cDNA第一鏈。根據GenBank公布的核桃CBF基因(登錄號:AFV93473.1)設計引物(表1),使用PrimeSTAR GXL Premix(TaKaRa,大連)按照說明書進行PCR反應,反應體系:PrimeSTAR GXL Premix 12.5 μL,上、下游引物0.5 μL,cDNA模板1 μL,加ddH2O水至25 μL;反應程序:98 ℃預變性5 min,98 ℃變性10 s, 56 ℃退火15 s,72 ℃延伸60 s,30個循環。擴增產物經1%瓊脂糖凝膠電泳檢測后,使用MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0進行純化(TaKaRa,大連),回收的產物與pMD19-T載體(TaKaRa,大連)連接,轉化大腸桿菌DH5α感受態細胞,測序得到新疆野生核桃JfDREB1A基因的cNDA全長序列。

表1 引物列表Table 1 List of primers
1.2.2 生物信息學分析 利用ExPASy ProtParam軟件預測JfDREB1A蛋白質的等電點和相對分子質量,利用Predict Protein和SMART軟件預測JfDREB1A蛋白的二級結構和保守功能域,利用DNAMAN軟件進行同源序列分析,利用MEGA7軟件繪制系統發育樹。
1.2.3JfDREB1A基因的表達水平分析 將幼苗置于4 ℃人工培養箱(DLRX-450B-LED,錦玟,上海)中進行脅迫處理,時間設置為0、1、2、4、8、12和24 h,分別取頂葉下2~5片嫩葉液氮速凍,置于-80 ℃冰箱保存,備用。使用Primer 5.0設計引物,以18S rRNA作為內參,利用qTOWER 3 G熒光定量PCR儀(Analytikjena,德國),使用SYBR Green qPCR Master Mix kit(賽維爾,武漢)方法對幼苗在低溫下的基因表達水平進行分析。qPCR反應體系:qPCR Mix 7.5 μL,上、下游引物0.75 μL,cDNA模板2 μL,加ddH2O水至15 μL;反應程序:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火30 s,40個循環,熔解曲線(95 ℃~65 ℃,0.3 ℃/15 s),3次生物學重復試驗,采用2-ΔΔCt方法計算相對表達量。
1.2.4JfDREB1A基因的原核表達載體構建 設計帶有BamHI和SalI的酶切位點引物(表1),以JfDREB1A質粒為模板,利用高保真聚合酶TransStar KD Plus(TransGen)進行PCR擴增,按照孫偉等[17]方法進行酶切連接轉化,菌液PCR及測序鑒定陽性克隆。將測序正確的重組質粒轉化大腸桿菌DE3感受態細胞,菌液PCR篩選陽性克隆,用于接下來的JfDREB1A蛋白誘導試驗。
1.2.5 融合蛋白在大腸桿菌中的誘導表達 取重組菌液接種于2 mL液體LB培養基中,37 ℃、200 r/min培養12~16 h。次日使用1∶50配比轉接到10 mL現配LB液體培養基中,待菌液濃度達到OD600為0.6~0.8時(約3 h),加入(PTG(Isopropyl beta-D-thiogalacyranoside)至終濃度分別為0、0.2、0.5、1.0、1.5和2.0 mmol/L, 37 ℃誘導4 h。0.5 mmol/L IPTG誘導4 h的pET-28a空載體作為對照。取100 μL菌液, 12 000 r/min,離心2 min,棄上清,用40 μL PBS 懸浮菌體,加入10 μL 5×SDS Loading Buffer, 95 ℃變性5 min,冷卻至4 ℃后備用。取10 μL進行12% SDS-PAGE電泳檢測,確定最適誘導劑濃度。
按上述方法,以終濃度0.5 mmol/L IPTG進行誘導表達,以相同條件的pET-28a轉化菌為對照,37 ℃條件下培養0、2、4和6 h后分別收集菌液,進行12% SDS-PAGE電泳檢測,確定最適培養時間。
1.2.6 數據分析 采用Microsoft Office Excel 2019進行試驗數據分析及圖表制作,低溫脅迫下的表達水平采用SPSS 21.0軟件統計分析,進行One Way ANOVA和Duncan’s多重比較(P<0.05)。
2 結果與分析
2.1 JfDREB1A基因的克隆和生物信息學分析
以新疆野生核桃嫩葉cDNA為模板,通過PCR擴增獲得了DREB1A基因的編碼區,長度為645 bp(圖1),相對分子質量為23.96 ku,理論等電點為6.2。NCBI比對表明,該基因與擬南芥DREB1A同源,命名為JfDREB1A。

M.DL2000 marker; 1. JfDREB1A
利用Predict Protein和SMART軟件預測JfDREB1A蛋白的二級結構和保守功能域,結果表明:該蛋白由214個氨基酸組成,H-螺旋占 23.36%,H-環64.02%,包含大約60個氨基酸組成的一個AP2結構域,屬于典型的DREB1/CBF轉錄因子(圖2)。
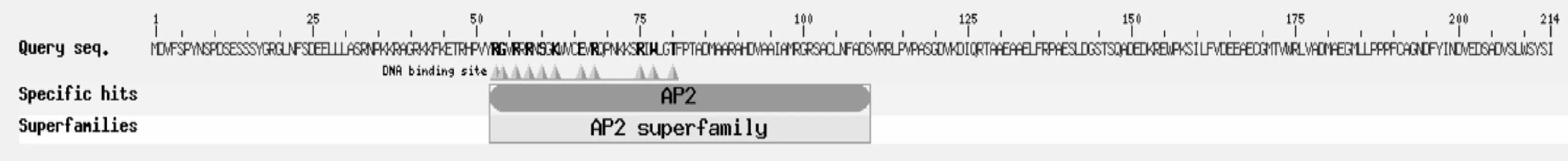
圖2 JfDREB1A蛋白的結構示意圖Fig.2 Schematic diagram of JfDREB1A protein structure
利用DNAMAN 9.0軟件對新疆野生核桃JfDREB1A的氨基酸序列與其他植物基因編碼序列進行多序列比(圖3),結果表明,JfDREB1A編碼蛋白與其他植物的DREB1轉錄因子具有高度同源性,其中同普通核桃的相似性為100%,JfDREB1A基因具有高度保守性。利用MEGA 7.0軟件將JfDREB1A與其他植物DREB1轉錄因子構建系統進化樹,結果發現,JfDREB1A與普通核桃(AFV93473.1)的DREB1基因聚集在同一分支上,親緣關系最近(圖4)。

AFV93473.1.核桃; ALJ92425.1.香樟; AYM54799.1.美味獼猴桃; QDM14392.1.軟棗獼猴桃; AIX87844.1.扁桃;ADZ23479.1.白樺; ABC79626.1.毛白楊; ABR23056.1.番薯; XP_042976720.1.美國山核桃

圖4 JfDREB1A蛋白與其他物種DREB轉錄因子氨基酸序列的系統進化樹Fig.4 Phylogenetic tree of JfDREB1A protein and other DREB1A transcription factors
2.2 JfDREB1A基因在低溫脅迫下的表達水平
在4 ℃低溫脅迫處理下,JfDREB1A基因在1 h時表達量即明顯上調,直到8 h時達到最大,相對表達量為2.05,為對照的2.1倍,之后開始降低并保持相對恒定,處理24 h時的表達量仍高于對照(圖5)。
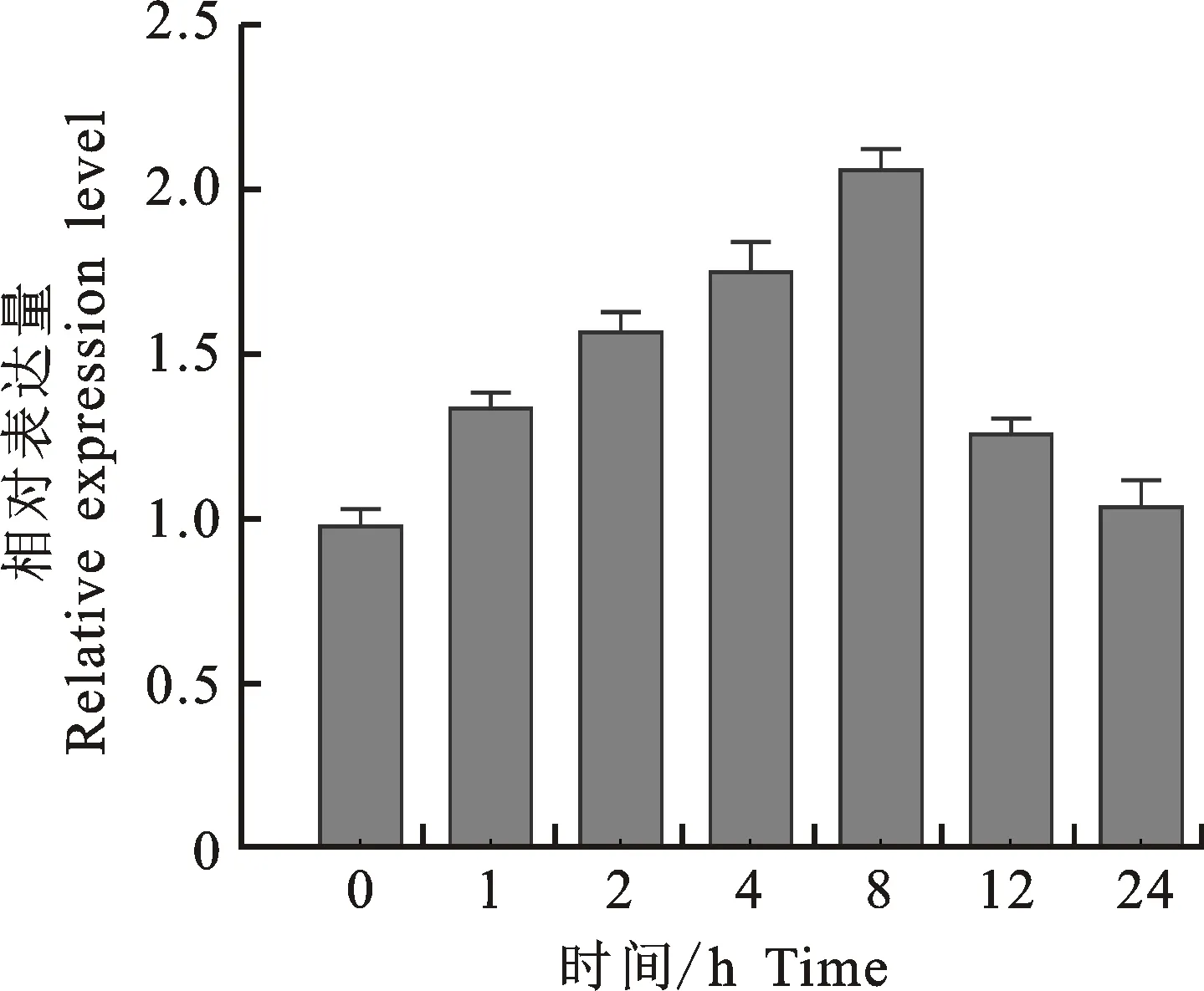
圖5 JfDREB1A基因在4 ℃低溫脅迫下的表達變化Fig.5 Relative expression level of JfDREB1A gene at 4 ℃
2.3 原核表達載體構建及SDS-PAGE檢測
將JfDREB1A基因片段與pET-28a(+)表達載體連接后,轉化大腸桿菌(DE3),成功獲得pET-28a-JfDREB1A重組表達質粒,經菌液PCR鑒定,表達載體正確(圖6)。

M.DL2000 marker; A:1.pET-28a-JfDREB1A; B:1~8.pET-28a-JfDREB1A菌液PCR
SDS-PAGE電泳檢測結果如圖7所示,在誘導溫度為37 ℃,0.2、0.5、1.0、1.5 mmol/L的IPTG誘導下,均能誘導出pET-28a-JfDREB1A蛋白,且與預期大小一致,而經0.5 mmol/L IPTG誘導的對照pET-28a空載體則沒有表達(圖7)。另外,用0.5 mmol/L IPTG誘導JfDREB1A重組蛋白2、4和6 h,均能誘導出pET-28a-JfDREB1A蛋白,在2 h時表達量達到峰值,而對照pET-28a空載體則沒有表達(圖8)。

M.蛋白質標準分子量; 1.pET-28a-JfDREB1A未誘導; 2~5.pET-28a-JfDREB1A經終濃度為0.2、0.5、1.0、1.5 mmol/L的IPTG誘導4 h; 6.pET-28a空載體經終濃度為0.5 mmol/L的IPTG誘導4 h

M.蛋白質標準分子量; 1~4.pET-28a-JfDREB1A經終濃度為0.5 mmol/L的IPTG誘導0、2、4、6 h; 5~8.pET-28a空載體經終濃度為0.5 mmol/L的IPTG誘導0、2、4、6 h
3 討論與結論
研究植物如何響應低溫脅迫一直是植物研究領域中的熱點話題,對于保障植物可持續發展有著重要的理論與實踐價值[3, 18]。植物可通過轉錄因子調節應激信號途徑中基因的表達,從而響應低溫逆境脅迫[19],DREB1/CBF轉錄因子能與DRE/CRT元件結合,在植物應對低溫等非生物脅迫中發揮著重要作用[1, 20-21]。本研究從新疆野生核桃中克隆得到JfDREB1A基因的cDNA全長序列,對其結構域、進化關系、低溫脅迫表達特征及蛋白的誘導表達等方面進行了分析。新疆野生核桃JfDREB1A基因的開放閱讀框為645 bp,蛋白質分子質量為23.96 ku,具有DREB1/CBF轉錄因子的保守結構域,與普通核桃的CBF基因(AFV93473.1)聚集在同一分支上,親緣關系最近。研究發現,當受到低溫脅迫時,核桃CBF基因表達上調,預測其受低溫信號調節,在核桃適應寒冷的過程中起著重要作用[22]。與同源的核桃CBF基因相似,JfDREB1A基因對低溫脅迫表現出很強的誘導表達特征,4 ℃低溫脅迫1 h時表達量即明顯上調,8 h時達到最大,推測JfDREB1A基因在新疆野生核桃響應低溫過程中可能具有一定功能。
為進一步探索JfDREB1A基因在大腸桿菌(DE3)感受態細胞中的高效表達,構建了pET-28a-JfDREB1A重組表達質粒,經SDS-PAGE檢測得到大小約為29 ku的融合蛋白pET-28a-JfDREB1A,與預測蛋白大小相符。原核表達融合蛋白的結果易受多種條件影響[23]。不同的蛋白,最佳誘導劑濃度和誘導時間也不同[24-25]。新疆野生核桃pET-28a-JfDREB1A重組蛋白在誘導劑IPTG終濃度為0.5 mmol/L、誘導時間為 2 h時表達量最高。在添加一定濃度IPTG時,IPTG濃度和表達速度成正比,新疆野生核桃pET-28a-JfDREB1A重組蛋白在2 h表達量最高,可能是由于IPTG的終濃度比上述研究濃度要高。由于原核表達受誘導溫度、誘導劑濃度和誘導時間等多種條件影響,還需進一步優化以更好地獲取目的蛋白,制備抗體、研究其功能作用。

