不同營(yíng)養(yǎng)類型培養(yǎng)基番茄內(nèi)生細(xì)菌群落結(jié)構(gòu)研究
張澤宇 肖揚(yáng) 詹亞斌 魏雨泉 徐道清 李季
摘要:通過采用Biolog EcoPlate 培養(yǎng)、16S r RNA基因高通量測(cè)序技術(shù)等方法研究不同培養(yǎng)基上植物內(nèi)生細(xì)菌群落結(jié)構(gòu)的組成差異,探究不同培養(yǎng)基等營(yíng)養(yǎng)條件對(duì)番茄內(nèi)生細(xì)菌群落結(jié)構(gòu)的影響。結(jié)果表明:(1)4種培養(yǎng)基上生長(zhǎng)的內(nèi)生菌群在Biolog EcoPlate 微平板培養(yǎng)96 h 后,菌群生長(zhǎng)達(dá)到穩(wěn)定期,且在牛肉膏蛋白胨(NA)培養(yǎng)基下菌群代謝活性較高。R2A培養(yǎng)基下菌群代謝活性較低。(2) 番茄內(nèi)生微生物組包括檸檬酸桿菌屬(Citroebacteria)、芽孢桿菌屬(Bacillus)、鞘脂單胞菌(Sphingbacterium)、布克氏菌屬(Burkholderia)。(3)LB、TSA培養(yǎng)基分離到的內(nèi)生菌多為芽孢桿菌屬;在NA、R2A培養(yǎng)基中番茄內(nèi)生菌組成多為檸檬酸桿菌、芽孢桿菌、鞘脂單胞菌、布克氏菌,為優(yōu)勢(shì)菌種。(4)NA培養(yǎng)基中番茄內(nèi)生微生物組香農(nóng)指數(shù)高于其他處理(P<0.05)差異;PCoA分析顯示4種培養(yǎng)基中番茄內(nèi)生細(xì)菌群落結(jié)構(gòu)具有差異(P<0.05)。(5)網(wǎng)絡(luò)分析發(fā)現(xiàn)NA、R2A培養(yǎng)基中番茄內(nèi)生細(xì)菌微生物組模塊化水平更高,而且網(wǎng)絡(luò)拓?fù)湫愿摺#?)LEfSe分析發(fā)現(xiàn),LB富集的物種為芽孢桿菌,NA培養(yǎng)基富集物種多為假單胞菌(Pseudomonas),R2A培養(yǎng)基富集物種多鞘脂單胞菌,TSA培養(yǎng)基富集物種多布克氏菌屬。 本研究通過高通量測(cè)序分析不同營(yíng)養(yǎng)類型培養(yǎng)基對(duì)番茄內(nèi)生微生物組群落結(jié)構(gòu)的影響,對(duì)于生產(chǎn)中通過利用營(yíng)養(yǎng)條件調(diào)控植物內(nèi)生菌群群落結(jié)構(gòu)組成及靶向篩選有益微生物具有重要的指導(dǎo)意義。
關(guān)鍵詞:培養(yǎng)基;營(yíng)養(yǎng)條件;Biolog EcoPlate微平板;16S rRNA基因高通量測(cè)序;內(nèi)生菌群
中圖分類號(hào):S182文獻(xiàn)標(biāo)志碼:A文章編號(hào):1002-1302(2023)11-0128-05
植物內(nèi)生菌是指真菌和細(xì)菌在某個(gè)生活階段能夠進(jìn)入活體植物組織內(nèi),并且在植物組織內(nèi)不引起顯著變化的一類微生物[1]。植物內(nèi)生菌主要來源于土壤微生物,或者大氣中的微生物通過植物氣孔、自然傷口進(jìn)入植物組織內(nèi)。內(nèi)生細(xì)菌作為一類特殊的微生物,與植物宿主一同演化共生,但不引起宿主的明顯癥狀,所處環(huán)境穩(wěn)定,營(yíng)養(yǎng)來源豐富、可靠[2]。研究表明,植物內(nèi)生菌產(chǎn)生的次生代謝產(chǎn)物,如各類型保護(hù)酶、生長(zhǎng)素等物質(zhì),可以調(diào)節(jié)植物代謝,幫助植物抵御逆境脅迫,促進(jìn)植物生長(zhǎng),具有良好的生態(tài)功能[3]。
植物內(nèi)生菌是一類多樣性十分豐富的微生物類群,與宿主存在協(xié)同進(jìn)化關(guān)系[4],隨著研究領(lǐng)域的不斷擴(kuò)寬和研究方法的改進(jìn),探尋植物內(nèi)生菌的最適營(yíng)養(yǎng)條件成為當(dāng)下植物與微生物互作研究的熱點(diǎn)領(lǐng)域之一[5]。自然生長(zhǎng)環(huán)境下有很多因素均可以影響植物內(nèi)生菌的組成結(jié)構(gòu),如碳源、氮源、根系分泌物等關(guān)鍵營(yíng)養(yǎng)因子[6-7]。內(nèi)生菌群與植物之間的相互作用對(duì)植物的各項(xiàng)生命活動(dòng)具有重要影響,如促進(jìn)植物生長(zhǎng)、防止病原微生物的侵害[8-10]等。
隨著高通量測(cè)序技術(shù)的發(fā)展和微生物組研究的深入,越來越多的模式植株如擬南芥、水稻、小麥、番茄、甜菜等多種植物根系微生物組的結(jié)構(gòu)得到了解析。研究表明,無論是單子葉植物還是雙子葉植物,根系微生物組多集中于變形菌門、放線菌門、擬桿菌門、厚壁菌門[4]。由植物自身代謝引起的營(yíng)養(yǎng)調(diào)節(jié)作用對(duì)植物內(nèi)生細(xì)菌的組成有很大影響[4],因此從營(yíng)養(yǎng)成分差異角度揭示營(yíng)養(yǎng)成分對(duì)番茄內(nèi)生細(xì)菌群落結(jié)構(gòu)組成的影響對(duì)于有益內(nèi)生菌的定向篩選及有益生物學(xué)功能的發(fā)揮具有重要意義。
本研究通過將番茄根部組織研磨液涂布在LB、TSA、NA、R2A這4種培養(yǎng)基上,通過制備不同營(yíng)養(yǎng)條件下的番茄內(nèi)生微生物組,通過Biolog Ecoplate測(cè)定和16S r RNA gene高通量測(cè)序技術(shù)分析番茄根部?jī)?nèi)生細(xì)菌群落結(jié)構(gòu)多樣性,研究不同營(yíng)養(yǎng)類型培養(yǎng)基對(duì)內(nèi)生細(xì)菌群落結(jié)構(gòu)的影響,以期能夠利用營(yíng)養(yǎng)條件定向調(diào)控內(nèi)生菌群落結(jié)構(gòu)組成,以期為靶向篩選目標(biāo)內(nèi)生菌提供理論依據(jù)。
1材料與方法
番茄植株來自于中國(guó)農(nóng)業(yè)大學(xué)科學(xué)園溫室,栽培管理措施均按日常管理措施進(jìn)行。
1.1供試分離培養(yǎng)基
R2A培養(yǎng)基:稱取R2A瓊脂培養(yǎng)基41 g,蒸餾水1 000 mL,121 ℃高壓蒸汽滅菌20 min。
LB培養(yǎng)基:酵母提取物5 g,胰蛋白胨5 g,NaCl 10 g,蒸餾水1 000 mL,瓊脂20 g,pH值7.4,121 ℃高壓蒸汽滅菌 20 min。
TSA培養(yǎng)基:稱取TSA瓊脂培養(yǎng)基40 g,蒸餾水1 000 mL,121 ℃高壓蒸汽滅菌 20 min。
NA培養(yǎng)基:稱取蛋白胨 10 g,牛肉粉3 g,NaCl 5 g,蒸餾水1 000 mL,瓊脂15 g,121 ℃高壓蒸汽滅菌 20 min。
PBS緩沖液:8 g NaCl,0.2 g KCl,1.44 g Na2HPO4,pH值7.4,去離子水定容至1 L,121 ℃高壓蒸汽滅菌 20 min。
1.2番茄根部?jī)?nèi)生微生物組的制備
番茄植株于2021年8月采集自中國(guó)農(nóng)業(yè)大學(xué)科學(xué)園溫室,栽培管理措施均按照日常管理措施進(jìn)行。采集4葉期番茄苗,稱取番茄根1 g,在PBS緩沖液中將其研磨后將研磨液用無菌水按照倍比稀釋法,取100 μL稀釋液分別涂布于TSA、LB、NA、R2A培養(yǎng)基中,25 ℃培養(yǎng)箱中培養(yǎng)7 d,各培養(yǎng)基平板上生長(zhǎng)的菌落即為番茄根部?jī)?nèi)生微生物組。
1.3Biolog EcoPlate測(cè)定
植物研磨液在各類型培養(yǎng)基培養(yǎng)7 d后,用無菌水沖洗各個(gè)培養(yǎng)基平板,并用涂布棒將培養(yǎng)基平板上的菌在無菌水中涂抹均勻,最后用移液器吸取各培養(yǎng)基平板上的菌懸液1 mL到裝有10 mL PBS緩沖溶液的50 mL離心管中,振蕩2 min 后,5 000 g 離心5 min,取1 mL上清液加入到裝有20 mL PBS緩沖液的離心管中,混合均勻后加入到Biolog EcoPlate 平板中,每孔加入100 mL懸浮液。將接種后的微平板置于25 ℃ 培養(yǎng)箱中培養(yǎng),每隔 24 h用細(xì)菌讀數(shù)儀讀取微平板吸光度,連續(xù)測(cè)定5 d。
1.416S rRNA基因高通量測(cè)序分析內(nèi)生細(xì)菌群落結(jié)構(gòu)多樣性
培養(yǎng)7 d后,用無菌水沖洗各培養(yǎng)基平板,并用涂布棒涂抹,用移液槍吸取各平板上的菌懸液1 mL提取菌懸液DNA,采用特異性引物799F(5′-AACMGGATTAGATACCCKG-3′) 和1193R (5′-ACGTCATCCCCACCTTCC-3′),以菌懸液DNA為模板,擴(kuò)增16S rRNA基因V7~V9區(qū),擴(kuò)增片段大小約為394 bp。反應(yīng)體系25 μL:TaKaRa Mix 12.5 μL,779F 1 μL,1392R 1 μL,DNA 1 μL,ddH2O 9.5 μL,PCR 擴(kuò)增程序如下:94 ℃ 2 min;94 ℃ 30s;55 ℃ 30 s;72 ℃ 1 min共25個(gè)循環(huán),最后72 ℃延伸 5 min。產(chǎn)物經(jīng)過1%瓊脂糖凝膠電泳檢測(cè)。用PCR純化試劑盒(Cycle-Pure Kit,OMEGA,美國(guó))將PCR產(chǎn)物純化,按照說明書的操作步驟進(jìn)行,然后將純化后的產(chǎn)物按照測(cè)序要求建立測(cè)序文庫(kù),送交廣州美格生物科技有限公司進(jìn)行高通量測(cè)序,并分析結(jié)果。
1.5數(shù)據(jù)分析
采用IBM SPSS Statistics 20.0軟件對(duì)數(shù)據(jù)進(jìn)行單因素方差分析,并采用Duncan's新復(fù)極差法進(jìn)行差異顯著性分析,獨(dú)立樣本t檢驗(yàn),用Origin軟件畫圖。
2結(jié)果與分析
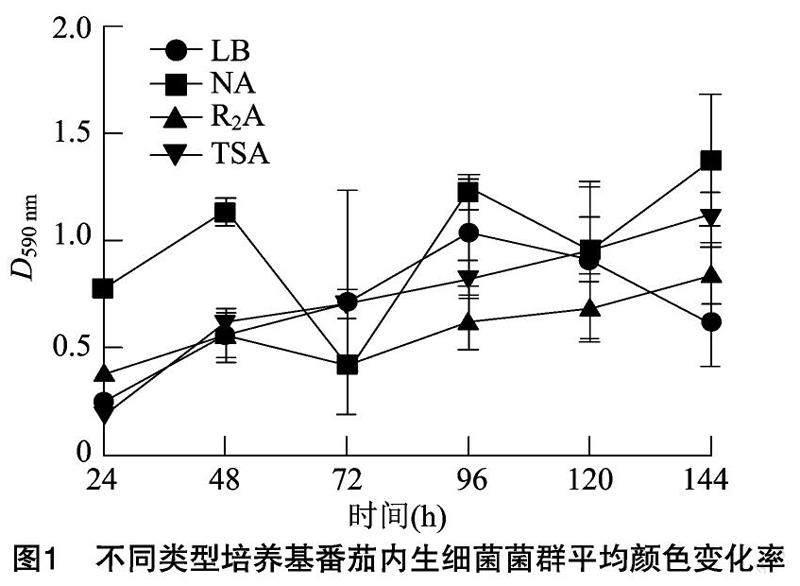
2.1番茄內(nèi)生菌菌群的AWCD值隨培養(yǎng)時(shí)間的變化
平均顏色變化率(AWCD)是反映微生物代謝活性(即微生物利用碳源的能力)的指標(biāo)(圖1),隨著培養(yǎng)時(shí)間的延長(zhǎng),微生物利用碳源數(shù)量整體逐漸增加。在24~96 h內(nèi),番茄內(nèi)生菌群處于對(duì)數(shù)生長(zhǎng)期,菌群代謝活性逐漸升高;在培養(yǎng)96 h后,番茄菌群的生長(zhǎng)達(dá)到穩(wěn)定期,NA培養(yǎng)基下菌群代謝活性較高。R2A培養(yǎng)基下菌群代謝活性較低。
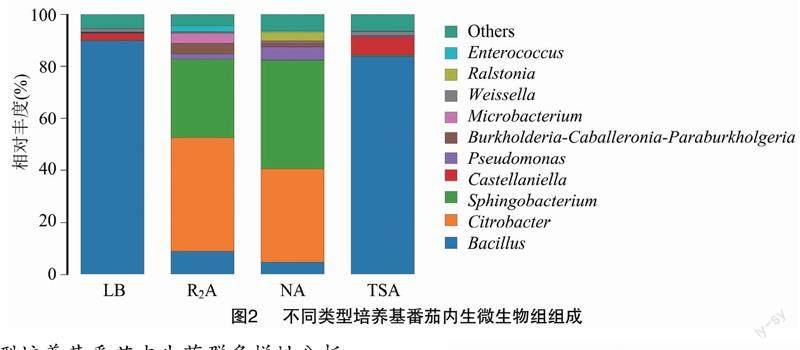
2.2不同類型培養(yǎng)基番茄內(nèi)生細(xì)菌種屬分布
各個(gè)類型培養(yǎng)基分離出的內(nèi)生菌大部分屬于檸檬酸桿菌屬(Citrobacter)、芽孢桿菌屬(Bacillus)、鞘脂單胞菌(Sphinogbacterium)、布克氏菌屬(Burkholderia)。R2A培養(yǎng)基作為一種廣譜的營(yíng)養(yǎng)來源,內(nèi)生細(xì)菌組成種類較多,各類型內(nèi)生菌分布較為均勻;NA培養(yǎng)基中內(nèi)生菌分布情況與R2A類似:芽孢桿菌、布克氏菌屬、鞘脂單胞菌、檸檬酸桿菌均為優(yōu)勢(shì)物種;但是在TSA和LB培養(yǎng)基中,內(nèi)生菌群中芽孢桿菌屬豐度較高,所占比例均在80%左右,成為該培養(yǎng)基中的優(yōu)勢(shì)物種(圖2)。
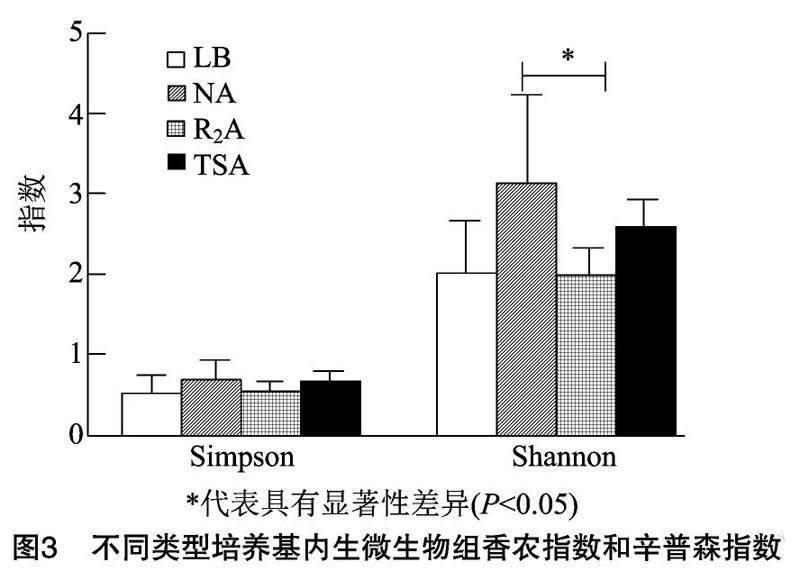
2.3不同類型培養(yǎng)基番茄內(nèi)生菌群多樣性分析
TSA、LB、NA、R2A 4種類型的培養(yǎng)基上內(nèi)生菌群結(jié)構(gòu)具有顯著差異(P<0.05),不同營(yíng)養(yǎng)類型的培養(yǎng)基成分對(duì)植物內(nèi)生菌群結(jié)構(gòu)具有顯著影響。α多樣性分析中,辛普森指數(shù)(Simpson)之間沒有顯著差異,但從香農(nóng)指數(shù)(Shannon)來看,牛肉膏蛋白胨(NA)培養(yǎng)基中的番茄內(nèi)生微生物組高于其他處理(P<0.05)(圖3)。
主成分分析可以將不同樣本的多元變量變換為互不相關(guān)的主元變量(PC1和PC2),在降維后主元向量空間中可以利用點(diǎn)的位置直觀反映出不同培養(yǎng)基微生物群落代謝特征。發(fā)現(xiàn)4種培養(yǎng)基培養(yǎng)條件下番茄內(nèi)生細(xì)菌群落結(jié)構(gòu)具有顯著差異(P<0.05)(圖4)。
2.4不同類型培養(yǎng)基番茄內(nèi)生菌群網(wǎng)絡(luò)共線性分析及物種差異分析
網(wǎng)絡(luò)共線性分析發(fā)現(xiàn),NA、R2A培養(yǎng)基中番茄
內(nèi)生細(xì)菌微生物組模塊化水平更高,而且網(wǎng)絡(luò)拓?fù)湫愿撸琇B、TSA培養(yǎng)基中番茄內(nèi)生細(xì)菌微生物組模塊化水平較低(圖5)。LEfSe分析發(fā)現(xiàn)LB培養(yǎng)基富集的物種為芽孢桿菌,NA培養(yǎng)基富集物種多為假單胞菌(Pseudomonas),R2A培養(yǎng)基富集物種多為鞘脂單胞菌,TSA培養(yǎng)基富集物種多為布克氏菌屬(圖6)。
3討論
本研究通過高通量測(cè)序技術(shù)對(duì)各類型培養(yǎng)基上得到的番茄內(nèi)生微生物組組成進(jìn)行分析發(fā)現(xiàn),LB、TSA培養(yǎng)基中芽孢桿菌屬是優(yōu)勢(shì)物種,但是在R2A、NA培養(yǎng)基中,內(nèi)生菌群組成較為均勻,不存在絕對(duì)的優(yōu)勢(shì)物種。
微平板培養(yǎng)96 h后,菌群生長(zhǎng)達(dá)到穩(wěn)定期,NA培養(yǎng)基下菌群代謝活性較高。R2A培養(yǎng)基下菌群代謝活性較低,可能是NA培養(yǎng)基中氨基酸含量較高引起[11]。可見氮源對(duì)于增強(qiáng)微生物代謝活性具有重要意義。4種培養(yǎng)基分離到的內(nèi)生菌多為檸檬酸桿菌屬、芽孢桿菌屬、鞘脂單胞菌、布克氏菌屬,且不同營(yíng)養(yǎng)類型的培養(yǎng)基下內(nèi)生菌群中優(yōu)勢(shì)物種有所差異:LB、TSA培養(yǎng)基分離到的內(nèi)生菌多為芽孢桿菌,為優(yōu)勢(shì)物種;NA、R2A培養(yǎng)基分離到的內(nèi)生菌中檸檬酸桿菌、芽孢桿菌、鞘脂單胞菌、布克氏菌為優(yōu)勢(shì)菌屬。何紅通過高通量測(cè)序發(fā)現(xiàn)番茄內(nèi)生菌中放線菌、假單胞菌含量較高[12],與本研究結(jié)果有所差異。可見通過培養(yǎng)組學(xué)獲得的物種信息與生物信息學(xué)分析相比,還存在一定差距,今后還需要改善營(yíng)養(yǎng)條件以期獲得更為全面的物種分類信息。PCoA分析顯示β多樣性有顯著差異(P<0.05),即在不同營(yíng)養(yǎng)水平下番茄內(nèi)生菌群落結(jié)構(gòu)不同,文才藝等也發(fā)現(xiàn)了類似的結(jié)果[13]:不同生境下的番茄微生物組不同,可能是由于理化環(huán)境中營(yíng)養(yǎng)條件的異質(zhì)性引起的。
本研究中培養(yǎng)基內(nèi)的營(yíng)養(yǎng)條件與自然環(huán)境植物相比,成分有所不同[14],番茄根系分泌物中多含有醛類、酸類等物質(zhì),根系分泌物等復(fù)雜化學(xué)物質(zhì)對(duì)番茄內(nèi)生菌群結(jié)構(gòu)的影響有待于進(jìn)一步研究。
不同種類微生物所需要的營(yíng)養(yǎng)條件不同,根據(jù)試驗(yàn)?zāi)康目赏ㄟ^調(diào)控營(yíng)養(yǎng)水平達(dá)到靶向分離內(nèi)生細(xì)菌的方法。本研究分析了外源營(yíng)養(yǎng)物質(zhì)對(duì)于番茄內(nèi)生菌群的影響,進(jìn)一步探求內(nèi)生菌群中的重要成員結(jié)構(gòu)變化,分析各類型營(yíng)養(yǎng)條件下優(yōu)勢(shì)菌群特征,為更好地研究?jī)?nèi)生菌與植物互作奠定基礎(chǔ),同時(shí)為改善植物生長(zhǎng)環(huán)境達(dá)到服務(wù)于農(nóng)業(yè)生產(chǎn)的目的創(chuàng)造理論基礎(chǔ)。
4結(jié)論
(1)4種培養(yǎng)基上生長(zhǎng)的內(nèi)生菌群在Biolog 微平板培養(yǎng)96 h 后,菌群生長(zhǎng)達(dá)到穩(wěn)定期,NA培養(yǎng)基
下菌群代謝活性較高,R2A培養(yǎng)基下菌群代謝活性較低。(2)4種培養(yǎng)基下番茄微生物組成分多為檸檬酸桿菌屬、芽孢桿菌屬、鞘脂單胞菌、布克氏菌屬,且群落結(jié)構(gòu)具有顯著差異。(3)LB、TSA培養(yǎng)基分離到的內(nèi)生菌多為芽孢桿菌屬,為優(yōu)勢(shì)物種;NA、R2A培養(yǎng)基分離到的內(nèi)生菌中檸檬酸桿菌、芽孢桿菌、鞘脂單胞菌、布克氏菌為優(yōu)勢(shì)菌種。(4)網(wǎng)絡(luò)共線性分析發(fā)現(xiàn),R2A、NA培養(yǎng)基中的網(wǎng)絡(luò)模塊化程度更高,具有更強(qiáng)的網(wǎng)絡(luò)拓?fù)湫浴?/p>
參考文獻(xiàn):
[1]陸藍(lán)翔,江明明,王焱,等. 兩株樟樹促生抗病內(nèi)生細(xì)菌的分離、篩選及鑒定[J]. 南京林業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),2018,42(6):128-136.
[2]Nafis A,Kasrati A,Azmani A,et al. Endophytic Actinobacteria of medicinal plant Aloe vera:isolation,antimicrobial,antioxidant,cytotoxicity assays and taxonomic study[J]. Asian Pacific Journal of Tropical Biomedicine,2018,8(10):513-518.
[3]馬榮琴,曹毅,周俊雄,等. 番茄根內(nèi)生假單胞菌的分離與鑒定[J]. 生物技術(shù),2015,25(6):564-568,580.
[4]黎起秦,謝義靈,林緯,等. 廣西番茄內(nèi)生細(xì)菌的多樣性和數(shù)量動(dòng)態(tài)[J]. 生物多樣性,2006,14(6):534-540.
[5]王美琴,劉慧平,韓巨才,等. 番茄內(nèi)生細(xì)菌種群動(dòng)態(tài)分析及拮抗菌株的篩選[J]. 中國(guó)農(nóng)學(xué)通報(bào),2010,26(9):277-282.
[6]李艷琴,申泉,劉彬彬,等. 番茄內(nèi)生菌分離及其ERIC-PCR指紋圖譜分析[J]. 微生物學(xué)通報(bào),2003,30(5):89-93.
[7]黎起秦,羅寬,林緯,等. 番茄青枯病內(nèi)生拮抗細(xì)菌的篩選[J]. 植物病理學(xué)報(bào),2003,33(4):364-367.
[8]曹理想,田新莉,周世寧. 香蕉內(nèi)生真菌、放線菌類群分析[J]. 中山大學(xué)學(xué)報(bào)(自然科學(xué)版),2003,42(2):70-73.
[9]馮永君,宋未. 植物內(nèi)生細(xì)菌[J]. 自然雜志,2001,23(5):249-252.
[10]Dong C J,Wang L L,Li Q,et al. Bacterial communities in the rhizosphere,phyllosphere and endosphere of tomato plants[J]. PLoS One,2019,14(11):e0223847.
[11]Constantin M E,de Lamo F J,Vlieger B V,et al. Endophyte-mediated resistance in tomato to Fusarium oxysporum is independent of ET,JA,and SA[J]. Frontiers in Plant Science,2019,10:979.
[12]何紅,邱思鑫,胡方平,等. 植物內(nèi)生細(xì)菌生物學(xué)作用研究進(jìn)展[J]. 微生物學(xué)雜志,2004,24(3):40-45.
[13]文才藝,吳元華,田秀玲. 植物內(nèi)生菌研究進(jìn)展及其存在的問題[J]. 生態(tài)學(xué)雜志,2004,23(2):86-91.
[14]胡雅麗,戴睿,劉永鑫,等. 水稻典型品種日本晴和IR24根系微生物組的解析[J]. 遺傳,2020,42(5):506-518.

