兩種糖尿病腦病動物模型建立及應用
林海容 許永劼 陳鋼 許雯 黃昶煜東 韋思佳 楊婷婷 李興 潘衛,3
(貴州醫科大學 1附屬醫院產前診斷中心,貴州 貴陽 550004;2醫學檢驗學院;3公共衛生學院;4貴州中醫藥大學)
糖尿病腦病(DE)是糖尿病導致中樞神經系統(CNS)功能障礙和認知下降的一種嚴重并發癥〔1〕,臨床上主要表現為注意力下降、學習記憶能力減退和認知功能障礙等〔2〕,嚴重認知障礙的糖尿病患者將發展為不可逆轉癡呆〔3〕。DE的發病機制復雜,包括胰島素抵抗與信號轉導通路受損、炎癥與線粒體功能障礙、氧化應激及細胞凋亡等。有研究發現,海馬神經元凋亡會導致衰老大鼠的學習和記憶障礙〔4〕。此外,越來越多的證據表明,糖尿病大鼠海馬神經元凋亡導致記憶障礙。本課題組前期研究也發現高糖能誘導海馬神經元細胞的凋亡。
DE認知功能障礙的分子機制等方面已被廣泛研究,但仍然不夠完善,防治仍有欠缺〔5,6〕,而動物模型是DE臨床與基礎研究工作中必不可少的工具〔7〕。已有研究通過采用自發性Ⅱ型糖尿病小鼠建立DE模型、鏈脲佐菌素(STZ)誘導SD大鼠建立Ⅰ型DE模型、高脂飲食聯合STZ誘導Ⅱ型DE模型等〔8~10〕,研究DE的發病機制,但是單純選用Ⅰ型或Ⅱ型DE模型進行研究,并不能夠完全模擬人類DE發生發展過程。因此,本實驗選用STZ誘導SD大鼠構建Ⅰ型DE模型和db/db小鼠構建Ⅱ型DE進行聯合分析,以期了解兩種腦病模型的應用優勢及缺點,為今后研究DE選擇動物模型提供參考。
1 材料和方法
1.1實驗動物 由貴州醫科大學動物中心提供體質量180~220 g 的健康清潔級雄性SD大鼠〔SCXK(黔)2014-0010〕用于Ⅰ型DE模型;購自南京君科生物工程有限公司,8~9周齡,體質量38~41 g 的雄性健康清潔級db/db小鼠和體質量18~22 g的雄性健康清潔級db/m小鼠[SCXK(蘇) 2016-0010]用于Ⅱ型DE模型。動物被安置在溫度22~25 ℃,濕度50%~60%的房間內,12 h的光照周期中隨時使用食物和水。在實驗期間,通過貴州醫科大學動物倫理委員會審查(IACUC-2017-006)。實驗中,嚴格按照《實驗動物關愛和使用指南》給予實驗動物人道關懷。
1.2主要試劑與儀器 鏈脲佐菌素購自美國Sigma公司;0.1 mol/L檸檬酸-檸檬酸鈉緩沖液購自索萊寶公司;血糖儀及試紙條購自美國強生公司;JA2003N型電子天平購自上海菁海儀器有限公司;Morris 水迷宮購自中國醫學科學院藥物研究所;SMART 3.0小動物行為學記錄分析系統購自西班牙Panlab;透射電子顯微鏡購自日本HITACHI HT7700;酶標分析儀購自Rayto RT-6100;Western印跡電泳儀購自美國Bio-Rad公司;冷凍離心機購自美國Beckman公司;搖床購自江蘇其林貝爾儀器制造有限公司。
1.3動物模型
1.3.1Ⅰ型DE模型的復制 SD大鼠適應性喂養7 d后,用Morris水迷宮檢測認知功能,挑選10只正常的大鼠為Ⅰ型對照組、10只為Ⅰ型DE組。實驗開始前,大鼠被禁止食物12 h,Ⅰ型DE組根據體質量給予50 mg/kg STZ進行腹腔注射,對照組每只大鼠給予等劑量0.1 mol/L檸檬酸-檸檬酸鈉緩沖液進行腹腔注射,并從注射后開始,于3 d、1 w、3 w三次取尾靜脈血檢測隨機血糖,隨機血糖值連續3 w均≥16.7 mmol/L,達到DE大鼠模型復制成功標準,視為DE模型復制成功,后繼續飼養大鼠模型2個月。
1.3.2Ⅱ型DE模型的建立 適應性飼養小鼠7 d后,測隨機血糖,運用Morris水迷宮檢測認知功能,挑選10只正常db/m小鼠為Ⅱ型對照組、10只db/db小鼠為Ⅱ型DE組,繼續飼養16 w。
1.3.3體質量及隨機血糖的測定 Ⅰ型DE組在實驗開始前、造模后72 h、1、3、8、12 w時檢測體質量,尾靜脈取血測隨機血糖;Ⅱ型DE組在實驗開始第1、5、9、13、17周時檢測體質量,尾靜脈取血測隨機血糖。
1.4行為學實驗
1.4.1Morris水迷宮實驗 Morris水迷宮由一個恒溫水池和一個站臺組成。其中,水池形狀為圓柱形,直徑160 cm(大鼠)、80 cm(小鼠),高50 cm,內壁涂成黑色;可移動站臺直徑12 cm。實驗開始前,向水池放入清水,以水位高25 cm為宜,db小鼠實驗時需加入奶粉使池水變為乳白色,水池水位高出站臺0.5 cm,在水池內壁上做好標記,即每次實驗動物的入水點。動物在水迷宮中接受了為期4 d的訓練,每天進行4個60 s的實驗,如果60 s內沒有找到站臺,則被引導到站臺上,并被允許在站臺上休息15 s。每1 d的起點順序在不同動物之間是一致的,但1 d之間的順序不同。在最后一次訓練后約1 h進行,結束后1 h,將站臺移走,將動物從新入水點放入水池里,實驗長度為60 s,測量游泳軌跡、找到站臺的時間和游泳速度,對每只動物4個象限的日均測量值進行平均化。
1.4.2Y迷宮實驗 Y迷宮共3個臂,各臂夾角為120 °,每一臂尺寸為300 mm×80 mm×150 mm(小鼠)、425 mm×145 mm×225 mm(大鼠),內壁為黑色,在中央處各有一個可移動隔板。使用SMART 3.0系統進行圖像采集分析。每只動物在一個面向迷宮中心的臂末端放置,允許其在迷宮內自由活動5 min,記錄動物進入的臂總數和順序。
1.4.3曠場實驗 大鼠曠場反應箱高30 cm,邊長100 cm,小鼠曠場反應箱高25 cm,邊長50 cm,內壁涂黑,將實驗動物放入反應箱中央區,允許自由活動5 min,記錄進入中央區次數、后肢站立次數和運動距離。
1.5蘇木素-伊紅(HE)染色觀察海馬神經元形態變化 將分離后的海馬迅速置于裝有甲醛溶液的管子中固定24 h以上,進行石蠟包埋,切片、染色、封片,然后放入切片盒內,所有染片在光鏡下觀察并拍片。
1.6透射電鏡觀察海馬組織超微結構 將分離后的海馬組織(切片厚度70 nm)迅速在預冷的2.5%戊二醛固定液中固定2 h,制作切片,用HT7700透射電鏡觀察神經元細胞超微結構。
1.7血清白細胞介素(IL)-1β和IL-18的含量測定 DM組動物出現認知功能障礙后,心臟取血,3 000 r/min離心5 min,收集血清,采用酶聯免疫吸附試驗(ELISA)檢測血清中IL-1β、IL-18的含量。實驗嚴格按照說明書進行操作。
1.8Western印跡檢測各組動物海馬組織B細胞淋巴瘤(Bcl)-2、Bcl-2相關X蛋白(Bax)的表達水平 取海馬組織,按照課題組之前的方法〔11〕提取總蛋白,采用二喹啉甲酸(BCA)法定量蛋白濃度。將蛋白樣品(35 μg)通過聚丙烯酰胺凝膠電泳分離在10%凝膠上,然后將目的蛋白轉移0.45 μm的聚偏氟乙烯(PVDF)膜上,脫脂牛奶封閉2 h后加入兔多抗Bcl-2(1∶2 000)、Bax(1∶2 000),在振蕩器上4 ℃孵育過夜,然后將膜在TB沖洗液中進行3次10 min漂洗,再在羊抗兔二抗(1∶10 000)孵育2 h后,將膜在TB沖洗液中進行3次10 min漂洗,電化學發光(ECL)法顯色,用ImageJ軟件對圖片進行分析,得到灰度值,按照公式計算各組目的蛋白的相對表達量。
1.9統計學方法 采用GraphPad Prism8.0軟件對正態分布的計量資料進行t檢驗。
2 結 果
2.1一般情況 Ⅰ、Ⅱ型對照組飲食飲水正常,毛發光亮,動作敏捷,精神狀態良好;Ⅰ、Ⅱ型DE組精神萎靡不振,動作遲緩,毛發發暗且有脫毛現象,飲食飲水增加,尿量增加。
2.2體質量與隨機血糖變化情況 與Ⅰ型對照組比較,Ⅰ型DE組腹腔注射STZ后72 h、2、3、7、12 w體質量明顯下降(P<0.05)并趨于穩定,血糖明顯升高(P<0.05)并保持在16.7 mmol/L 以上。與Ⅱ型對照組比較,Ⅱ型DE組自第9周起體質量及血糖均明顯升高(P<0.05)。見表1。
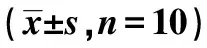
表1 兩種模型動物體質量與隨機血糖變化
2.3Morris水迷宮 與對照組比較,Ⅰ型和Ⅱ型DE組動物游泳速度變慢,逃避潛伏期延長,穿越平臺的次數減少,差異有統計學意義(均P<0.05)。見表2。
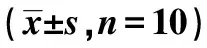
表2 各組Morris 水迷宮、Y迷宮及曠場實驗
2.4Y迷宮 與對照組比較,Ⅰ型及Ⅱ型DE組動物自發交替率明顯降低,且進入新異臂的次數明顯減少(均P<0.05)。見表2。
2.5曠場實驗 與對照組比較,Ⅰ型及Ⅱ型DE組動物運動總路程明顯縮短,進入中央區次數和后肢站立次數顯著減少(均P<0.05)。見表2。
2.6HE染色觀察海馬神經元形態變化 對照組海馬CA1區錐體細胞形態規則,胞體豐滿,排列整齊有序,細胞核藍染,核仁明顯。Ⅰ型DE組海馬CA1區錐體細胞形態不規則,排列疏散,部分神經元壞死,細胞核淡染;Ⅱ型DE組海馬神經元形態未觀察到明顯異常。見圖1。

圖1 各組海馬神經元形態(HE染色,×200)
2.7海馬組織透射電鏡結果 對照組海馬神經元細胞胞質內廣泛分布內質網,線粒體結構完整,線粒體嵴明顯,細胞核大小正常,核膜清晰,染色質分布均勻,神經纖維區富含突觸,結構正常;兩種DE組海馬神經元細胞胞質中內質網和線粒體數量減少,出現脫粒和腫脹,細胞核明顯收縮,核膜增厚,突觸結構被破壞,數量減少。見圖2。

圖2 透射電鏡觀察各組海馬神經元超微結構(×10 000)
2.8血清IL-1β、IL-18水平 兩種DE組血清中促炎因子IL-1β、IL-18水平顯著高于各自對照組(均P<0.05)。見表3。

表3 各組血清IL-1β、IL-18水平比較
2.9Western印跡檢測各組海馬組織Bax、Bcl-2表達水平 與對照組比較,兩種DE組海馬組織凋亡相關蛋白Bax表達顯著增加,Bcl-2表達顯著降低(均P<0.05)。見表3、圖3。

圖3 Western印跡檢測各組Bax、Bcl-2表達
3 討 論
理想的動物模型是DE研究的基礎,應該能夠完全模擬人類DE發生發展過程,模型制作簡單,誘導因素單一,重復性好,可引起DE,并盡可能避免其他因素對認知功能障礙指標的干擾。臨床上最常見的糖尿病類型主要是Ⅰ型及Ⅱ型,DE是糖尿病慢性并發癥之一,是糖尿病患者葡萄糖代謝紊亂導致腦血管發生改變,進而損害中樞神經系統,導致大腦結構、神經生理和神經精神等的病理改變〔12〕。在糖尿病患者中,Ⅱ型糖尿病占90%以上〔13〕,已有大量研究采用Ⅱ型DE模型探究DE可能的發病機制及治療藥物的篩選〔14~17〕。Ⅰ型糖尿病多發于兒童、青少年,且其發病率在世界范圍內呈上升趨勢,建立臨床相關的腦病動物模型對Ⅰ型DE研究具有重要意義。本課題組前期構建Ⅰ型DE模型為DE研究提供參考方法,不論是Ⅰ型還是Ⅱ型DE模型都不能完整呈現DE的發病機制。因此,從全面性和系統性角度考慮,本研究在實驗中同時選用Ⅰ型和Ⅱ型DE模型進行研究。
動物行為學評估在認知功能障礙相關疾病的動物模型評估中具有重要作用〔18~20〕。Morris水迷宮測試是目前評估動物空間認知功能最為常用的研究方法,這種方法利用動物喜水的天性,強迫其盡快找到水下站臺,來測試其記憶能力和空間學習,但是這種方法是強迫性的,會引起實驗動物的情緒反應,可能會影響評估結果〔21〕。每種行為學實驗的側重點與使用條件不一樣,在實驗中,僅通過動物的一種行為學測試表現是不可能準確評估學習和記憶相關的信息,因為受試者可能會被與認知能力無關的其他信息干擾,必要時結合多種行為學方法進行綜合分析,為認知功能障礙相關研究提供科學可靠的依據〔22〕。因此,本實驗選用了Morris水迷宮、Y迷宮和曠場實驗等多種行為學實驗綜合分析動物的認知功能。多種行為學測試結果明確提示,Ⅰ型DE模型組在發病8 w時和Ⅱ型DE模型組在25周齡時與對照組動物確實存在表現差異。
海馬是學習和記憶的中樞,神經元細胞的凋亡和損傷會引起認知功能的障礙〔23~25〕。本實驗顯示,Ⅰ型和Ⅱ型模型組動物海馬組織凋亡Bax/Bcl-2蛋白水平顯著升高,且Ⅰ型模型大鼠海馬神經元細胞排列松散、空泡化明顯、細胞數量減少,這與行為學實驗結果相符;而Ⅱ型模型小鼠海馬神經元細胞無明顯異常,可能由于該時期認知功能障礙屬于早期。因此,如需觀察嚴重的認知功能障礙,Ⅱ型DE模型小鼠還需繼續飼養一段時間。
綜上所述,兩種DE模型作為經典模型,在一定程度上均模擬了臨床DE認知功能障礙的病癥特點,兩種模型之間各有優缺點,適合不同的實驗需求。Ⅰ型DE模型大鼠價格低廉,成模時間短,但個體差異大,在喂養過程中,由于高血糖導致大鼠抵抗力變差,進而出現較高死亡率;Ⅱ型DE模型穩定,但價格偏貴,成模需要的時間較長,飼養的條件要求較嚴格、繁殖率低,且人類糖尿病患者很少發生瘦素受體基因缺失,因此db/db小鼠不能完全模擬人類DE發生過程,其用于DE病因學研究有一定的局限性,可用于DE干預治療研究的模型。若課題組經費充足且實驗條件允許,建議同時選用兩種DE模型進行研究,這樣更能完整模擬人類DE的發生發展過程。實驗中應根據研究目的,結合不同模型的特點,選擇適合的動物模型,從而有助于課題的實施和完成。

