運動預干預對心肌缺血再灌注大鼠心肌損傷及線粒體視神經萎縮蛋白1的影響
程吟 曹振峰 黃怡 盧洪梅 郭文濤
(1廣東醫科大學第二臨床醫學院,廣東 東莞 523808;2海南體育職業技術學院;3廣東醫科大學基礎醫學院)
急性心肌梗死和心力衰竭是世界范圍內導致死亡和殘疾的主要原因之一。心肌缺血時,心肌組織因心肌缺氧和營養供應不足而死亡,再灌注治療如通過溶栓或經皮冠狀動脈介入等干預是心肌梗死的治療選擇,可使心肌組織損傷最小化〔1〕。然而,再灌注本身也可加劇心肌損害,使心臟更容易發生室性心律失常、心肌功能障礙和猝死,是急性心肌梗死臨床治療后的嚴重并發癥之一〔2〕,給家庭和社會帶來了日益沉重的經濟負擔。因此,如何保證缺血心肌組織血供的恢復,制定預防心肌缺血再灌注(I/R)損傷的有效策略至關重要。
心臟I/R損傷是通過一系列相互關聯的途徑介導的,包括活性氧的過度產生、內質網應激、細胞凋亡及線粒體代謝紊亂〔3〕。大量研究表明,線粒體動力學失衡是心肌I/R損傷過程中導致線粒體功能障礙和心肌細胞凋亡的重要因素〔4〕。在生理情況下,線粒體通過裂變和融合不斷分裂和延長,從而以動態的方式保持其形態。線粒體裂變產生小的線粒體碎片,而融合形成伸長的相互連接網絡,因此線粒體融合對于維持線粒體的正常結構和功能至關重要〔5〕。研究認為,線粒體融合對線粒體能量的產生及功能具有一定的保護作用,而I/R時線粒體融合減少,在心肌I/R損傷中起關鍵作用〔6〕。視神經萎縮(OPA)1是一種嵌在線粒體內膜中的蛋白,主要控制線粒體融合。Wang等〔7〕研究發現,心肌I/R損傷中OPA1表達降低,可加重線粒體碎片化,導致線粒體功能障礙和線粒體凋亡,進而導致心肌I/R損傷發生;而過表達的OPA1已被證明可以逆轉線粒體功能,改善I/R大鼠心臟功能〔8〕。因此調控心肌細胞線粒體融合,尤其是OPA1可能是治療心肌I/R損傷潛在的治療靶點。
研究認為,運動是一種眾所周知的非藥物干預手段,能夠改善健康和患病個體的心血管健康,并被證明可以持續改善心肌梗死患者的生活質量,減少住院和心源性死亡〔9〕。動物實驗證實,運動的長期適應性變化與急性心肌梗死發生率降低有關,并通過減輕心肌細胞死亡,對I/R心臟產生有益的保護作用。Campos等〔10〕研究發現,運動可以通過減少心力衰竭時線粒體碎片的積累重建線粒體分裂-融合平衡,改善心力衰竭大鼠心臟功能。而Li等〔11〕研究發現,運動預干預可通過增加線粒體融合下調海馬區β淀粉樣蛋白(Aβ)水平,緩解癡呆小鼠的認知功能下降。基于上述文獻可知,運動訓練對線粒體動力學具有有益的影響,可以推測運動預干預可能通過增強線粒體融合減輕I/R大鼠心肌損傷。本研究通過構建大鼠心肌I/R模型,觀察8 w有氧運動預干預對I/R大鼠心肌梗死面積、心律失常的發生及融合蛋白OPA1表達的影響,探討運動預處理對I/R大鼠心肌的保護效應及可能機制。
1 材料與方法
1.1實驗動物及分組 雄性SD大鼠共39只,體質量220~250 g,由廣東醫科大學實驗動物中心提供〔使用許可證SYXK(粵)2015-0104〕。實驗開始前,將所有大鼠置于標準實驗室環境中飼養(室溫 22 ℃±2 ℃,濕度 50%±5%,晝夜循環12 h),自由進食和飲水。適應實驗室環境1 w后,將大鼠隨機分為:假手術(sham)組、缺血再灌注(I/R)組、缺血再灌注運動(I/R+E)組,每組13只。心肌I/R期間I/R組死亡2只,I/R+E組死亡1只。
1.2跑臺運動方案 參考Bedford等〔12〕中等強度跑臺運動訓練方案,共8 w(5 d/w)。跑臺運動速度為20 m/min 開始,一開始每天運動15 min,每3 d運動時間增加5 min,直至每天運動時間為60 min時,運動時間不再變化,坡度為 由0 ° 調為5 °。
1.3心肌I/R模型建立 跑臺運動結束后,I/R組及I/R+E組建立心肌I/R模型。術前大鼠禁食12 h,腹腔注射戊巴比妥鈉(30 mg/kg)麻醉大鼠,仰臥位固定大鼠,連接小動物呼吸機進行機械通氣(潮氣量設置為5~6 ml,通氣速率60 ~ 70次/min,實驗采用加熱平臺將大鼠體溫維持在37 ℃)。術中電極夾連接大鼠四肢,使用Ⅱ導聯心電圖記錄大鼠心臟活動(圖1),待心電圖基線穩定后,常規手術備皮在第三和第四根肋骨之間開胸暴露心臟,確定左前降支(LAD),并在其遠端約2 mm用6-0 絲線結扎,以心電圖Ⅱ導聯ST段抬高和缺血區心肌組織顏色發紺證實心肌缺血。缺血30 min后松開LAD,缺血心肌持續再灌注90 min,以ST段逐漸降低,左室前壁缺血組織顏色明顯恢復,心電圖T波反轉,證實再灌注成功。Sham組進行相同手術,只穿線不進行心臟結扎。
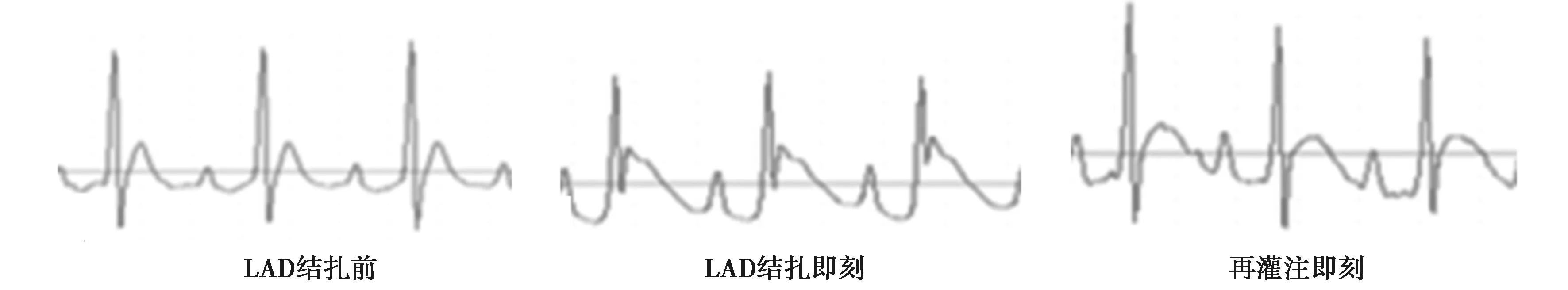
圖1 大鼠心臟LAD結扎前、LAD結扎即刻及再灌注即刻心電圖
1.4大鼠I/R期間心律失常監測 于缺血及再灌注期間采用標準肢體Ⅱ導聯連續檢測各組心電圖變化,根據Lambeth原則〔1〕觀察室性心動過速(VT)、室性顫動(VF)和室性早搏(PVB)發生率,并記錄缺血及再灌注期間VT、VF及PVB第1次出現的時間和缺血及再灌注期間心律失常總持續時間。
1.5伊文氏藍2,3,5-三苯基四氮唑(TTC)雙著色法測定心肌梗死面積 心肌再灌注90 min結束時,再次結扎冠狀動脈,經主動脈灌注2%伊文藍3 ml,以確定心肌缺血危險區。迅速取下心臟,冰鹽水沖洗濾紙試干后置于-20 ℃的冰箱冷凍15 min后切成2 mm冠狀切片,隨后切片被置于1% TTC中染色15 min,孵育20 min(37 ℃)。TTC將心肌危險區染成深紅色,灰白色區域為缺血梗死區,非缺血區心肌呈深藍色,最后將切片置于4%多聚甲醛溶液中,室溫下固定過夜。拍攝心肌切片圖像,使用 Image-ProV6.0 分析計算出梗死區面積(IFA)與危險區面積(RA)的比值,即為心肌梗死面積百分比(IFA/RA)%。
1.6心肌組織OPA1免疫組織化學染色 再灌注90 min后取左心室前壁心肌組織,4%多聚甲醛固定,常規脫水,石蠟包埋,連續切片5張(5 μm),將切片經二甲苯脫蠟、梯度酒精水化后入3% H2O2室溫孵育30 min,磷酸鹽緩沖液(PBS)漂洗后(3次×5 min)加山羊血清封閉液,室溫下放置10 min后滴加OPA1兔抗鼠多克隆抗體(1∶300),室溫孵育1 h后4 ℃過夜,PBS漂洗(3次×5 min)后滴加山羊抗兔IgG 二抗(1∶300),室溫孵育1 h、PBS漂洗3次×5 min后二氨基聯苯胺(DAB)顯色1~3 min,自來水充分沖洗后蘇木素復染2~3 min,梯度酒精脫水、二甲苯透明、樹膠封片。光鏡下觀察并拍照,每張切片取5個視野(400倍)采集圖像,利用形態學圖像分析系統對心肌組織OPA1表達進行分析,用心肌組織5個不同視野內OPA1細胞個數的平均值表示心肌組織OPA1表達水平。
1.7統計學方法 采用SPSS26.0軟件進行t檢驗、χ2檢驗、單因素方差分析。
2 結 果
2.1跑臺運動預干預對I/R大鼠缺血期及再灌注期心律失常的影響 與sham組比較,I/R組心肌缺血及復灌過程中I/R期間VT、VF及PVB發生率均顯著增加,第1次出現心律失常的時間及心律失常持續時間均明顯延長(均P<0.05)。與I/R組比較,8 w跑臺運動預干預可顯著降低大鼠心肌缺血及復灌過程中VT、VF及PVB發生率(P<0.05,P<0.01),且能明顯延長I/R大鼠心肌缺血及復灌期間第1次出現心律失常的時間,明顯縮短心律失常持續時間(P<0.01)。見表1。
表1 各組缺血期及再灌注期心律失常比較
2.2跑臺運動預干預對I/R大鼠心肌梗死面積的影響 與sham組〔(0.96±0.70)%〕比較,I/R組及I/R+E組心肌IFA/RA〔(44.36±9.43)%、(36.02±4.74)%〕均明顯增加(P<0.05)。經過8 w跑臺運動預干預,與I/R組比較,I/R+E組心肌IFA/RA明顯下降(P<0.01)。見圖2。
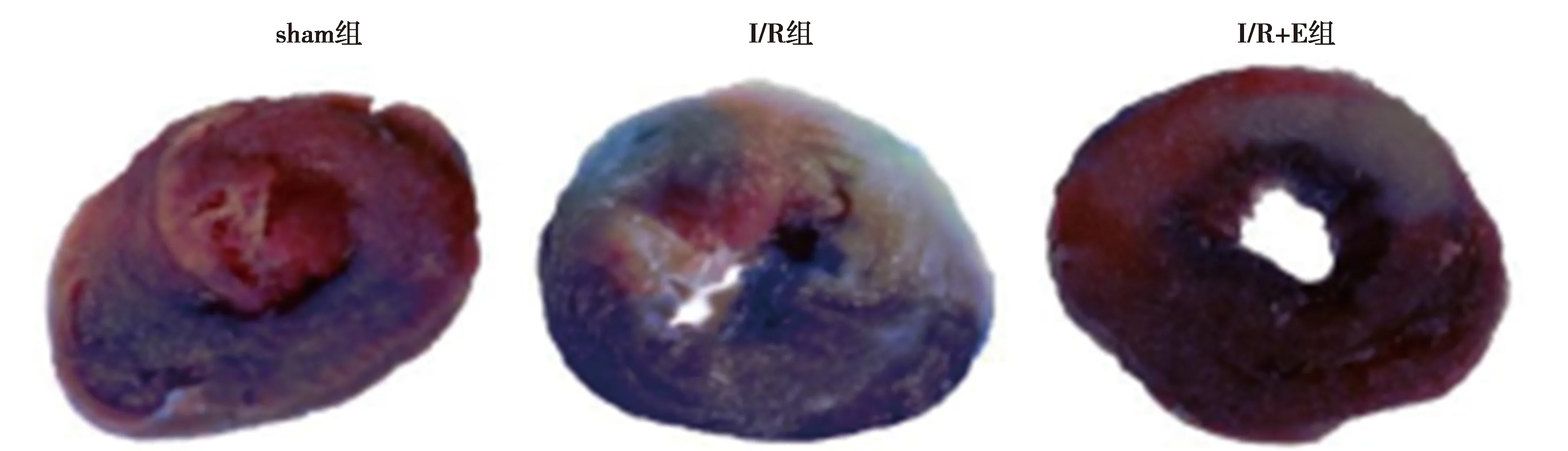
圖2 各組心肌(TTC染色)
2.3跑臺運動預干預對IR大鼠心肌組織OPA1表達的影響 與sham組(11.08±1.98)比較,I/R組及IR+E組心肌組織OPA1表達(6.27±1.56、8.08±1.78)均顯著降低(P<0.005);與I/R組比較,I/R+E組心肌組織OPA1表達顯著增多(P<0.05)。見圖3。
3 討 論
急性心肌梗死后,早期成功的心肌再灌注,如采用溶栓治療或經皮冠狀動脈介入治療是減小心肌梗死面積、提高臨床療效的最有效策略,但再灌注本身可導致心肌細胞死亡,使心臟更容易發生室性心律失常及猝死〔13〕。研究表明,I/R誘導的心肌細胞損傷可觸發強烈的炎癥反應及I/R導致心臟電生理變化均可增加心肌對心律失常的易感性〔14〕。Lee等〔15〕研究發現,大鼠室性心律失常發生在LAD閉塞后及再灌注期內,表現為PVB、VT和VF,并且大鼠心律失常評分及死亡率均顯著增高。并且Jiang等〔16〕研究發現,I/R可使大鼠心梗面積增加、心律失常發生率和死亡率均顯著增加,心肌組織及心臟功能嚴重受損,本研究得到相同結果。
近年來,缺血預處理已經成為預防心肌I/R損傷、改善心律失常及心臟功能的主要研究途徑〔17〕。作為安全有效、臨床可操作性強的處理措施,運動預處理已被報道可以有效降低心血管疾病的發病率和死亡率〔18〕。Meta分析顯示,經常進行體育鍛煉的受試者中心肌梗死的發生率明顯較低,而經常運動的心臟病患者的生存率要高于不運動的心臟病患者。并且動物實驗證實,運動預干預可通過介導抗心肌炎癥及凋亡等通路抵抗心肌I/R損傷,包括減少心律失常(VT、VF及PVB)及心肌梗死等現象的發生〔19〕。此外有研究發現,運動預干預(3 d,跑臺速度 18 m/min)可通過抗炎通路預防心肌I/R損傷,減輕心律失常的發生及心肌壞死,發揮心臟保護作用〔20〕。本研究結果與上述學者研究結果一致。然而Veiga等〔21〕研究發現,雌性大鼠心肌梗死前進行8 w游泳運動預干預(1 h/d,5 d/w)并不能減少LAD永久性閉塞大鼠梗死面積,也不能對心肌缺血大鼠提供心臟保護作用,可能是因為永久性冠狀動脈閉塞可能比短暫缺血再灌注對心肌組織造成更大的損害有關。據報道,I/R誘發心律失常的發生率和嚴重程度取決于心肌梗死的面積,本研究8 w跑臺運動預干預降低I/R大鼠心律失常發生可能與此運動減小I/R大鼠的心肌梗死面積有關,具體機制需進一步研究。
線粒體是不斷發生融合和分裂的動態細胞器,線粒體裂變和融合的失衡導致線粒體結構異常和功能障礙,在I/R損傷的發病機制中起著重要作用〔22〕。研究表明,心肌I/R時抑制線粒體裂變、促進線粒體融合已被證實可以改善I/R中異常的線粒體形態,增加三磷酸腺苷(ATP)的產生,減少線粒體凋亡,逆轉線粒體功能,改善心肌I/R損傷的心臟性能〔23〕。研究表明,在調節線粒體融合中起關鍵作用的OPA1對各種心臟疾病特別是心肌I/R損傷具有保護作用〔24〕。Varanita等〔25〕研究發現,線粒體OPA1表達下降與線粒體功能障礙及IR損傷的敏感性增加有關。并且Le Page等〔26〕研究發現,與正常小鼠比較,OPA1缺失的小鼠梗死面積明顯增大,心律失常的發生率更高。而心臟保護劑褪黑素最近被證明可通過增強與OPA1相關的線粒體融合對I/R大鼠提供心臟保護,從而減少I/R大鼠心肌細胞凋亡及心肌梗死面積。
本研究結果說明,I/R后線粒體融合減少,從而導致了I/R心肌損傷的發生。近年來,與OPA1相關的線粒體融合已成為治療急性心肌I/R損傷潛在發展的新靶點。Ghahremani等〔27〕研究發現,8 w有氧運動可通過提高心肌梗死大鼠心肌融合蛋白OPA1的表達,減少大鼠心肌梗死面積、改善心肌病理變化,表明有氧運動是一種非藥理學的有效的干預心肌梗死的治療方式。Zhao等〔28〕研究表明,8 w游泳運動預干預(15 min/d,5次/w)可通過調節線粒體裂變及融合信號改善線粒體形態,抑制心肌梗死小鼠心肌纖維化和細胞凋亡,從而恢復心肌梗死后線粒體形態并改善心臟功能。另一項研究發現,2 w跑臺運動預處理(20 m/min,30 min/d)可以上調腦缺血再灌注大鼠線粒體OPA1表達、但對分裂蛋白的表達無顯著影響,說明此運動訓練可通過增加線粒體融合對腦缺血再灌注損傷產生神經保護作用〔29〕。本研究結果與上述學者研究結果一致。而馬靜芬〔30〕研究發現,一次急性運動(分別為45、90、120 min)即刻均可使線粒體融合蛋白OPA1表達減少,心肌線粒體融合趨勢下降、分裂趨勢增強,從而增加心肌的炎癥反應。因此,針對不同研究得到不同結果可能與運動干預方式不同有關。心臟線粒體去極化已被證明有助于心律失常的發生,并且線粒體融合蛋白增加可減少心肌I/R損傷引起的心臟線粒體去極化,產生抗心律失常作用。Dai 等〔31〕研究認為,I/R導致的心肌梗死面積增加與線粒體融合不足有關。因此,本研究8 w跑臺運動預干預可能通過增加線粒體融合發揮心肌保護作用,從而減輕心肌I/R損傷,最終導致IR大鼠心律失常減少,梗死面積減小。但是,線粒體融合蛋白OPA1通過何種途徑發揮心肌保護作用,需要進一步研究證實。

