利拉魯肽對高糖介導人牙周膜成纖維細胞的影響
趙東強 林仰東
(1天津市泰達醫院口腔科,天津 300457;2天津市第一中心醫院口腔科)
慢性牙周炎(CP)是一種普遍存在的慢性炎癥性疾病,主要涉及牙齒周圍支撐組織的炎癥,如牙周和血管骨的破壞、牙齒松動,嚴重時可導致牙齒的脫落〔1,2〕,影響了全球大概11%的人口〔3〕。糖尿病已被明確確認為牙周炎的主要危險因素〔4~6〕,與非糖尿病患者相比,糖尿病患者患牙周炎的風險大約增加三倍〔7〕。因此,血糖水平的控制對于牙周炎的發生至關重要。炎癥反應是糖尿病和牙周炎的共同特征,Ⅰ型和Ⅱ型糖尿病都受炎癥因子水平增加的影響〔8〕。炎癥水平的升高會導致糖尿病患者產生眾多血管并發癥,血糖水平的升高可導致炎癥因子釋放進一步增加、氧化應激加劇及造成細胞凋亡〔9〕。作為牙周組織的一部分,牙周韌帶(PDL)是一種將牙齒與牙槽骨連接起來的專用組織纖維。PDL主要由成纖維細胞、成牙骨質細胞、成骨細胞和破骨細胞組成〔10〕。人類牙周韌帶成纖維細胞(hPDLFs)是主要的成纖維細胞類型,可識別病原體,分泌炎癥介質,如白細胞介質(IL)-8和IL-6,與牙周炎的發展密切相關〔11~13〕。因此,維持hPDLFs的免疫平衡被認為有利于牙周疾病的控制。
利拉魯肽(Lira)是一種乙酰化胰高血糖素狀肽-1類似物,與原生胰高血糖素樣肽-1具有97% 氨基酸同源性,并且作用持久,臨床上被廣泛用于治療2型糖尿病〔14〕。研究顯示,Lira具有多重生物學效應,對牙周炎具有改善作用,可減輕其炎癥反應〔15〕,在牙體牙周疾病治療中的具有潛在應用價值,但是關于Lira對高糖誘導的hPDLFs損傷的保護作用及機制有待進一步研究。本文擬研究Lira對高糖介導hPDLFs損傷的影響及機制,探討Lira在CP治療領域里的應用前景。
1 材料和方法
1.1試劑和儀器 hPDLFs購自上海中喬新舟生物科技有限公司,大腸桿菌內毒素/脂多糖類(E.coli LPS,Sigma,美國)、辣根過氧化物酶(HRP)標記的山羊抗兔多克隆抗體、基質金屬蛋白酶(MMP)-2、MMP-3、MMP-9、磷酸甘油醛脫氫酶(GAPDH)單克隆抗體(Santa Cruz),Trizol試劑盒(Invitrogen,美國),IL-8、IL-6、腫瘤壞死因子(TNF)-α、IL-1β酶聯免疫吸附試驗(ELISA)檢測試劑盒(eBioscience)、CCK8細胞增殖檢測試劑盒(碧云天)、Hoechst染色試劑盒(索萊寶)、Western印跡試劑盒(碧云天),相關引物合成(生工生物),DMEM低糖培養基、胎牛血清(Gibco,美國),CO2培養箱(ThermoFisher,美國),酶標儀(Bio-Rad公,美國)、Fluo-3/AM鈣離子熒光探針(Invitrogen,Insight-PlusIQ型激光共聚焦顯微鏡(Meridian,美國),熒光相差顯微鏡(北京榮興光恒科技有限公司)。
1.2方法
1.2.1人牙周膜成纖維細胞培養 hPDLFs培養在10%胎牛血清(FBS)的低糖DMEM培養基中,培養箱設置為37 ℃、5% CO2、飽和濕度。于熒光相差顯微鏡下觀察細胞形態及生長狀況,取對數生長期時用于后續實驗。
1.2.2分組 hPDLFs調整密度為5×108個/L。對照組培養條件為:含11 mmol/L葡萄糖(GLU)常規培養基;甘露醇組:含19.5 mmol/L甘露醇培養基;高糖組:含40 mmol/L GLU培養基中培養;Lira 組:含40 mmol/L GLU和100 nmol/ml Lira的培養基。
1.2.3細胞增殖檢測 使用CCK-8試劑盒檢測細胞增殖,以1×104個細胞/孔在96孔板中種植細胞。24 h后,向其中加10 μl CCK-8試劑,96孔板在37 ℃孵育2 h,酶標儀上測定OD 450 nm值,細胞增殖率=(OD實驗組/OD對照組)×100%。
1.2.4細胞內游離Ca2+濃度的測定 將hPDLFs細胞懸浮并與5 μmol/L Fluo-3/AM分子探針在 37 ℃下孵育45 min。使用Insight-PlusIQ型激光共聚焦顯微鏡觀察細胞中Fluo-3/AM的熒光強度。
1.2.5Hoechst染色檢測細胞凋亡率 未經處理和處理的細胞在磷酸鹽緩沖液中洗兩次,并固定在含有4%甲醛的磷酸鹽緩沖液中,之后用水沖洗,滴加上Hoechst染色液(最終濃度,10 μg/ml)10 min。在染色后,用熒光顯微鏡觀察到細胞核的形態。
1.2.6含半胱氨酸的天冬氨酸蛋白水解酶(Casp-ase)3、6、9活性的檢測 采用熒光比色法測定hPDLFs中Caspase 3、6、9的活性。收集不同處理組hPDLFs,加入提前遇冷的裂解液(50 μl/1×106細胞),混勻后,置于冰上10 min;以2 991 r/min離心10 min,吸取上清液,測定蛋白濃度,加入50 μl特異性的熒光報告底物,分別檢測hPDLFs中Caspase3、6、9的活性。通過熒光分光光度計定量檢測各組hPDLFs中的Caspase3、6、9的活性變化情況。
1.2.7ELISA測定細胞上清液MMP-2、MMP-3和MMP-9的含量 采用ELISA按說明書測定4個實驗組hPDLFs細胞上清液中MMP-2、MMP-3和MMP-9的含量,經離心后,收集各組細胞上清液,按相應的試劑盒說明書檢測相關因子含量,于PR-521酶標儀讀取各細胞OD值,按照試劑盒指示計算MMP-2、MMP-3和MMP-9的含量。
1.2.8Wnt3a連環蛋白β(CTNNB)1、Bcl關聯X蛋白(Bax)、重組人B細胞淋巴瘤因子2XL(Bcl-xl)mRNA的表達測定 收集細胞,加入Trizol試劑提取總RNA。行逆轉錄合成相應的cDNA。逆轉錄條件為:25 ℃ 10 min,48 ℃ 30 min,95 ℃ 5 min。利用合成的cDNA為底物依據qRT-PCR說明書行檢測相應指標mRNA的含量,qRT-PCR條件為:95 ℃預變性1 min,95 ℃變性30 s,59 ℃退火30 s,59 ℃延伸30 s,共40個循環。以GAPDH為內參,利用2-ΔΔCt法計算進行結果分析。所用引物序列見表1。

表1 qRT-PCR的引物序列
1.2.9Wnt3a、CTNNB1、Bax、Bcl-xl蛋白表達水平檢測 處理結束后收集細胞,使用RIPA裂解提取總蛋白質。蛋白質濃度由BCA試劑測定,調整為4 μg/μl,由12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離,并轉移到聚偏氟乙烯(PVDF)膜。然后,5%的脫脂奶粉孵育2 h,然后加入相應的一抗抗體(1∶1 000)在4 ℃的孵育過夜。次日,殘留的一抗抗體通過對苯二甲酸丁二醇酯(PBST)清洗去除,加入HRP標記的山羊抗兔免疫球蛋白(Ig)G二次抗體(1∶5 000)室溫孵育1 h,然后用PBST沖洗3次,每次5 min,多余的液體用過濾紙吸收。電化學發光(ECL)顯色液顯色,采用ImageJ軟件掃描蛋白質條帶并分析灰度值。蛋白質的相對表達水平=目標蛋白帶/GAPDH蛋白條帶的灰度值。
1.3統計學分析 采用SPSS24.0軟件進行單因素方差分析、LSD-t檢驗。
2 結 果
2.1hPDLFs培養鑒定 當hPDLFs細胞接種1 d后,鏡下觀察,可見大部分細胞貼壁,細胞呈長梭形或多角形,胞質均勻,胞體豐滿,細胞兩端的突起明顯可見。取傳代后處于對數生長期的hPDLFs細胞,于相差顯微鏡下觀察,細胞呈柵欄狀或放射狀。于免疫熒光顯微鏡觀察,綠色熒光指示細胞波形絲蛋白,為中胚層來源的成纖維細胞(圖1)。

圖1 hPDLFs相差顯微鏡觀察及免疫熒光染色(×200)
2.2細胞存活率及細胞內鈣離子濃度 與對照組和甘露醇組比較,高糖組hPDLFs細胞內游離Ca2+濃度顯著增加,細胞增殖率顯著降低(P<0.05)。與高糖組比較,Lira組細胞內游離Ca2+濃度顯著降低,細胞增殖率顯著升高(P<0.05)。見表2。
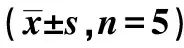
表2 細胞增殖率及細胞內鈣離子濃度、細胞中及細胞上清液Caspase3、Caspase6、Caspase9含量
2.3Caspase3、Caspase6、Caspase9含量測定 與對照組和甘露醇組相比較,高糖組hPDLFs細胞中及細胞上清中MMP-2、MMP-3、MMP-9的含量均顯著升高(均P<0.05)。與高糖組比較,Lira組hPDLFs細胞中及細胞上清液中MMP-2、MMP-3、MMP-9的含量均顯著降低(均P<0.05)。見表2。
2.4Hoechst染色凋亡率檢測結果 與對照組〔(6.45±1.19)%〕和甘露醇組〔(8.23±1.13)%〕相比較,高糖組細胞凋亡率〔(41.62±1.97)%〕顯著增加(均P<0.05);與高糖組相比較,Lira組細胞凋亡率〔(22.70±2.73)%〕明顯降低(P<0.05)。見圖2。

圖2 hPDLFs細胞凋亡率檢測(Hoechst染色,×200)
2.5各組Wnt3a、CTNNB1、Bax、Bcl-xl mRNA及蛋白表達水平 與對照組和甘露醇組相比,高糖組hPDLFs細胞Wnt3a、CTNNB1、Bax mRNA及蛋白表達顯著升高(均P<0.05),Bcl-xl mRNA及蛋白表達顯著降低(P<0.05)。與高糖組比較,Lira組hPDLFs細胞Wnt3a、CTNNB1、Bax mRNA及蛋白表達顯著降低(均P<0.05),Bcl-xl mRNA及蛋白表達顯著升高(P<0.05)。見表3、圖3。

圖3 Wnt3a、CTNNB1、Bax、Bcl-xl 蛋白表達
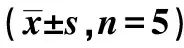
表3 各組Wnt3a、CTNNB1、Bax、Bcl-xl mRNA及蛋白表達水平
3 討 論
牙周炎被認為是人類最常見的疾病之一,目前在全世界范圍內呈明顯增長趨勢,全世界總體患病率為11.2%〔16〕。我國牙周炎患病率遠遠高于世界平均水平,根據最近發布的《中國第四次流行病學抽樣調查》,在35~44歲年齡段人群中,牙周炎患病率約為90.9%。牙周炎是世界牙齒流失的主要原因,并給社會造成巨大的經濟負擔,牙周炎的治療仍然是一個長期且艱巨的任務〔17〕。
Wnt信號通路被認為是人體內重要的信號通路,它調節生物體生長、發育,并控制細胞命運,如增殖、分化、凋亡和癌變。自21世紀初人類遺傳學研究報告了Wnt信號通路成員與骨質疏松之間聯系以來,Wnt信號通路在骨骼發育相關疾病中被廣泛關注〔18〕,人們普遍認為,Wnt信號與牙周炎的發展有關。研究表明,Wnt3a在骨細胞的分化中具有重要的調節作用。在骨細胞分化早期可以誘導堿性磷酸酶的活性,促進骨細胞的分化〔19〕。在骨細胞分化后期階段,Wnt3a可以調節骨原蛋白和骨蛋白(OPG),從而調節骨細胞的分化〔20〕。本研究結果說明高糖誘導hPDLFs細胞損傷模型制備成功;在牙周炎中存在Wnt信號通路的激活;牙周炎發作過程,利拉魯肽在一定程度上通過Wnt/CTNNB1信號通路發揮作用。MMPs是胞外蛋白酶家族,負責細胞外基質的重塑和降解〔21〕。研究顯示,MMPs是與牙周疾病相關的組織破壞過程中最重要的途徑〔22〕。先前的研究表明,在牙周炎患者的牙周組織中檢測到MMP-1、MMP-2、MMP-3、MMP-8、MMP-9水平顯著升高〔23〕。本研究中,高糖處理hPDLFs細胞損傷后,細胞上清液中MMP-2、MMP-3、MMP-9表達升高,與上述研究結果相一致。
綜上,利拉魯肽處理后可顯著抑制高糖引起的hPDLFs細胞損傷后導致的細胞凋亡及凋亡相關因子釋放,改善hPDLFs細胞損傷。利拉魯肽可降低細胞上清液中MMP-2、MMP-3和MMP-9含量及抑制Wnt信號通路成員Wnt3a和CTNNB1表達。本研究結果可為臨床上牙周炎的治療提供借鑒,并為利拉魯肽在牙周炎治療中應用提供理論基礎。

