脫糖預處理對荔枝渣果粉分散特性及營養品質的影響
王宇婷,安可婧,徐玉娟*,彭健,余元善,吳繼軍,肖更生
1(仲愷農業工程學院 輕工食品學院,廣東 廣州,510225)2(廣東省農業科學院蠶業與農產品加工研究所,農業農村部功能食品重點實驗室,廣東省農產品加工重點實驗室,廣東 廣州,510610)
荔枝(Litchichinensis)屬于無患子科荔枝屬常綠喬木[1],是我國最具特色的熱帶、亞熱帶水果之一,含有豐富的營養和獨特的風味,深受消費者的喜愛。荔枝采收季節集中,其特殊的生理特征使得果實采摘后極易發生變色變質,嚴重影響了新鮮荔枝的銷路,據統計每年荔枝因此而造成的損失率高達25%~30%[2]。因此,利用現代食品加工技術將相對過剩的荔枝進行深加工、實現資源充分利用是保障荔枝產業健康發展,提高荔枝附加值的重要途徑。
目前荔枝的加工產品形式主要包括荔枝酒、荔枝醋、荔枝飲料等,在這些產品加工過程中會產生大量皮、核、渣等下腳料,占鮮果重量的40%~50%。這些副產物因含有較高的糖分、果膠等營養物質,極易被微生物利用而發生變質,造成環境的污染[3]。荔枝果渣具有荔枝特有的香氣成分,富含膳食纖維、酚類和多糖等營養成分,但目前果渣主要被用于飼料行業,缺乏高附加值產品。荔枝果粉可作為食品基料用于面包、蛋糕、飲料、冰淇淋等食品中,因應用廣泛、營養豐富、風味宜人而具有良好的經濟價值和廣闊的市場前景。梁世強[4]在傳統米粉中加入了荔枝果粉,改善了米粉的風味,提高了米粉的營養價值;熊雄[5]使用荔枝果粉作為膳食補充物添加到面包中,提高面包營養價值,為功能性面包開發提供依據。
荔枝渣加工中存在的主要問題是由于荔枝渣中含有大量的果糖、葡萄糖、蔗糖,由果渣制成的果粉流動性差、容易結塊,因此在粉劑加工前需要進行脫糖處理。目前常用的脫糖方法有醇沉法、酶法、水洗法和發酵法,醇沉法通常需要借助熱水浸提和超聲輔助提取,所需時間長,過程繁瑣;酶法脫糖效率高,但成本較高;水洗法操作簡單,成本較低;發酵法脫糖效率較高,品質保留好。劉金亮[6]通過對面粉進行二次水洗處理,有效分離了面粉中的淀粉多糖,大大提高了面粉的綜合利用率;郭小宇等[7]采用釀酒酵母L610生產乙醇,發現該酵母對菊芋總糖的利用率最高可達86%。目前關于荔枝渣脫糖的內容尚未有研究報道,基于此,本研究選擇水洗法和發酵法對荔枝果渣進行脫糖效果的比較,以及研究脫糖處理對荔枝果粉分散特性和營養品質的影響,旨在為工業化的脫糖處理技術提供理論依據。
1 材料與方法
1.1 材料與試劑
荔枝渣,廣州順昌源綠色食品有限公司。為淮枝去皮去核后果肉榨汁產生的果渣,儲存于-20 ℃備用。
釀酒酵母RV002,安琪酵母股份有限公司;DPPH、Trolox、沒食子酸、葡萄糖、Folin-Ciocalteu,上海源葉生物科技有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
WF-A2000榨汁機,美的有限公司;BJ-200高速多功能粉碎機,德清拜杰電器有限公司;ALC-210.4電子分析天平,德國ACCULAB公司;PB-10 pH計,賽多利斯公司;HWS24電熱恒溫水浴鍋,上海一恒科學儀器有限公司;JW-1042低速離心機,安徽嘉文儀器裝備有限公司;SU8000超高分辨場發射掃描電子顯微鏡,日立高新技術公司;UV1800紫外分光光度計,日本島津公司;ST85B3-1真空冷凍干燥機,美國Milirock公司;XDW-6B低溫粉碎機,濟南達微機械有限公司。
1.3 實驗方法
1.3.1 實驗流程
(1)未脫糖處理:淮枝去皮去核后果肉榨汁產生的果渣。
(2)發酵脫糖處理:參考李依娜等[8]的方法。酵母粉于50 mL 37 ℃水中活化12 h;荔枝渣與水1∶1混合后,接入樣品量0.02%(質量分數)的酵母粉,30 ℃下發酵24 h后過濾。
(2)水洗脫糖處理:參考劉金亮[6]的方法。稱取一定量的荔枝果渣,加入2倍體積的蒸餾水,于室溫下進行打漿處理,濾去蒸餾水,重復2次洗滌。
(3)冷凍干燥:將未處理、發酵和水洗后的荔枝渣置于-20 ℃冰箱中預凍,然后放入真空冷凍干燥機,冷阱溫度為-0 ℃,真空度13 Pa,加熱溫度20 ℃,干燥至水分含量為5%。
(4)粗粉:凍干后的荔枝渣采用高速多功能粉碎機,在轉數和功率分別為28 000 r/min和1 200 W條件下打粉30 s。
(5)超微粉碎:用粗粉進行超微粉碎處理,在轉數和功率為910 r/min、3 500 W條件下進行不同時間的超微粉碎。
1.3.2 指標測定方法
1.3.2.1 總糖含量及脫糖率
采用3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)法測定總糖[9]。取0.1 g粗粉和超微粉于50 mL燒杯中加入2.5 mL(6 mol/L)的鹽酸溶液,再加入25 mL蒸餾水搖勻,于70 ℃的水浴中加熱20 min后加入2.5 mL(6 mol/L)的氫氧化鈉溶液,并用蒸餾水定容至50 mL,取其中1 mL水解液與2 mL DNS溶液反應,沸水浴中加熱顯色反應3 min,于540 nm下測定吸光值。脫糖率計算如公式(1)所示:
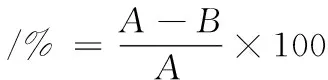
(1)
式中:按干基計算,A,未去糖果渣中總糖含量,mg/g;B,去糖后果渣中總糖含量,mg/g。
1.3.2.2 休止角測定
休止角指在重力場中,粉料堆積體的自由表面處于平衡的極限狀態時自由表面與水平面之間的角度。本文采用注入法測定,參考任亞梅等[10]的方法有所改動。將漏斗置于繪圖紙上方一定距離,把物料顆粒加入到漏斗中,使物料顆粒從漏斗下口自由流出,紙與填充物出口的距離H為0.9 cm,直到粉末形成的圓錐尖端接觸到填料的出口,測量每種粉末的錐形直徑(2R)。休止角計算如公式(2)所示:
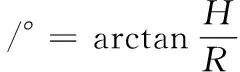
(2)
式中:H,漏斗尾端距平板的距離,cm;R,圓錐體半徑,cm。
1.3.2.3 滑角測定
滑角指自然堆放在光滑平板上的粉料,隨平板做傾斜運動時,粉料開始滑動時的平板傾斜角。滑角的測定常用傾斜法,參考任亞梅等[10]的方法。取3 g微粉置于玻璃平板上,然后將玻璃平板傾斜至約90%微粉移動,玻璃平板與水平面之間形成一夾角,該角即為微粉的滑角。滑角計算如公式(3)所示:
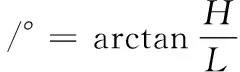
(3)
式中:H,平板的垂直距離,cm;L,平板所對應的水平距離,cm。
1.3.2.4 堆積密度測定
堆積密度是把粉塵或者粉料自由填充于某一容器中,在填充完成后所測得的單位體積質量。將粉料自然填滿10 mL量筒,然后稱量10 mL體積中的樣品質量[11]。堆積密度計算如公式(4)所示:
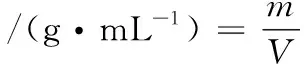
(4)
式中:m,樣品的質量,g;V,樣品的體積,mL。
1.3.2.5 樣品的提取
準確稱取5 g荔枝果粉置于25 mL離心管中,加入15 mL 80%(體積分數)甲醇溶液,超聲波提取30 min 后進行離心(8 000 r/min,10 min),取上清液,再重復上述操作3次,合并上清液,最后用80%甲醇溶液定容至50 mL,-20 ℃條件下貯存, 備用。
1.3.2.6 總酚測定
采用Folin-Ciocalteu法[12]測定總酚含量。取適當稀釋的樣品1 mL,加入2 mL福林酚試劑,振蕩搖勻(避光),加入2 mL 50 g/L碳酸鈉溶液,避光反應1 h,于760 nm下測定吸光值。按干基計算,總酚含量以沒食子酸當量表示,得到線性回歸方程為y=0.021 8x+0.073 5(R2=0.994 7)。
1.3.2.7 抗氧化活性測定
(1)DPPH自由基清除率測定
參考GURSOY等[13]的方法。樣品組:1 mL適當稀釋后的樣品加入5 mL DPPH溶液;空白組:1 mL水加入5 mL DPPH溶液;調零組:1 mL樣品稀釋液加入5 mL乙醇溶液,避光反應10 min,于517 nm下測吸光值。按干基計算,以Trolox為標準品,測定不同質量濃度下的清除率,得到線性回歸方程為y=1.74x+1.432 2(R2=0.999 9)。
(2)ABTS陽離子自由基清除率測定
參考李斌等[14]的方法。取適當稀釋后的樣品0.1 mL,加入3.6 mL ABTS溶液,漩渦振蕩30 s,室溫下避光反應30 min,于734 nm波長下測吸光值。按干基計算,以Trolox為標準品,得到清除率的線性回歸方程為y=-0.001 3x+0.576 1(R2=0.998 4)。
1.3.2.8 電鏡掃描電子顯微鏡(scanning electron microscope,SEM)
將樣品粉末黏在碳導電膠布上,放入離子濺射儀在15 mA下噴鉑金35 s,噴好后放入電鏡樣品倉。抽真空后打開電壓,加速電壓為1.5 kV,觀察樣品形貌。
1.4 數據處理
數據采用Excel 2015進行處理分析,所有指標重復測定3次,實驗結果表示為平均值±標準差,采用SPSS軟件進行顯著性分析,采用Origin 2018進行繪圖。
2 結果與分析
2.1 總糖含量變化
如表1所示,未處理的荔枝渣總糖含量為155.61 mg/g,發酵預處理和水洗預處理后荔枝果粉總糖含量變為24.77~27.63 mg/g d.b和44.03~49.13 mg/g,糖分脫除率分別為81.89%~84.60%和68.3%~71.59%。說明發酵預處理和水洗預處理均能有效降低總糖含量,發酵預處理脫糖效果更顯著。這是因為荔枝渣中的糖主要是蔗糖、果糖和葡萄糖,而酵母菌對果糖、葡萄糖、蔗糖的利用能力非常強, 幾乎可以把這些糖全部代謝為二氧化碳和乙醇[15],此外,經前期研究發現,RV002釀酒酵母中的纖維素酶,利用不可溶性膳食纖維將其轉化為葡萄糖后,再代謝為二氧化碳和乙醇;而水洗預處理則使可溶性糖溶解于水中,通過溶解過濾將荔枝渣中的可溶性糖脫除,只能脫除可溶性糖,很難將糖分完全脫除,并且需要消耗大量的水,所以從脫糖效率和成本角度考量,發酵脫糖預處理優于水洗脫糖預處理。此外,隨著超微粉碎時間的延長,荔枝果粉總糖含量也逐漸增加,發酵預處理脫糖率由84.60%降低至81.89%;水洗預處理脫糖率由71.59%降低至68.3%(圖1)。這是由于超微粉碎破壞了荔枝渣細胞結構,促進細胞內活性物質釋放,故總糖含量增加[16]。
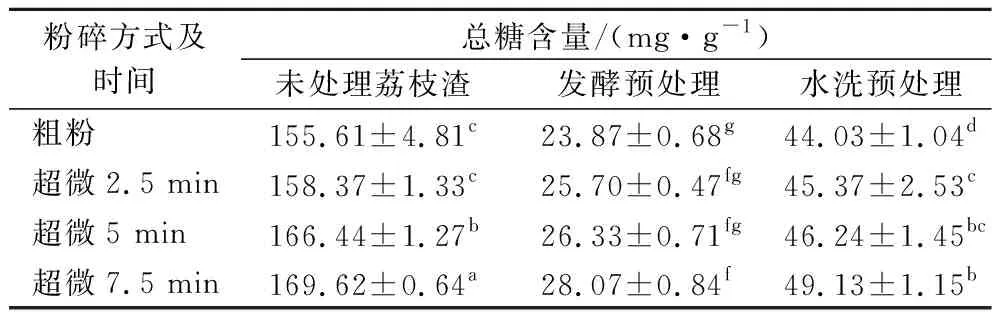
表1 不同預處理對荔枝果粉的總糖含量的影響Table 1 Effects of different pretreatments on the total sugar content of litchi fruit powder
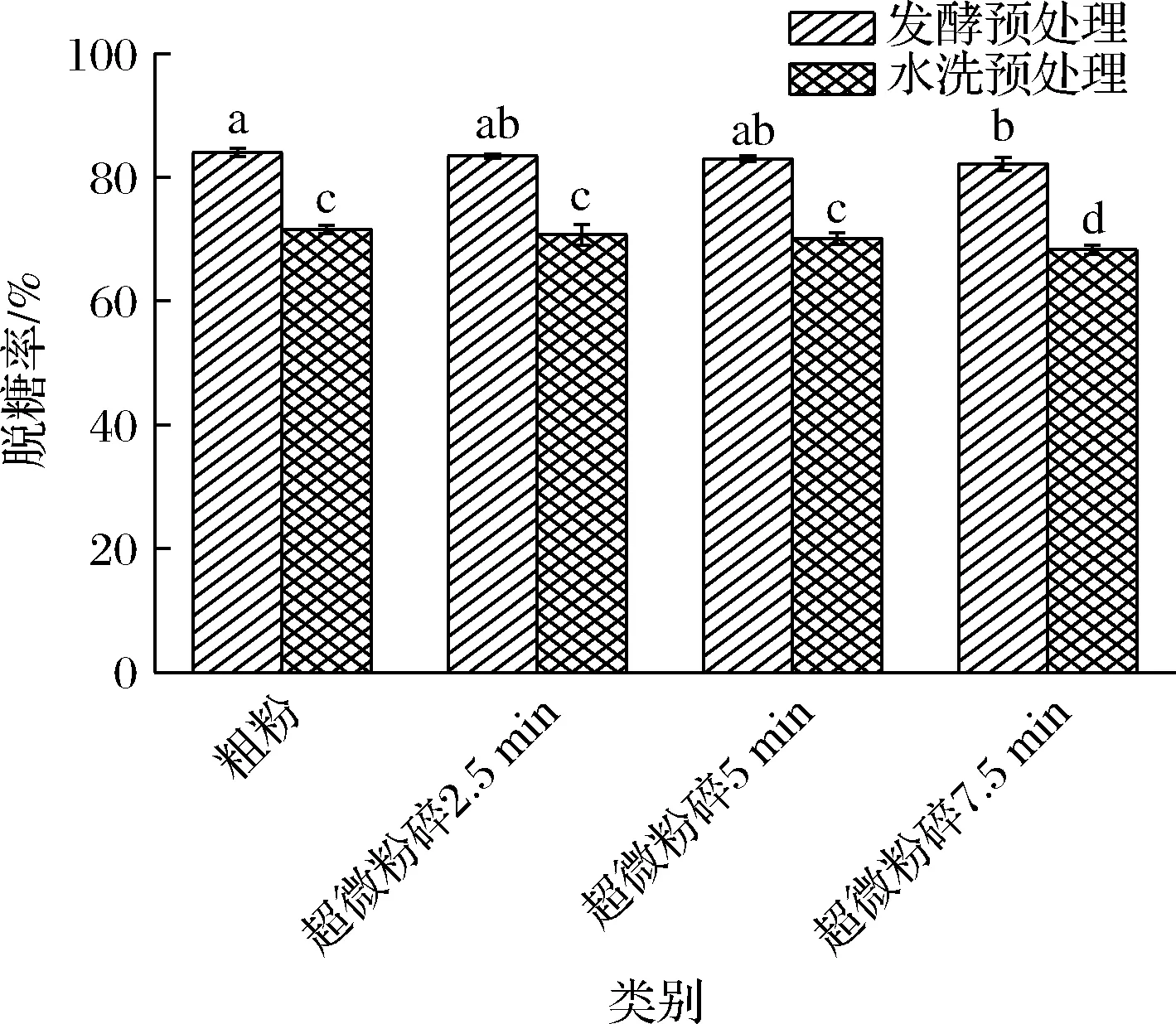
圖1 不同預處理對荔枝果粉脫糖率的影響Fig.1 Effect of different pretreatments on the desugar rate of litchi fruit powder注:不同小寫字母表示顯著性差異(P<0.05)(下同)
2.2 不同預處理對荔枝果粉休止角、滑角、堆積密度的影響
目前常用休止角和滑角表示粉體的流動性能,休止角和滑角越小,摩擦力越小,粉體流動性越好[17]。如表2所示,未處理的荔枝粗粉休止角和滑角分別為62.26°和38.29°,發酵預處理的荔枝粗粉休止角和滑角分別為55.01°和34.51°,水洗預處理的荔枝粗粉的休止角和滑角分別為57.66°和36.66°,說明發酵預處理比水洗預處理的荔枝粗粉的流動性好,這是因為未處理及水洗預處理的荔枝果粉粉體含糖量較高,會出現團聚現象,因此流動性變差。隨著超微粉碎時間的延長,未脫糖處理的果粉及2種預處理粉劑的休止角與滑角都逐漸增大,未處理處理的荔枝果粉休止角由62.26°增大到68.01°,滑角由38.29°增大到52.54°;發酵預處理的荔枝果粉休止角由55.01°增大到62.77°,滑角由34.51°增大到45.64°;水洗預處理的荔枝果粉休止角由57.66°增大到63.61°,滑角由36.66°增大到49.83°。這是因為隨著超微粉碎時間的延長,果渣細胞內部的糖分逐漸釋放,粉體表面聚合力和黏著力相應增大,致使流動性變差。

表2 不同預處理對荔枝果粉的分散特性的影響Table 2 Effect of different pretreatments on the dispersion characteristics of litchi fruit powder
堆積密度又稱填充密度,堆積密度越高,粉體疏松性越差[18]。未處理的荔枝果粉堆積密度為0.25~0.34 g/mL,發酵預處理的荔枝果粉堆積密度為0.20~0.31 g/mL,水洗預處理的荔枝果粉堆積密度為0.21~0.32 g/mL,相同超微粉碎條件下,水洗脫糖預處理的荔枝果粉堆積密度高于發酵脫糖預處理,這是因為發酵預處理后粉體含糖量低,所得粉體質地疏松,顆粒間隙較大,所以堆積密度較小;水洗預處理含糖量較高、粉體顆粒有粘黏結塊現象,所以堆積密度較高。此外,隨著超微粉碎時間的延長,堆積密度增大,這是因為超微粉碎使粉體顆粒變小,空隙減小,堆積密度增大,并且隨著含糖量增加,黏性增加,粉體的堆積密度進一步升高。
2.3 不同預處理對荔枝果粉總酚含量的影響
如圖2所示,未處理的荔枝渣總酚含量為19.82 mg/g,經發酵和水洗預處理后荔枝果粉總酚含量分別為20.70、17.95 mg/g,說明發酵預處理的荔枝果粉總酚含量顯著高于水洗預處理荔枝果粉,這可能是因為荔枝中含有苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL),PAL與一些重要的次生物質如木質素、黃酮類物質的合成有關,為多種酚類及類黃酮終產物提供前體,酵母通過誘導PAL活性升高,促進酚類物質的生成[19];另一方面,酵母菌代謝產生的蛋白酶、纖維素酶和果膠酶可從不溶性基質中釋放結合酚類化合物,并將其水解為游離形式,增加發酵產物中多酚含量[20];其次,在水洗脫糖處理的過程中,會造成營養物質流失,使總酚含量降低。因此,發酵預處理的荔枝果粉總酚含量高于水洗預處理的。此外,隨著超微粉碎時間的延長,總酚含量逐漸增加,未經脫糖處理的荔枝果粉總酚含量由19.82 mg/g增加到23.81 mg/g,發酵預處理的荔枝果粉總酚含量由20.70 mg/g增加到25.59 mg/g,水洗預處理的荔枝果粉總酚含量由17.95 mg/g增加到19.04 mg/g,這是因為原料經超微粉碎后,細胞壁破碎,超微粉碎使大量酚類物質從細胞內釋放出來,并且有一些結合酚在超微粉碎過程中轉變為游離酚,更容易被檢測[21]。
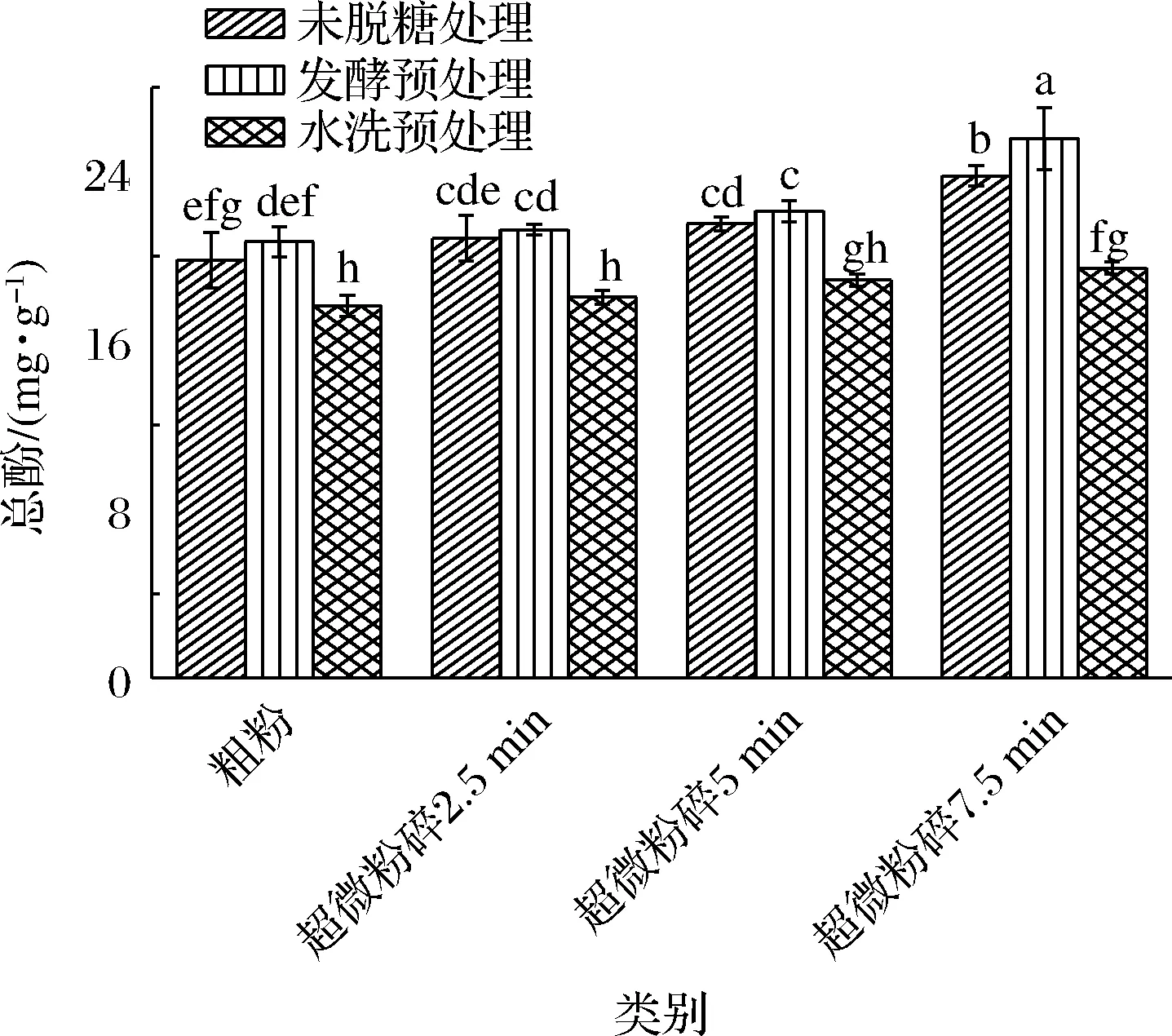
圖2 不同預處理對荔枝果粉總酚含量的影響Fig.2 Effect of different pretreatment on the total phenolic content of litchi fruit powder
2.4 不同預處理對荔枝果粉抗氧化活性的影響
在本研究中采用DPPH和ABTS兩種方法對荔枝果粉抗氧化能力做出評價。由圖3可知,根據Trolox當量,發酵預處理的清除DPPH自由基的能力及清除ABTS陽離子自由基能力最強,其值分別為78.12 mg/g及72.03 mg/g。很多文獻證實了酚類物質含量與抗氧化呈正相關性[22-23],因此,發酵脫糖處理使荔枝渣抗氧化活性提高的原因是由于微生物轉化促進促進酚類物質的生成,以及微生物使結合酚轉化為游離酚,增加了可被檢測的酚類物質。

A-DPPH自由基清除能力;B-ABTS陽離子自由基消除能力圖3 不同預處理對荔枝果粉抗氧化能力的影響Fig.3 Effect of different pretreatments on the antioxidant capacity of litchi fruit powder
此外,隨著微粉化程度的增加,荔枝渣自由基清除能力與總酚含量變化趨勢一致,未脫糖處理的清除DPPH自由基的能力由85.96 mg/g增至107.14 mg/g,發酵預處理清除DPPH自由基的能力由90.90 mg/g增加至111.17 mg/g,水洗預處理清除DPPH自由基的能力由78.12 mg/g增加至101.90 mg/g;未脫糖處理清除ABTS陽離子自由基能力由69.60 mg/g增加至112.83 mg/g;發酵預處理清除ABTS陽離子自由基能力由72.03 mg/g增加至116.49 mg/g;水洗預處理清除ABTS陽離子自由基能力由65.55 mg/g增加至108.92 mg/g,是因為隨著荔枝微粉的粒徑減小,多酚等抗氧化物質與提取溶劑的接觸面積增大,粉體的抗氧化活性增高,其次超微粉碎處理使荔枝渣中的抗氧化活性成分更易于溶出,自由基清除率逐漸增加[24]。
2.5 不同預處理對荔枝果粉微觀結構的影響
不同脫糖預處理的荔枝粗粉與超微粉的掃描電鏡形態如圖4所示,荔枝粗粉中,未處理的果粉大小不均、有粘黏現象;發酵預處理的果粉表面平整光滑,無明顯褶皺收縮;水洗預處理的果粉表面有明顯褶皺收縮,粉體表面凹凸不平,有許多孔隙。隨著超微粉碎時間的延長,未處理的荔枝果粉,表面富集微小粉體,果粉之間黏附現象愈加明顯;發酵預處理的荔枝果粉粉體逐漸變小,大小均勻;水洗預處理的荔枝果粉,隨著超微粉碎時間的延長,顆粒大小不均一,粒徑較小的顆粒間交互面積增加,說明粉體有團簇聚集結塊的現象[25]。果粉的微觀結構顯示,發酵脫糖預處理的果粉顆粒大小更均勻、分散性更好,無明顯結塊現象,優于水洗脫糖預處理。

a-1為未處理粗粉;a-2為未處理超微2.5 min微粉;a-3為未處理超微5 min微粉;a-4未處理超微7.5 min微粉;b-1為發酵預處理粗粉;b-2為發酵預處理超微2.5 min微粉;b-3為發酵預處理超微5 min微粉;b-4為發酵預處理超微7.5 min微粉;c-1為水洗預處理粗粉;c-2為水洗預處理超微2.5 min微粉;c-3為水洗預處理超微5 min微粉;c-4水洗預處理超微7.5 min微粉圖4 不同預處理荔枝粗粉與微粉的掃描電鏡形態(1 000×)Fig.4 SEM morphology of different pretreatment litchi coarse and powder (1 000×)
3 結論與討論
與未處理的荔枝粉相比,2種預處理方式均能顯著降低荔枝果粉總糖含量,發酵預處理脫糖效率比水洗預處理更高。與未處理及水洗預處理的果粉相比,經過發酵預處理的荔枝果粉的堆積密度、滑角及休止角降低,說明發酵后的荔枝果粉具有更好的流動性,并且隨著超微粉碎時間的延長,水洗預處理果粉出現團聚現象,流動性變差。在粉體營養品質方面,發酵預處理的荔枝果粉的總酚含量、抗氧化能力顯著高于水洗處理的荔枝果粉。電鏡結果顯示發酵預處理的荔枝果粉表面光滑,水洗預處理的荔枝果粉表面有明顯褶皺收縮,隨著超微粉碎時間的延長,發酵處理的荔枝果粉的大小均勻,而水洗預處理的荔枝果粉有明顯粘黏現象產生。綜上,從脫糖效率、粉體分散性及營養品質方面考慮,發酵脫糖處理顯著優于水洗脫糖處理,本研究可為工業化采用微生物轉化脫糖技術的應用提供理論依據。

