基于網絡藥理學和實驗驗證探討甘草防治非酒精性脂肪肝病及肥胖的作用機制
李 云,劉天宇,袁恒杰,李正翔
基于網絡藥理學和實驗驗證探討甘草防治非酒精性脂肪肝病及肥胖的作用機制
李 云1,劉天宇2,袁恒杰1,李正翔1*
1. 天津醫科大學總醫院 藥劑科,天津 300052 2. 天津醫科大學總醫院 消化科,天津 300052
基于網絡藥理學和實驗驗證探討甘草et防治非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)及肥胖的活性成分、作用靶點及潛在機制。采用TCMSP數據庫結合已發表文獻篩選獲得甘草主要活性化學成分及其作用靶點,GeneCards數據庫獲取NAFLD及肥胖靶點,分別用String平臺、Cytoscape 3.9.1軟件分析并構建蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡。借助Metascape平臺分析交集靶點并進行基因本體(gene ontology,GO)功能及京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,采用Cytoscape 3.9.1軟件構建“甘草成分-疾病靶點-通路”網絡,進一步采用分子對接驗證預測的關鍵成分與靶點之間的結合能力與親和力,通過動物實驗證實關鍵成分對靶點通路的調控作用。甘草主要通過核心活性成分槲皮素、甘草酸、山柰酚、柚皮素和芒柄花素等作用于前列腺素G/H合酶2(prostaglandin G/H synthase 2,PTGS2)、雌激素受體1(estrogen receptor 1,ESR1)、過氧化物酶體增殖激活受體γ(peroxisome proliferator-activated receptor gamma,PPARG)、一氧化氮合酶2(nitric oxide synthase 2,NOS2)及糖原合成酶激酶3β(glycogen synthase kinase-3 beta,GSK3B)等關鍵靶點蛋白,經脂質與動脈粥樣硬化、胰島素抵抗、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信號通路、PPAR信號通路、T細胞受體信號等通路發揮防治NAFLD及肥胖的功效。活性成分甘草酸可以緩解高脂飲食小鼠肝臟脂肪變性,顯著減輕小鼠體質量增加(<0.05),明顯改善血脂及肝功能水平(<0.05、0.01),同時顯著增加肝臟視黃酸受體α(retinoic acid receptor RXR-alpha,)、及膽固醇7α-羥化酶(cholesterol 7α-hydroxylase,)的mRNA及蛋白表達(<0.05、0.01)。甘草通過多成分、多靶點、多途徑干預NAFLD及肥胖,其主要活性成分甘草酸能通過激活高脂飲食小鼠肝臟RXRA/PPARG/ CYP7A1信號通路發揮抗NAFLD及肥胖藥效作用。
網絡藥理學;甘草;非酒精性脂肪肝病;肥胖;高脂飲食小鼠;甘草酸;柚皮素;芒柄花素;RXRA/PPARG/CYP7A1信號通路
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)及肥胖在全世界的發病率迅速增加,二者已成為慢性炎癥性疾病及代謝性疾病病死率的重要危險因素,并成為新的全球衛生問題之一[1-2]。NAFLD及肥胖均由遺傳背景和環境因素共同作用引起,發病隱匿。NAFLD病理改變包括肝臟單純脂肪變性、脂肪性肝炎、肝硬化甚至可發展為肝細胞性肝癌,肥胖往往由高脂高糖飲食引起,以脂肪過度堆積為特征,脂肪沉積在肝臟則表現為脂肪肝。NAFLD的病理生理學機制復雜,目前并未完全闡明,臨床尚無專一對癥藥物治療,常以抗炎、降酶、保肝藥物等輔助改善癥狀[3];肥胖臨床治療藥物種類有限,選擇性少,且多見胃腸道及營養素缺乏等不良反應[4]。與此同時,多項臨床回顧研究指出NAFLD的全球患病率約25%[5],而在當今肥胖流行的情況下則持續上升,約36.1%[6],二者關系密切,同時具備兩者特征的群體背后常具有相同的誘因和發病機制[7]。臨床目前針對NAFLD及肥胖的主流治療方式仍為生活方式飲食干預、控制體質量及血糖。因此,針對誘因及病機相同的NAFLD和肥胖患病人群尋找可用于改善二者的中藥及中藥活性成分并加以合理研究利用具有重要社會價值。
甘草為豆科植物甘草Fisch.、脹果甘草Bat.或光果甘草L.的干燥根及根莖,味甘,性平。甘草最早收載于《神農本草經》,并列為上品,明代李時珍《本草綱目》中更將其列為百藥之首。臨床上具有補脾益氣、清熱解毒、祛痰止咳、緩急止痛和調和諸藥等功效,因而也是我國最常用的大宗藥材之一,在民間素有“國老”之稱。甘草中主要有效成分為甘草酸皂苷類和黃酮類化合物[8]。現代臨床和藥理研究表明,甘草粗提物具有減輕體質量、抵抗NAFLD、改善糖脂代謝等多種作用[9-12],臨床上也將各類甘草酸制劑應用于NAFLD的治療,并取得較好的療效[13-14],近來研究發現甘草酸制劑可減輕高脂飲食誘導的小鼠肥胖[15]。然而代謝性疾病臨床病理變化復雜,且甘草的藥效物質基礎及其作用機制尚不明確。因此,系統整體地研究甘草抗NAFLD及肥胖生物活性成分及其潛在分子作用機制,可為臨床用藥的選擇和創新提供參考依據。
網絡藥理學是從整個生物網絡角度去探究疾病機制和藥物作用機制的新興學科,在整合了醫學、生物學、計算機科學、生物信息學等多學科基礎理論的基礎上,可系統預測中藥有效活性成分及藥物作用機制。本研究運用網絡藥理學的研究思路和方法,結合分子對接驗證與動物實驗藥效評價,探討了甘草抗NAFLD及肥胖的主要活性成分及作用靶點,揭示其潛在的作用機制,對闡釋甘草抗NAFLD及肥胖的科學內涵、推廣其臨床應用、挖掘臨床防治NAFLD及肥胖的中藥活性成分具有重要意義。
1 材料
1.1 動物
SPF級4周齡C57BL/6J雄性小鼠15只,體質量(20±2)g,購自北京華阜康生物科技有限公司,許可證號SCXK(京)2019-0008,飼養于天津醫科大學SPF級實驗動物中心。動物實驗經天津醫科大學總醫院實驗動物福利倫理委員會批準(批準號IRB2022-DWFL-353)。
1.2 藥品與試劑
甘草酸(批號200116,質量分數>98%)由江蘇正大天晴藥業股份有限公司提供;鼠源過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor gamma,)引物(F: 5’-GGAAGACCACTCGCATTCCTT-3’,R: 5’-GTAAT- CAGCAACCATTGGGTCA-3’)、膽固醇7α-羥化酶(cholesterol 7α-hydroxylase,)引物(F: 5’-AGGCATTTGGACACAGAAG-3’,R: 5’-ACAGAT- TGGAGGTTTTGCAT-3’)、視黃酸受體α(retinoic acid receptor RXR-alpha,)引物(F: 5’-ATGGACACCAAACATTTCCTGC-3’,R: 5’-CCAG- TGGAGAGCCGATTCC-3’)、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,)引物(F: 5’-TGTGTCCGTCGTGGATCTGA-3’,R: 5’-CCTGCTTCACCACCTTCTTGA-3’)購自蘇州金唯智生物技術有限公司;Trizol試劑(批號017E2231FA)、逆轉錄試劑盒(批號7E691I2)購自南京諾唯贊生物科技股份有限公司;PPARG兔單克隆抗體(批號GR240085-9)、CYP7A1兔多克隆抗體(批號GR240038-2)、RXRA兔單克隆抗體(批號GR152085-14)、HRP標記的山羊抗兔IgG多克隆抗體(批號15044790-5)購自英國Abcam公司;β-actin兔單克隆抗體(批號F210094)購自上海泊灣生物科技有限公司;RIPA裂解液(批號20220416)、BCA蛋白濃度測定試劑盒(批號20230206)購自北京索萊寶科技有限公司;
1.3 儀器
D37520型低溫高速離心機(德國Kendro公司);7180型全自動生化分析儀(日本Hitachi公司);組織脫水機、石蠟包埋切片機(德國Leica公司);SZX7型光學顯微鏡(日本Olympus公司);DNA Thermal Cycle 480擴增儀(美國Perkin Elmer Cetus公司);Realtime PCR儀、5415D型小型臺式高速離心機(上海銳聰實驗室設備有限公司);Infinite M200 Pro型多功能酶標儀(奧地利Infinite公司);電泳儀和轉膜儀(美國Bio-Rad公司)ChemiScope 6200型化學發光成像系統(上海勤翔科學儀器有限公司)。
2 方法
2.1 網絡藥理學分析
2.1.1 甘草潛在活性成分及靶點的獲取、NAFLD及肥胖相關靶點的獲取 利用TCMSP數據庫(https://old.tcmsp-e.com/tcmsp.php)檢索“甘草”活性成分及靶點,將檢索結果以口服生物利用度(oral bioavailability,OB)≥30%及類藥性(drug-likeness,DL)≥0.18[16]的2個吸收、分布、代謝、排泄(absorption, distribution, mentabolism, excretion,ADME)參數為條件對甘草入血成分進行初步篩選,得到其潛在活性成分及對應靶點信息。而后經STITCH數據庫(http://stitch.embl.de/)設置置信度大于0.4,剔除不含相關信息化學成分,同時查閱《中國藥典》2020年版和已發表的相關文獻補充上述限制條件篩去或未預測到的甘草中含量較高、藥理作用明確的主要活性成分。在TCMSP數據庫中未查詢到靶點的成分,通過PubChem數據庫下載SDF格式文件,導入PharmMapper數據庫(http:// lilab-ecust.cn/pharmmapper/submitfile.html),設置Normal Fit值大于0.6,補充甘草成分靶點信息。將上述成分及靶點信息整合匯總去重后,將蛋白名靶點在Uniprot數據庫中匹配為基因名稱,即獲得甘草的潛在活性成分及靶點。
以“nonalcoholic fatty liver disease”“obesity”為關鍵詞分別進入GeneCards數據庫(https://www.genecards.org)和TTD數據庫(https://db.idrblab.net/ttd/),進行檢索,搜集整理各數據庫疾病靶點結果。在GeneCards數據庫中,當預測靶點結果過多時,則可設定relevance score大于中位數的靶點為目標疾病的潛在靶點[17]。合并匯總各數據庫結果,刪去重復值取并集,由此獲得NAFLD及肥胖的潛在靶點。
2.1.2 甘草治療NAFLD及肥胖的關鍵靶點蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡的構建 將整理好的甘草成分的藥物靶點、NAFLD相關靶點及肥胖相關靶點導入jvenn在線作圖軟件平臺做交集處理,繪制Venn圖,三者的交集靶點即為甘草治療NAFLD及肥胖的關鍵靶點。將交集得到的關鍵靶點提交至String在線平臺(https://cn.string-db.org/),設定物種“Homo Sapiens”、最低相互作用閾值0.4,構建PPI網絡,下載數據導入Cytoscape 3.9.1軟件,進行拓撲分析,按度值排序構建關鍵靶點PPI網絡。
2.1.3 甘草活性成分-NAFLD及肥胖關鍵靶點功能與通路的富集分析 將關鍵靶點上傳至Metascape平臺(https://metascape.org/),物種設定為“Homo Sapiens”,設置<0.01進行基因本體(gene ontology,GO)功能及京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,下載保存數據結果,分別選擇排名前10、20的條目采用bioinformatics在線繪圖平臺進行數據可視化。
2.1.4 “甘草活性成分-NAFLD及肥胖靶點-通路”網絡構建 選擇主要與NAFLD及肥胖相關的KEGG富集分析排名前20的信號通路,建立參與相關通路的成分及靶點之間的聯系,導入Cytoscape 3.9.1構建“甘草活性成分-NAFLD及肥胖靶點-通路”的相互關系網絡。對其進行網絡拓撲參數分析,以度值排序,判斷發揮藥效的主要活性成分及核心作用靶點。
2.1.5 分子對接驗證 將上述獲得的前5個核心成分及核心靶點進行分子對接驗證。小分子的3D結構從PubChem數據庫下載獲得,對接使用的核心靶點蛋白晶體結構從PDB數據庫中下載獲得,使用PyMol 2.5軟件對所有蛋白進行處理,包括去除水分子,鹽離子以及小分子,采用AutoDock Vina 1.1.2軟件進行分子對接工作,PyMol 2.5以及Ligplus 2.2將對接結果進行可視化。
2.2 動物實驗驗證
2.2.1 分組、造模與給藥 C57BL/6J雄性小鼠適應性喂養1周后,隨機分為對照組、模型組和甘草酸(150 mg/kg[18])組,每組5只。對照組以含10%脂肪的常規飲食飼養,模型組和給藥組以含60%脂肪的高脂飲食飼養,給藥組隔日ip 0.3 mL甘草酸,對照組和模型組隔日ip等體積生理鹽水,持續14周。
2.2.2 各組小鼠血清總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)水平和丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)活性的測定 給藥結束后稱定質量,并于眼眶靜脈叢取血,置試管中,室溫放置30 min充分凝血,然后立即在4 ℃、3500 r/min離心獲得血清,采用全自動生化分析儀檢測血清中TC、TG水平和ALT、AST活性。
2.2.3 各組小鼠附睪白色脂肪和肝組織病理學觀察 各組小鼠以異氟醚麻醉后處死,剝離肝臟、附睪白色脂肪組織,稱定質量,用4%多聚甲醛固定,經脫水、透明、浸蠟、包埋后切片(厚度4 μm),進行蘇木素-伊紅(HE)染色[19],于顯微鏡下觀察肝臟脂肪變性程度及附睪脂肪形態并拍照。
2.2.4 qRT-PCR檢測各組小鼠肝臟組織、和mRNA表達 按照試劑盒說明書提取各組小鼠肝臟組織中總RNA并合成cDNA,進行qRT-PCR分析[19]。
2.2.5 Western blotting檢測各組小鼠肝臟組織PPARG、CYP7A1和RXRA蛋白表達 取各組小鼠肝臟組織,加入RIPA裂解液提取總蛋白,BCA法測定蛋白濃度。蛋白樣品經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉至PVDF膜,封閉后分別加入PPARG(1∶200)、CYP7A1(1∶200)、RXRA(1∶200)和β-actin(1∶200)抗體,4 ℃孵育過夜后,加入HRP標記的IgG二抗(1∶5000),室溫孵育1 h,電發光試劑盒顯影,經蛋白凝膠成像儀進行曝光,采用Image J軟件定量分析。

3 結果
3.1 甘草活性成分及靶點的獲取、NAFLD及肥胖相關靶點的獲取
通過TCMSP數據庫檢索甘草化學成分,共檢索到280個化學成分,經ADME參數(OB≥30%、DL≥0.18)對甘草入血活性成分進行初步篩選,得到92個活性成分。然后經STITCH數據庫置信度>0.4剔除不含相關信息的成分,同時查閱相關文獻補充重要化學成分,最終獲得89個活性成分,具體信息見表1。從TCMSP數據庫檢索甘草各化學成分的靶點信息,并通過PharmMapper數據庫預測補充缺乏靶點信息的化合物,整合去重后獲得417個藥物靶點。
基于Genecards數據庫通過關鍵詞搜索,共獲得1195個NAFLD靶點、9842個肥胖靶點(Score值最大值為77.40,最小值為0.10)。Genecards數據庫中的Score值越高說明該靶點與疾病密切關聯,針對過多的肥胖靶點,通過設定Score值大于中位數,篩選得到1184個肥胖靶點。TTD數據庫檢索得到7個NAFLD靶點、81個肥胖靶點。合并去重后,獲得1195個NAFLD靶點、1184個肥胖靶點。
3.2 甘草治療NAFLD及肥胖的關鍵靶點PPI網絡的構建
將甘草成分靶點與NAFLD靶點及肥胖靶點取交集,數據導入jvenn在線作圖軟件平臺,繪制韋恩圖,得到106個甘草治療NAFLD及肥胖的關鍵靶點(圖1-A),將交集靶點提交至String在線平臺,下載蛋白相互作用數據,進一步通過Cytoscape 3.9.1進行拓撲分析,按度值排序構建類似同心圓的PPI網絡(圖1-B),該網絡共包括106個節點,1961條邊。節點表示蛋白,直線表示存在相互關系。節點的度值越大,在圖中顏色越深,面積越大,說明有更多的蛋白與其發生相互作用,此節點蛋白在網絡中的作用越重要。網絡中關鍵節點蛋白主要是白蛋白(albumin,ALB)、腫瘤壞死因子(tumor necrosis factor,TNF)、白細胞介素-6(interleukin-6,IL6)、RAC-α絲氨酸/蘇氨酸蛋白激酶(RAC-alpha serine/threonine-protein kinase,AKT1)、PPARG、IL1B(表2)。

表2 關鍵節點蛋白信息
3.3 關鍵靶點功能與通路的富集分析
采用Metascape數據平臺對106個關鍵靶點進行生物學過程(biological process,BP)、細胞組成(cellular component,CC)和分子功能(molecular function,MF)3部分的GO富集分析與KEGG通路富集分析。GO富集共得到1864個條目,BP包括對營養元素、激素、外源性物質刺激、脂質的應答,調節小分子代謝進程,炎癥反應等共1647個,CC包括細胞膜、囊腔、內質網腔、胞外基質、血漿脂蛋白、常染色質等75個,MF包括信號受體、核受體、蛋白質二聚體激活,蛋白酶、激酶、羧酸、血紅素、磷酸酶、類固醇結合等142個。分別根據值排序,選擇排名前10的用氣泡圖展示(圖2-A)。通路富集共得到包含癌癥信號通路、脂質與動脈粥樣硬化、胰島素抵抗、IL-17信號通路、缺氧誘導因子1(hypoxia-inducible factor 1,HIF-1)信號通路、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信號通路、PPAR信號通路、T細胞受體信號通路在內的175個條目。說明甘草可能是通過多條通路達到治療NAFLD及肥胖的作用,選擇前20條通路用氣泡圖展示(圖2-B)。
3.4 “甘草活性成分-NAFLD及肥胖靶點-通路”網絡構建
根據參與前20條通路的成分及靶點之間的聯系,采用Cytoscape 3.9.1構建“甘草活性成分-NAFLD及肥胖靶點-通路”網絡(圖3),共有188個節點,811條邊。其中節點表示靶點或成分,直線表示相互作用,圖中綠色方形表示關鍵靶點,橙色圓圈表示甘草活性成分,粉紅色三角形表示通路。通過Cytoscape 3.9.1內置的Analyse Network對該網絡進行拓撲參數分析,按度值排序,節點的度值越高,面積越大,顏色越深,說明此節點在網絡中的作用越重要。通過分析發現,甘草活性成分中槲皮素(GC88)、甘草酸(GC89)、山柰酚(GC13)、柚皮素(GC14)和芒柄花素(GC11)度值、介度及緊密度均較高,說明這些成分極有可能是甘草治療NAFLD及肥胖的核心成分,而前列腺素G/H合酶2(prostaglandin G/H synthase 2,PTGS2)、雌激素受體1(estrogen receptor 1,ESR1)、PPARG、一氧化氮合酶2(nitric oxide synthase 2,NOS2)及糖原合成酶激酶3β(glycogen synthase kinase-3 beta,GSK3B)的度值、介度及緊密度在眾多靶點中排名相對靠前,是主要的核心作用靶點,可以初步認為甘草主要通過調節這些核心靶點產生效果,具體信息見表3。以上這些結果也體現出了甘草通過多成分、多靶點、多通路發揮治療NAFLD及肥胖的藥理作用。
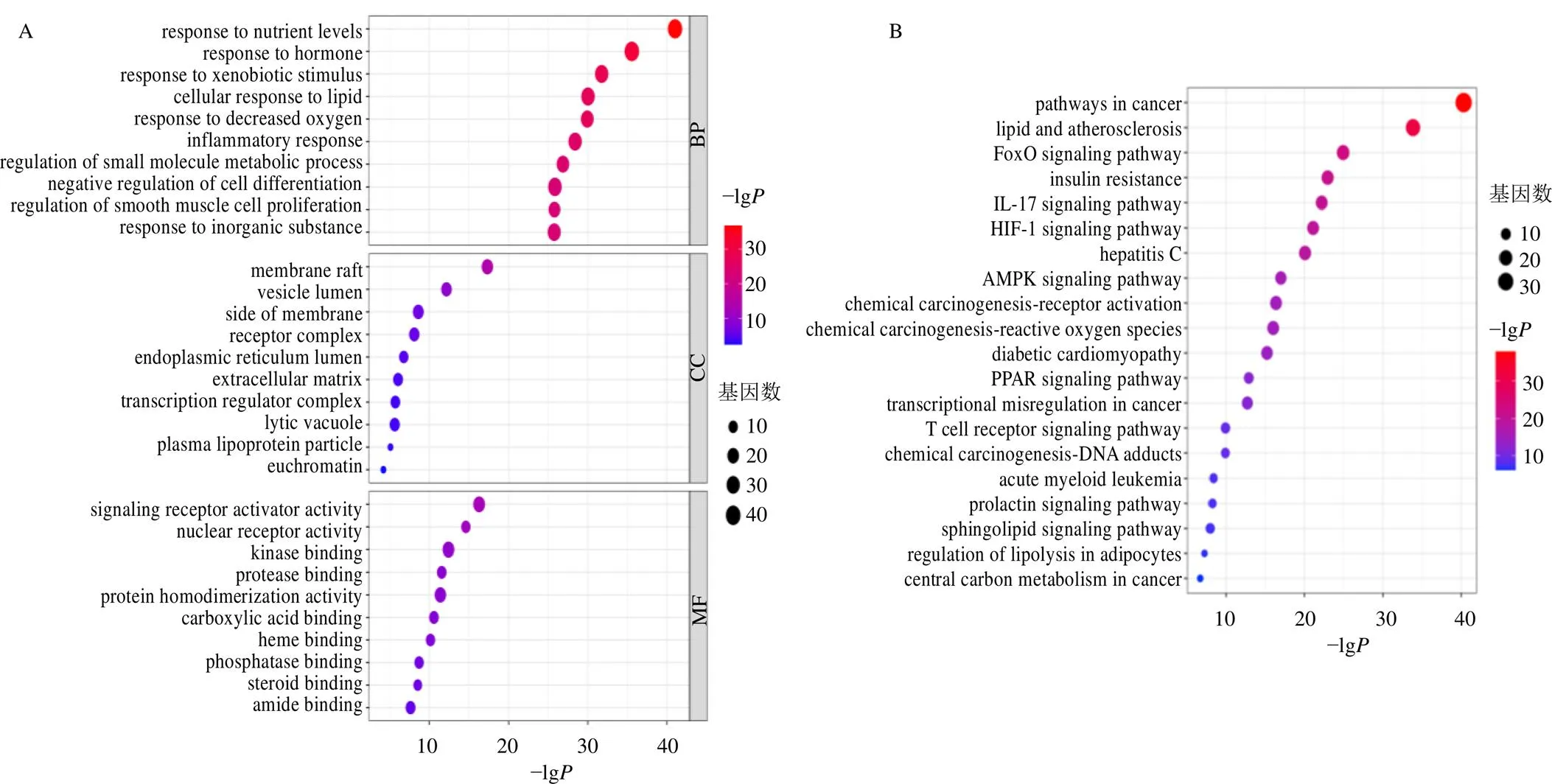
圖2 甘草治療NAFLD及肥胖關鍵靶點GO功能(A) 和KEGG通路(B) 富集分析

節點表示靶點或成分,直線表示相互作用,方形表示關鍵靶點,圓圈表示甘草活性成分,三角形表示通路;節點面積越大,顏色越深代表其度值越大,說明該節點越重要

表3 核心成分及靶點信息
3.5 分子對接驗證
采用AutoDock Vina 1.1.2軟件將上述“成分-靶點-通路”網絡中篩選出的前5個核心成分(槲皮素、甘草酸、山柰酚、柚皮素和芒柄花素)及核心靶點PTGS2(PDB ID:5F19)、ESR1(PDB ID:7UJM)、PPARG(PDB ID:8DSY)、NOS2(PDB ID:1NSI)、GSK3B(PDB ID:4J1R)進行對接驗證,得到各小分子化合物與大分子蛋白的結合能。通常認為結合能<0,配體和受體能自發結合,結合能越低,親和力越強,發生作用的可能性越大。將獲得的各成分與靶點的結合能結果以熱圖展示(圖4-A)。由結果可知,各結合能均<?5 kJ/mol,均能自發結合,其中甘草酸與各靶點蛋白結合能明顯較低,均<?10 kJ/mol,顯示出較強的親和力。選擇甘草酸與PTGS2、ESR1、PPARG的分子對接圖進行可視化展示(圖4-B~D)。

A-5個核心成分與靶點蛋白對接結合能熱圖 B~D-甘草酸配體分別與PTGS2蛋白、ESR1蛋白、PPARG蛋白的分子對接模式圖(1-基于對接獲得的配體-蛋白結合模式;2-小分子-蛋白的3D作用模式,黃色虛線為氫鍵作用;3-小分子-蛋白的2D作用模式,綠色虛線為氫鍵作用,紅色樣氨基酸為小分子周圍產生弱相互作用的氨基酸-范德華力)
3.6 動物實驗驗證
上述分子對接實驗表明甘草中的主要含量及活性成分甘草酸和各關鍵靶點蛋白顯示出較強的結合能力,推測其可能是發揮抗NAFLD及肥胖的主要藥效成分,進一步通過動物實驗評價甘草酸藥效。
3.6.1 甘草酸減輕高脂飲食小鼠體質量增加并抵抗肥胖 小鼠經14周高脂飲食喂養后,體質量和附睪白色脂肪質量均較對照組顯著增加(<0.05、0.001,圖5-A、B),血清TC水平顯著高于對照組(<0.01,圖5-C),TG水平較對照組有升高趨勢(圖5-D)。附睪白色脂肪形態較對照組明顯增大,展現出肥胖表型(圖5-E)。甘草酸能夠顯著減輕高脂小鼠體質量(<0.05),減輕附睪白色脂肪堆積并減小脂肪形態(<0.001),顯著降低高脂小鼠血清TC含量(<0.05),逆轉TG升高現象。
3.6.2 甘草酸改善高脂飲食小鼠肝臟脂肪變性并防治NAFLD 高脂喂養14周后,病理組織學發現,高脂小鼠較對照組呈現出明顯肝臟脂肪變性(圖6-A),表明小鼠NAFLD模型成功,同時伴隨肝功能下降,血清ALT、AST活性明顯升高(<0.01,圖6-B、C)。甘草酸處理后能改善高脂小鼠肝臟脂肪變性程度,顯著降低ALT、AST活性(<0.01),改善小鼠肝功能。
3.6.3 甘草酸對高脂飲食小鼠肝臟組織PPARG信號通路的影響 PPAR信號通路在脂肪細胞分化、糖脂代謝、胰島素抵抗和能量代謝方面發揮重要作用,與NAFLD及肥胖等代謝綜合征關系密切[20]。核激素受體PPARG能控制脂肪酸的過氧化物酶體β-氧化途徑,是脂肪細胞分化的關鍵調節因子。該受體調節基因轉錄的經典途徑包括其通過與配體結合的初始激活即與RXR的異二聚化,其下游能調控肝臟膽汁酸合成限速酶,參與肝臟膽固醇代謝,進而影響機體脂代謝[21]。本研究根據網絡藥理學分析結果發現甘草防治NAFLD及肥胖的重要通路涉及PPAR信號通路,“成分-靶點-通路”網絡中關鍵靶點涉及到PPARG及RXRA,與此同時,甘草酸也表現出與PPARG蛋白靶點的高親和力。qRT-PCR實驗結果顯示甘草酸能顯著激活高脂飲食小鼠肝臟及的mRNA表達(<0.05,圖7-A),研究進一步發現甘草酸能明顯增加PPARG下游調節因子的mRNA表達水平(<0.01)。Western blotting結果也表明甘草酸能顯著增加高脂小鼠肝臟中RXRA、PPARG及CYP7A1蛋白表達水平(<0.05,圖7-B)。以上結果說明甘草可以通過其主要活性成分甘草酸發揮抗NAFLD及肥胖作用,而其潛在作用機制可能是甘草酸通過激活高脂飲食小鼠肝臟RXRA/PPARG/CYP7A1信號通路,進而影響機體脂代謝,發揮抗NAFLD及肥胖作用。

與對照組比較:#P<0.05 ##P<0.01 ###P<0.001;與模型組比較:*P<0.05 **P<0.01 ***P<0.001,下圖同

圖6 甘草酸對高脂飲食小鼠肝臟HE染色(A) 及血清ALT (B)、AST (C) 活性的影響(, n = 5)
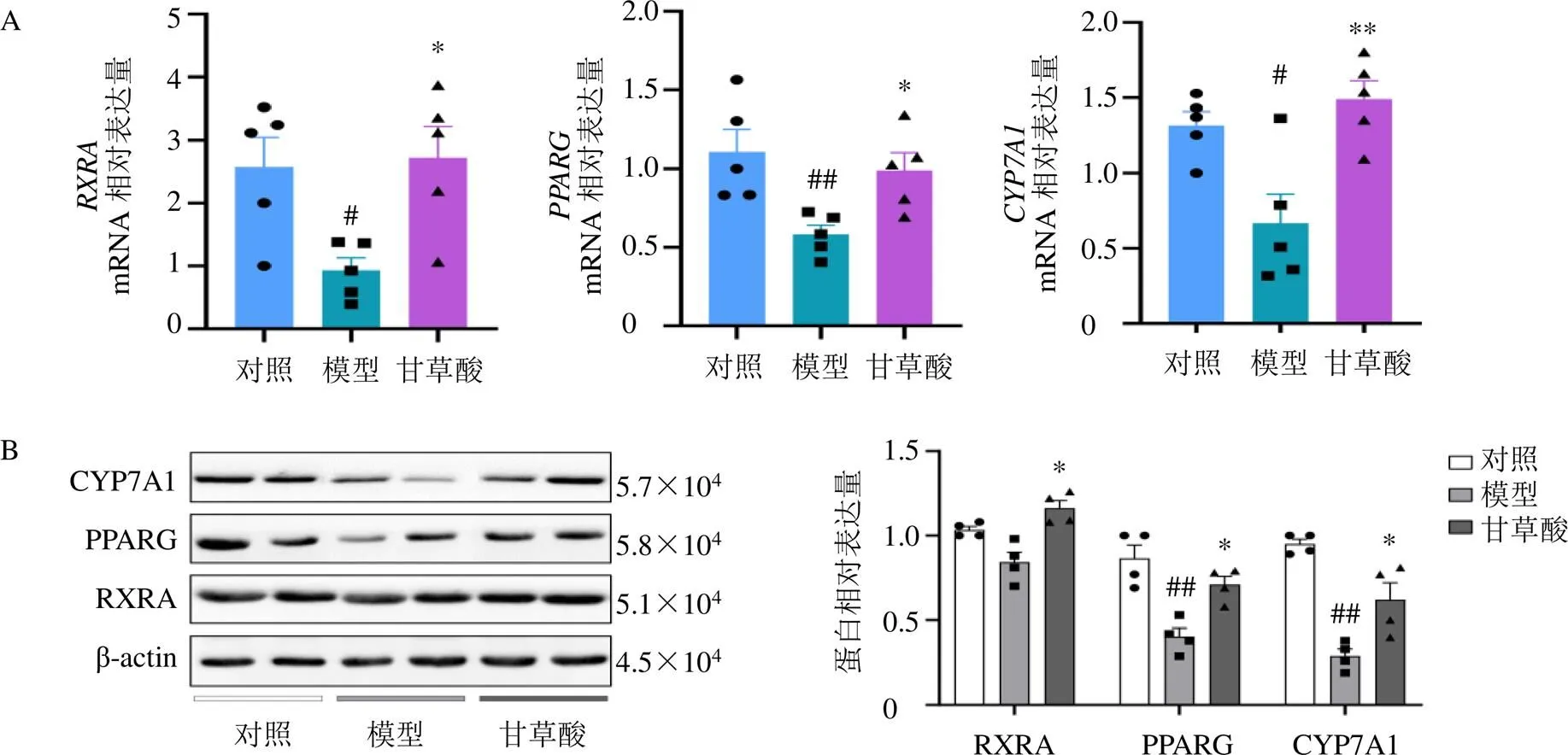
圖7 甘草酸對高脂飲食小鼠肝臟RXRA/PPARG/CYP7A1信號通路基因(A) 及蛋白 (B) 表達的影響(, n = 5)
4 討論
當下流行病學研究發現,快速發展的經濟水平導致人們的飲食習慣與生活節奏發生變化,NAFLD及肥胖患病率逐年升高,呈流行趨勢[2-3]。由于二者同屬代謝性疾病,涉及的病理機制復雜,單一成分或靶點觸發的通路較單一,往往只能改善部分指標,且易導致不良反應[1,4]。而中藥具有多成分、多途徑、多靶點協同作用的特點,可從多方面改善NAFLD及肥胖。本研究通過數據庫檢索,運用網絡藥理學方法構建了“甘草成分-靶點-信號通路”網絡,輔以分子對接驗證和動物實驗評價藥效,探討甘草治療NAFLD及肥胖的主要活性物質和潛在作用機制。
結果顯示,篩選得到的甘草活性成分達89個,說明甘草成分種類繁多,藥效物質基礎復雜。成分靶點與疾病靶點結果顯示,甘草和NAFLD及肥胖的交集靶點有106個,說明甘草在治療NAFLD及肥胖方面的活性成分所影響的相關蛋白的生物學功能、分子功能和這2種疾病的發生、發展過程存在一定相關性。拓撲分析篩選得到的排名前5的活性成分依次為槲皮素、甘草酸、山柰酚、柚皮素和芒柄花素。研究發現,槲皮素可以通過恢復腸道菌群失衡,逆轉相關內毒素血癥誘導的Toll樣受體4通路的激活,隨后抑制炎癥小體反應和網狀應激通路的激活,進而導致脂質代謝基因表達紊亂來降低胰島素抵抗和NAFLD活動度評分[22]。甘草酸可以通過降低腸道膽鹽水解酶相關菌群豐度,增加結合膽汁酸,抑制腸道法尼酯X受體(farnesoid X-activated receptor,FXR),調節膽汁酸代謝,減輕高脂飲食誘導的小鼠體質量增加[15]。山柰酚可有效控制血糖,調節血脂及ALT、AST活性,抑制脂質生成基因過度表達[23];轉錄組學和代謝組學分析也表明,山柰酚具有改善與能量代謝、脂質代謝、氧化應激和炎癥相關的NAFLD的能力[24]。柚皮素可通過下調Kupffer細胞和肝細胞中NOD樣受體熱蛋白結構域相關蛋白3(NOD like receptor thermal protein domain associated protein 3,NLRP3)/核因子-κB(nuclear factor-κB,NF-κB)信號通路來預防NAFLD,從而減輕小鼠肝臟中的炎癥[25],也可以通過直接和間接激活AMPK來增加能量消耗和調節自噬來緩解NAFLD及肥胖[26]。芒柄花素可以有效調節腸道微生物群,改善宿主代謝和全身炎癥,調節參與肥胖的特定肝臟miRNA的表達,并下調促炎細胞因子、和的mRNA表達水平來有效控制體質量、高血糖和胰島素抵抗[27];還可以激活AMPK,通過促進轉錄因子EB(transcription factor EB,TFEB)介導的溶酶體生物發生和脂肪自噬來緩解肝脂肪變性[28]。PPI網絡分析發現甘草防治NAFLD及肥胖的排名前5的核心靶點蛋白依次是PTGS2、ESR1、PPARG、NOS2及GSK3B,這些可能是甘草防治NAFLD及肥胖的重要靶點。PTGS2參與介導疼痛,在炎癥反應中具有重要作用,研究發現選擇性髓系細胞PTGS2缺失導致單核細胞募集和巨噬細胞增殖增加,導致促炎巨噬細胞增加,吞噬能力降低,致使體質量增加和肥胖,外周胰島素敏感性和葡萄糖利用率降低,脂肪組織炎癥和纖維化增加,脂肪組織血管生成異常[29]。類固醇激素受體ESR1在調節新陳代謝中起著重要作用,能介導肝臟對雌激素的反應。ESR1敲除雄性大鼠的肝轉錄組數據顯示其參與碳水化合物和脂質代謝相關基因的表達改變[30-31]。核激素受體PPARG能促進脂肪細胞分化以增強血糖攝取[32]。NOS2是一種信使分子,參與炎癥,增強促炎介質如IL-6、IL-8的合成[33]。GSK3B通過磷酸化PPARα-Ser280促進脂質合成代謝,延緩肥胖誘發的脂毒性心肌病發生發展[34-35]。動物和人類研究表明,甘草會影響血糖、血脂和血壓[12]。棕色脂肪組織的主要功能是通過產熱將多余的熱量攝入消散成熱能,增加能量消耗,而研究發現甘草提取物可以誘導脂肪細胞褐變,增加棕色脂肪表型有效減少肥胖,恢復代謝穩態[10]。富含甘草提取物的一種膳食補充劑可改善腸道菌群,增加腸屏障,降低Toll樣受體介導的炎癥通路抵抗高脂高蔗糖飲食誘導的NAFLD形成[11]。KEGG通路分析主要涉及脂質與動脈粥樣硬化、胰島素抵抗、IL-17信號通路、HIF-1信號通路、AMPK信號通路、PPAR信號通路、T細胞受體信號通路。這些文獻研究及網絡分析結果充分說明,甘草可通過多成分、多靶點、多通路協同發揮防治NAFLD及肥胖的作用。
將篩選得到的甘草中的主要活性成分和關鍵靶點蛋白進行分子對接,結果顯示這些小分子成分都能自發較好地結合到關鍵靶蛋白的多個氨基酸殘基上,驗證了網絡藥理學的篩選結果。同時發現甘草酸成分和各靶點蛋白均具有較強的親和力,且其為甘草中主要含量及活性成分,提示其可能在甘草發揮抗NAFLD及肥胖方面貢獻較大,其中甘草酸展現出與PPARG之間較強的結合力。PPARG作為一種核激素配體激活受體,其經典途徑通過與RXR的異二聚化激活該信號通路,調控下游膽汁酸合成限速酶[21],膽汁酸在肝臟中由膽固醇主要通過經典途徑合成,該途徑通過CYP7A1起始催化[36]。因此,這些限速酶能介導肝臟膽固醇轉化生成膽汁酸,從而影響膽汁酸代謝和膽固醇消耗,調控脂質代謝,參與代謝性疾病發生發展。基于網絡藥理研究與分子對接結果,進一步運用動物實驗評價了甘草酸對高脂飲食小鼠的藥效活性,并從基因及蛋白水平上發現甘草酸能通過激活高脂飲食小鼠肝臟RXRA/PPARG信號通路,繼而活化下游CYP7A1,改善機體血清TC、TG代謝,降低血清ALT、AST活性,防治NAFLD,抵抗肥胖(圖8)。分子對接顯示甘草酸能與PPARG等靶點蛋白結合,表明其可能直接激活或抑制該靶點蛋白,Western blotting實驗結果發現甘草酸能顯著抑制高脂飲食小鼠肝臟中這些靶點蛋白的減少,相應增加其表達,這也進一步佐證了分子對接的結論。本研究同時發現甘草酸也能顯著促進高脂小鼠這些靶蛋白的mRNA轉錄水平,說明甘草酸可能一方面能直接抑制高脂小鼠PPARG等靶點蛋白的減少,另一方面還可能通過其他通路參與并調控這些靶點蛋白基因上游的某些或某個分子來增加高脂小鼠體內這些靶點的mRNA轉錄水平,而其具體調控機制仍需實驗探索驗證。這些結果也反映出甘草酸這單一成分可能通過多靶點、多通路來發揮抗NAFLD及肥胖作用。
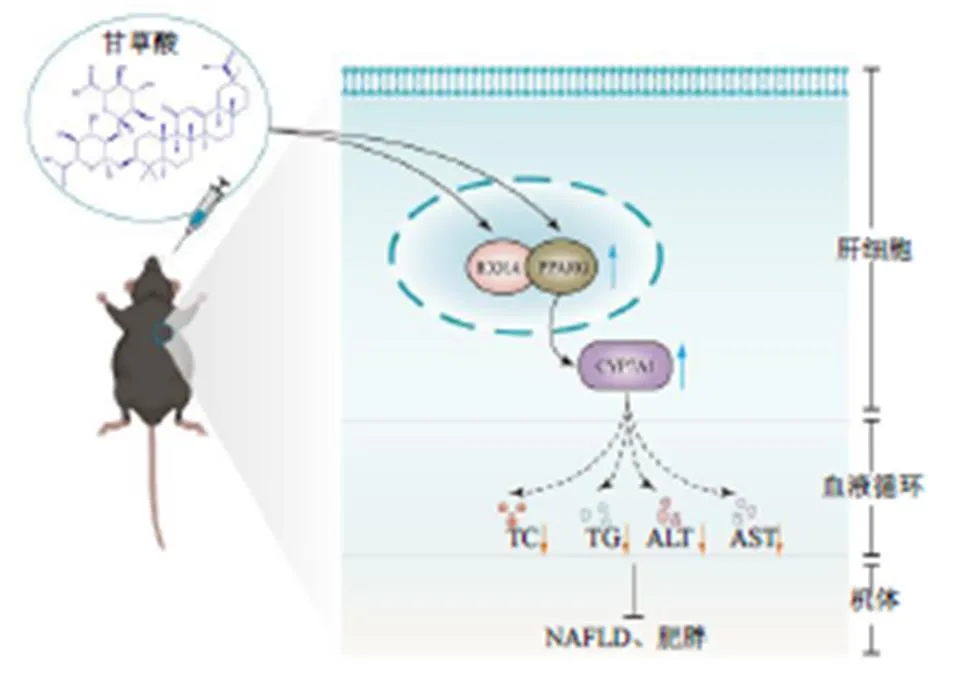
圖8 甘草酸防治NAFLD及肥胖的潛在機制
綜上,本研究基于網絡藥理學和整合生物信息學方法較為系統地分析預測了甘草防治NAFLD及肥胖的主要生物活性成分及潛在作用機制,通過結合當前相關文獻研究結果進行印證,并采用分子對接方法驗證了預測的關鍵活性成分與核心靶點蛋白之間的結合能力。動物實驗結果揭示了重要活性成分甘草酸能通過調節肝臟PPARG信號通路產生抗NAFLD及肥胖的作用,進一步證實了網絡藥理學預測及分子對接的可靠性。然而,本研究得出的潛在作用機制僅局限于在動物基因及蛋白水平上,后續還需要更多的臨床試驗來進一步證實這些結論;與此同時,本實驗也僅僅選用了其中的主要含量及活性成分甘草酸進行藥效學驗證,未能充分研究甘草防治NAFLD及肥胖的其他主要活性成分的藥效作用和其他靶點通路的變化。總的來說,本研究將為促進傳統中藥甘草及其主要活性成分甘草酸的臨床應用與機制研究提供科學依據,也為病機復雜且誘因相同的NAFLD及肥胖等代謝性疾病的防治思路提供參考借鑒。而具有“多成分、多靶點、多通路”作用特點的中藥甘草防治NAFLD及肥胖的后續作用機制研究仍任重而道遠。
利益沖突 所有作者均聲明不存在利益沖突
[1] Clark J M, Cryer D R H, Morton M,. Nonalcoholic fatty liver disease from a primary care perspective [J]., 2023, 25(6): 1421-1433.
[2] Serna-Gutiérrez A, Castro-Juarez A A, Romero-Martínez M,. Prevalence of overweight, obesity and central obesity and factors associated with BMI in indigenous Yaqui people: A probabilistic cross-sectional survey [J]., 2022, 22(1): 308.
[3] Raza S. Current treatment paradigms and emerging therapies for NAFLD/NASH [J]., 2021, 26(2): 206-237.
[4] Ryan D H. Drugs for treating obesity [J]., 2022, 274: 387-414.
[5] Mundi M S, Velapati S, Patel J,. Evolution of NAFLD and its management [J]., 2020, 35(1): 72-84.
[6] Shaunak M, Byrne C D, Davis N,. Non-alcoholic fatty liver disease and childhood obesity [J]., 2021, 106(1): 3-8.
[7] Hagstr?m H, Simon T G, Roelstraete B,. Maternal obesity increases the risk and severity of NAFLD in offspring [J]., 2021, 75(5): 1042-1048.
[8] 裴玉瓊, 石海培, 嚴輝, 等. 基于HPLC指紋圖譜及多成分一測多評法定量的炙甘草飲片質量評價研究 [J]. 中草藥, 2019, 50(18): 4293-4304.
[9] Armanini D, De Palo C B, Mattarello M J,. Effect of licorice on the reduction of body fat mass in healthy subjects [J]., 2003, 26(7): 646-650.
[10] Lee H E, Yang G, Han S H,. Anti-obesity potential ofand licochalcone A through induction of adipocyte browning [J]., 2018, 503(3): 2117-2123.
[11] Chen L, Kan J, Zheng N,. A botanical dietary supplement from white peony and licorice attenuates nonalcoholic fatty liver disease by modulating gut microbiota and reducing inflammation [J]., 2021, 91: 153693.
[12] Jafari F, Jafari M, Moghadam A T,. A review of(licorice) effects on metabolic syndrome [A] //[M]. Cham: Springer International Publishing, 2021: 385-400.
[13] Zhang R, Cheng K R, Xu S Z,. Metformin and diammonium glycyrrhizinate enteric-coated capsule versus metformin alone versus diammonium glycyrrhizinate enteric-coated capsule alone in patients with nonalcoholic fatty liver disease and type 2 diabetes mellitus [J]., 2017, 2017: 8491742.
[14] 袁陳婷, 孫錦秀, 郭晶晶, 等. 還原型谷胱甘肽聯合甘草酸二銨治療非酒精性脂肪肝的臨床研究[J]. 現代藥物與臨床, 2023, 38(2): 359-362.
[15] Li Y, Hou H Q, Wang X L,. Diammonium glycyrrhizinate ameliorates obesity through modulation of gut microbiota-conjugated BAs-FXR signaling [J]., 2021, 12: 796590.
[16] 牛明, 張斯琴, 張博, 等. 《網絡藥理學評價方法指南》解讀 [J]. 中草藥, 2021, 52(14): 4119-4129.
[17] 但文超, 何慶勇, 曲藝, 等. 基于網絡藥理學的枳術丸調治血脂異常的分子機制研究 [J]. 世界科學技術—中醫藥現代化, 2019, 21(11): 2396-2405.
[18] Lee C H, Park S W, Kim Y S,. Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice [J]., 2007, 30(10): 1898-1904.
[19] Dai X, Wang C, Guo Z X,. Maternal sucralose exposure induces Paneth cell defects and exacerbates gut dysbiosis of progeny mice [J]., 2021, 12(24): 12634-12646.
[20] Botta M, Audano M, Sahebkar A,. PPAR agonists and metabolic syndrome: An established role? [J]., 2018, 19(4): 1197.
[21] K?kény G, Calvier L, Hansmann G. PPARγ and TGFβ—Major regulators of metabolism, inflammation, and fibrosis in the lungs and kidneys [J]., 2021, 22(19): 10431.
[22] Porras D, Nistal E, Martínez-Flórez S,. Protective effect of quercetin on high-fat diet-induced non-alcoholic fatty liver disease in mice is mediated by modulating intestinal microbiota imbalance and related gut-liver axis activation [J]., 2017, 102: 188-202.
[23] Guruvaiah P, Guo H M, Li D X,. Preventive effect of flavonol derivatives abundant Sanglan Tea on long-term high-fat-diet-induced obesity complications in C57BL/6 mice [J]., 2018, 10(9): 1276.
[24] Lu Y F, Shao M M, Xiang H J,. Integrative transcriptomics and metabolomics explore the mechanism of kaempferol on improving nonalcoholic steatohepatitis [J]., 2020, 11(11): 10058-10069.
[25] Wang Q Y, Ou Y J, Hu G M,. Naringenin attenuates non-alcoholic fatty liver disease by down-regulating the NLRP3/NF-κB pathway in mice [J]., 2020, 177(8): 1806-1821.
[26] Yang Y, Wu Y, Zou J,. Naringenin attenuates non-alcoholic fatty liver disease by enhancing energy expenditure and regulating autophagy via AMPK [J]., 2021, 12: 687095.
[27] Naudhani M, Thakur K, Ni Z J,. Formononetin reshapes the gut microbiota, prevents progression of obesity and improves host metabolism [J]., 2021, 12(24): 12303-12324.
[28] Wang Y, Zhao H, Li X,Formononetin alleviates hepatic steatosis by facilitating TFEB-mediated lysosome biogenesis and lipophagy [J]., 2019, 73: 108214.
[29] Pan Y, Cao S R, Tang J Q,. Cyclooxygenase-2 in adipose tissue macrophages limits adipose tissue dysfunction in obese mice [J]., 2022, 132(9): e152391.
[30] Khristi V, Ratri A, Ghosh S,. Disruption of ESR1 alters the expression of genes regulating hepatic lipid and carbohydrate metabolism in male rats [J]., 2019, 490: 47-56.
[31] Khristi V, Ratri A, Ghosh S,. Liver transcriptome data ofknockout male rats reveals altered expression of genes involved in carbohydrate and lipid metabolism [J]., 2019, 22: 771-780.
[32] Zhuang J L, Liu Y Y, Li Z Z,. Amentoflavone prevents ox-LDL-induced lipid accumulation by suppressing the PPARγ/CD36 signal pathway [J]., 2021, 431: 115733.
[33] Vuolteenaho K, Koskinen A, Kukkonen M,. Leptin enhances synthesis of proinflammatory mediators in human osteoarthritic cartilage-Mediator role of NO in leptin-induced PGE2, IL-6, and IL-8 production [J]., 2009, 2009: 345838.
[34] Welsh G I, Proud C G. Glycogen synthase kinase-3 is rapidly inactivated in response to insulin and phosphorylates eukaryotic initiation factor eIF-2B [J]., 1993, 294(3): 625-629.
[35] Nakamura M, Liu T, Husain S,Glycogen synthase kinase-3α promotes fatty acid uptake and lipotoxic cardiomyopathy [J]., 2019, 29(5): 1119-1134.
[36] Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis [J]., 2018, 15(2): 111-128.
Mechanism ofet Rhizoma against non-alcoholic fatty liver disease and obesity based on network pharmacology and experimental verification
LI Yun1, LIU Tian-yu2, YUAN Heng-jie1, LI Zheng-xiang1
1. Department of Pharmacy, General Hospital, Tianjin Medical University, Tianjin 300052, China 2. Department of Gastroenterology, General Hospital, Tianjin Medical University, Tianjin 300052, China
To explore the active ingredients, targets and potential mechanism of Gancao (et) in the prevention and treatment of non-alcoholic fatty liver disease (NAFLD) and obesity based on network pharmacology and experimental verification.The main chemical active constituents and their action targets ofetwere screened by TCMSP database combined with published literature, and the targets of NAFLD and obesity were obtained from GeneCards database. The protein-protein interaction (PPI) network was following analyzed and constructed using String platform and Cytoscape 3.9.1 software, respectively. Then, the intersection targets were analyzed by Metascape platform, and gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were performed. In addition, Cytoscape 3.9.1 software was used again to construct the “component ofet-disease target-pathway” network. Molecular docking was further used to verify the binding ability and affinity between the predicted key components and targets. And finally, the regulatory effect of key components on the target pathway was confirmed by animal experiments.etmainly acted on key targets such as prostaglandin G/H synthase 2 (PTGS2), estrogen receptor 1 (ESR1), peroxisome proliferator-activated receptor gamma (PPARG), nitric oxide synthase 2 (NOS2) and glycogen synthase kinase-3 beta (GSK3B) through core active components like quercetin, glycyrrhizic acid, kaempferol, naringin and formononetin. And it might prevent and treat NAFLD and obesity via lipid and atherosclerosis, insulin resistance, adenosine monophosphate-activated protein kinase (AMPK) signaling pathway, PPAR signaling pathway, T cell receptor signaling and other pathways. The active ingredient glycyrrhizic acid could alleviate liver steatosis, dramatically reduce weight gain (< 0.05), observably improve blood lipid level as well as liver function (< 0.05, 0.01), and significantly increase both hepatic mRNA and protein expressions of retinoic acid receptor RXR-alpha (),and cholesterol 7α-hydroxylase () in high fat diet mice (< 0.05, 0.01).etcould effectively intervene in NAFLD and obesity with the characteristics of multi-component, multi-target and multi-pathway. And its main active ingredient glycyrrhizic acid could play a role in anti-NAFLD and obesity by activating hepatic RXRA/ PPARG/CYP7A1 signaling pathway in high fat diet mice.
network pharmacology;et; nonalcoholic fatty liver disease; obesity; high fat diet mice; glycyrrhizic acid; naringin; formononetin; RXRA/PPARG/CYP7A1 signaling pathway
R285.5
A
0253 - 2670(2023)15 - 4882 - 13
10.7501/j.issn.0253-2670.2023.15.014
2023-03-13
國家自然科學基金資助項目(82100574);天津市衛生健康科技項目(TJWJ2022QN010)
李 云,女,碩士,主管藥師,研究方向為消化性疾病中藥藥物藥理。Tel: 18322186706 E-mail: 15210690439@163.com
通信作者:李正翔,男,本科,主任藥師,碩士生導師,研究方向為醫院藥學與臨床藥理學。E-mail: 13820893896@163.com
[責任編輯 李亞楠]

