中性粒細胞/淋巴細胞比值對急性大血管閉塞性卒中血管內治療后癥狀性顱內出血的影響
張曉鴿, 吳 敏, 高 旸, 左 朦
在我國,卒中是第三位死亡原因,其中急性缺血性卒中(acute ischemic stroke,AIS)約占所有卒中的80%[1],該病治療的關鍵是盡早再灌注治療、恢復血流以挽救缺血半暗帶組織[2]。血管內治療(EVT)聯合rtPA靜脈溶栓治療是急性缺血性卒中早期血管再通的一線治療方法[3~8]。EVT最嚴重的并發癥之一是癥狀性顱內出血(sICH)[9]。sICH的發生可能增加EVT后的死亡率和不良的臨床結局。因此,探究EVT后sICH發生的預測因素對于持續提高EVT療效至關重要。
大量既往研究表明,神經炎癥反應在缺血性卒中的病理生理學中起著重要作用。中性粒細胞/淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)[10,11]最近被報道為基線炎癥過程中潛在的新型生物標志物,可作為缺血性卒中患者預后及相關并發癥的預測因子[12~14]。但是有關血管內治療術后NLR與術后sICH發生的相關研究還比較少,術后NLR與術后sICH之間的關系尚不確定。本研究通過收集 437例急性前循環大血管閉塞性腦卒中患者的臨床資料、住院時及術后24 h實驗室檢查、72 h內影像學資料及患者90 d臨床結局,分析術后NLR與急性前循環大血管閉塞性腦卒中血管內治療術后sICH的關系,以期為臨床上預測血管內治療術后sICH提供依據。
1 資料與方法
1.1 研究對象 研究從陸軍軍醫大學第一附屬醫院神經內科和自貢市第三人民醫院兩個中心連續納入2017年1月-2021年4月的急性前循環大血管閉塞性卒中且接受支架樣取栓裝置進行血管內治療的患者。納入標準:(1)急性腦卒中患者;(2)年齡大于18歲;(3)CTA、MRA或術中DSA確定前循環大血管閉塞;(4)發病至股動脈穿刺時間為6 h,或發病至股動脈穿刺時間為6~24 h且存在臨床癥狀與影像學不匹配;(5)行血管內再通治療。排除標準:(1)動脈瘤;(2)小血管病型;(3)后循環大血管閉塞;(4)未進行血管內治療的患者;(5)臨床或影像學資料不齊全患者。
本研究獲得陸軍軍醫大學第一附屬醫院倫理委員會和自貢市第三人民醫院倫理委員會批準[批號(B)KY2021146;2021-01-01],入組患者或家屬均簽署知情同意書。
1.2 治療方法 (1)患者在急診行CT或CTA,明確沒有明顯的出血病灶。在溶栓時間窗(4.5 h)內的患者排除禁忌證且與家屬溝通后行靜脈內rt-PA治療。若患者超過4.5 h溶栓時間窗,但發病仍在6 h內,與家屬溝通后直接進行血管內治療;發病在6~24 h內的患者,且存在臨床癥狀與影像學不匹配。充分告知患者家屬風險與獲益后簽署知情同意書,方可進行血管內治療。(2)麻醉為全麻或局麻,選擇Solitaire支架取栓器作為血管內治療裝置。在閉塞遠端置入Solitaire支架。3~5 min后取出支架,完成數字減影血管造影(DSA)檢查是否有前向血流。取栓重復最多4次,直至成功再通[定義為腦梗死的改良溶栓(modified Thrombolysis in Cerebral Infarction,mTICI)評分2b或3分]。如果再通失敗,則進行球囊血管成形術、支架植入、動脈內溶栓或導管內替羅非班給藥。(3)所有患者在血管內治療后72 h復查CT或MRI。
1.3 研究方法及觀察指標 (1)收集患者的臨床、影像學及隨訪資料。(2)本研究根據患者術后72 h內的頭部CT及臨床表現,將患者分為癥狀性顱內出血組與非癥狀性顱內出血組。(3)將患者分組后,比較兩組患者的基線資料。影像資料的評估由1位經驗豐富的介入醫生及1位神經內科醫師進行評估,如二者結果存在不一致的情況,交由第3位評估者進行最后的決定。血管再通情況采用改良腦梗死溶栓分級(mTICI)評分標準評價,0~2a級定義為血管未再通;2b~3級定義為血管再通良好。側支循環情況的評估采用神經介入和治療神經放射學會/介入放射學會側支循環評分標準(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology ASITN/SIR)。臨床預后結局采用發病后90 d mRS評分,0~2為良好結局,3~6分為不良結局。90 d隨訪以電話或門診的形式進行評估。(4)癥狀性出血(sICH)(sICH根據海德堡標準定義)[15]:如果血管內治療后72 h內CT掃描發現新的顱內出血,且伴有以下情況之一,則診斷為癥狀性顱內出血:①NIHSS評分較病情惡化前提高>4分;②NIHSS評分在某一類神經功能缺損提高了>2分;③ NIHSS評分增加<4分,但新增癥狀與原腦卒中范圍無關;④神經系統狀況惡化導致插管、半顱部切除術、外腦室引流置管或任何其他重大醫療。(5)中性粒和淋巴細胞的檢測:血管內治療術后24 h內采用邁瑞全自動血液分析儀檢測患者外周血細胞指標。(6)建立Logistic回歸模型來評估癥狀性顱內出血的獨立危險因素。
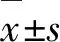
2 結 果
2.1 患者的臨床資料 437例患者中,平均年齡69.83歲,男性220例(50.3%);基線NIHSS評分平均 19.82分;大動脈粥樣硬化性卒中208例(47.6%),心源性卒中198例(45.3%),其他類型卒中31例(7.1%);靜脈溶栓87例(19.9%),術后血管再通379例(86.7%);術后 90 d 預后良好患者224例(51.3%)。
2.2 癥狀性顱內出血組和非癥狀性顱內出血組臨床特征及預后轉歸的比較 437例患者中,癥狀性顱內出血患者65例(14.9%),非癥狀性顱內出血患者372例(85.1%)。與非癥狀性顱內出血組相比,癥狀性顱內出血組的基線NIHSS評分更高[(22.25±10.56) 分 vs (19.4±10.04) 分,P=0.037],既往卒中史占比更高[12例(18.5%) vs 29例(7.8%),P=0.007],中性粒細胞/淋巴細胞比值更高[7.11(4.08~13.84)vs 5.69(3.43~9.50),P=0.032]。余變量如性別、年齡、靜脈溶栓率、動脈溶栓率、血管內補救治療等未見明顯統計學差異(見表1)。多變量Logistic回歸分析納入了基線NIHSS評分、既往卒中史、中性粒細胞/淋巴細胞比值、低密度脂蛋白,結果顯示既往卒中史[優勢比(odds ratio,OR)=2.221,95%可信區間(confidence interval,CI) 1.003~4.915;P=0.049]、中性粒細胞/淋巴細胞比值[優勢比(odds ratio,OR)=1.041,95%可信區間(confidence interval,CI) 1.007~1.088;P=0.021]兩個指標是sICH的獨立危險因素(見表2)。

表1 非癥狀性顱內出血組與癥狀性顱內出血組人口統計學和臨床特征比較

表2 癥狀性顱內出血的多因素 Logistic 回歸分析
2.3 ROC曲線分析中性粒細胞/淋巴細胞比值對癥狀性顱內出血的預測價值 ROC曲線分析結果表明,中性粒細胞/淋巴細胞比值預測血管內治療后患者癥狀性顱內出血的曲線面積(AUC)為0.589(95%CI0.509~0.688,P=0.029)。其Youden指數為最大值0.166時的最佳截止值為5.89,敏感度為65.00%,特異度為51.65% (見圖 1)。

圖1 NLR預測血管內治療患者發生sICH的ROC曲線
3 討 論
癥狀性顱內出血是腦卒中血管內治療后最常見的并發癥之一[16]。癥狀性顱內出血的發生可能會降低患者良好臨床預后率、增加患者死亡率,從而降低患者血管內治療收益。因此,早期識別腦卒中血管內治療后癥狀性顱內出血對于持續提高血管內治療療效至關重要。本研究顯示,基線NIHSS評分、既往卒中史、術后NLR與急性前循環大血管閉塞性腦卒中血管內治療后癥狀性顱內出血(sICH)相關。其中既往卒中史、術后NLR偏高是術后sICH的獨立危險因素。
sICH是缺血性腦卒中患者最嚴重的并發癥,可由缺血性腦卒中的自然演化或再灌注治療引起[17]。中性粒細胞與淋巴細胞的比值(NLR)代表了一種免疫水平,反應了中性粒細胞和淋巴細胞之間作用的平衡。NLR已被證明是個體炎癥狀態的一個指標,之前許多研究表明NLR可以預測AIS患者的臨床結局[18,19]。但NLR與出血轉化之間的關系尚不明確。炎癥被認為是卒中后繼發性腦損傷發展的主要因素,卒中后的炎癥反應可能產生有益或有害的影響,這取決腦卒中的階段和炎癥反應所涉及的白細胞的亞型[20,21]。血腦屏障的破壞已被確定為缺血性卒中后出血轉化的潛在原因。血清基質金屬蛋白酶9(MMP-9)可引起AIS后的血腦屏障早期破壞。中性粒細胞已被證實是MMP-9的重要來源,因此中性粒細胞升高是AIS后出血轉化的危險因素[22,23]。淋巴細胞數量的減少導致促炎細胞因子的增加,加重缺血損傷,這也是導致出血轉化的原因之一。因此NLR增高很可能是血管內治療后癥狀性顱內出血的預測因素。但之前的研究有關血管內治療后癥狀性顱內出血與NLR之間關系的研究較少,且多為單中心小樣本的研究。Milena等的一項小型研究發現NLR是缺血性腦卒中再灌注治療后的獨立預測因素,但該研究僅納入51例患者[24]。本研究共納入兩個高級卒中中心,共437例急性前循環大血管閉塞性腦卒中患者的數據資料進行分析。研究發現,既往卒中史、術后NLR偏高是術后sICH的獨立危險因素。術后 NLR 大于 5.89的血管內治療患者發生 sICH 的風險是普通患者的0.59倍(95%CI0.509~0.688,P=0.029)。
總而言之,NLR是導致急性前循環大血管閉塞性腦卒中血管內治療術后癥狀性顱內出血的獨立危險因素且對術后癥狀性顱內出血有一定的預測作用。神經科醫師在臨床工作中對于術后NLR高于5.89的血管內治療患者在后續治療中,應當警惕顱內出血的發生。但是本研究仍存在一些局限性,首先本研究是一個回顧性研究,存在選擇性偏移。此外本研究未經過外部數據的驗證,ROC曲線下面積小于0.6,且術后NLR對患者術后癥狀性顱內出血的敏感度和特異度均欠佳,其準確性有限。未來仍需有更多研究來驗證本研究的結論。

