基于毒性表型和基因型的主要冬繁區(qū)小麥條銹菌群體遺傳分析
高新培,趙鋆,劉博凡,郭一,康振生,詹剛明
基于毒性表型和基因型的主要冬繁區(qū)小麥條銹菌群體遺傳分析
高新培,趙鋆,劉博凡,郭一,康振生,詹剛明
西北農(nóng)林科技大學植物保護學院/旱區(qū)作物逆境生物學國家重點實驗室,陜西楊凌 712100
【目的】明確中國主要冬繁區(qū)小麥條銹菌群體毒性結(jié)構(gòu)和遺傳多樣性,為冬繁區(qū)及黃淮海麥區(qū)小麥條銹病的防控及小麥抗性基因的合理布局提供參考依據(jù)。【方法】從四川盆地、湖北和河南南部等主要冬繁區(qū)采集并分離得到148個小麥條銹菌菌株,利用中國鑒別寄主和單基因系鑒別寄主進行毒性表型鑒定;并利用17對KASP-SNP引物對菌株進行標記,完成基因型分析。【結(jié)果】基于中國鑒別寄主共鑒定出14個已知小種和63個未知致病類型,其中CYR34(16.2%)、G22-14(12.2%)、CYR32(6.8%)、CYR33(5.4%)為優(yōu)勢小種(致病類型);基于單基因系鑒別寄主鑒定得到113個小種(致病類型),其中race1(7.4%)、race2(3.4%)、race3(3.4%)為優(yōu)勢小種(致病類型)。貴農(nóng)22類群是中國冬繁區(qū)小麥條銹菌群體的最大流行類群,供試條銹菌均不侵染攜帶和的單基因系品種。單基因系毒性鑒定及分子標記均顯示CYR34和G22-14的毒性表型及基因型呈現(xiàn)多樣化,表明這兩個優(yōu)勢小種內(nèi)部存在高度分化。基于兩套鑒別寄主的毒性數(shù)據(jù)聚類顯示,四川盆地與湖北南部條銹菌群體相似,而湖北西北部與河南南部條銹菌群體相似;基于KASP-SNP分子數(shù)據(jù)的遺傳聚類顯示,四川盆地、湖北南部條銹菌群體與湖北西北部、河南南部條銹菌群體基因型存在分化;Structure分析顯示四川盆地、湖北南部群體主要有2種遺傳背景,湖北西北部、河南南部群體主要有一種遺傳背景;群體遺傳分化分析顯示四川盆地條銹菌群體與河南南部條銹菌群體二者值最大,為0.118,遺傳差異最大且遺傳分化明顯;湖北西北部群體與河南南部群體遺傳分化程度最小,值為0.010;基因流分析得到湖北西北部群體與河南南部群體之間的m值為25.236,m>4,二者存在較大的基因流,湖北西北部和河南南部群體與四川盆地群體之間的m值分別為2.923和1.864,均存在較小的基因流;遺傳多樣性分析結(jié)果表明,四川盆地、湖北南部地區(qū)條銹菌群體遺傳多樣性水平均較高,湖北西北部、河南南部條銹菌群體遺傳多樣性水平較低。上述結(jié)論均支持四川盆地、湖北南部群體同湖北西北部、河南南部群體存在遺傳分化。【結(jié)論】單基因系鑒別寄主能夠精準地進行中國小麥條銹菌小種鑒定;中國主要冬繁區(qū)的小麥條銹菌群體存在不同來源。
小麥條銹菌;冬繁區(qū);毒性鑒定;KASP-SNP;群體遺傳
0 引言
【研究意義】由條形柄銹菌小麥專化型(f. sp.,)所引致的小麥條銹病,是小麥生產(chǎn)上最具毀滅性的病害之一[1-2],嚴重威脅著中國的小麥安全生產(chǎn)[3-4]。加強冬繁區(qū)小麥條銹菌群體的監(jiān)測、明確小麥產(chǎn)區(qū)條銹菌個體毒性特征及群體毒性結(jié)構(gòu)并揭示小麥條銹病的傳播流行規(guī)律對于防止春季流行區(qū)病害的發(fā)生、制定合理有效的病害防控策略至關(guān)重要。【前人研究進展】前人研究表明,中國小麥條銹病分為三大流行區(qū)系[5-6],其中,冬繁區(qū)是中國春季小麥條銹病流行的菌源基地,在越夏易變區(qū)和春季流行區(qū)之間起著橋梁作用。研究報道,2016年秋河南省南部及湖北省北部麥區(qū)接受了來自甘肅東南以及陜西關(guān)中等地的菌源,使得小麥條銹病在江漢平原擴散[7]。Huang等[8]對2017、2018年中國中西部多個省份的條銹菌菌株進行研究,發(fā)現(xiàn)鄂西北與鄂南的條銹菌存在不同的來源。Zhan等[9]通過群體遺傳分析,發(fā)現(xiàn)2019年湖北地區(qū)的小麥條銹菌來源于云南東部和貴州。【本研究切入點】目前,關(guān)于冬繁區(qū)小麥條銹菌群體結(jié)構(gòu)及其菌源的研究鮮見報道,而冬繁區(qū)小麥條銹菌的小種和致病類型構(gòu)成在相當大程度上代表了黃淮海麥區(qū)春季流行的群體構(gòu)成。因此,及早監(jiān)測冬繁區(qū)小麥條銹菌群體遺傳結(jié)構(gòu)對針對性防控春季流行區(qū)病害具有關(guān)鍵意義。【擬解決的關(guān)鍵問題】本研究利用中國鑒別寄主和單基因系鑒別寄主兩套鑒別寄主,并利用17對競爭性等位基因特異性單核苷酸多態(tài)性(kompetitive allele specific PCR-single-nucleotide polymorphism,KASP-SNP)引物,研究中國四川盆地、湖北南部、湖北西北部和河南南部地區(qū)的小麥條銹菌群體毒性結(jié)構(gòu)和遺傳多樣性,明確冬繁區(qū)群體的毒性特征及遺傳關(guān)系,旨在明確冬繁區(qū)小麥條銹病的傳播流行規(guī)律,為冬繁區(qū)及黃淮海麥區(qū)小麥條銹病的防控及小麥抗性基因的合理布局提供參考依據(jù)。
1 材料與方法
1.1 材料
小麥條銹菌標樣:2020年1月在四川盆地(SCB)、湖北南部(S-HB)、湖北西北部(NW-HB)和河南南部(S-HN)采集小麥條銹菌標樣,共繁殖存活148份。其中,四川盆地81份,湖北南部25份,湖北西北部26份,河南南部16份(表1)。

表1 2020年冬繁區(qū)標樣采集信息表
供試小麥品種:19個中國鑒別寄主依次為Trigo Eureka、Fulhard、保春128、南大2419、維爾、阿勃、早洋、阿夫、丹麥1號、尤皮Ⅱ號、豐產(chǎn)3號、洛夫林13、抗引655、水源11、中四、洛夫林10、Hybrid 46、和貴農(nóng)22,對照品種銘賢169(高度感病),均由西北農(nóng)林科技大學旱區(qū)作物逆境生物學國家重點實驗室提供(電子附表1)。小麥條銹菌18個單基因系及5個輔助鑒別寄主材料(電子附表2)由美國華盛頓州立大學陳賢明教授惠贈。
1.2 標樣分離與菌系擴繁
將銘賢169種植于10 cm×10 cm×10 cm(長×寬×高)的花盆中,每盆播種12—15粒種子,待第一葉完全展開時接種。用流水沖去標樣葉片上的泥土和雜質(zhì),甩干,將葉片正面朝上,放入鋪有濕潤濾紙的托盤中,10 ℃黑暗保濕8—10 h。用無菌大頭針挑取標樣上的單個夏孢子堆均勻涂抹于脫蠟后的幼苗葉片正面,保證每個幼苗葉片只接種1個夏孢子堆,每盆幼苗只接種1個標樣。接種后于10 ℃黑暗保濕24 h,而后再轉(zhuǎn)移到溫室培養(yǎng),培養(yǎng)條件為17 ℃ 17 h光照/13 ℃ 7 h黑暗。待接種葉片出現(xiàn)明顯褪綠斑時,每盆只留1株發(fā)病較好的幼苗并加上隔離罩,防止不同菌系間的交叉污染。接種后13—15 d,用干凈試管分別收集病葉上的夏孢子,置于4 ℃干燥器內(nèi)保存?zhèn)溆没蛴?80 ℃長期留存?zhèn)溆谩?/p>
1.3 菌系的毒性表型鑒定與毒性分析
將兩套鑒別寄主的小麥品種編號,按順序依次種植19個中國鑒別寄主、18個單基因系和5個輔助鑒別寄主,以及對照品種銘賢169,每個花盆的4個角落種植4個品種,并插上標簽牌以作標記。在鑒別寄主幼苗一葉完全展開后,均勻噴灑展布劑0.1%吐溫20溶液,將足量夏孢子分別與干燥的滑石粉按1﹕20的比例混合,均勻接種至兩套鑒別寄主及銘賢169(對照)的葉面上,噴灑少量水霧,置于黑暗濕潤的保濕間中10—12 ℃保濕24 h,再轉(zhuǎn)入溫室培育17—21 d,按照9級分級標準[10],記錄各菌種在鑒別寄主上的反應(yīng)型,0—6級為無毒性,7—9級為毒性。無毒性數(shù)據(jù)轉(zhuǎn)化為0,毒性數(shù)據(jù)轉(zhuǎn)化為1,用Excel統(tǒng)計條銹菌群體對各鑒別寄主的毒性頻率。
1.4 菌系夏孢子DNA的提取及KSAP-SNP標記
參照Aljanabi等[11]的CTAB法提取條銹菌夏孢子DNA,并稍加改進。用分光光度計檢測DNA的濃度和純度,并將其稀釋至標準液50 ng·μL-1備用。
實驗室前期完成了特異性KASP-SNP引物的設(shè)計和篩選工作[12],通過進一步篩選得到17對對條銹菌群體具有多態(tài)性的KASP-SNP引物(表2),用于本研究。
取DNA樣品稀釋液2 μL于384孔板底部并烘干;配置KASP反應(yīng)體系(5 μL):2×KASP Mastermix 2.5 μL、primer mix(Forward primer 12 mmol·L-1和Reverse primer 30 mmol·L-1)0.056 μL和ddH2O 2.444 μL。

表2 17對具有多態(tài)性的KASP-SNP引物
采用Touchdown方法進行PCR擴增:94 ℃ 15 min;94 ℃ 20 s,65 ℃ 60 s,每個循環(huán)退火溫度降0.8 ℃,10個循環(huán);94 ℃ 20 s,57 ℃ 60 s,32個循環(huán)。PCR反應(yīng)結(jié)束后,用酶標儀讀取384孔板中的熒光數(shù)據(jù)(數(shù)據(jù)讀取在40 ℃以下進行)。對熒光信號較低的數(shù)據(jù),可適量增加循環(huán)后再次讀取,但總循環(huán)數(shù)不能超過48個,除去缺失數(shù)據(jù)結(jié)果共得到138株菌株數(shù)據(jù)結(jié)果。(具體操作步驟參考LGC官網(wǎng))。
1.5 數(shù)據(jù)分析
用毒性分析軟件VAT[13]統(tǒng)計毒性多樣性指數(shù)、毒性表型特征及毒性頻率(病原菌群體對特定抗性基因的侵染頻次)。用Structure2.3.4軟件分析KASP-SNP分子標記結(jié)果[14],設(shè)置運行參數(shù)K(2—5),10次重復,利用Structure Harvester確定最佳K值,利用Clusters軟件重復抽樣分析[15],利用distruct軟件繪制結(jié)果圖在Adobe Illustrator CS5展現(xiàn)[16];利用POPGENE計算基于分子數(shù)據(jù)群體間的遺傳距離、基因流m、遺傳分化指數(shù)、觀察等位基因數(shù)a、有效等位基因數(shù)e、香農(nóng)信息指數(shù)、Nei’s遺傳多樣性指數(shù)s、多態(tài)性位點數(shù)、多態(tài)性位點百分比;使用Powermarker V3.25計算遺傳距離,并用MGEA5.2生成菌株個體聚類圖;根據(jù)得到的毒性數(shù)據(jù)與分子數(shù)據(jù),利用R軟件中的2.5.0軟件包的層次聚類分析基于Nei’s遺傳距離采用UPGMA生成聚類樹,自展值(Bootstrap value)通過1 000次的重復計算所得;利用NTSYS-pc軟件中的MXCOMP矩陣比較程序?qū)Ψ肿踊蛐团c毒性表型進行Mantel相關(guān)檢驗分析[17]。使用R語言程序包2.5.0進行連鎖不平衡分析[18]。
2 結(jié)果
2.1 供試菌系的毒性鑒定結(jié)果
2.1.1 冬繁區(qū)小麥條銹菌生理小種分析 根據(jù)中國鑒別寄主鑒定結(jié)果(表3),供試冬繁區(qū)148份小麥條銹菌分屬于4個不同類群:即貴農(nóng)22致病類群(頻率為40.0%)、雜種46致病類群(頻率為29.7%)、水源11致病類群(頻率為18.9%)和洛夫林13致病類群(頻率為8.8%)。4個類群共計占所鑒定菌株總數(shù)的97.0%以上;另發(fā)現(xiàn)古老生理小種CYR24各1株,出現(xiàn)在四川盆地和湖北南部。

表3 生理小種鑒定結(jié)果
共鑒定出14個已知條銹菌小種,其中,CYR34有24株菌株,頻率為16.2%,位居首位;G22-14有18株菌株,頻率為12.2%,居于第二位;CYR32有10株菌株,頻率為6.8%,居第三位;CYR33有8株菌株,頻率為5.4%,居第四位。這4個生理小種出現(xiàn)頻率總和占比40.6%,其余生理小種各自所占頻率均小于3.0%。
從分布地區(qū)來看(表4),在四川盆地排名前三的小種是:CYR34(9.9%)、G22-14(9.9%)和CYR32(4.9%);在湖北南部排名前三的小種是:CYR34(28.1%)、G22-14(12.5%)和CYR32(12.5%);在湖北西北部排名前三的小種是:CYR34(20.0%)、G22-14(15.6%)和CYR33(11.1%);在河南南部排名前三的小種是:CYR34(18.8%)、G22-14(18.8%)和G22-13(12.5%)。

表4 各地區(qū)出現(xiàn)頻率前三的小種類型
從單基因系鑒別寄主鑒定結(jié)果來看(電子附表3),148個菌分為113個小種。其中,頻率最高的是race1,達7.4%,共計11株菌株;race2和race3出現(xiàn)頻率均達3.4%,各有5株菌株;race4—race6出現(xiàn)頻率達2.0%,各有3株菌株;race7—race17出現(xiàn)頻率均達1.4%,各有2株菌株;剩余其他96種小種頻率都為0.7%,各有1株菌株。
從分布地區(qū)來看,四川盆地群體出現(xiàn)頻率最高的小種為race1和race2(6.2%),湖北南部群體的小種出現(xiàn)頻率均為4.0%,湖北西北部群體出現(xiàn)頻率最高的小種為race1(23.1%),河南南部群體出現(xiàn)頻率最高的小種為race1(18.8%)。race1在湖北西北部及河南南部地區(qū)出現(xiàn)頻率均為第一,全部表型鑒定結(jié)果見電子附表3。以上結(jié)果表明,race1出現(xiàn)頻率逼近10.0%,存在流行趨勢。
綜上,貴農(nóng)22類群是中國冬繁區(qū)小麥條銹菌群體的最大流行類群,CYR34出現(xiàn)頻率位居所有小種首位;G22-14出現(xiàn)頻率超過10.0%已經(jīng)造成流行,通過單基因系鑒定出的優(yōu)勢小種race1有發(fā)展流行風險。
2.1.2 冬繁區(qū)小麥條銹菌毒性頻率分析 冬繁區(qū)148份小麥條銹菌菌株對中國鑒別寄主的毒性頻率范圍為0—94.6%(圖1)。冬繁區(qū)的條銹菌均不能侵染中四和。毒性頻率在90%—100%的有C2(93.2%)、C6(93.2%)、C8(94.6%)、C11(91.9%),這4種鑒別寄主幾乎喪失鑒別能力;毒性頻率在70%—90%的有C1(79.1%)、C3(89.2%)、C4(87.8%)、C5(77.7%)、C7(89.2%)、C9(71.6%)、C10(78.4%)、C12(75.0%)、C14(83.8%)和C16(80.4%),這些鑒別寄主毒性差異區(qū)分能力不高;其余毒性頻率相對較低的是C13(58.8%)、C17(52.0%)和C19(39.9%)。冬繁區(qū)小麥條銹菌群體對19個中國鑒別寄主中的大多數(shù)具有較高毒性頻率。
148份小麥條銹菌菌株對單基因系的毒性頻率(圖2)范圍為0—96.6%。其中,條銹菌群體對跟的毒性頻率是0.0;對(96.6%)、(91.9%)、(92.6%)、(92.6%)、(94.6%)、(90.5%)、(95.9%)的毒性頻率都在90%以上,對的毒性頻率為最高,達到了96.2%;對(89.2%)、(89.9%)、(82.4%)、(85.8%)的毒性頻率都在80%以上,對(78.4%)、(79.1%)的毒性頻率達到了70%以上;對(63.5%)、(68.9%)、(56.8%)、(61.5%)的毒性頻率高于50%而低于70%;對(30.4%)、(31.1%)、(24.3%)和(8.1%)的毒性頻率均在40%以下。就18個單基因系及5個輔助鑒別寄主鑒定結(jié)果來看,鑒別寄主被侵染頻率達到70%以上的有13個,占比56.5%。說明半數(shù)以上的單基因系鑒別寄主已經(jīng)喪失抗性;攜帶、、和的鑒別寄主具有較好抗銹性,攜帶與的鑒別寄主表現(xiàn)出高抗性水平。

SCB:四川盆地;S-HB:湖北南部;NW-HB:湖北西北部;S-HN:河南南部。下同
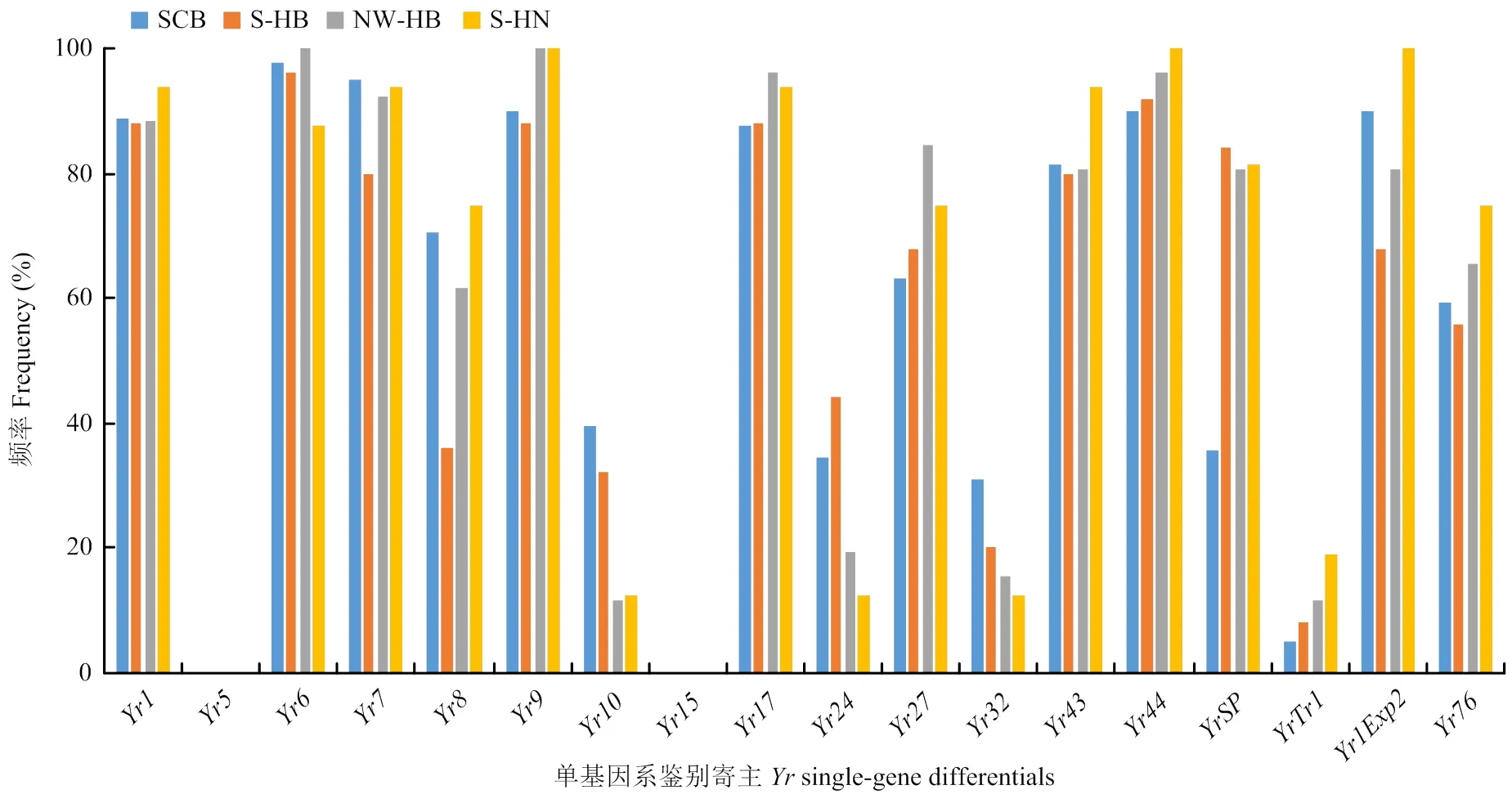
圖2 條銹菌群體對單基因系的毒性頻率
2.2 冬繁區(qū)不同地區(qū)條銹菌群體聚類分析
基于中國鑒別寄主毒性數(shù)據(jù),利用遺傳相似系數(shù)構(gòu)建表型聚類圖(圖3-A),結(jié)果顯示,冬繁區(qū)群體遺傳相似系數(shù)范圍為0.961—0.980,當遺傳相似系數(shù)為0.961時,群體可分為2大組。A組:第一亞組為四川盆地、湖北南部群體,第二亞組的群體是湖北西北部群體。B組為河南南部群體。從圖3可以看出,四川盆地與湖北南部群體結(jié)構(gòu)最為相近,它們之間可能存在較為密切的菌源交流,但與河南南部相對差異較大,且地理位置也較遠,地理距離可能是影響兩地區(qū)間菌源交流的重要原因。
基于單基因系鑒別寄主毒性數(shù)據(jù)聚類圖(圖3-B),結(jié)果顯示,冬繁區(qū)遺傳相似系數(shù)范圍為0.958— 0.971,當遺傳相似系數(shù)為0.958時,菌株可分為2大組。A組是四川盆地、湖北南部群體。B組是湖北西北部、河南南部群體。從圖可以看出湖北西北部跟河南南部群體最為相近,同時四川盆地與湖北南部群體聚為一類。對比兩幅聚類圖,四川盆地跟湖北南部群體均被聚為一類,具有較高相似度。以上結(jié)果表明,四川盆地和湖北南部條銹菌群體毒性結(jié)構(gòu)相似,可能有相同的來源。
通過KASP-SNP分子標記,除去缺失數(shù)據(jù)結(jié)果共計得到138株菌株數(shù)據(jù)。通過Structure Harvester得到最佳K值為2,138個菌株分屬于2個類群(圖4)。湖北西北部(NW-HB)與河南南部(S-HN)遺傳結(jié)構(gòu)相對簡單;四川盆地(SCB)與湖北南部(S-HB)、湖北西北部(NW-HB)與河南南部(S-HN)分別有相似的遺傳背景,但存在差異。結(jié)果表明,四川盆地與湖北南部群體同湖北西北部與河南南部群體存在遺傳分化,前者主要有2種遺傳背景,后者主要有1種遺傳背景。
分子聚類分析結(jié)果顯示(圖3-C),在0.913處被分為2組,A組是四川盆地與湖北南部條銹菌群體,B組是湖北西北部和河南南部條銹菌群體。A組與B組基因型存在分化,這與Structure所得結(jié)論一致。

A:基于中國鑒別寄主的毒性聚類分析;B:基于單基因系鑒別寄主的毒性聚類分析;C:基于SNP標記的聚類分析

圖4 不同地區(qū)條銹菌群體結(jié)構(gòu)的Structure分析
2.3 CYR34和G22-14的分化比較
共得到24株CYR34菌株,其在單基因系上出現(xiàn)表型分化(圖5-A),分化出20個致病類型,最高出現(xiàn)頻率為12.5%。當相似性系數(shù)為0.727時,菌株被分為2個毒性類群;當相似性系數(shù)為0.864時,菌株被聚為5個類群。表明CYR34類群毒性分化復雜。
共得到18株G22-14菌株,其在單基因系上出現(xiàn)表型分化(圖5-B),分化出15個致病類型,最高頻率為11.1%,有3種表型。當相似性系數(shù)為0.707時,菌株被分為2個毒性類群;當相似性系數(shù)為0.854時,菌株被聚為5個類群。表明G22-14毒性分化復雜。
在138株菌株的分子數(shù)據(jù)中,共有22株CYR34和17株G22-14菌株,分別進行基因型個體聚類分析(圖6),結(jié)果表明,22株CYR34共計15個基因型,17株G22-14共計10個基因型,二者內(nèi)部均存在遺傳分化。

A:CYR34基于單基因系鑒別寄主的毒性聚類分析;B:貴22-14基于單基因系鑒別寄主的毒性聚類分析
2.4 群體遺傳分化及基因流分析
遺傳分化分析結(jié)果表明(表5),四川盆地群體平均值0.072,湖北南部群體平均值0.030,湖北西北部群體平均值0.050,河南南部平均值0.055。相比較而言,四川盆地條銹菌群體與河南南部條銹菌群體二者值最大,為0.118,遺傳差異最大且遺傳分化明顯。湖北西北部群體與河南南部群體遺傳分化程度最小,值為0.010。
從m值來看,湖北西北部群體與河南南部群體之間的m值為25.236,m>4,表明二者存在較大的基因流[19],湖北北部和河南南部群體與四川盆地群體之間的m值分別為2.923和1.864,二者存在較小的基因流。四川盆地與湖北南部群體同湖北西北部與河南南部群體存在遺傳分化,以上結(jié)果與Structure的分析結(jié)果指向一致。

圖6 CYR34和G22-14的個體聚類分析

表5 四地區(qū)條銹菌群體的遺傳分化值Fst(上對角線)和Nm值(下對角線)
2.5 遺傳多樣性指數(shù)分析
遺傳多樣性統(tǒng)計分析結(jié)果顯示(表6),在各地區(qū)群體之間a范圍為1.647—2.000,e為1.523— 1.724,為0.396—0.591,s為0.277—0.406,四川盆地、湖北南部地區(qū)、湖北西北部、河南南部依次為17、17、11和11,分別為100%、100%、64.7%和64.7%,表明四川盆地及湖北南部地區(qū)條銹菌群體遺傳多樣性水平均較高,湖北西北部與河南南部條銹菌群體遺傳多樣性水平較低。其中,四川盆地地區(qū)條銹菌群體多態(tài)性最高,為0.591,s為0.406,湖北西北部條銹菌群體多態(tài)性最低,為0.396,s為0.277。
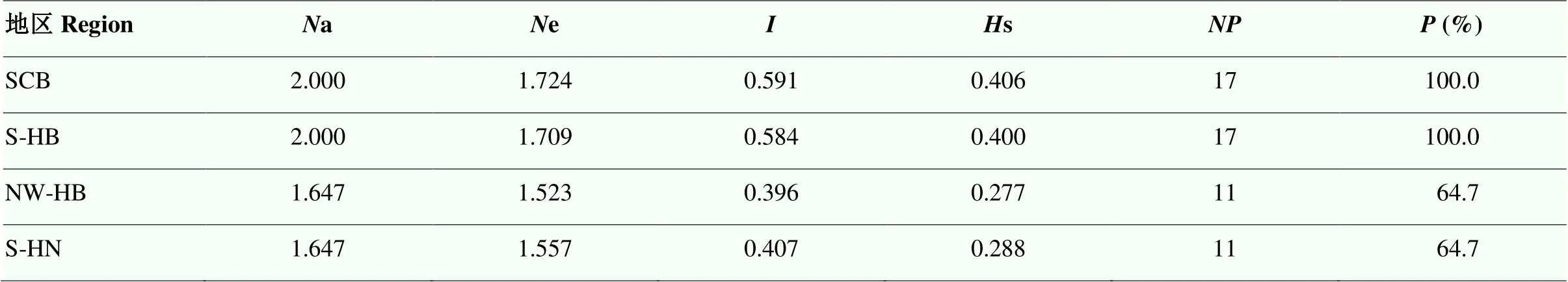
表6 遺傳信息指數(shù)
a:觀察等位基因數(shù);e:有效等位基因數(shù);:香農(nóng)信息指數(shù);s:Nei’s遺傳多樣性指數(shù);:多態(tài)性位點數(shù);多態(tài)性位點百分比
a: observed number of alleles;e: effective number of alleles;: Shannon’s information index;s: Nei's genetic diversity;: number of polymorphic loci;: percentage of polymorphic loci
2.6 冬繁區(qū)條銹菌群體繁殖模式分析
小麥條銹菌群體中存在無性生殖跟有性生殖2種繁殖方式,用所得SNP分子標記數(shù)據(jù)進行連鎖不平衡分析,結(jié)果顯示,所有群體的標準關(guān)聯(lián)指數(shù)值顯著(<0.01)(圖7),這表示連鎖平衡的假設(shè)不成立,說明這些群體中未發(fā)生隨機交配或有性生殖。推測這些地區(qū)條銹菌群體繁殖模式為無性繁殖。
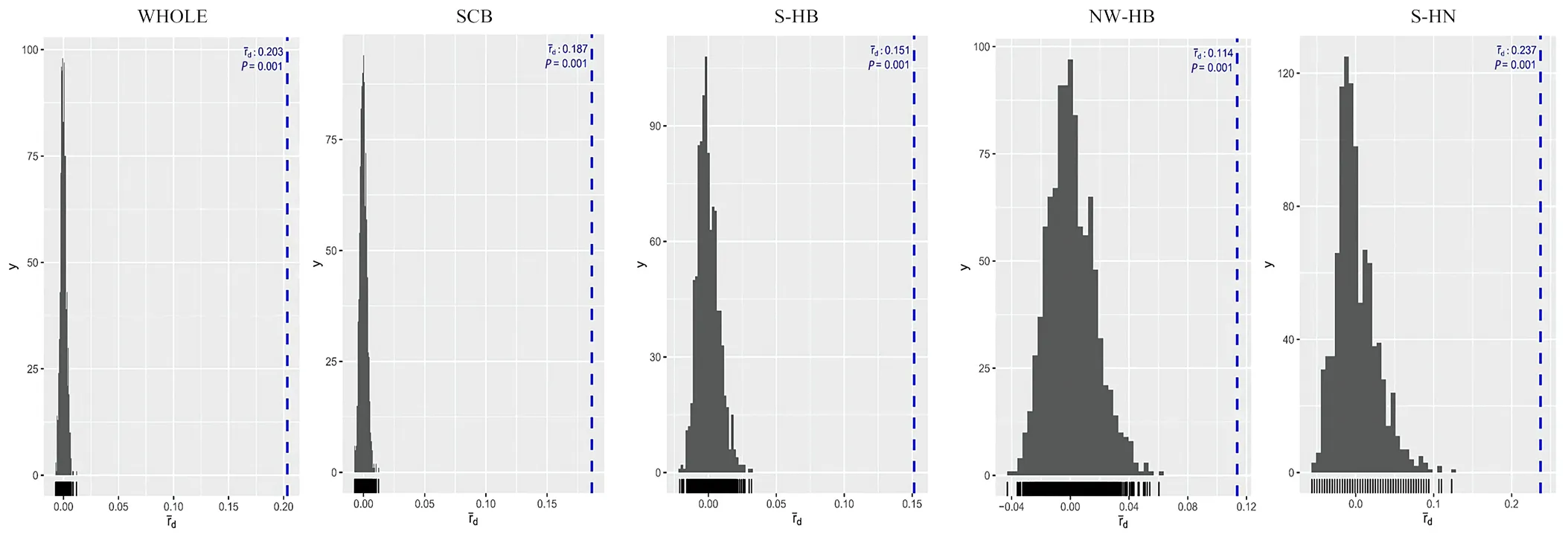
圖7 連鎖不平衡分析
2.7 基因型數(shù)據(jù)與毒性數(shù)據(jù)相關(guān)性分析
利用NTSYS-pc的MXCOMP矩陣比較程序?qū)?38株菌株的基因型數(shù)據(jù)與毒性表型數(shù)據(jù)進行Mantel相關(guān)性檢驗分析。結(jié)果顯示,KASP-SNP所得基因型數(shù)據(jù)與中國鑒別寄主毒性數(shù)據(jù)相關(guān)性極低(1=-0.001,=0.489),與單基因系及輔助鑒別寄主毒性數(shù)據(jù)相關(guān)性極低(2=0.061,=0.955),1和2均接近于0,說明基因型多態(tài)性與毒性多態(tài)性這兩者間的相關(guān)性很低,表明基于分子標記的基因型與基于毒性標記的表型2種標記體系之間相互獨立。
3 討論
3.1 冬繁區(qū)小麥條銹菌群體結(jié)構(gòu)分析
本研究從四川盆地、湖北和河南南部等主要冬繁區(qū)采集并分離得到148個小麥條銹菌菌株,利用中國鑒別寄主和單基因系鑒別寄主對這些分離株進行毒性表型鑒定。同時,利用17對KASP-SNP引物對供試菌株進行分子標記,明確了冬繁區(qū)小麥條銹菌群體的流行致病類型、生理小種結(jié)構(gòu)及毒性頻率與分布,分析了冬繁區(qū)各地區(qū)間條銹菌群體遺傳結(jié)構(gòu)的差異、基因交流程度及遺傳多樣性水平。通過毒性表型鑒定與基因型分析,發(fā)現(xiàn)冬繁區(qū)小麥條銹菌群體存在分化,表明它們可能有不同的來源。
毒性表型鑒定與分子標記聚類分析結(jié)果表明,四川盆地與湖北南部條銹菌群體遺傳結(jié)構(gòu)高度相似,湖北西北部與河南南部條銹菌群體遺傳結(jié)構(gòu)高度相似;Structure分析結(jié)果表明,四川盆地及湖北南部地區(qū)有兩種遺傳背景,而湖北西北部與河南南部有近乎單一的遺傳背景;從基因流和遺傳多樣性分析來看,湖北西北部與河南南部群體間存在較大的基因流[19],兩群體交流頻繁,而二者與四川盆地群體存在較小基因流。這可能是由于地理距離相對較遠影響了群體交流,但也說明四川盆地、湖北南部群體與湖北西北部、河南南部群體存在遺傳分化[20],從而推測產(chǎn)生這種分化的原因是傳播至四川盆地與鄂西北、豫南地區(qū)群體的菌源不同,表明冬繁區(qū)除接受西北越夏區(qū)的菌源以外,還可能接受其他地區(qū)的菌源。
甘肅等西北越夏區(qū)被認為是小麥條銹菌最重要的菌源地,因此西北越夏區(qū)的小麥條銹病歷來備受關(guān)注與防控。但近年研究表明,西南越夏區(qū)不容忽視。Wang等[21]2010年對四川、云南和貴州的越冬和越冬過程進行了研究,指出三地區(qū)的菌源極有可能對中國北部、西北和西南部麥區(qū)小麥條銹病造成影響。Huang等[8]對中國中西部多個省份2017、2018年的條銹菌進行研究,揭示了條銹菌從云貴地區(qū)向湖北地區(qū)傳播的新路徑,鄂西北的條銹菌來自于西北的甘肅地區(qū),而鄂南的條銹菌來自于云貴高原。Zhan等[9]通過群體遺傳分析,發(fā)現(xiàn)2019年湖北地區(qū)的條銹菌來源于貴州和云南東部。本研究表明2020年冬繁區(qū)菌源可能不僅來自于西北越夏區(qū),而且可能來自西南越夏區(qū)。云貴高海拔地區(qū)由于其涼爽的氣候和耕作方式,小麥條銹菌可在自生麥苗上越夏,并隨氣流向其他地方傳播。通過對云貴高原八年的氣象軌跡數(shù)據(jù)進行分析,發(fā)現(xiàn)氣流最遠可到達長江中下游地區(qū)[22],這表明云貴地區(qū)的條銹菌可傳播到其他小麥種植區(qū)。過去研究認為西南越夏區(qū)條銹菌群體只在當?shù)匦←湕l銹病周年循環(huán)中發(fā)揮作用,但對全國小麥條銹病的發(fā)生與流行有何作用尚不清楚[4],因此后續(xù)研究可依據(jù)條銹病在田間發(fā)病時間的先后采樣,用冬繁區(qū)條銹菌群體與相關(guān)越夏區(qū)菌源進行比較分析,進一步探明冬繁區(qū)小麥條銹菌來源,為越夏區(qū)、冬繁區(qū)乃至全國小麥條銹病的精準防控提供依據(jù)。
3.2 冬繁區(qū)小麥條銹菌流行類群分析
中國鑒別寄主鑒定結(jié)果顯示貴農(nóng)22類群是冬繁區(qū)的最大流行類群,其大范圍流行的原因主要是由于攜帶(被認為與是相同的)小麥品種的廣泛種植[23],使得V26(能克服攜帶品種抗性的小麥條銹菌)迅速成為優(yōu)勢類群,導致其近年出現(xiàn)頻率居高不下且已接近50%。值得注意的是,G22-14的出現(xiàn)頻率已經(jīng)達到了12.2%,比黃瑾等[24]報道的高一倍。結(jié)合本研究所得毒性頻率結(jié)果,發(fā)現(xiàn)G22-14與CYR34對單基因系鑒別寄主有相近的毒性頻率。G22-14出現(xiàn)頻率的快速增長不僅給小麥生產(chǎn)安全帶來極大的威脅,而且表明小麥條銹菌群體存在連續(xù)不斷的毒性變異與毒性分化。中國鑒別寄主毒性頻率分布顯示:冬繁區(qū)小麥條銹菌只對中四和毒性頻率為0,對貴農(nóng)22毒性頻率逼近50%,存在抗性喪失風險,這表明中國需要改變以貴農(nóng)系小麥品種為主的種植策略;單基因系鑒別寄主毒性頻率分布顯示:條銹菌群體對(30.4%)、(31.1%)、(24.3%)、(8.1%)的毒性頻率均在40%以下,對和的毒性頻率為0,表明以上基因可以作為有效抗源應(yīng)用于抗病育種工作。Bai等[25]在2018年對CYR32、CYR33、CYR34和G22-14的寄生適合度測試后,指出小麥育種應(yīng)減少對和的使用,再結(jié)合目前貴農(nóng)22類群的流行現(xiàn)狀,和應(yīng)被謹慎使用。Huang等[26]測試了2000年到2016年在黃淮海麥區(qū)廣泛種植的66個商業(yè)小麥品種的抗銹基因,發(fā)現(xiàn)66個小麥品種均不含有和。結(jié)合本試驗結(jié)果來看,若小麥條銹病在冬繁區(qū)發(fā)生大流行,積累了足夠的菌源量,在春季流行期可輕松攻破黃淮海麥區(qū)的小麥抗性防線,引起條銹病的大爆發(fā),嚴重威脅小麥生產(chǎn)安全。因此,冬繁區(qū)抗性基因的精準布局十分重要。
3.3 冬繁區(qū)小麥條銹菌毒性分化評價
CYR34與G22-14的毒性聚類圖也證實了生理小種內(nèi)部存在明顯分化。就毒性頻率分析,CYR34與G22-14毒性相當;CYR34與G22-14對某些單基因系鑒別寄主毒性更強,也存在毒性更弱的情況;Han等[27]在2015年評估了2種可侵染攜帶品種的小種對四川盆地小麥品種和育種系的毒力強弱,指出后來出現(xiàn)的小種(V26/貴22)比初始出現(xiàn)的小種(V26/CM42)毒性譜更寬,表明可侵染攜帶品種的小種已經(jīng)進化為毒性更復雜的小種群體,結(jié)合G22-14快速增長的情況,可推斷在病原菌與寄主植物的“軍備競爭”過程中,G22-14獲得了更強的毒性,使其在與群體中其他小種的競爭中取得生存優(yōu)勢,并在各地主栽品種的選擇壓力下發(fā)生了毒性分化;姚強等[28]用單基因系及SSR分子標記研究了CYR32及CYR33的分化,發(fā)現(xiàn)這兩個流行小種在單基因系上出現(xiàn)了多樣性分化,且不受地域的影響。本試驗通過單基因系鑒別寄主鑒定所得優(yōu)勢小種race1的11株菌株中,通過中國鑒別寄主鑒定為CYR34的有3株,G22-14有2株,CYR33有1株,其余菌株均未通過中國鑒別寄主得到區(qū)分,更加說明中國鑒別寄主的區(qū)分力度不夠,需要進行調(diào)整。上述結(jié)果表明,現(xiàn)有的這套中國鑒別寄主已不能反映當前中國條銹菌毒性變異的實際情況。
小麥條銹菌具有明顯的毒性分化現(xiàn)象,利用鑒別寄主鑒定出不同的小種,可以較準確地反映小種群體與寄主群體之間的互作關(guān)系[1, 3, 29]。當前沿用的中國鑒別寄主主要由我國的歷史重要生產(chǎn)品種和主要抗源品種組成,盡管能夠明確某小種所能侵染的特定抗源品種類型,但由于這些品種抗銹基因尚不清楚,因此,無法推導小種所攜帶的無毒基因/毒性基因,也無法統(tǒng)計病原菌群體的毒性頻率;此外,許多當前應(yīng)用的已知抗性遺傳背景的鑒別寄主攜帶有2個或2個以上的抗性基因,這些附加抗性基因可能限制了無毒基因與抗性基因互作結(jié)果的遺傳學解釋。實際上條銹菌自然群體小種毒性類型遠高于報道的小種數(shù)量,對生產(chǎn)極具潛在威脅的新毒性小種未能及時監(jiān)測和報道[30]。而單等基因系擁有相似遺傳背景且抗性基因明確單一,在毒性小種頻率動態(tài)監(jiān)測領(lǐng)域更具優(yōu)勢[31]。因此,有必要篩選一套遺傳背景相同、各鑒別寄主僅攜帶單個抗病基因并適合中國生產(chǎn)實際的單基因系(single gene lines)作為新的鑒別寄主體系,開展我國小麥條銹菌群體小種的系統(tǒng)精準鑒定。
4 結(jié)論
四川盆地與湖北南部群體同湖北西北部與河南南部群體存在遺傳分化,明確冬繁區(qū)菌源不僅來自西北越夏區(qū),而且來自西南越夏區(qū);貴農(nóng)22類群是冬繁區(qū)的最大流行類群;CYR34與G22-14的毒性分化證實生理小種內(nèi)部存在明顯分化,相較于中國鑒別寄主,單基因系鑒別寄主能夠更精準地進行中國小麥條銹菌群體小種的鑒定。
[1] CHEN X M. Epidemiology and control of stripe rust [f. sp.] on wheat. Canadian Journal of Plant Pathology, 2005, 27(3): 314-337.
[2] WELLINGS C R. Global status of stripe rust: a review of historical and current threats. Euphytica, 2011, 179(1): 129-141.
[3] 康振生, 王曉杰, 趙杰, 湯春蕾, 黃麗麗. 小麥條銹菌致病性及其變異研究進展. 中國農(nóng)業(yè)科學, 2015, 48(17): 3439-3453.
KANG Z S, WANG X J, ZHAO J, TANG C L, HUANG L L. Advances in research of pathogenicity and virulence variation of the wheat stripe rust fungusf. sp.. Scientia Agricultura Sinica, 2015, 48(17): 3439-3453. (in Chinese)
[4] 李振岐, 曾士邁. 中國小麥銹病. 北京: 中國農(nóng)業(yè)出版社, 2002.
LI Z Q, ZENG S M. Wheat Rust in China. Beijing: China Agriculture Press, 2002. (in Chinese)
[5] CHEN W Q, WELLINGS C, CHEN X M, KANG Z S, LIU T G. Wheat stripe (yellow) rust caused byf. sp.Molecular Plant Pathology, 2014, 15(5): 433-446.
[6] 陳萬權(quán), 康振生, 馬占鴻, 徐世昌, 金社林, 姜玉英. 中國小麥條銹病綜合治理理論與實踐. 中國農(nóng)業(yè)科學, 2013, 46(20): 4254-4262.
CHEN W Q, KANG Z S, MA Z H, XU S C, JIN S L, JIANG Y Y. Integrated management of wheat stripe rust caused byf.sp.in China. Scientia Agricultura Sinica, 2013, 46(20): 4254-4262. (in Chinese)
[7] 黃沖, 姜玉英, 紀國強, 張國芝, 李輝, 李亞紅. 2017年我國小麥條銹病流行大尺度時空動態(tài)分析. 植物保護學報, 2018, 45(1): 20-26.
HUANG C, JIANG Y Y, JI G Q, ZHANG G Z, LI H, LI Y H. Spatiotemporal dynamics of wheat stripe rust epidemics at regional level in China in 2017. Journal of Plant Protection, 2018, 45(1): 20-26. (in Chinese)
[8] HUANG L, YANG H, XIA C J, LI H F, WANG J F, WANG A L, ZHANG M, KANG X H, GAO L, ZHOU Y L, CHEN W Q, LIU T G. Long-distance transport off. sp.by upper airflow on the Yunnan-Guizhou Plateau disrupts the balance of agricultural ecology in central China. Plant Disease, 2022, 106(11): 2940-2947.
[9] ZHAN G M, JI F, CHEN X M, WANG J X, ZHANG D L, ZHAO J, ZENG Q D, YANG L J, HUANG L L, KANG Z S. Populations off. sp.in winter spore production regions spread from southwestern oversummering areas in China. Plant Disease, 2022, 106(11): 2856-2865.
[10] CHEN X M, MOORE M, MILUS E A, LONG D L, LINE R F, MARSHALL D, JACKSON L. Wheat stripe rust epidemics and races off. sp.in the United States in 2000. Plant Disease, 2002, 86(1): 39-46.
[11] ALJANABI S M, MARTINEZ I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques. Nucleic Acids Research, 1997, 25(22): 4692-4693.
[12] 孟巖, 楊彩柏, 姜舒暢, 黃麗麗, 康振生, 詹剛明. 基于KASP技術(shù)的小麥條銹菌SNP分子標記開發(fā)與評價. 植物保護學報, 2020, 47(9): 65-73.
MENG Y, YANG C B, JIANG S C, HUANG L L, KANG Z S, ZHAN G M. Development and evaluation of SNP molecular markers of wheat stripe rust based on KASP technology. Journal of Plant Protection, 2020, 47(9): 65-73. (in Chinese)
[13] KOSMAN E, LEONARD K J. Conceptual analysis of methods applied to assessment of diversity within and distance between populations with asexual or mixed mode of reproduction. The New Phytologist, 2007, 174(3):683-696.
[14] PRITCHARD J K, STEPHENS M, DONNELLY P. Inferenceof population structure using multilocus genotype data. Genetics, 2000, 155(2):945-959.
[15] JAKOBSSON M, ROSENBERG N A. CLUMPP: a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure.Bioinformatics, 2007, 23(14): 1801-1806.
[16] ROSENBERG N A. Distruct: a program for the graphical display of population structure. Molecular Ecology Notes, 2004, 4(1): 137-138.
[17] MANTEL N. The detection of disease clustering and a generalized regression approach. Cancer Research, 1967, 27(2): 209-220.
[18] AGAPOW P M, BURT A. Indices of multilocus linkage disequilibrium. Molecular Ecology Notes, 2001, 1(1/2): 101-102.
[19] WRIGHT S. Evolution in mendelian populations. Bulletin of Mathematical Biology, 1990, 52: 241-295.
[20] 曲若竹, 侯林, 呂紅麗, 李海燕. 群體遺傳結(jié)構(gòu)中的基因流. 遺傳, 2004, 26(3): 377-382.
QU R Z, HOU L, Lü H L, LI H Y. The gene flow of population genetic structure. Hereditas, 2004, 26(3): 377-382. (in Chinese)
[21] WANG H G, YANG X B, MA Z H. Long-distance spore transport of wheat stripe rust pathogen from Sichuan, Yunnan, and Guizhou in southwestern China. Plant Disease, 2010, 94(7): 873-880.
[22] LI M J, ZHANG Y H, CHEN W Q, DUAN X Y, LIU T G, JIA Q Z, CAO S Q, XU Z. Evidence for Yunnan as the major origin center of the dominant wheat fungal pathogenf. sp.. Australasian Plant Pathology, 2021, 50(2): 241-252.
[23] MCINTOSH R, MU J M, HAN D J, KANG Z S. Wheat stripe rust resistance gene/: A retrospective review. The Crop Journal, 2018, 6(4): 321-329.
[24] 黃瑾, 賈秋珍, 張勃, 孫振宇, 黃苗苗, 金社林. 小麥條銹病菌新菌系G22-9(CYR34)和G22-14流行趨勢預測. 植物保護學報, 2018, 45(1): 101-108.
HUANG J, JIA Q Z, ZHANG B, SUN Z Y, HUANG M M, JIN S L. Epidemic forecasting of the new strains G22-9(CYR34) and G22-14 off. sp. tin wheat in Gansu province. Journal of Plant Protection, 2018,45(1): 101-108. (in Chinese)
[25] BAI B B, LIU T G, LIU B, GAO L, CHEN W Q. High relative parasitic fitness of G22 derivatives is associated with the epidemic potential of wheat stripe rust in China. Plant Disease, 2018, 102(3): 483-487.
[26] HUANG L, XIAO X Z, LIU B, GAO L, GONG G S, CHEN W Q, ZHANG M, LIU T G. Identification of stripe rust resistance genes in common wheat cultivars from the Huang-Huai-Hai region of China. Plant Disease, 2020, 104(6): 1763-1770.
[27] HAN D J, WANG Q L, CHEN X M, ZENG Q D, WU J H, XUE W B, ZHAN G M, HUANG L L, KANG Z S. Emerging-virulent races off.are threatening wheat production in the Sichuan basin, China. Plant Disease, 2015, 99(6): 754-760.
[28] 姚強, 王潔榮, 孟巖, 詹剛明, 黃麗麗, 康振生. 中國小麥條銹病菌CYR32和CYR33的毒性及基因型多樣性. 植物保護學報, 2018, 45(1): 46-52.
YAO Q, WANG J R, MENG Y, ZHAN G M, HUANG L L, KANG Z S. Virulence and genotypic diversity of wheat stripe rust races CYR32 and CYR33 in China. Journal of Plant Protection, 2018, 45(1): 46-52. (in Chinese)
[29] WANG C C, JIANG B B, LIANG J M, LI L F, GU Y L, LI J T, LUO Y, MA Z H. Population genetic structures off. sp.in the Gansu-Ningxia region and Hubei province, China. Genes, 2021, 12(11): 1712.
[30] 劉太國, 王保通, 賈秋珍, 章振羽, 李強, 曹世勤, 彭云良, 金社林, 李明菊, 劉博, 高利, 胡小平, 陳萬權(quán). 2010-2011年度我國小麥條銹菌生理專化研究. 麥類作物學報, 2012, 32(3): 574-578.
LIU T G, WANG B T, JIA Q Z, ZHANG Z Y, LI Q, CAO S Q, PENG Y L, JIN S L, LI M J, LIU B, GAO L, HU X P, CHEN W Q. physiological specialization off. sp.in China during 2010-2011. Journal of Triticeae Crops, 2012, 32(3): 574-578. (in Chinese)
[31] 萬安民. 小麥條銹菌鑒別寄主和小種命名現(xiàn)狀. 植物病理學報, 2003, 33(6): 481-486.
WAN A M. Differentials and nomenclature of races ofWest f. sp.Eriksson. Acta Phytopathologica Sinica, 2003, 33(6): 481-486. (in Chinese)
Population Genetic Analysis ofin Main Winter-increasing Areas Based on Virulent Phenotypes and Genotypes
GAO XinPei, ZHAO Jun, LIU BoFan, Guo Yi,KANG ZhenSheng, ZHAN GangMing
College of Plant Protection, Northwest A & F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi
【Objective】To clarify the virulence structure and genetic diversity ofpopulations in the major winter-increasing areas of China, and to provide reference for the prevention and control ofand the rational layout of wheat resistance genes in the winter-increasing areas and the wheat production in Huang-huai-hai. 【Method】A total of 148isolates were collected and isolated from the major winter-increasing areas such as Sichuan Basin, Hubei and southern Henan, and the virulence phenotype was identified by using Chinese differentials and single-gene lines, and 17 pairs of KASP-SNP primers were used to mark the isolates and complete the genotype analysis. 【Result】Based on the Chinese differentials, 14 known races and 63 unknown pathotypes were identified, among which CYR34 (16.2%), G22-14 (12.2%), CYR32 (6.8%), CYR33 (5.4%) were the dominant races (pathotypes); based on the single-gene lines, 113 races (pathotypes) were identified, among which race1 (7.4%), race2 (3.4%), race3 (3.4%) were the dominant races (pathotypes). The Guinong 22 group was the largest epidemic group ofpopulation in China’s winter-increasing area, and all testedisolates did not infect single-gene lines varieties carryingand. The virulence phenotype and genotype of CYR34 and G22-14 showed diversification by single-gene lines virulence identification and molecular marker, indicating that there was high differentiation within these two dominant races. The clustering based on the virulence data of two sets of differentials showed that thepopulations in Sichuan Basin and southern Hubei were similar, while thepopulations in northwestern Hubei and southern Henan were similar; the genetic clustering based on KASP-SNP molecular data showed that there was genotype differentiation between thepopulations in Sichuan Basin, southern Hubei and northwestern Hubei, southern Henan; Structure analysis showed that Sichuan Basin, southern Hubei population mainly had two genetic backgrounds, northwestern Hubei, southern Henan population mainly had one genetic background; population genetic differentiation analysis showed that Sichuan Basinpopulation and southern Henanpopulation had the largestvalue, which was 0.118, with the largest genetic difference and obvious genetic differentiation; northwestern Hubei population and southern Henan population had the smallest degree of genetic differentiation,value was 0.010; gene flow analysis obtainedm value between northwestern Hubei population and southern Henan population was 25.236,m>4, there was a high-level gene flow between them, northwestern Hubei and southern Henan population and Sichuan Basin population hadm values of 2.923 and 1.864 respectively, both had a low-level gene flow; genetic diversity analysis results showed that Sichuan Basin, southern Hubei regionpopulation had a high-level of genetic diversity, northwestern Hubei, southern Henanpopulation had a low-level of genetic diversity. The above conclusions all support that Sichuan Basin, southern Hubei population has genetic differentiation with northwestern Hubei, southern Henan population. 【Conclusion】Single-gene lines can accurately identify Chineseraces;populations in China’s major winter-increasing areas have different sources.
wheat stripe rust; winter-increasing area; virulence identification; KASP-SNP; population genetics

10.3864/j.issn.0578-1752.2023.14.001
2023-02-27;
2023-04-11
國家重點研發(fā)計劃(2021YFD1401000)、國家自然科學基金(32172380)
高新培,E-mail:1350261784@qq.com。趙鋆,E-mail:1138094105@qq.com。高新培和趙鋆為同等貢獻作者。通信作者詹剛明,E-mail:zhangangming@nwsuaf.edu.cn。通信作者康振生,E-mail:kangzs@nwsuaf.edu.cn
(責任編輯 李莉)

