星孢寄生菇個體發育對可控環境因子的響應
趙婭通,吳 丹,周會明,梁 婷,沈清林,谷朝政,陳雪雯,寧亞娟
(滇西科技師范學院生物技術與工程學院 云南臨滄 677000)
星孢寄生菇隸屬于真菌門(Eumycota)、擔子菌綱(Basidiomycota)、傘菌目(Agaricales)、離褶傘科(Lyophyllaceae)、寄生菇屬(Asterophora),主要分布于我國的云南、貴州、四川等地區[1]。該菇是一種兼有寄生與腐生的菌寄生菇,有著獨特的營養方式。在人工培養基上,星孢寄生菇的菌絲體與一般食用菌相比具有生長速度快、出菇迅速的特點[2]。因此,研究其出菇機制與遺傳學原理對推動名貴食藥用真菌人工栽培進程具有重要意義。
適宜的環境因子是眾多野生菇類得以出菇的必備條件,而個體發育是菇類在環境因子影響下遺傳基因的外在表達,也是菇類對環境因子的最終響應。然而,目前絕大多數野生菇類仍無法有效地人工栽培,其子實體發育機制也難以解釋,馴化模式仍受內在因素與環境因素的影響[3]。筆者以獨特的星孢寄生菇為研究對象,探究其個體發育與可控環境因子的關系,對于闡釋其出菇機制、遺傳學原理及其應用具有重要的意義。
目前,國內外有關星孢寄生菇的研究主要集中于形態學[4]、種質資源[5-6]、親緣關系[7]等方面。王建東等[2]對該菇個體發育所需的基礎培養基、碳源、氮源、溫度以及pH 行了初步篩選,但除此之外,關于該菇的生理學研究未見其他報道,導致野生星孢寄生菇的開發與利用嚴重滯后,因此有必要對該菇進行更深入的研究。
環境因子能夠影響菇類的生理代謝過程[8],從而影響其生長發育全過程。因此,厘清不同環境因子脅迫下菇類個體的發育規律與特點,是野生菇類人工馴化的基礎[9]。與此同時,隨著人們生活水平的提高,菇類的消費需求呈快速增長趨勢,而野生菇類馴化的速度卻緩慢滯后[10],這種矛盾日益凸顯。因此,探究該菇個體發育對可控環境因子的響應對突破野生菇類資源人工化難度大這一瓶頸意義重大。
筆者的研究從星孢寄生菇菌種的活化入手,重點探究不同溫度、瓊脂濃度、酸堿度、氧氣含量、光照時長等可控環境因子單因素及其正交組合對該菇菌絲生長、原基分化及子實體發育的影響,旨在篩選該菇個體發育的最佳可控環境因子組合,厘清該菇生長發育過程中的主要影響因素,并為其進一步開發與利用提供一定的理論參考。
1 材料和方法
1.1 材料
1.1.1 供試菌株 星孢寄生菇菌株YAASM4665由云南省農業科學院生物技術與種質資源研究所鑒定、提供及保存。
1.1.2 培養基 母種培養基(PDA):馬鈴薯濃度(w,后同)20%、葡萄糖濃度2%、瓊脂濃度1.5%、蒸餾水1 L、pH 自然。基礎培養基(PSA):馬鈴薯濃度20%、蔗糖濃度2%、瓊脂濃度1.5%、蒸餾水1 L、pH 自然。
1.2 方法
1.2.1 培養基的制作 試驗于2021 年5 月在滇西科技師范學院食用菌實訓室內進行。馬鈴薯去皮、棄芽眼并清洗干凈,將其切成1 cm3的小塊,用蒸餾水對其煮沸10 min,并經4 層紗布過濾后取濾液,再加入蔗糖和瓊脂,待上述藥品完全溶解后用蒸餾水定容,將培養基分裝于250 mL 的錐形瓶內,在121 ℃下滅菌30 min。滅菌結束后,趁熱倒平板并將其放入自制的緩慢降溫容器中,以防止平板內產生小水珠[11]。
1.2.2 菌種的活化、接菌、培養及測定 取4 ℃冰箱內保存的菌株YAASM4665,將其置于培養室常溫下活化培養3~5 d。在無菌操作條件下,取黃豆大小的菌塊接種于母種培養基平板中央,將其25 ℃下倒置培養7 d,備用。用上述同樣的方法,將直徑為5 mm 的菌塊接入培養基平板中央,用保鮮膜密封,記錄菌絲萌發時間(d)、菌絲與子實體顏色、原基分化時間(d)。待同一因素下最大菌落直徑長到平板2/3 時,測定菌絲生長勢(“+++及以上”表示濃密健壯,“++”表示較濃密,“+”表示生長稀疏、“─”表示不生長)[12]、菌落直徑(mm)、生長速度(mm·d-1)[13]、原基分化數量(個·皿-1)、菌蓋直徑(mm)、菌柄 直 徑(mm)、菌柄長度(mm)以及子實體數量(個·皿-1)。
1.2.3 溫度試驗 在基礎培養基平板上設置9 個梯度的5 ℃溫差(0、5、10、15、20、25、30、35、40 ℃)進行初試。根據初試最佳溫度范圍設計2 ℃溫差試驗。菌絲在遮光下培養,下同。
1.2.4 瓊脂濃度試驗 通過控制瓊脂濃度來改變基礎培養基的含水量,設計瓊脂濃度為0.2%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的7 個梯度試驗。在菌絲生長最佳溫度下培養,下同。
1.2.5 pH 試驗 使用1 mol·L-1HCl 溶液和1 mol·L-1NaOH 溶液調節基礎培養基的pH 值,設置19 個pH 梯度試驗[14],分別為4.0、4.5、5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.5、8.0、8.5、9.0、9.5、10.0。在菌絲生長最佳瓊脂濃度下培養,下同。
1.2.6 氧氣含量試驗 通過改變培養皿直徑的大小控制氧氣含量,設計培養皿直徑為60、70、90、100 mm 的4 種基礎培養基平板試驗。在菌絲生長最佳pH 值下進行培養,下同。
1.2.7 光照時長試驗 在基礎培養基平板上,設置光照時間分別為0、12、24 h·d-1的3 組處理試驗[15]。除氧氣試驗外,上述研究培養皿直徑均為60 mm。
1.2.8 正交試驗 以溫度、瓊脂濃度、pH、光照和含氧量5 個單因素進行設計,分別以菌絲體生長速度(表1)、原基分化數量(表2)及子實體發育數量(表3)為指標,進行L16(45)正交試驗。
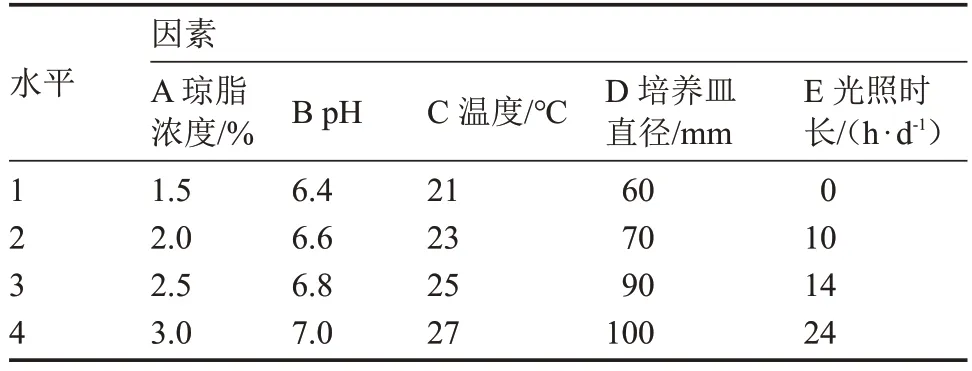
表1 基于菌絲體生長速度的正交試驗因素與水平表Table 1 The orthogonal test factors and levels based on mycelium growth rate
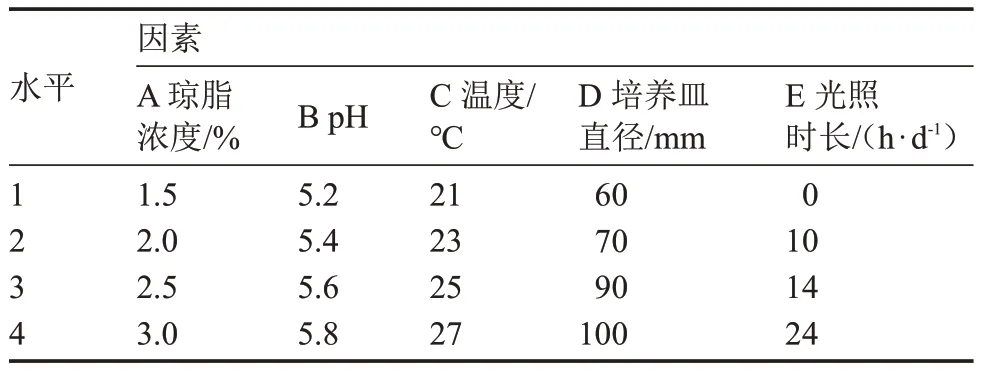
表2 基于原基分化數量的正交試驗因素與水平Table 2 The orthogonal test factors and levels based on number of primordial differentiation
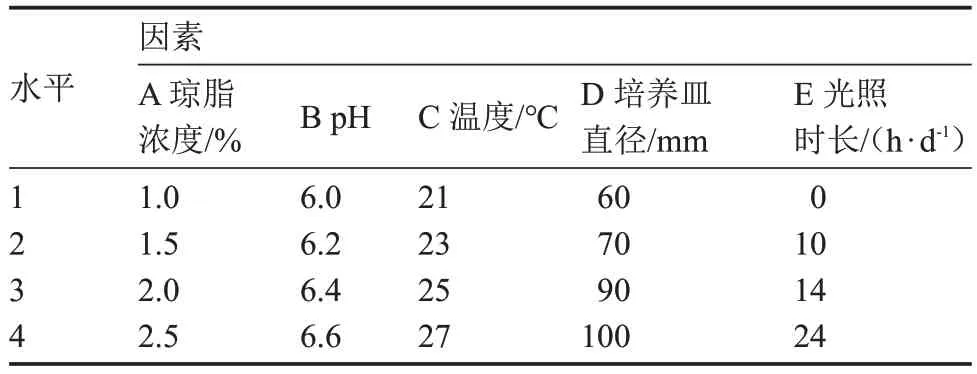
表3 基于子實體發育數量的正交試驗因素與水平Table 3 The orthogonal test factors and levels based on number of fruiting body development
1.2.9 數據分析 所有試驗數據均為3 次重復,采用SPSS 22.0 軟件進行處理分析[16]。
2 結果與分析
2.1 溫度對菌株YAASM4665生長發育的影響
2.1.1 5 ℃溫差試驗 由表4 可知,當溫度≤10 ℃或≥35 ℃時,該菇菌絲不萌發,而在15~30 ℃范圍內,均能生長且為白色(圖1)。當溫度為25 ℃時,其菌絲萌發時間最短,濃密健壯,菌落直徑最大,生長速度最快,達到(6.33±0.06)mm·d-1,與其他處理呈極顯著差異,而30 ℃處理其菌絲生長情況最差。總之,該菇菌絲生長受溫度的影響較大,25 ℃是該菇菌絲生長的最適溫度。

圖1 5 ℃溫度梯度下菌株YAASM4665 在PSA 平板中的培養情況Fig.1 The cultivation of bacterial strain YAASM4665 in PSA slab at 5 ℃temperature gradient
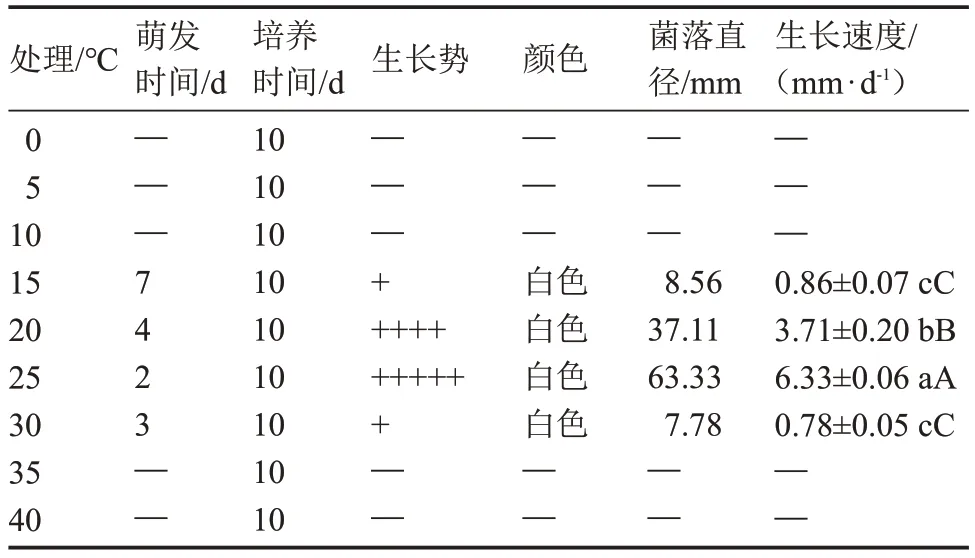
表4 5 ℃溫度梯度下菌絲體生長情況Table 4 The mycelium growth at 5 ℃temperature gradient
該菇在溫度為15~25 ℃范圍內,原基分化與子實體均能正常發育,而溫度≤10 ℃或≥30 ℃時,該菇無法形成原基和子實體(表5)。當溫度為25 ℃時,該菇的原基分化與子實體發育各項指標綜合表現最佳,與其他處理均呈極顯著差異,而15 ℃處理該菇生長發育情況最差。總之,溫度較高或較低時,該菇的原基分化與子實體發育受到限制,25 ℃是該菇原基分化與子實體發育的最適溫度。
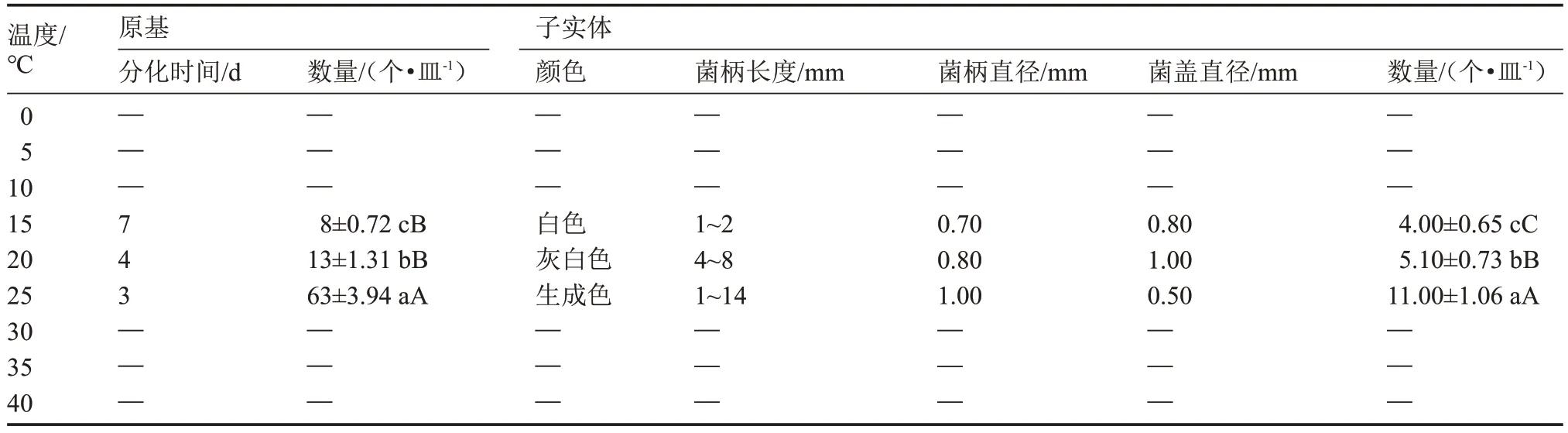
表5 5 ℃溫度梯度下原基分化與子實體發育情況Table 5 The primordial differentiation and fruiting body development at 5 ℃temperature gradient
2.1.2 2 ℃溫差試驗 由表6 可知,在19~29 ℃范圍內,該菇菌絲為白色且均能生長(圖2)。25 ℃的溫度處理下其菌絲生長情況各項參數表現最佳,該結果與5 ℃溫差試驗結果相符。

圖2 2 ℃溫度梯度下菌株YAASM4665 在PSA 平板中的培養情況Fig.2 The cultivation of bacterial strain YAASM4665 in PSA slab at 2 ℃temperature gradient
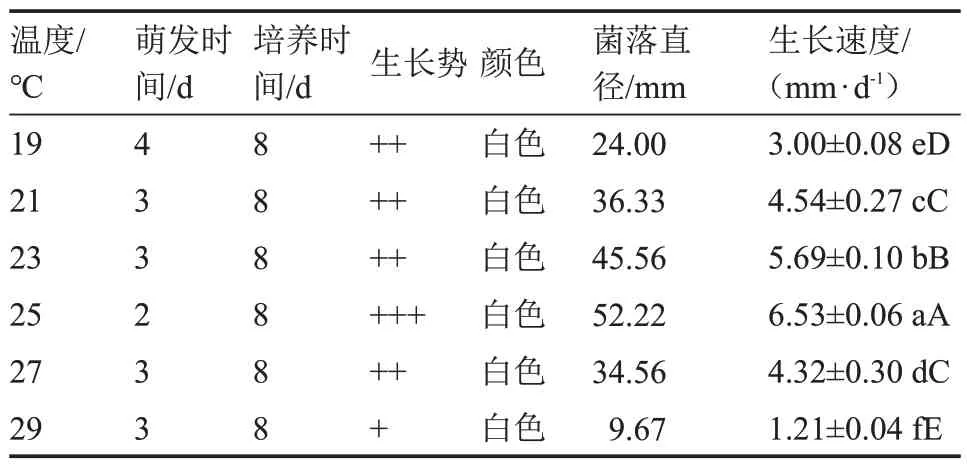
表6 2 ℃溫度梯度下菌絲體生長情況Table 6 The mycelium growth at 2 ℃temperature gradient
由表7 可知,19~27 ℃是該菇原基分化與子實體發育正常進行的溫度范圍,而溫度≥29 ℃時,該菇停止發育。在25 ℃的溫度處理下,該菇原基分化與子實體發育的各項指標也表現最佳,與上述5 ℃溫差試驗結果相符。
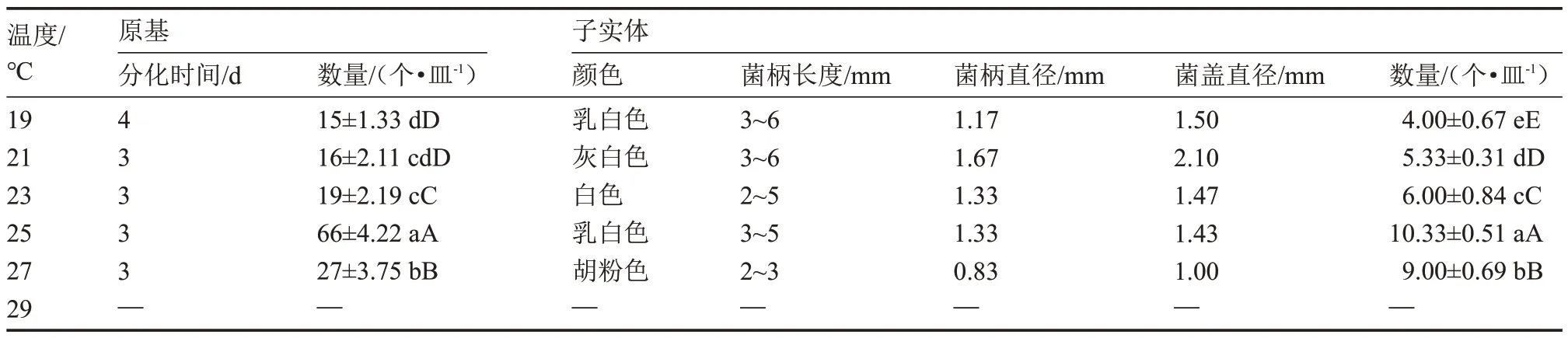
表7 2 ℃溫度梯度下原基分化與子實體發育情況Table 7 The primordial differentiation and fruiting body development at 2 ℃temperature gradient
2.2 瓊脂濃度對菌株YAASM4665 生長發育的影響
由表8 可知,在培養基瓊脂濃度0.2%~3.0%的范圍內,該菇菌絲均能正常生長,呈白色,萌發時間均為2 d。當瓊脂濃度為3.0%時,菌絲較濃密(圖3),菌落直徑最大,生長速度最快[(7.17±0.10)mm·d-1],與其他處理呈極顯著差異,而瓊脂濃度為0.2%時,菌絲長勢稀疏,生長速度最慢[(5.51±0.10)mm·d-1]。總之,不同的培養基瓊脂濃度對該菇菌絲生長影響較大,3.0%是其菌絲生長最佳瓊脂濃度。

圖3 不同瓊脂濃度下菌株YAASM4665 在PSA平板中的培養情況Fig.3 The cultivation of bacterial strain YAASM4665 in PSA slab at different agarose gel concentration
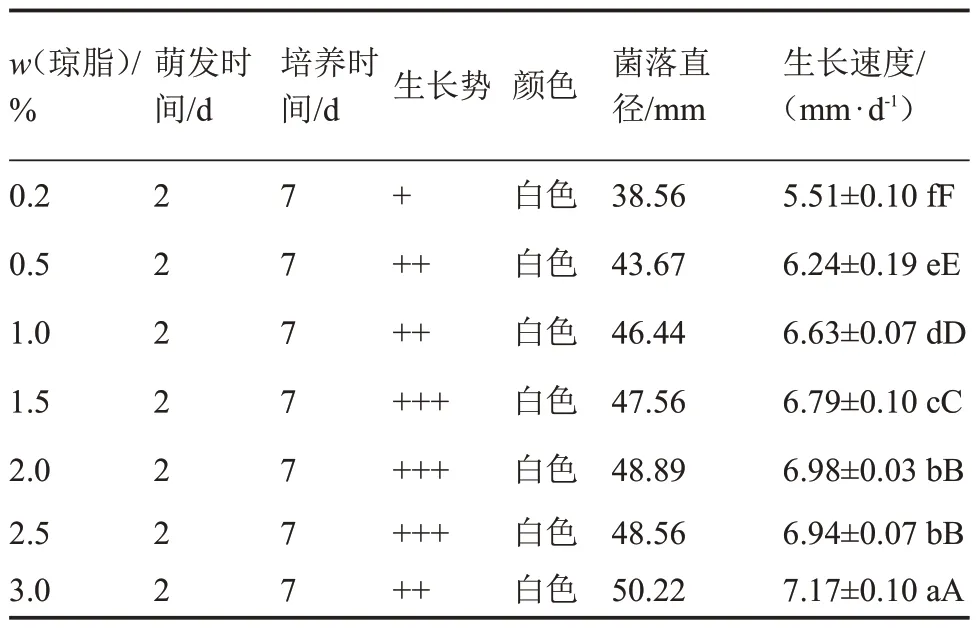
表8 不同瓊脂濃度下菌絲體生長情況Table 8 The mycelium growth at different agarose gel concentration
由表9 可知,該菇在所有瓊脂濃度處理下均能正常生長發育,其中原基分化時間均為3 d。而瓊脂濃度為2.5%時,該菇的原基分化數量最多[(106±7.13)個·皿-1],與其他處理相比,達到極顯著差異,而1.0%的瓊脂濃度處理,該菇原基分化情況最差。當瓊脂濃度為1.5%時,該菇子實體呈灰白色,農藝性狀綜合表現最佳,發育數量最多[(8.67±0.58)個·皿-1],與其他處理呈顯著差異,而0.2%的瓊脂濃度處理,該菇子實體發育情況較差,數量最少。總之,培養基瓊脂濃度的大小影響該菇的生長發育情況,其原基分化與子實體發育的最適瓊脂濃度依次為2.5%、1.5%。
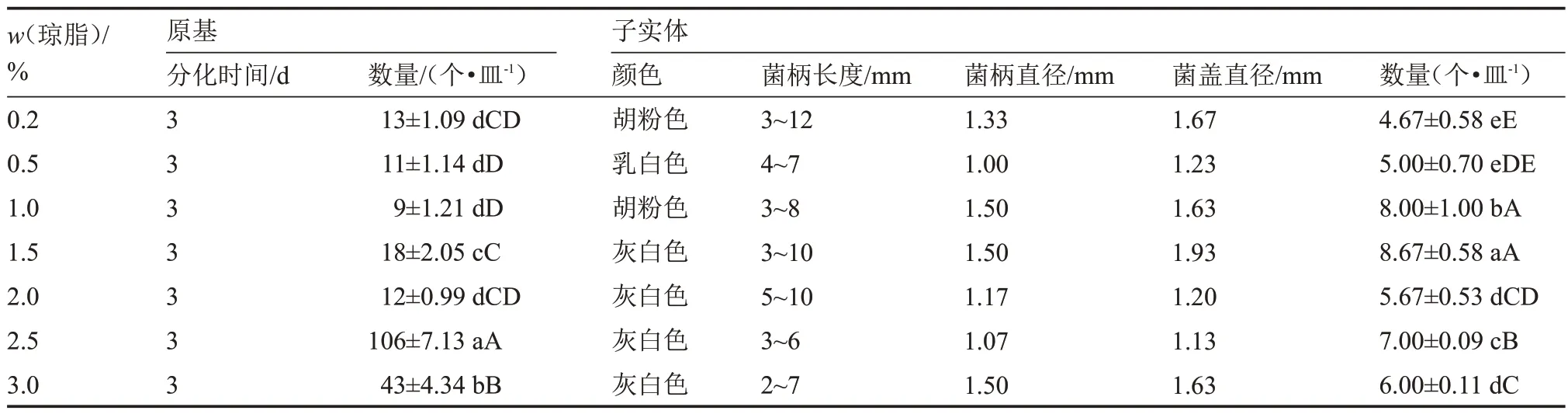
表9 不同瓊脂濃度下原基分化與子實體發育情況Table 9 The primordial differentiation and fruiting body development at different agarose gel concentration
2.3 pH值對菌株YAASM4665生長發育的影響
由表10 可知,在培養基pH 4.0~10.0 的范圍內,該菇菌絲均能正常生長,萌發時間均為2 d(圖4)。當培養基pH 6.6 時,該菇菌絲較濃密,菌落直徑最大,生長速度最快[(6.89±0.15)mm·d-1],除與培養基pH 6.8 的處理相比差異不顯著外,與其他處理呈極顯著差異。而培養基pH 4.0 時,該菇菌落直徑最小,生長速度最慢[(4.48±0.54)mm·d-1]。總之,該菇在不同酸堿度的培養基上菌絲生長差異較大且最佳pH 為6.6~6.8。
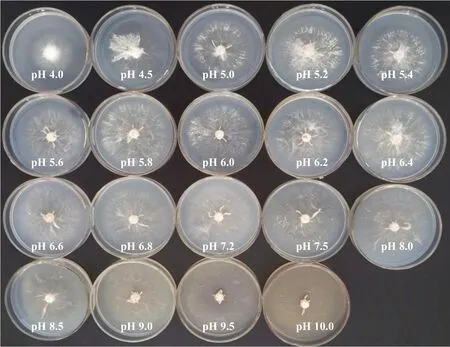
圖4 不同pH 值下菌株YAASM4665 在PSA 平板中的培養情況Fig.4 The cultivation of bacterial strain YAASM 4665 in PSA slab at different pH
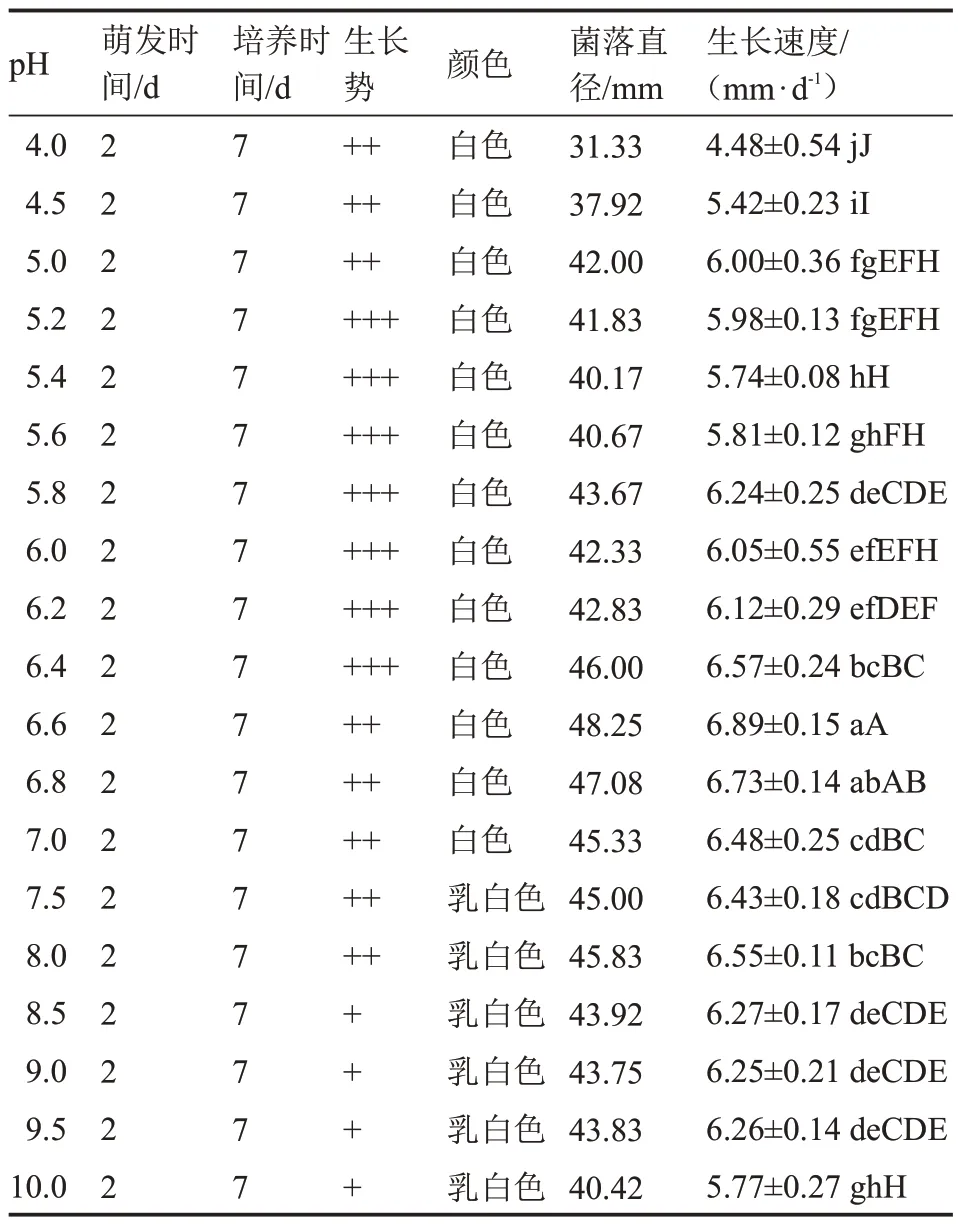
表10 不同pH 值下菌絲體生長情況Table 10 The mycelium growth at different pH
在培養基pH 4.5~10.0 的范圍內,該菇均能生長發育(表11)。當培養基pH 4.0 時,該菇無法形成原基,pH 10.0 時,子實體發育情況最差。在pH 5.4 的培養基上,該菇原基分化時間短(3 d),數量最多[(214±13.04)個·皿-1],與其他處理呈極顯著差異。當培養基pH 為6.2 時,該菇子實體呈乳白色,農藝性狀綜合表現較佳,發育數量最多[(8.00±0.94)個·皿-1],除與培養基pH 6.0、6.4、6.6 的處理相比差異不顯著外,與其他處理呈極顯著差異。總之,該菇的生長發育受酸堿度影響較大,其原基分化與子實體發育的最適pH 值依次為5.4、6.0~6.6。
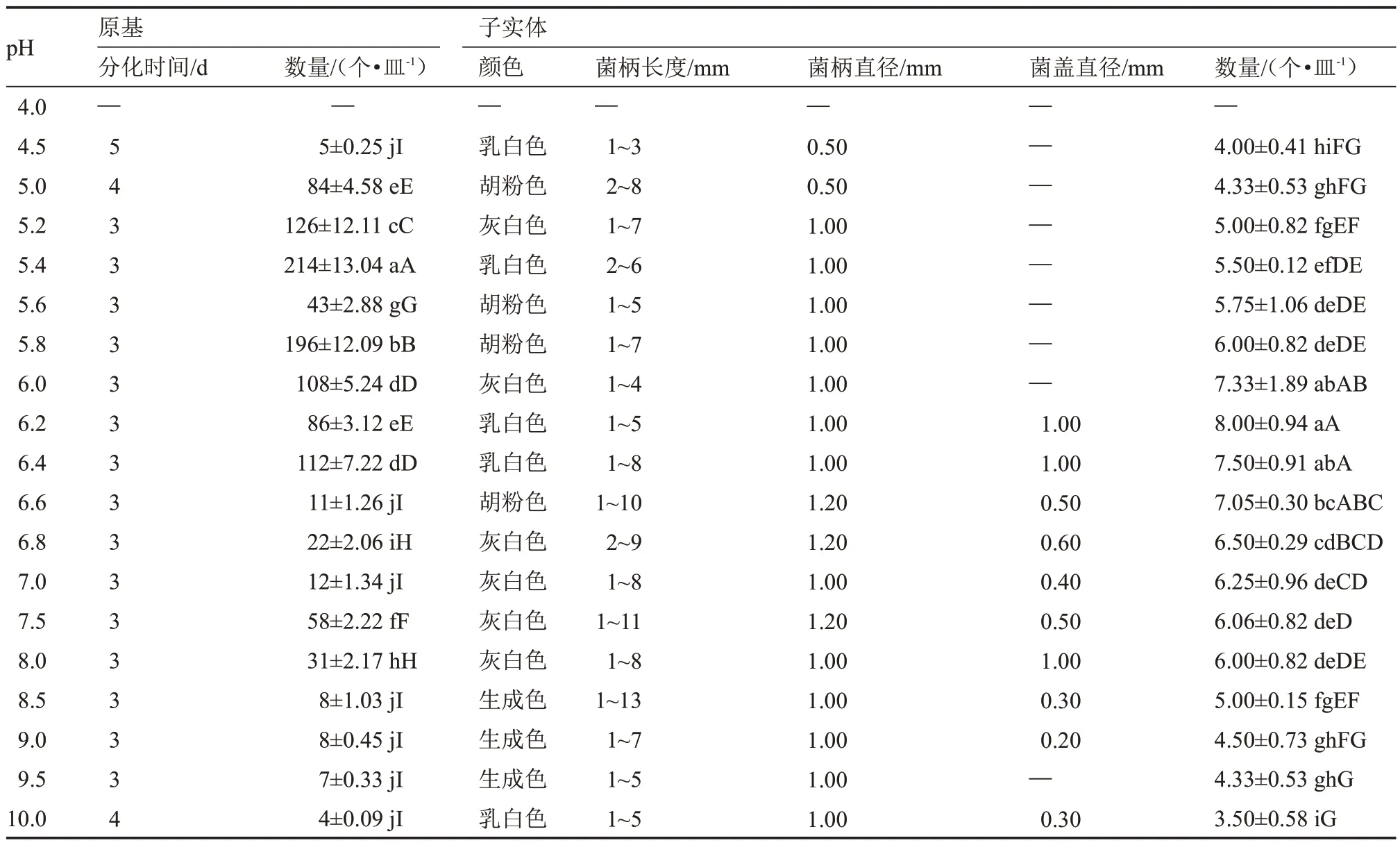
表11 不同pH 值下原基分化與子實體發育情況Table 11 The primordial differentiation and fruiting body development at different pH
2.4 氧氣對菌株YAASM4665生長發育的影響
由表12 可知,該菇在所有型號的培養皿平板上均能生長,菌絲呈白色(圖5),且萌發時間均為1 d。然而,隨著培養皿直徑的增大,該菇菌落的生長勢逐漸減弱,其菌絲生長速度在各處理下無顯著差異。因此,氧氣對菌絲生長的影響較小。
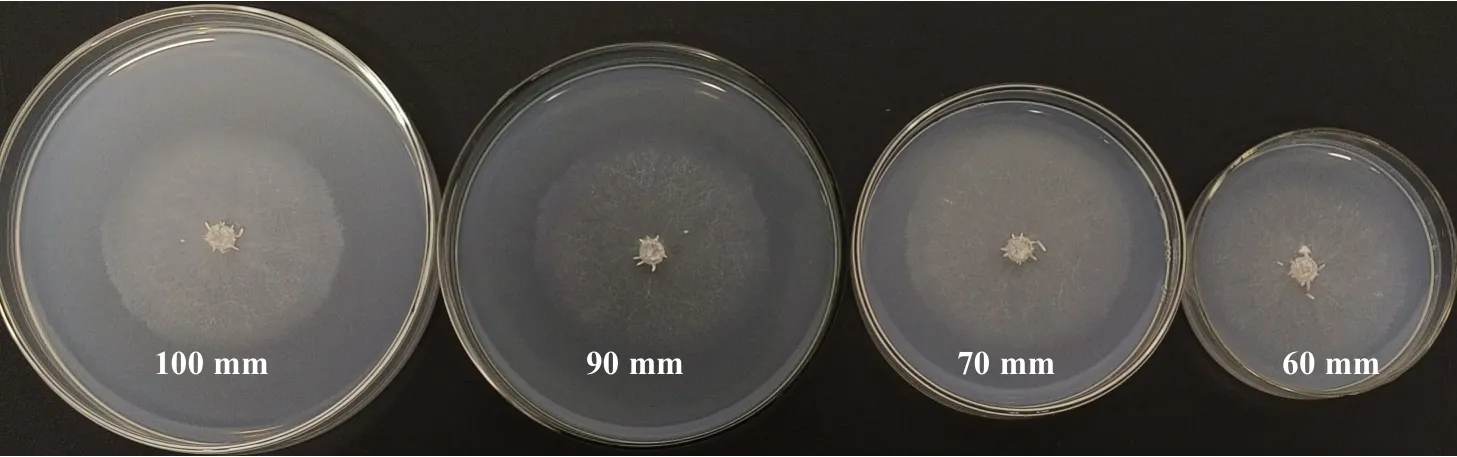
圖5 不同含氧量下菌株YAASM4665 在PSA 平板中的培養情況Fig.5 The cultivation of bacterial strain YAASM4665 in PSA slab at different oxygen content
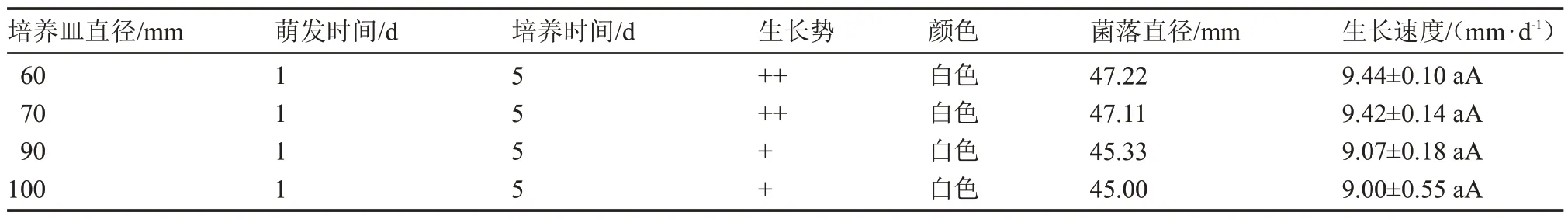
表12 不同含氧量下菌絲體生長情況Table 12 The mycelium growth at different oxygen content
由表13 可知,該菇在各種型號的培養皿處理下均能生長發育,且原基分化時間均為2 d,子實體呈胡粉色。在培養皿直徑為70 mm 的條件下,該菇的原基分化數量最多[(19.67±0.58)個·皿-1],且與其他處理呈極顯著差異。而培養皿直徑為100 mm時,該菇的子實體農藝性狀綜合表現較佳,發育數量最多[(4.33±0.58)個·皿-1],并且與培養皿直徑為60 mm 的處理相比達到顯著差異。總之,各類型號培養皿對該菇生長發育具有一定程度的影響,其原基分化與子實體發育的最適培養皿直徑依次為70、70~100 mm。
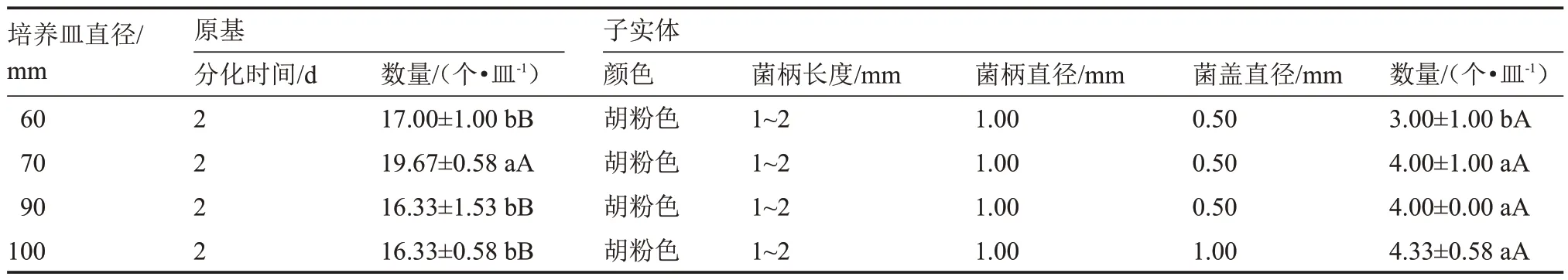
表13 不同含氧量下原基分化與子實體發育情況Table 13 The primordial differentiation and fruiting body development at different oxygen content
2.5 光照時長對菌株YAASM4665 生長發育的影響
由表14 可知,該菇菌絲在不同光照時長處理下均能生長,呈白色(圖6),且萌發時間均為2 d。在0 h·d-1的光照處理下該菇菌絲生長濃密健壯,菌落直徑最大,菌絲生長速度最快[(7.15±0.25)mm·d-1],與24 h·d-1的光照時長處理相比差異顯著,但與12 h·d-1的光照時長處理相比差異不顯著。總之,黑暗處理組下該菇菌絲生長情況優于光照組。
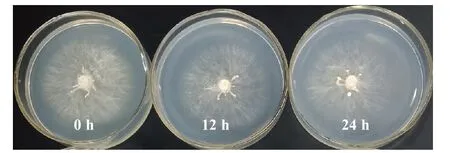
圖6 不同光照時長的菌株YAASM4665 在PSA 平板中的培養情況Fig.6 The cultivation of bacterial strain YAASM4665 in PSA slab at different light time

表14 不同光照時長的菌絲體生長情況Table 14 The mycelium growth at different light time
該菇在不同光照時長下均能生長發育,其原基分化時間均為3 d(表15)。在12 h·d-1的光照下,該菇的原基分化數量最多[(16±3.14)個·皿-1],與其他處理相比有極顯著差異,而24 h·d-1的光照處理下原基分化情況最差。當光照時間為24 h·d-1時,該菇的子實體呈生成色,其農藝性狀綜合表現最好,發育數量最多[(7.75±0.71)個·皿-1],與12 h·d-1的光照處理相比差異不顯著,與0 h·d-1的光照時長處理呈極顯著差異。總之,適宜的散射光有利于該菇原基的分化與子實體發育,其最適光照時間依次為12、12~24 h·d-1。

表15 不同光照時間下原基分化與子實體發育情況Table 15 The primordial differentiation and fruiting body development at different light time
2.6 正交試驗
2.6.1 以菌絲體生長速度為指標的正交試驗 由表16 可知,在16 種正交組合下,該菇菌絲呈白色且均能生長。在組合8 上菌絲萌發時間短,菌絲濃密健壯,生長速度最快[(9.72±0.38)mm·d-1](表17),與其他處理相比呈極顯著差異,而組合9 和11 上菌絲生長情況最差。
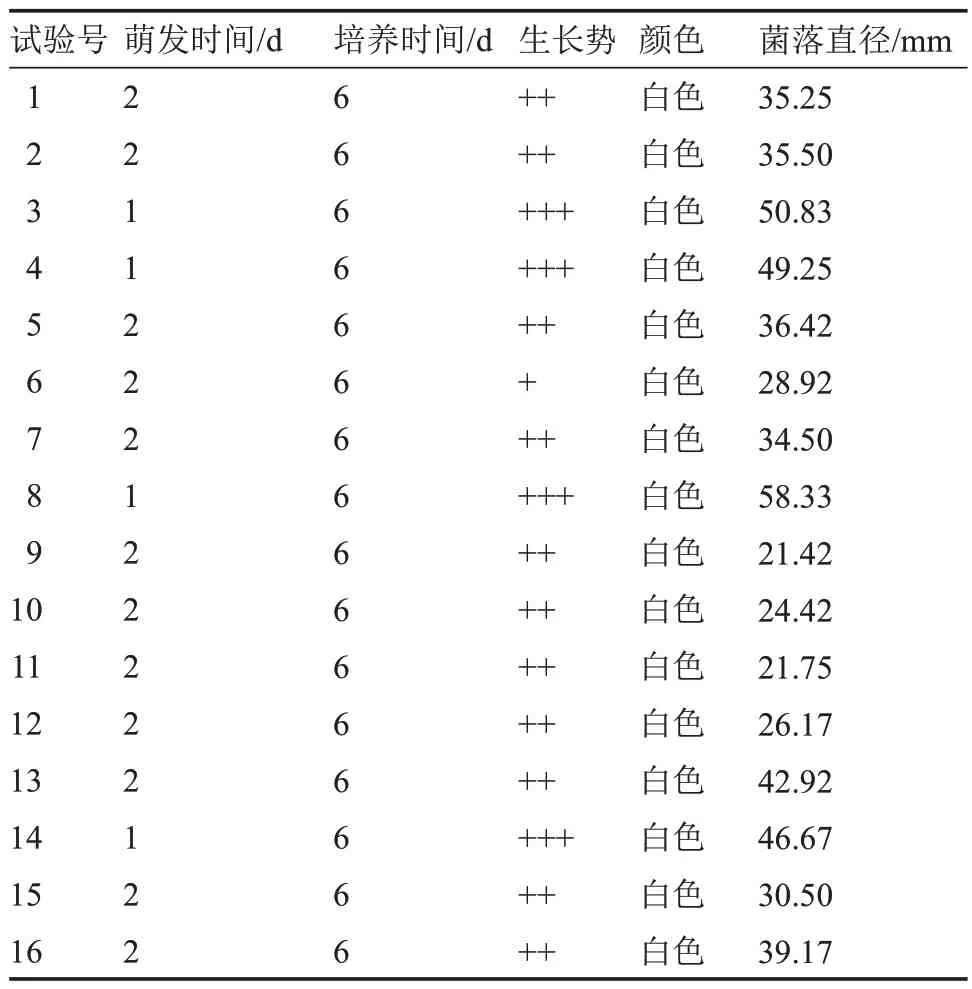
表16 不同正交組合下菌絲體生長情況Table 16 The mycelium growth at different orthogonal combination
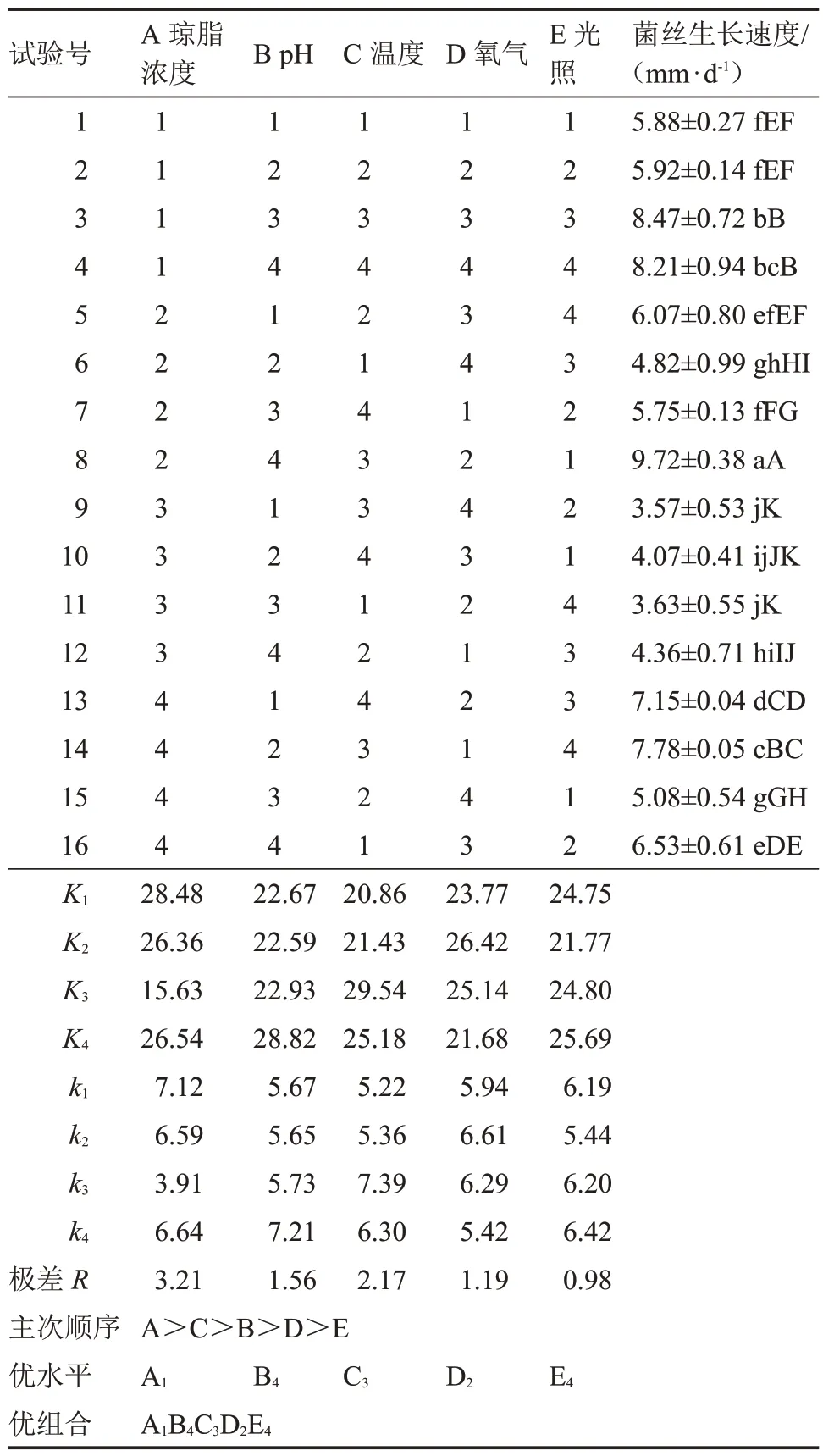
表17 以菌絲體生長速度為指標的極差分析Table 17 The range analysis based on mycelium growth rate
極差分析表明,各列極差大小順序為R1>R3>R2>R4>R5,試驗因素的主次順序為A>C>B>D>E,即瓊脂濃度對菌絲生長速度影響最大,其最優組合為 A1B4C3D2E4,該組合與顯著性分析結果(A2B4C3D2E1)不一致。經試驗驗證,在組合A2B4C3D2E1培養基上,該菇菌絲生長速度最快[(9.02±0.18)mm·d-1]。因此,最優組合為瓊脂濃度2%、pH 7.0、溫度25 ℃、培養皿直徑70 mm、0 h·d-1光照。
2.6.2 以原基數量為指標的正交試驗 由表18 可知,在16 種正交組合條件下,該菇原基均能分化,在組合8 條件下,該菇原基分化數量最多[(17.67±1.06)個·皿-1],與其他處理相比有極顯著差異。
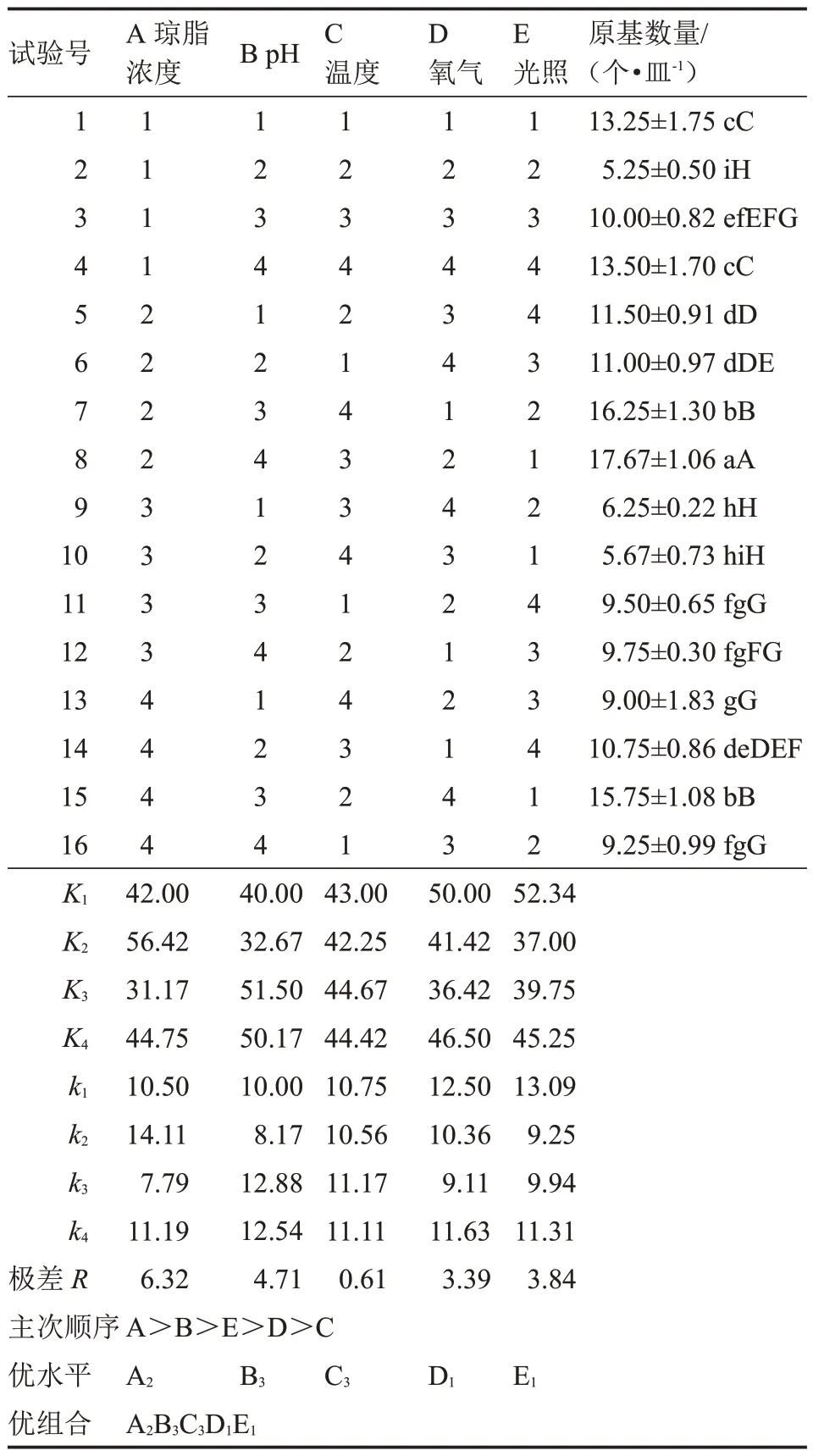
表18 以原基數量為指標的極差分析Table 18 The range analysis based on number of primordial
極差分析表明,各列極差大小順序為R1>R2>R5>R4>R3,試驗因素的主次順序為A>B>E>D>C,即瓊脂濃度對原基分化影響最大,其最優組合為A2B3C3D1E1,該組合與顯著性分析結果(A2B4C3D2E1)不一致。經試驗驗證,在組合A2B3C3D1E1培養基上,該菇的原基分化時間短(3 d),數量最多[(20.75±3.31)個·皿-1]。因此,最優組合為:瓊脂濃度2%、pH 5.6、溫度25 ℃、培養皿直徑60 mm、0 h·d-1光照。
2.6.3 以子實體數量為指標的正交試驗 由表19可知,在16 種正交組合條件下,該菇子實體均能發育。在組合10 條件下,該菇子實體呈白色,其農藝性狀綜合良好,發育數量最多[(5.25±0.71)個·皿-1](表20),與其他處理相比有顯著差異。
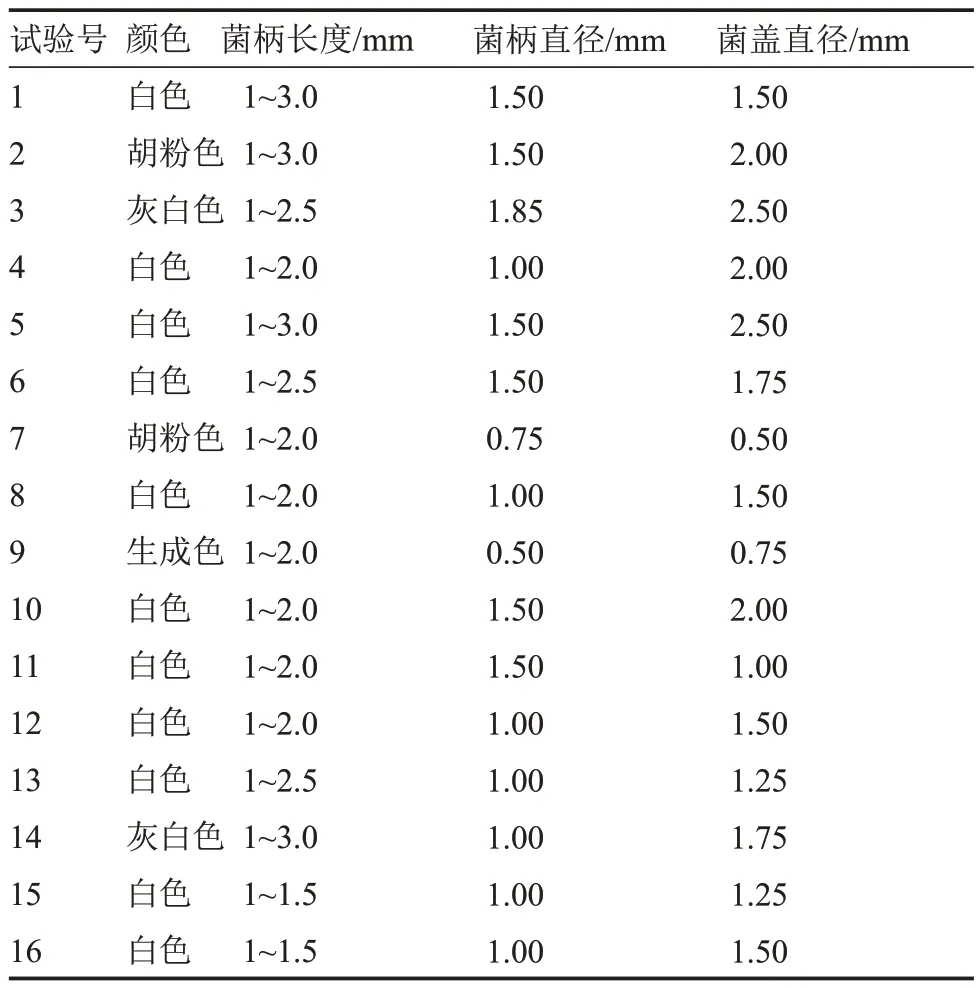
表19 不同正交組合條件下子實體發育情況Table 19 The fruiting body development at different orthogonal combination
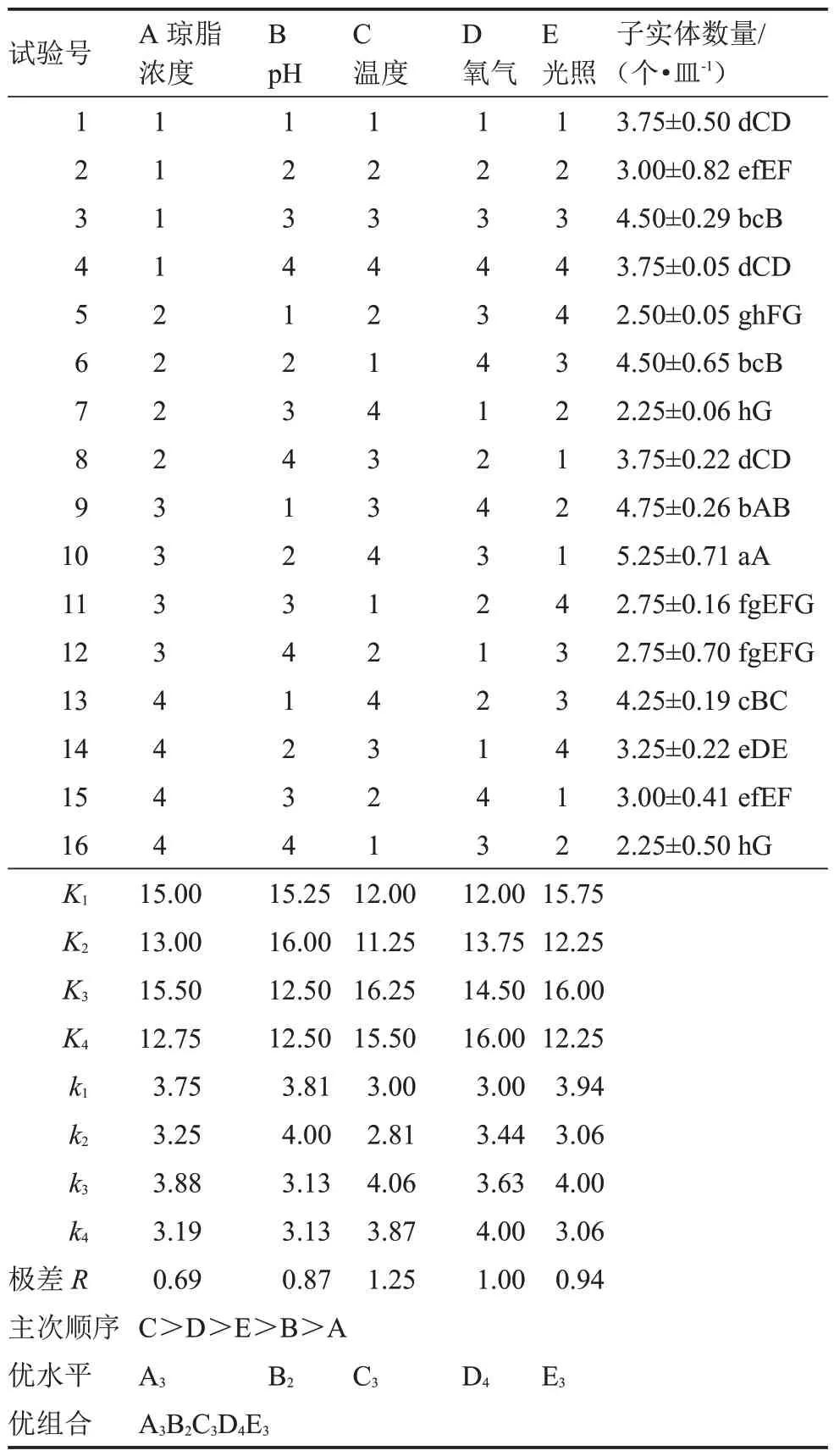
表20 以子實體數量為指標的極差分析Table 20 The range analysis based on number of fruiting body
極差分析表明,各列極差大小順序為R3>R4>R5>R2>R1,試驗因素的主次順序為C>D>E>B>A,即溫度對子實體發育影響最大,其最優組合 A3B2C3D4E3,該組合與顯著性分析結果(A3B2C4D3E1)不一致。經試驗驗證,在組合A3B2C3D4E3培養基上,該菇子實體發育數量最多[(5.50±0.58)個·皿-1]。因此,最優組合為:瓊脂濃度2%、pH 6.2、溫度25 ℃、培養皿直徑100 mm、14 h·d-1光照。
3 討論與結論
環境因子與個體發育的關系是菇類研究的熱點和難點問題,也是野生菇類馴化栽培的研究基礎[18]。通過對菇類生長的環境因子進行人為控制,能有效提高農業生產方面的經濟效益[19]。
研究表明,星孢寄生菇在溫度15~27 ℃、培養基pH 4.5~10.0 以及其他可控環境條件所有處理下均能生長發育,以25 ℃為最適溫度。單因素試驗條件下,在瓊脂濃度3%、pH 6.6~6.8、光照時間0 h·d-1各處理下,該菇菌絲生長最快且培養皿直徑大小對其無顯著影響;在瓊脂濃度2.5%、pH 5.4、培養皿直徑70 mm、光照時間12 h·d-1各處理下,該菇原基數量最多。在瓊脂濃度1.5%、pH 6.2、培養皿直徑70~100 mm、光照時間12~24 h·d-1處理下該菇子實體數量最多。然而,除溫度外,該菇生長發育的單因素最佳水平與最佳可控環境因子組合均不相符,其中瓊脂濃度、溫度是該菇關鍵的環境因素。
上述結果驗證了適宜溫度范圍是菇類細胞正常代謝的基礎[20],且不同菇類或同一菇類的不同品種,甚至同一品種在不同生長階段其菌絲生長發育所需的溫度也有所不同[21],該菇生長發育的溫度以及pH 范圍與王建東等[2]研究結果基本相同。前人也充分證明了菇類在整個發育過程中均依賴細胞儲存的水分[22];酸堿度決定營養物質吸收的快慢進而影響菇類的農藝性狀[23-24];多數菇類菌絲生長不需要光照,而子實體發育需要光的刺激;大多數菇類是好氧型真菌,O2的含量會影響菇類菌絲萌發和子實體發育[25]。同時,該菇的個體發育除與可控環境因子有關外,有必要進一步探究營養條件[26]、胞外酶活性[27]、基因轉錄組學[28]等與該菇個體發育的關系。
總之,星孢寄生菇菌絲生長的最佳組合為:溫度25 ℃、瓊脂濃度2%、pH 7.0、培養皿直徑70 mm、光照時間0 h·d-1。該菇原基分化的最佳組合為:溫度25 ℃、瓊脂濃度2%、pH 5.6、培養皿直徑60 mm、光照時間0 h·d-1。該菇子實體發育的最佳組合為:溫度25 ℃、瓊脂濃度2%、pH 6.2、培養皿直徑100 mm、光照時間14 h·d-1。

