條斑紫菜栽培過程中有害藻類的分離與鑒定
杜藝菲, 王廣策, 牛建峰, 馮澤中, 王旭雷, 卓錦濤, 4, 邵之卓, 4, 郇 麗, 宮相忠
條斑紫菜栽培過程中有害藻類的分離與鑒定
杜藝菲1, 王廣策2, 3, 5, 牛建峰2, 3, 5, 馮澤中2, 3, 王旭雷2, 3, 5, 卓錦濤2, 3, 4, 邵之卓2, 3, 4, 郇 麗2, 3, 5, 宮相忠1
(1. 中國海洋大學 海洋生命學院, 山東 青島 266003; 2. 中國科學院海洋研究所, 山東 青島 266071; 3. 青島海洋科學與技術試點國家實驗室 海洋生物學和生物技術功能實驗室, 山東 青島 266237; 4.中國科學院大學, 北京 100049; 5. 中國科學院海洋大科學研究中心, 山東 青島 266071)
針對條斑紫菜栽培過程中出現的有害藻類問題, 進行了葉狀體和絲狀體有害藻類分離與鑒定等相關研究。通過形態學分析和分子生物學鑒定, 發現葉狀體中的雜藻主要有大型綠藻(滸苔、曲滸苔)、大型紅藻(紅毛菜)以及微型綠藻和硅藻, 絲狀體中的雜藻主要為褐藻、微型綠藻和硅藻。針對部分微型雜藻進行了抑制劑處理實驗, 結果表明低濃度的抗生素可以有效抑制部分硅藻和綠藻的生長, 二氧化鍺對硅藻生長具有顯著的抑制效果。研究結果為系統、全面認識條斑紫菜栽培過程中的有害藻類提供了科學依據。
條斑紫菜; 葉狀體; 絲狀體; 有害藻類; 分離純化; 分子鑒定
條斑紫菜()隸屬于紅藻門紅毛菜目紫菜屬, 是我國重要的栽培海藻。雖然條斑紫菜產量低于壇紫菜, 但產值較高, 其栽培業的發展創造了良好的經濟效益。與此同時, 在栽培過程中條斑紫菜大量吸收近岸海域氮磷等營養物質, 具有碳匯能力和重要的生態價值[1]。我國條斑紫菜栽培區域主要分布在江蘇省和山東省沿海, 藻體的健康養殖對當地經濟發展起著重要作用。然而, 栽培期間筏架和藻體容易受到其他藻類的附著與侵占, 影響了條斑紫菜的產量和產品的品質, 制約了產業發展[2-3]。因此, 開展條斑紫菜栽培期間有害藻類的調查和綜合防控等工作非常重要。
條斑紫菜具有兩個形態特征明顯不同的生活史階段, 分別為葉狀體階段(單倍配子體)和絲狀體階段(二倍孢子體)。葉狀體為宏觀世代, 呈膜狀, 即我們通常食用的紫菜; 葉狀體發育到一定階段后放散果孢子, 果孢子在貝殼等含碳酸鈣的物質上附著萌發形成絲狀體; 絲狀體發育成殼孢子囊釋放殼孢子, 進而附著萌發形成葉狀體。葉狀體在開放海區的養殖階段開始于9月下旬至10月中旬前后, 至翌年4月結束[4], 在此期間養殖筏架和網簾會繁生各種雜藻, 一般通過干露、曬網等方式進行處理, 以降低有害藻類的危害[5]。絲狀體培養是紫菜人工養殖的基礎, 每年的培養時間約為5~6個月, 鉆入貝殼的絲狀體在培養池中進行培養, 雖然培養絲狀體的海水會經過暗沉淀等處理, 但仍然會受到海水中有害藻類的影響。
按照藻體大小可將影響條斑紫菜生長的藻類分為大型有害藻類和微型有害藻類, 其中大型有害藻類一般附生在養殖筏架和網簾上, 微型有害藻類一般附著在條斑紫菜表面。有害藻類的附著會影響條斑紫菜對光照和營養鹽的吸收, 從而影響其產量及加工后產品的品質。然而, 目前關于條斑紫菜有害藻類的研究只局限于某一物種或某一類群, 尚未有系統全面的報道。
因此, 本文以條斑紫菜葉狀體和絲狀體為研究材料, 對其養殖過程中出現的有害藻類進行分離、純化與鑒定, 同時探索了一系列處理方法以減少有害藻類產生的負面影響。研究結果為系統、全面認識條斑紫菜栽培過程中的有害藻類提供了科學依據, 具有一定的實用價值和推廣意義。
1 材料和方法
1.1 材料的采集
2020年12月至2021年5月多次至江蘇省贛榆區、山東省即墨區條斑紫菜養殖海域采集樣品, 包括條斑紫菜葉狀體和附著在養殖筏架上的藻類(圖1)。此外, 葉狀體和絲狀體在實驗室培養過程中也會受到其他藻類污染, 因此也將這些藻類作為有害藻類進行相關研究。

圖1 栽培于開放海區的條斑紫菜葉狀體
1.2 材料的分離與培養
對于采集到的大型海藻, 使用滅菌海水清洗以去除雜質及浮游生物, 選取一段藻體放入培養瓶中進行培養。對于微型雜藻, 在PES海水培養基中添加1%的Agarose滅菌制備固體培養基, 將條斑紫菜表面附著的雜藻涂布于固體平板上, 長出藻落后挑取單個藻落置于PES海水培養基中進行培養。培養環境光照強度為40 μmol photons?m–2?s–1, 溫度為20 ℃。
1.3 有害藻類的鑒定
使用光鏡(ECLIPSE Ti, 尼康)與掃描電子顯微鏡(S-3400N, 日立)對雜藻進行分類與觀察。
將分離出來的單株雜藻收集在EP管中, 離心去除培養基, 加入研磨珠, 使用全自動樣品研磨機(JX- FSTPRP-24, 上海凈信科技)研磨后, 加入適量TE 緩沖液(T1120, Solarbio)于95 ℃處理15 min, 離心取上清作為DNA模板。
使用表1所示引物進行PCR擴增, 引物由生工生物工程(上海)股份有限公司合成。PCR反應體系為: 10 μL 2×Taq Master Mix, 7 μL RNase-free水, 1 μL Primer F, 1 μL Primer R, 1 μL DNA模板。PCR反應程序為: 95 ℃預變性4 min; 95 ℃變性30 s、退火30 s、72 ℃延伸1 min, 35個循環; 72 ℃延伸10 min, 4 ℃保溫。擴增產物進行1%瓊脂糖凝膠電泳檢測。合格的擴增產物送生工生物工程(上海) 股份有限公司測序, 測序結果在National Center for Biotechnolo-gy Information (https://www.ncbi.nlm.nih.gov/)上進行BLAST比對, 獲得鑒定結果。

表1 分子鑒定引物列表
1.4 有害藻類的處理
選取指數生長時期的雜藻作為實驗對象, 在12 mL培養管里分別加入5 mL含有不同濃度氯霉素(10、20、40 U/mL)、草銨膦(10、20、30 mg/L)、二氧化鍺(10、15 mg/L)的PES海水培養基, 同時設置對照組, 每組加入等量同種微藻, 14 d后計數觀察不同濃度處理試劑對各種雜藻的作用程度。
在本研究中采取了兩種方法進行計算。一種為血球計數板計數法[11], 將培養管中的藻液吹打均勻使用血球計數板(上海市求精生化試劑儀器有限公司)在光鏡(ECLIPSE Ti, 尼康)下對對照組和各實驗組進行計數, 每個樣品重復計數3次, 計算出細胞密度平均值。根據公式: 死亡率=(對照組密度–實驗組密度)/對照組密度[12], 計算微藻死亡率。
另一種方法為赤蘚紅染色法, 使用0.1%赤蘚紅B對藻細胞進行染色, 隨機取樣, 使用光鏡(ECLIPSE Ti, 尼康)拍照, 其中死細胞染色后為紅色, 活細胞顏色不變, 根據被染色細胞比例計算出死亡率[13]。每組處理重復計數3次, 取平均值。
2 結果
2.1 條斑紫菜葉狀體養殖過程中有害藻類的鑒定
(1) 曲滸苔(), 大型綠藻, 隸屬于綠藻門石莼綱石莼目石莼科石莼屬, 分離于條斑紫菜養殖筏架, 藻體深綠色, 單條細長中空, 圓柱狀或管狀, 有明顯柄部, 基部細胞排列整齊, 向上膨脹細胞排列變不規則(圖2a)。
(2) 滸苔(), 大型綠藻, 隸屬于綠藻門石莼綱石莼目石莼科石莼屬, 分離于條斑紫菜養殖筏架。藻體亮綠色或暗綠色, 有明顯主枝, 多細長中空管狀分支, 由單層細胞組成(圖2b)。
(3) 紅毛菜(), 大型紅藻, 隸屬于紅藻門紅毛菜綱紅毛菜目紅毛菜科紅毛菜屬, 分離于條斑紫菜養殖筏架。藻體紅褐色至紫紅色, 絲狀, 韌性差, 大多由雙層細胞組成(圖2c)。

圖2 條斑紫菜栽培過程中分離鑒定的大型有害藻類
(4) 柯氏復球藻(), 微型綠藻, 隸屬于綠藻門共球藻綱溪菜目, 分離于實驗室養殖材料。綠色球形, 多數聚團生長, 呈二分體或四分體狀態(圖3a, 圖4a)。
(5), 褐藻, 隸屬于褐藻門褐藻綱水云目索藻科扭線藻屬, 分離于野生條斑紫菜表面。棕褐色, 有若干分枝, 分支由單列細胞組成, 成串珠狀排列(圖3b, 圖4b)。
(6), 硅藻, 隸屬于硅藻門硅藻綱硅藻目硅藻科菱形藻屬, 分離于野生條斑紫菜表面。藻體形態呈菱形, 中央有一條殼縫, 橫紋線相互平行(圖3c, 圖4c)。
(7), 硅藻, 隸屬于硅藻門硅藻綱舟形藻目舟形藻科舟形藻屬, 分離于野生條斑紫菜表面。藻體形態呈細長舟形, 兩端尖; 硅殼上條紋大致平行, 殼縫較直; 聚集在一起的單個硅藻之間有很大間隙, 經常包埋于膠質管中形成群體(圖3d, 圖4d)。
(8), 硅藻, 隸屬于硅藻門硅藻綱硅藻目硅藻科菱形藻屬, 在條斑紫菜絲狀體和葉狀體均分離出。藻體呈橢圓形, 兩端鈍圓; 藻體聚集緊密, 常多層疊在一起(圖3e, 圖4e)。
2.2 條斑紫菜絲狀體養殖過程中分離的有害藻類
(1), 微型綠藻, 隸屬于綠藻門共球藻綱小球藻目小球藻科, 分離于實驗室養殖材料。藻體為球形, 淺綠色, 表面略光滑; 繁殖力極強, 可耐惡劣環境(圖3f, 圖4f)。
(2), 硅藻, 隸屬于硅藻門硅藻綱硅藻目硅藻科筒柱藻屬, 分離于實驗室養殖材料。藻體中央部分呈菱形, 兩端細長, 直或常向一側彎曲呈現新月形, 有兩個載色體(圖3g, 圖4g)。
(3), 硅藻, 隸屬于硅藻門硅藻綱舟形藻目, 分離于實驗室養殖材料。藻體呈卵圓形, 橫紋對稱分布(圖3h, 圖4h)。
(4), 微型綠藻, 隸屬于綠藻門石莼綱石莼目科恩藻科似內枝藻屬, 分離于實驗室養殖材料。藻體由多細胞組成, 淺綠色, 纏繞在一起(圖3i, 圖4i)。

圖3 條斑紫菜栽培過程中分離鑒定的微型有害藻類(光鏡圖片)
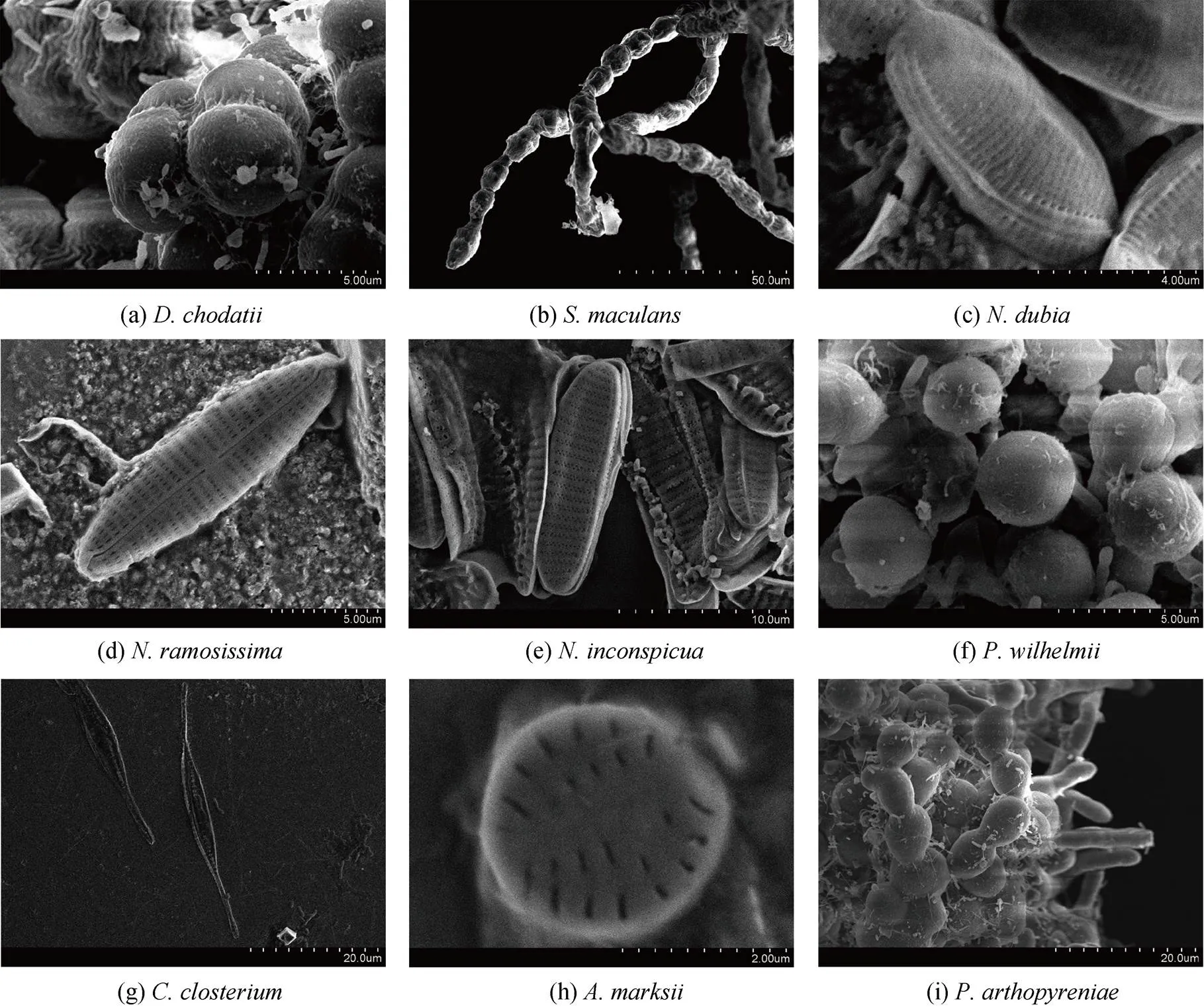
圖4 條斑紫菜栽培過程中分離鑒定的微型有害藻類(電鏡圖片)
2.3 有害藻類的處理
2.3.1 氯霉素對部分微藻的處理結果
選取、、和進行氯霉素處理。經過處理后幾種藻類的死亡率如圖5所示, 實驗濃度的氯霉素對于幾種藻類均有一定的抑制效果。、、經氯霉素處理后效果明顯, 其中在氯霉素濃度為20 U/mL時已經全部死亡;在20 U/mL氯霉素處理下死亡率達到85.18%, 在40 U/mL濃度處理時全部死亡;對低濃度氯霉素(10 U/mL)耐受性較強, 但在高濃度(40 U/mL)處理時死亡率達到97.08%。雖然氯霉素對于綠藻有一定的處理效果, 但效果不佳, 死亡率均在50%以下。
2.3.2 草銨膦對部分微藻的處理結果
選取、、、、、和進行草銨膦處理實驗。經過草銨膦處理后藻類的死亡率如圖6所示, 實驗濃度的草銨膦除了對于與兩種藻沒有明顯效果外, 對其他雜藻都有比較顯著的效果。
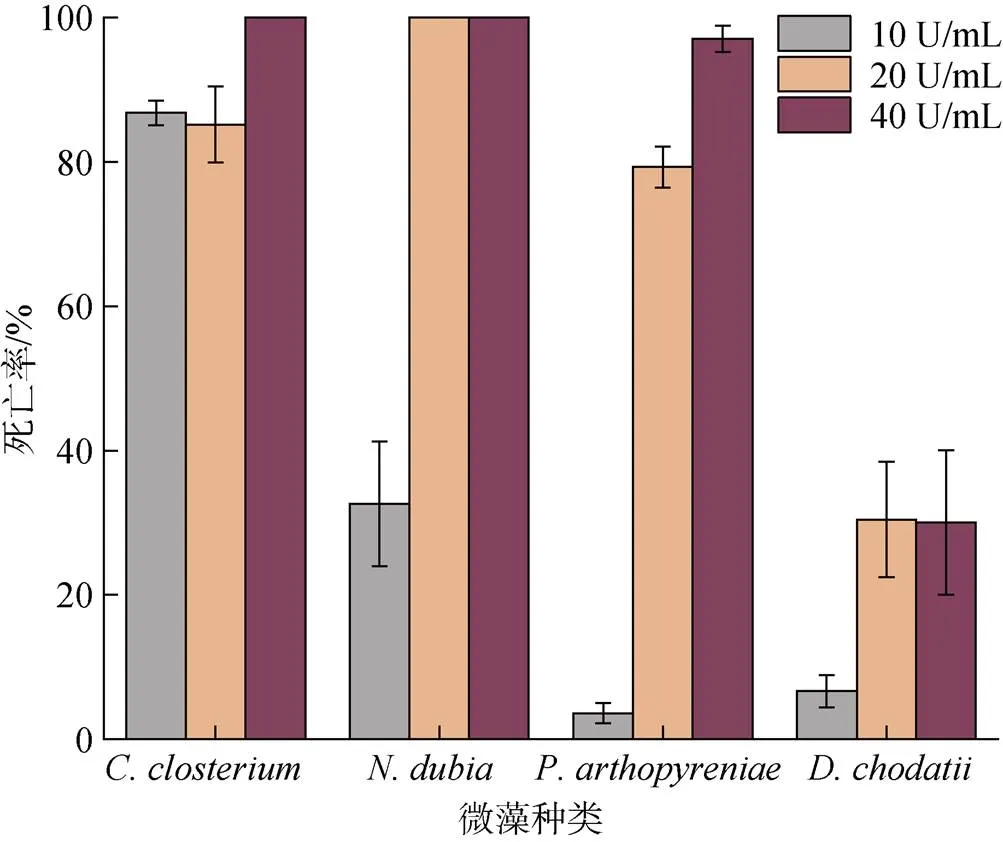
圖5 氯霉素對部分微藻的處理結果
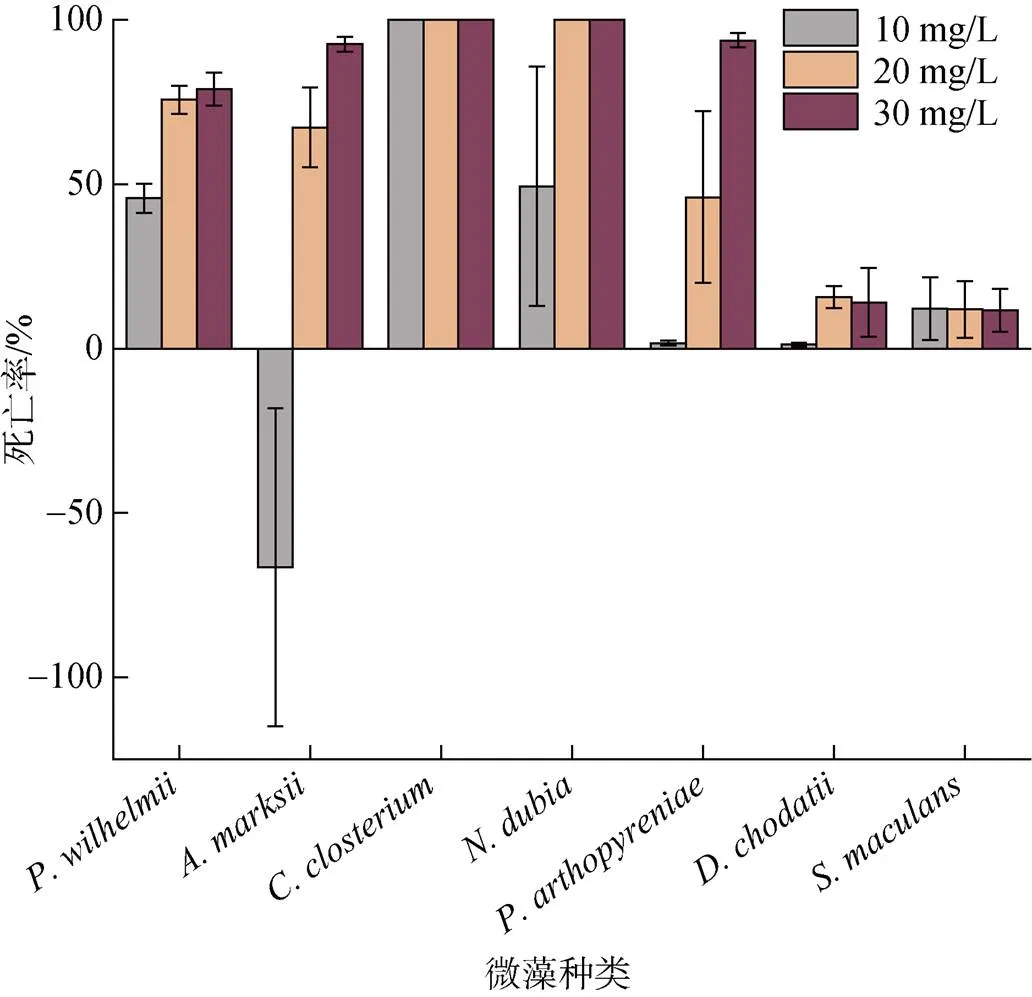
圖6 草銨膦對部分微藻的處理結果
對草銨膦格外敏感, 在低濃度(10 mg/L)時就已經全部死亡, 低濃度草銨膦對和也具有一定致死性, 反而對的生長起到促進作用。中濃度草銨膦(20 mg/L)對表現出極高的致死率, 對、和也產生了比較明顯的致死效果。在高濃度(30 mg/L)時, 草銨膦對、和的致死率分別達到了92.61%、78.96%、93.82%。整體來看, 草銨膦對硅藻的處理效果更加明顯。
2.3.3 二氧化鍺(GeO2)處理結果
選取、、和進行GeO2處理實驗。實驗濃度的GeO2對綠藻處理效果不明顯, 死亡率最高為34.81%; 硅藻、、在15 mg/L GeO2處理后死亡率分別為64.88%、92.31%、100%, 其中在GeO2濃度為10 mg/L時已經全部死亡(圖7)。
3 討論
條斑紫菜作為重要經濟海藻之一, 其葉狀體在栽培過程中容易受到其他大型海藻的影響。據《2017年江蘇海洋災害公報》顯示, 2017年江蘇省海域馬尾藻“金潮”大規模暴發, 漂浮的馬尾藻堆積在養殖設施上, 導致紫菜筏架倒塌、纜繩斷裂, 受災之處幾乎絕收, 直接經濟損失4億多元, 占全省海洋災害經濟損失的9成以上。除了這種突發性事件外, 紫菜養殖筏架和網繩上還經常會有各種綠藻的附生, 這些綠藻包括滸苔、緣管滸苔、扁滸苔、曲滸苔等[14]。在本研究中, 我們也發現了滸苔和曲滸苔的附著。許多學者開展了紫菜養殖過程中大型綠藻清除方法的研究, 主要包括曬網、檸檬酸浸泡、冷藏網、次氯酸鈉和過碳酸鈉處理等[5, 15-16], 已取得良好的處理效果并已應用于實際生產過程中。條斑紫菜絲狀體養殖過程中也會受到海水中有害藻類的侵染, 目前采用海水黑暗沉淀的方法, 在絲狀體繁育前期清除有害藻效果較為顯著[3]。
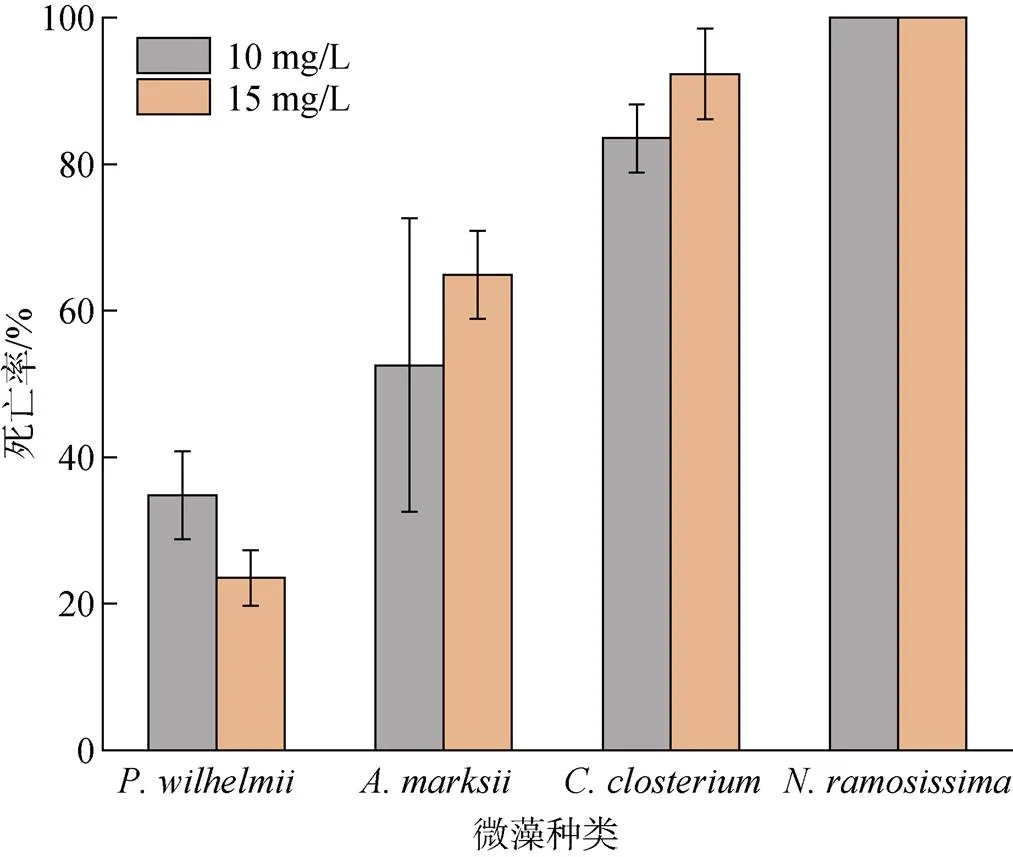
圖7 二氧化鍺對部分微藻的處理結果
如何減少這些有害藻類對條斑紫菜生長發育帶來的影響已經成為眾多學者關心和研究的問題[2, 14, 17-18]。但是關于條斑紫菜附生雜藻的研究, 一直以來都是從藻類門類來整體探究, 缺乏對優勢有害藻類的針對處理。因此, 在本研究中我們開展了條斑紫菜葉狀體和絲狀體有害藻類研究,先分離鑒定有害藻類, 再針對具體藻類進行處理,在雜藻污染量化分析和優勢雜藻防治等方面具有應用價值。
長期以來, 關于條斑紫菜附生硅藻的研究較多。實驗室多采用日本學者的方法使用二氧化鍺去除條斑紫菜上的硅藻。馬家海曾用多種物理方法如酸堿、干燥、冷藏來去除硅藻的附著, 取得了良好效果[2]。李金波等[17]探索了使用超聲波使附著硅藻脫落, 使用機械力給其他生物帶來的影響更小。此外, 關于條斑紫菜其他門類雜藻的研究較少, 薛學坤等[19]對于條斑紫菜絲狀體的各種雜藻污染給出了一些處理方法, 在硅藻污染時使用反復沖洗和二氧化鍺浸泡, 在藍藻污染時使用抗生素處理并多次換水, 在綠藻污染時降低光照。張美如[18]通過控制光照和使用青霉素及碳酸氫銨, 對絲狀體種質擴繁過程中的一些綠藻污染做了有效預防處理。本文選取了氯霉素、草銨膦以及二氧化鍺作為除藻劑, 探究對于從條斑紫菜生長過程中分離的各種有害雜藻的去除作用。
紫菜對氯霉素有很高的敏感性, 研究表明條斑紫菜體細胞在氯霉素濃度100 U/mL以下可以存活并持續生長[20], 李揚等[21]發現壇紫菜體細胞在100 μg/mL以下時可以存活1周以上。鑒于較高濃度的氯霉素會使條斑紫菜致死, 本文選取了較低濃度的氯霉素對雜藻進行處理, 根據圖5可以看出, 較低濃度的氯霉素可以使多種藻產生了一定致死性, 說明實驗濃度氯霉素可以對條斑紫菜一些附生雜藻進行有效清除。
草銨膦作為常用的滅生性除草劑, 對多種藻類都有一定的影響。在對銅綠微囊藻的研究中發現, 草銨膦對其毒性效應有“低促高抑”現象[22], 與本文圖6中草銨膦對的作用效果相似。同時, 在草銨膦對普通單細胞小球藻的毒性研究中, 發現使小球藻產生了一定的氧化損傷[23], 本文圖6展現了草銨膦對于小球藻科的具有一定的毒害效應。
二氧化鍺長期以來作為除硅藻劑廣為使用, 有研究發現二氧化鍺濃度在20 mg/L以下時, 對條斑紫菜葉狀體不產生毒性效應[18]。本文選用的二氧化鍺濃度為10 mg/L與15 mg/L, 均低于上述濃度。馬家海等[24]的研究表明二氧化鍺對硅藻的影響主要是對其細胞壁的破壞, 從而阻礙硅藻細胞形成。本文圖7也證實了二氧化鍺對硅藻具有較強的處理效果。
基于水產養殖禁用藥物品種簡表, 氯霉素在水產養殖中被列為禁用抗生素, 同時草銨膦也在一些國家和我國部分省份被禁止使用, 因此本文僅建議相關抑制劑在實驗室水平的種質保存方面使用。
4 結論
本文通過形態學分析與分子生物學鑒定, 在條斑紫菜葉狀體與絲狀體中分離出了多種附生雜藻, 對其形態做了簡單描述, 并選取了部分微型雜藻進行了抑制劑實驗, 結果顯示: 影響條斑紫菜栽培和種質保存的有害藻類種類較多; 低濃度的氯霉素與草銨膦對于部分綠藻與硅藻有一定抑制效果; 二氧化鍺對于去除硅藻具有良好效果。本研究有助于全面、深入地了解條斑紫菜生長過程中的有害藻類, 為解決條斑紫菜生長受雜藻影響的問題提供了有效的方法借鑒。
致謝: 感謝中國科學院海洋研究所李宇航博士建議部分新擬中文名稱, 特此致謝!
[1] 陸勤勤, 周偉, 朱建一, 等. 中國條斑紫菜產業的歷史、現狀與發展趨勢[J]. 中國海洋經濟, 2018(1): 3-11. LU Qinqin, ZHOU Wei, ZHU Jianyi, et al. The history, status quo and development trend ofindustry of China[J].Marine Economy in China, 2018(1): 3-11.
[2] 馬家海. 條斑紫菜硅藻附著癥防治研究[J]. 上海水產大學學報, 1996, 5(3): 163-169. MA Jiahai. Studies on the prevention and cure for diatom felt disease of[J]. Journal of Shanghai Fisheries University, 1996, 5(3): 163-169.
[3] 施敏健, 王惠沖. 條斑紫菜人工育苗期預防綠藻的方法[J]. 水產養殖, 1996(2): 10-11. SHI Minjian, WANG Huichong. Method for preventing green algae in artificial seedling stage of[J]. Journal of Aquaculture, 1996(2): 10-11.
[4] 中國科學院海洋研究所藻類實驗生態組. 條斑紫菜的人工養殖[M]. 北京: 科學出版社, 1978. Algae Experimental Ecology Group, the Institute of Oceanology, Chinese Academy of Sciences. Artificial culture of[M]. Beijing: Science Press, 1978.
[5] 陳昌生, 翁琳, 汪磊, 等. 干露和冷藏對壇紫菜及雜藻存活與生長的影響[J]. 海洋學報, 2007, 29(2): 131-136. CHEN Changsheng, WENG Lin, WANG Lei, et al. Influence of desiccation and cold preservation on the survive and growth ofand unwanted-alga[J]. Acta Oceanologica Sinica, 2007, 29(2): 131-136.
[6] DU G, WU F, MAO Y, et al. DNA barcoding assessment of green macroalgae in coastal zone around Qingdao, China[J]. Journal of Ocean University of China, 2014, 13(1): 97-103.
[7] DARIENKO T, PROESCHOLD T. Toward a mono-graph of non-marine Ulvophyceae using an integrative approach (Molecular phylogeny and systematics of terrestrial Ulvophyceae II.)[J]. Phytotaxa, 2017, 324(1): 1-41.
[8] LIU C, SUBASHCHANDRABOSE S, MING H, et al. Phycoremediation of dairy and winery wastewater usingsp.MM1[J]. Journal of Applied Phycology, 2016, 28(6): 3331-3341.
[9] 胡蝶, 程寶文, 邢豫明, 等. 滇池水域硅藻DNA多態性檢驗引物的篩選[J]. 中國法醫學雜志, 2018, 33(3): 280-285. HU Die, CHENG Baowen, XING Yuming, et al. Scree-ning of primers for DNA polymorphism test of diatom in Dianchi[J]. Chinese Journal of Forensic Medicine, 2018, 33(3): 280-285.
[10] 薛紅凡. 基于DNA條形碼技術的山東半島潮間帶褐藻和綠藻分類研究[D]. 青島: 中國海洋大學, 2014. XUE Hongfan. Classification research of maroalgae of brown algae and green algae from the intertidal zone of Shandong Peninsula based on DNA barcoding technology[D]. Qingdao: Ocean University of China, 2014.
[11] 黃美玲, 何慶, 黃建榮, 等. 小球藻生物量的快速測定技術研究[J]. 河北漁業, 2010(4): 1-3, 14. HUANG Meiling, HE Qing, HUANG Jianrong, et al. A rapid determination ofbiomass[J]. Hebei Fisheries, 2010(4): 1-3, 14.
[12] 霍元子, 田千桃, 徐柵楠, 等. 滸苔對米氏凱倫藻生長的克生作用[J]. 海洋環境科學, 2010, 29(4): 496-499.HUO Yuanzi, TIAN Qiantao, XU Zhanan, et al. Allelopathic effects ofon growth of[J]. Marine Environmental Science, 2010, 29(4): 496-499.
[13] FRANKE J D, BRAVERMAN A L, CUNNINGHAM A M, et al. Erythrosin B: a versatile colorimetric and fluorescent vital dye for bacteria[J]. Biotechniques, 2020, 68(1): 7-13.
[14] 陳斌斌, 馬家海, 蔡永超, 等. 江蘇省如東海區條斑紫菜栽培筏架固著L.屬綠藻的分子生物學與形態學分析[J]. 海洋環境科學, 2013, 32(3): 394-397. CHEN Binbin, MA Jiahai, CAI Yongchao, et al. Morphological and molecular analysis of attachedL. green algae fromrafts from Rudong coasts in Jiangsu Province[J]. Marine Environmental Science, 2013, 32(3): 394-397.
[15] 朱瑩. 紫菜養殖筏架固著綠藻的清除方法研究[D]. 上海: 上海海洋大學, 2014. ZHU Ying. Studies on the methods for removing attachedL. green algae fromraft[D]. Shanghai: Shanghai Ocean Universiy, 2014.
[16] 嚴興洪, 鐘晨輝, 亓慶寶, 等. 鮮凍與酸處理對壇紫菜和滸苔苗存活的影響[J]. 上海海洋大學學報, 2011, 20(5): 697-704. YAN Hongxing, ZHONG Chenhui, QI Qingbao, et al. Effects of refrigeration and acid treatment on the survival of the blades inand[J]. Journal of Shanghai Ocean Universiy, 2011, 20(5): 697-704.
[17] 李金波, 閻斌倫, 秦松, 等. 超聲波對條斑紫菜硅藻附著癥的作用[J]. 海洋科學, 2007, 31(12): 1-3. LI Jinbo, YAN Binlun, QIN Song, et al. Effect of ultrasonic on diatom felt disease of[J]. Marine Sciences, 2007, 31(12): 1-3.
[18] 張美如. 條斑紫菜種質擴繁與保存中污染控制技術研究[D]. 南京: 南京農業大學, 2010. ZHANG Meiru. Study on large-scale artificial breeding technology of[D]. Nanjing: Nanjing Agricultural University, 2010.
[19] 薛學坤, 唐興本, 陳百堯, 等. 對條斑紫菜自由絲狀體污染的防與治[J]. 水產養殖, 2015(11): 23-25. XUE Xuekun, TANG Xingben, CHEN Baiyao, et al. Prevention and treatment of free filamentous pollution of[J]. Journal of Aquaculture, 2015(11): 23-25.
[20] 沈懷舜, 王素娟. 紫菜體細胞對抗生素的敏感性實驗[J]. 海洋科學, 1998, 22(1): 67-69. SHEN Huaishun, WANG Sujuan. The test of antibiotic sensitivity of sommatic cells of[J]. Marine Sciences, 1998, 22(1): 67-69.
[21] 趙揚, 李秀, 左正宏, 等. 壇紫菜葉狀體體細胞對抗生素敏感性的研究[J]. 臺灣海峽, 2004, 23(4): 496-499. ZHAO Yang, LI Xiu, ZUO Zhenghong, et al. Antibiotics sensitivities of somatic cells ofthallus[J]. Journal of Oceanography in Taiwan Strait, 2004, 23(4): 496-499.
[22] 周聰. 兩種滅生性除草劑暴露對銅綠微藻藻毒素產生和分泌影響的機制研究[D]. 杭州: 浙江工業大學, 2013. ZHOU Cong. The synthesis and release mechanism research of microcystin of microcystin aeruginosa exposed to two sterilant herbicides[D]. Hangzhou: Zhejiang University of Technology, 2013.
[23] QIAN H F, CHEN W, SHENG G D, et al. Effects of glufosinate on antioxidant enzymes, subcellular structure, and gene expression in the unicellular green alga[J]. Aquatic Toxicology, 2008, 88(4): 301-307.
[24] 馬家海, 劉青. 二氧化鍺對壇紫菜自由絲狀體生長發育的影響[J]. 水產學報, 1989, 13(1): 36-41. MA Jiahai, LIU Qing. The effect of germanium dioxide (GeO2) on the groeth of free-living conchocelis of[J]. Aquaculture and Fisheries, 1989, 13(1): 36-41.
Isolation and identification of harmful algae during the cultivation of
DU Yi-fei1, WANG Guang-ce2, 3, 5, NIU Jian-feng2, 3, 5, FENG Ze-zhong2, 3, WANG Xu-lei2, 3, 5, ZHUO Jin-tao2, 3, 4, SHAO Zhi-zhuo2, 3, 4, HUAN Li2, 3, 5, GONG Xiang-zhong1
(1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China; 5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
To inhibit harmful algae in the cultivation of, the separation and identification of harmful algae in leafy thalli and filamentous thalli were studied. Through morphological analysis and molecular biology identification, it was revealed that there were large green algae (,), large red alga (), microgreen algae, and diatoms in the leafy thalli. While brown algae, microgreen algae, and diatoms were mainly found in filamentous thalli. The inhibitor treatment experiments were carried out on some harmful microalgae. The results demonstrated that low concentrations of antibiotics could effectively inhibit the growth of some diatoms and green algae, and germanium dioxide exhibited a significant inhibitory effect on the growth of diatoms. The results provide a scientific basis for the systematic and comprehensive understanding of harmful algae in the cultivation of.
; leafy thalli; filamentous thalli; harmful algae; separation and purification; molecular identification
Jul. 14, 2022
P735
A
1000-3096(2023)6-0070-09
10.11759/hykx20220714002
2022-07-14;
2022-08-22
國家藻類產業技術體系(CARS-50), 山東省“泰山學者”工程專項經費資助項目(tspd20210316)
[Supported by the Earmarked Fund for CARS, No. CARS-50, the Research Fund for the Taishan Scholar Project of Shandong Province, No. tspd20210316]
杜藝菲(1998—), 女, 山東泰安人, 碩士研究生, 主要從事藻類分子生理學研究, E-mail: duyifei@foxmail.com; 郇麗(1986—),通信作者, 山東臨沂人, 副研究員, 主要從事藻類分子生理學與發育調控研究, E-mail: huanli@qdio.ac.cn; 宮相忠(1963—), 通信作者, 山東青島人, 教授, 主要從事海藻實驗生態學研究, E-mail: gxzhw@ ouc.edu.cn
(本文編輯: 趙衛紅)

